Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Balanceo Por Tanteo
Cargado por
lucely casango de la cruzDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Balanceo Por Tanteo
Cargado por
lucely casango de la cruzCopyright:
Formatos disponibles
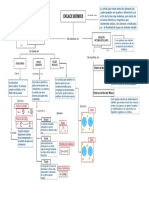
BALANCEO POR TANTEO
H2 +O2 H2O
PASO 1: Se debe observar que nuestra ecuación química tenga reactivos y productos y rectificar que esta no este
balanceada.
H2 +O2 H2O
REACTIVOS PRODUCTOS
PASO 2: Luego hacer un conteo de átomos de los respectivos elementos en ambos lados de la ecuación química, se
observa que solo el hidrogeno esta balanceado pero el oxígeno no.
H2 +O2 H2O
H: 2 H: 2
O: 2 O: 1
PASO 3: Se tiene que buscar coeficientes (estos multiplican a todo elemento o molécula que este después de ellos) que
permitan balancear la ecuación, para lograr un balance completo
H2 +O2 2H2O
H: 2 H: 4
O: 2 O: 2
PASO 4: Se debe tener en cuenta que cada vez que se coloque un coeficiente se debe hacer un conteo ya que es posible
que este altere la cantidad de los otros átomos, por lo que se tiene que estar haciendo un ajuste hasta que la ecuación
quede balanceada en su totalidad.
2H2 +O2 2H2O
H: 4 H: 4
O: 2 O: 2
ECUACION QUIMICA BALANCEADA
BALANCEO DE REACCIONES QUÍMICAS POR MÉTODO ALGEBRAICO
N2O5 N2O4 + O2
PASO 1: Se debe asignar una incógnita a cada elemento o molécula de la ecuación.
AN2O5 BN2O4 + CO2
PASO 2: Multiplicar la cantidad de átomos de cada elemento por la incógnita asignada, para así establecer la
ecuación, la significa =.
AN2O5 BN2O4 + CO2
N: 2A = 2B
O: 5A = 4B +2C
PASO 3: Utilizando esas ecuaciones, se debe dar un valor a cualquier incógnita (se puede comenzar con 1) esto
para poder despejar las incógnitas demás ecuaciones.
A=1 2A = 2B 5A = 4B + 2C
2(1)= 2B 5(1) = 4(1) + 2C
2/2 = B 5 = 4 + 2C
B= 1 5-4 = 2C
1 = 2C
C = 1/2
PASO 4: Como se sabe no se debe tener decimales en la ecuación química original, por lo que es necesario
multiplicar en este caso el denominador común de la fracción, pero no solo se multiplicará en el valor de
donde este la fracción sino también en las otras incógnitas.
A=1*2=2
B=1*2=2
C = 1/2 * 2 = 2
PASO 5: Asignar a cada una de las moléculas u elemento el valor encontrado en cada una de sus incógnitas.
2N2O5 2N2O4 + 2O2
ECUACION QUIMICA BALANCEADA
CÁLCULOS ESTEQUIOMÉTRICOS
La azida de sodio (NaN3) se descompone en Nitrogeno molecular y Sodio a altas temperaturas. Si reacciona una pastilla
de 120 gr de NaN3
a) Calcula los gr de Na que se forman
b) Calcula el volumen de Na obtenido en condiciones estándar.
PASO 1: SI EN EL PROBLEMA NO SE DA LA ECUACION, PUES SE PROCEDE A INTERPRETAR EL PROBLEMA , PARA SABER LA
ECUACCION QUIMICA
NaN3 N2 + Na
PASO 2: LUEGO SE BUSCA EL PM DE CADA ELEMENTO O SUSTANCIA
PM(Na) = 23 g/mol
NaN3 N2 + Na PM(N) = 14 g/mol
PM(Na) = 23 g/mol
PM(N2) = (14 g/mol)(2)=28 g/mol
PM(NaN3)= 23 g/mol + (14 g/mol)(3)
PM(NaN3)= 23 G/MOL + 42 G/MOL
PM(NaN3)= 65 g/mol
PASO 3: EL SIGUIENTE PASO ES AJUSTAR LA ECUACION, PARA ELLO
También podría gustarte
- CCNN Guia #2 de SeptiembreDocumento7 páginasCCNN Guia #2 de SeptiembreMauricio AndradeAún no hay calificaciones
- Guia Autoaprendizaje Estudiante 2do Bto Ciencia s15Documento6 páginasGuia Autoaprendizaje Estudiante 2do Bto Ciencia s15Esmeralda LopezAún no hay calificaciones
- Guia Autoaprendizaje Estudiante 2do Bto Ciencia f3 s3 ImpresoDocumento7 páginasGuia Autoaprendizaje Estudiante 2do Bto Ciencia f3 s3 ImpresoAlexis OrellanaAún no hay calificaciones
- 1° Medio - Guía N°3 - Balance de Ecuaciones - Método Del Tanteo y Método Algebraico - Lunes 26 de AbrilDocumento3 páginas1° Medio - Guía N°3 - Balance de Ecuaciones - Método Del Tanteo y Método Algebraico - Lunes 26 de AbrilDenisse Alejandra Pinto CaroAún no hay calificaciones
- 3.-Balanceo Por Tanteo Con Ejercicios.Documento14 páginas3.-Balanceo Por Tanteo Con Ejercicios.Emmanuel MartinesAún no hay calificaciones
- Balance de EcuacionesDocumento14 páginasBalance de Ecuacioneskevin dominguez valenciaAún no hay calificaciones
- Guía Teórico Práctica: Unidad Nº1Documento14 páginasGuía Teórico Práctica: Unidad Nº1rayenvaldes2009Aún no hay calificaciones
- TeamGGM Balanceo de Ecuaciones QuimicasDocumento3 páginasTeamGGM Balanceo de Ecuaciones QuimicasLorenzo Andrés Sánchez CarreraAún no hay calificaciones
- 1 - B2 Reacciones Quã Micas-2Documento17 páginas1 - B2 Reacciones Quã Micas-2Kevin VegaAún no hay calificaciones
- 05 - UNIDAD I - EstequiometríaDocumento44 páginas05 - UNIDAD I - EstequiometríaManuel LabraAún no hay calificaciones
- Quimica Tarea3Documento13 páginasQuimica Tarea3Felipe VergaraAún no hay calificaciones
- PRUEBA MEDIA Balance de Ecuaciones QuimicasDocumento5 páginasPRUEBA MEDIA Balance de Ecuaciones Quimicasclaudio valenzuelaAún no hay calificaciones
- Balanceo de Ecuaciones UATDocumento14 páginasBalanceo de Ecuaciones UATLeonorToledoAún no hay calificaciones
- Modulo 4 Periodo Cuarto CeapDocumento28 páginasModulo 4 Periodo Cuarto CeapMarielena Santamaria ChapoñanAún no hay calificaciones
- Quimica 8.Documento5 páginasQuimica 8.Elmer ReyesAún no hay calificaciones
- Guía 5 NM1QUI 2023Documento6 páginasGuía 5 NM1QUI 2023Juan Eduardo Herrera SeguraAún no hay calificaciones
- Balanceo de EcuacionesDocumento24 páginasBalanceo de EcuacionestabletAún no hay calificaciones
- 2.2.1 Balanceó de Ecuaciones QuímicasDocumento8 páginas2.2.1 Balanceó de Ecuaciones QuímicasPerla SantiagoAún no hay calificaciones
- Balanceo de Una Reacción QuímicaDocumento4 páginasBalanceo de Una Reacción QuímicaGermán ChávezAún no hay calificaciones
- Entregable 1 - 3PDocumento2 páginasEntregable 1 - 3PNath 23Aún no hay calificaciones
- Modulo 4 Periodo Cuarto CeapDocumento28 páginasModulo 4 Periodo Cuarto CeapMarielena Santamaria ChapoñanAún no hay calificaciones
- Balanceo de EcuaciónesDocumento11 páginasBalanceo de EcuaciónesRorinAún no hay calificaciones
- Capitulo 7. Reacciones y Ecuaciones Químicas 2022-IDocumento22 páginasCapitulo 7. Reacciones y Ecuaciones Químicas 2022-Iluis angel ruiz osorio100% (1)
- BalanceodereaccionesqumicasDocumento31 páginasBalanceodereaccionesqumicasEly RzAún no hay calificaciones
- Balance y Estequiometria de Las Reacciones QuimicasDocumento12 páginasBalance y Estequiometria de Las Reacciones QuimicasMichelle RodriguezAún no hay calificaciones
- Estequiometría - Educación FísicaDocumento20 páginasEstequiometría - Educación FísicaRolando LopezAún no hay calificaciones
- Repaso Ultimo Cepre IIIDocumento2 páginasRepaso Ultimo Cepre IIICN KramAún no hay calificaciones
- Balanceo de EcuacionesDocumento14 páginasBalanceo de EcuacionesMarco RodriguezAún no hay calificaciones
- Guia Resumen Ejercicios RenatoDocumento33 páginasGuia Resumen Ejercicios RenatoAlejandro GonzálezAún no hay calificaciones
- U1 Balanceo de Ecuaciones QuímicasDocumento21 páginasU1 Balanceo de Ecuaciones QuímicasJesus NavarroAún no hay calificaciones
- ESTEQUIOMETRIADocumento35 páginasESTEQUIOMETRIAAngel Humberto Bermudez ParraAún no hay calificaciones
- Anexo 3 Tarea 4 QuimicaDocumento4 páginasAnexo 3 Tarea 4 QuimicaEdna RuizAún no hay calificaciones
- Nstitucion Educativa Ditrital para El Desarrollo Del Talento HumanoDocumento4 páginasNstitucion Educativa Ditrital para El Desarrollo Del Talento HumanoMarioAún no hay calificaciones
- Balanceo de Ecuaciones QuímicasDocumento4 páginasBalanceo de Ecuaciones QuímicasjuanpabloizuAún no hay calificaciones
- Tarea Semana 4 Química IndustrialDocumento8 páginasTarea Semana 4 Química Industrialdarling100% (9)
- Tarea de QuimicaDocumento3 páginasTarea de QuimicaPedro RamirezAún no hay calificaciones
- Guia de Ejercicios para EstequiometriaDocumento7 páginasGuia de Ejercicios para EstequiometriaMarlon Teshe SorianoAún no hay calificaciones
- Cap 17 Quimica 3er Año - CorregidoDocumento14 páginasCap 17 Quimica 3er Año - CorregidoAlonso Flores BelloAún no hay calificaciones
- Balanceo de Ecuaciones Químicas2partescompletasDocumento9 páginasBalanceo de Ecuaciones Químicas2partescompletasDario MartínezAún no hay calificaciones
- Balanceo Por TanteoDocumento3 páginasBalanceo Por Tanteolorenzo quezadaAún no hay calificaciones
- Balanceo de Ecuaciones y EstequiometriaDocumento67 páginasBalanceo de Ecuaciones y EstequiometriaBlacho MolinaAún no hay calificaciones
- Unidad 7 REDOX y Metodo AlgebraicoDocumento4 páginasUnidad 7 REDOX y Metodo AlgebraicoMariale Arauz RizoAún no hay calificaciones
- Como Ajustar Reacciones Quimicas 1Documento3 páginasComo Ajustar Reacciones Quimicas 1Ariel HiramAún no hay calificaciones
- Reacciones QuímicasDocumento48 páginasReacciones QuímicasLily100% (1)
- Balanceo de Ecuaciones QuimicasDocumento2 páginasBalanceo de Ecuaciones QuimicasEddy PomaAún no hay calificaciones
- Balanceo 3ra AsignaciónDocumento11 páginasBalanceo 3ra AsignaciónMaria BravoAún no hay calificaciones
- Guía 2.1. Introducción Al Equilibrio QuímicoDocumento8 páginasGuía 2.1. Introducción Al Equilibrio QuímicoSamali Pinzon CorreaAún no hay calificaciones
- Reacciones QuimicasDocumento70 páginasReacciones Quimicasjose31759Aún no hay calificaciones
- Josue LopezDocumento31 páginasJosue LopezWilber Gonzalez JimenezAún no hay calificaciones
- 21 Q2 U I Balanceo Ec QuímDocumento8 páginas21 Q2 U I Balanceo Ec QuímMICHELLE RODRIGUEZ VALLEJOAún no hay calificaciones
- Balance de Ecuaciones y Reactivo LimitanteDocumento4 páginasBalance de Ecuaciones y Reactivo LimitanteKatthy NiiColAún no hay calificaciones
- U5 - Estequiometría Rev1-ModDocumento11 páginasU5 - Estequiometría Rev1-ModrachelAún no hay calificaciones
- 10 Guía Balanceo de Ecuaciones Químicas.Documento2 páginas10 Guía Balanceo de Ecuaciones Químicas.Liliana HernándezAún no hay calificaciones
- Ejercicios ResueltosDocumento2 páginasEjercicios ResueltosYhonatan Gaspar ReyesAún no hay calificaciones
- Quimica 6Documento50 páginasQuimica 6Ivan CisnerosAún no hay calificaciones
- Balance de Ecuaciones QuímicasDocumento12 páginasBalance de Ecuaciones QuímicasDaleskaAún no hay calificaciones
- ESTEQUIOMETRÍADocumento10 páginasESTEQUIOMETRÍADanna MartínezAún no hay calificaciones
- Balanceo de Reacciones Químicas2Documento6 páginasBalanceo de Reacciones Químicas2MANUELAún no hay calificaciones
- Balanceo Por TanteoDocumento3 páginasBalanceo Por Tanteolucely casango de la cruzAún no hay calificaciones
- Induccion Prueba de HeinzDocumento6 páginasInduccion Prueba de Heinzlucely casango de la cruzAún no hay calificaciones
- GastritisDocumento9 páginasGastritislucely casango de la cruzAún no hay calificaciones
- Enlace Quimico TrabajoDocumento1 páginaEnlace Quimico Trabajolucely casango de la cruzAún no hay calificaciones
- Division CelularDocumento1 páginaDivision Celularlucely casango de la cruzAún no hay calificaciones
- ESTEQUIOMETRÍADocumento25 páginasESTEQUIOMETRÍAJosé Carlos Torres VarillasAún no hay calificaciones
- Balanceo de Ecuaciones Por El Método de Gauss JordanDocumento3 páginasBalanceo de Ecuaciones Por El Método de Gauss JordanMaría José MorenoAún no hay calificaciones
- Rigidez de Nodos Metabólicos en La Producción de Lisina y PHB Desarrollado Por Los AlumnosDocumento8 páginasRigidez de Nodos Metabólicos en La Producción de Lisina y PHB Desarrollado Por Los AlumnosKeysi MoralesAún no hay calificaciones
- Balance de MateriaDocumento82 páginasBalance de MateriaIng Ronald Portales100% (1)
- Laboratorio Unidad N° 3 EstequiometríaDocumento5 páginasLaboratorio Unidad N° 3 EstequiometríaCristian MoraAún no hay calificaciones
- Preguntas Finales Quimica Uteq s1 2014 A J WDocumento24 páginasPreguntas Finales Quimica Uteq s1 2014 A J WCristh Adrian SilvaAún no hay calificaciones
- Reactivo LimiteDocumento5 páginasReactivo LimiteAngela Pinzón100% (1)
- Práctica 12. EstequiometríaDocumento6 páginasPráctica 12. EstequiometríaValentina LinaresAún no hay calificaciones
- TeoriaDocumento2 páginasTeoriaLuigui Ayrton Marcelo EspinozaAún no hay calificaciones
- Relacion de La Masa Con Las Reacciones Quimicas - Parte I IDocumento22 páginasRelacion de La Masa Con Las Reacciones Quimicas - Parte I IAlegria DlacosteAún no hay calificaciones
- Universidad Nacional de Ancash Santiago Antúnez de MayoloDocumento14 páginasUniversidad Nacional de Ancash Santiago Antúnez de MayoloKiara Jursiny Villenueva DominguezAún no hay calificaciones
- Balance de Materia Con Reacción QuimicaDocumento25 páginasBalance de Materia Con Reacción QuimicaYessiA.DelRioAún no hay calificaciones
- Práctica 5Documento4 páginasPráctica 5Adolfo HernandezAún no hay calificaciones
- QuimicaDocumento8 páginasQuimicaxp40Aún no hay calificaciones
- Marco Teórico Con BiblioDocumento7 páginasMarco Teórico Con BiblioDaniel RiañoAún no hay calificaciones
- Introducción A La EstequiometríaDocumento36 páginasIntroducción A La EstequiometríaEsteban Gabriel SaldiviaAún no hay calificaciones
- Calculos Quimicos PDFDocumento110 páginasCalculos Quimicos PDFMiriam Cantón ReyesAún no hay calificaciones
- Borrador Actividad Final QUIMICADocumento29 páginasBorrador Actividad Final QUIMICAivis mariaAún no hay calificaciones
- La Importancia Del Estudio de La Estequiometría y Su Aplicablilidad en La IndustriaDocumento9 páginasLa Importancia Del Estudio de La Estequiometría y Su Aplicablilidad en La IndustriaHUMBERTO RIVASAún no hay calificaciones
- Teoria y Ejercicios Nomenclatura, Reacciones, Estequiometria, Electroquimica PDFDocumento33 páginasTeoria y Ejercicios Nomenclatura, Reacciones, Estequiometria, Electroquimica PDFAderly PacoAún no hay calificaciones
- Balanceo de Ecuaciones Químicas2partescompletasDocumento9 páginasBalanceo de Ecuaciones Químicas2partescompletasDario MartínezAún no hay calificaciones
- Articulo Sobre Combustion de Lina Coronado 804Documento3 páginasArticulo Sobre Combustion de Lina Coronado 804Li JuAún no hay calificaciones
- Cinetica Quimica - Informe N°13Documento14 páginasCinetica Quimica - Informe N°13Mary Carmen CastroAún no hay calificaciones
- Química GeneralDocumento8 páginasQuímica GeneralPaulina Mendoza B.Aún no hay calificaciones
- Estequiometrã ADocumento20 páginasEstequiometrã ABraian FlorianAún no hay calificaciones
- Contenido Programático Quimica General 2019 IIDocumento14 páginasContenido Programático Quimica General 2019 IIMiguelAún no hay calificaciones
- Sbo Gálvez Balance de Materia y Energia Iq 2020-IDocumento11 páginasSbo Gálvez Balance de Materia y Energia Iq 2020-IHarold Isai Silvestre GómezAún no hay calificaciones
- Qui-Semana #8-Ordinario 2020-IiDocumento12 páginasQui-Semana #8-Ordinario 2020-IiJorge Cesar Rojas RamosAún no hay calificaciones
- Estequiometria #8Documento7 páginasEstequiometria #8Alvaro QuinteroAún no hay calificaciones
- Antología Quimica 2Documento156 páginasAntología Quimica 2Tirado JosefinaAún no hay calificaciones