Portada
Asignatura de Fisiología Humana - Práctico
Tarea 11 : Osmolaridad
Semestre Académico 2021-I (5º Ciclo)
INTEGRANTES:
• Barrantes Aguilar Flavia (2019120874)
• Bejarano Gonzales Katie (201644060)
• Cabredo Reyes Mariarosa(2018219792)
• Cadenillas Bustamante Jhonny (2019152701)
• Castillo Carrión Fátima Karina (2019152785)
• Estela Zamora Edwin (2018217999)
• García Navarrete María Clara (2019127844)
• Gutierrez Guevara Luis (2017223213)
• Gutierrez Rivera Shirley Mileiny (2019153018)
• Martínez Cerna Alex Jean Pierre (2018219985)
• Mendoza Cubas Ingridm Pamela (2019127936)
• Montaño Santa Cruz Shantal Niccol (2019121019)
• Quispe Estela Yessy Milagros (2018218099)
• Ramirez Vera Olga Arlet (2014440113)
• Rivas Chambergo Zahira Elizabeth (2019153433)
• Rodas Sembrera Antenor (2019153442)
• Salazar Diaz Juan Miguel (2019153503)
• Torres Cabanillas Christhopher (2017222488)
• Verástegui Talledo Gabriela (2019153666)
• Verona Aguilar Romina Briggit (2016117702)
• Villón Huayama César Oswaldo (2018220268)
• Yllescas Castillo Camila Alexandra (2016117727)
• Yovera Bravo Jhon (000072650505)
DOCENTE:
• Nestor Manuel Rodriguez Alayo
Chiclayo, Perú
Sábado 22 de mayo de 2021
1
� INTRODUCCIÓN
El desplazamiento del agua entre los espacios intra y extracelular, está
determinada por la diferencia de concentración de solutos suficientemente
activos a cada lado de las membranas celulares. La medida del número total de
solutos en una solución se denomina osmolaridad. Esta se relaciona
directamente con la concentración molar de todos los solutos y con el número de
partículas en las que se disocian en dicha disolución. Los principales
determinantes de la osmolaridad plasmática son el sodio, la glucosa y la urea.
Cuando la osmolaridad de un compartimiento disminuye, el agua se desplaza al
compartimiento de mayor osmolaridad, con el fin de igualar las diferencias de
osmolaridad. Ya que la concentración de agua en una solución depende del
número de partículas de soluto en la solución, es necesario un término referido
a la concentración para describir la composición total de partículas de soluto, sin
importar su composición exacta. El número total de partículas en una solución
se mide en osmoles. Un osmol (osm) es igual a 1 mol (6,02x10 23-) de partículas
de soluto, sin importar su composición exacta. Una solución que contenga 1 mol
de glucosa en cada litro tiene una concentración de 1osm/l. Una solución que
contenga1 mol de una molécula que se disocia en tres iones, como el sulfato de
sodio: Na 2 SO2, contendrá 3 osm/l. Luego el osmol, es una entidad demasiado
grande para expresar la actividad osmótica de los solutos en los líquidos
corporales. En general se usa el término miliosmol (mOsm) que es igual a
1/1.000 osmoles.
2
� OBJETIVOS
✓ Identificar las variables independientes de la regulación osmolar y
comprender el comportamiento de las variables dependientes.
✓ Comprender y calcular las concentraciones de las diferentes soluciones
con efecto osmótico. Conocer los diferentes solutos que contribuyen a
la osmolalidad plasmática.
✓ Identificar las diferencias entre Osmolalidad y Osmolaridad plasmática.
3
� MARCO TEÓRICO
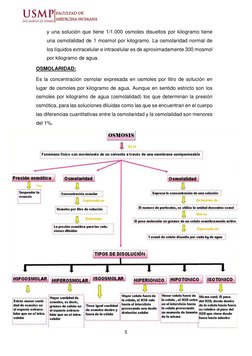
ÓSMOSIS Y PRESIÓN OSMÓTICA.
Las membranas celulares son relativamente impermeables a la mayoría de los
solutos, pero muy permeables al agua (es decir, son permeables
selectivamente), donde quiera que haya una mayor concentración de soluto a un
lado de la membrana celular, el agua se difundirá a través de la membrana hacia
la región de mayor concentración de soluto. Así, si se añade un soluto como el
cloruro de sodio al líquido extracelular, el agua difundirá rápidamente desde las
células a través de las membranas celulares hacia el líquido extracelular hasta
que la concentración de agua en los dos lados se iguales.
Por el contrario, si se extrae un soluto como el cloruro de sodio del líquido
extracelular, el agua difunde desde el líquido extracelular a través de las
membranas celulares y hacia el interior de las células. La velocidad de la difusión
del agua se denomina velocidad de la ósmosis.
OSMOLALIDAD: EL OSMOL
✓ Para expresar la concentración de una solución en función del número de
partículas se utiliza la unidad denominada osmol en lugar de los gramos.
✓ Un osmol es el peso molecular-gramo de un soluto osmóticamente activo.
Por tanto, 180 g de glucosa, que es el peso molecular-gramos de la
glucosa, son equivalentes a un osmol de glucosa porque la glucosa no se
disocia en iones. Si un soluto se disocia en dos iones, un peso
moleculargramo del soluto se convertirá en dos osmoles porque el número
de partículas osmóticamente activas es ahora el doble que en el caso del
soluto no disociado. Por tanto, cuando
está totalmente disociado, un peso
molecular-gramo de cloruro sódico,
58,5 g, es igual a dos osmoles.
✓ Así, se dice que una solución que tiene
✓ 1 osmol de soluto disuelto por cada
kilogramo de agua tiene una
osmolalidad de 1 osmol por kilogramo,
4
� y una solución que tiene 1/1.000 osmoles disueltos por kilogramo tiene
una osmolalidad de 1 mosmol por kilogramo. La osmolaridad normal de
los líquidos extracelular e intracelular es de aproximadamente 300 mosmol
por kilogramo de agua.
OSMOLARIDAD:
Es la concentración osmolar expresada en osmoles por litro de solución en
lugar de osmoles por kilogramo de agua. Aunque en sentido estricto son los
osmoles por kilogramo de agua (osmolalidad) los que determinan la presión
osmótica, para las soluciones diluidas como las que se encuentran en el cuerpo
las diferencias cuantitativas entre la osmolaridad y la osmolalidad son menores
del 1%.
5
� EJERCICIOS
1. Calcular la Osmolaridad de las siguientes soluciones:
a. 1 litro de Cloruro de sodio 0.9%
Paso1:Convertimos estaconcentración a g/L:
100 ml…….. 0.9 g X: 9 g/L
1000ml…….X
Paso 2: Reemplazar ese valor en la expresión:
mOsmol/L : [9 g/L / 58.5 g/mol] x 2 x 1000: 307.7 mOsmol/L
b. 1 ampolla de 20cc de Cloruro de sodio al 14.9%
Paso1:Convertimos estaconcentración a g/L:
0,1 L …….. 14.9 g X: 2.98 g/L
0,02 L …….X
Paso 2: Reemplazar ese valor en la expresión:
mOsmol/L : [2.98 g/L / 58.5 g/mol] x 2 x 1000: 101.9 mOsmol/L
c. 1 ampolla de 20 ml de Cloruro de sodio al 20%
Paso 1.
Convertimos esta concentración a g/L de la siguiente manera:
0,1 L……….20 g X= 4 g/L
0, 02 L………X
Paso 2.
Reemplazamos este valor en la expresión:
mOsmol/L= [4 g/L / 58.5 g/mol] x 2 x 1000 : 136, 75mOsmol/ L
d. 1 ampolla de 10 cc de Cloruro de potasio 14.9%
Conversión de g/L
0,1 L ………… 14,9 g X: 1,49 g/L
0,01 L ………… X
Reemplazo del valor en
mOsmol/L= [1,49 g/L / 74,5513 g/mol] x2 x1000: 39,9 mOsmol/L
6
�e. 1 ampolla de 20 cc de Cloruro de potasio 20%
Convertimos esta concentración a g/L:
0,1L ….. 20g X=4 g/L
0,02L …. X
Reemplazamos el valor obtenido de la siguiente manera:
mOsmol=(4 g/L)/(74,55 g/mol)×2×1000=107.31 mOsmol / L
f. 1 litro de dextrosa al 5%
Convertimos esta concentración a g/L:
100mL …. 5g X = 50g/L
1000mL …. X
Reemplazamos el valor obtenido de la siguiente manera:
50 𝑔/𝐿
𝑚𝑂𝑠𝑚𝑜𝑙 = × 2 × 1000 = 𝟐𝟕𝟕. 𝟕 𝒎𝑶𝒔𝒎𝒐𝒍 / 𝑳
180 𝑔/𝑚𝑜𝑙
2. Cuantos mEq hay en las siguientes soluciones:
a. 1 ampolla de 20 cc de ClNa al 20%
20g ClNa ------------ 100 ml
X ------------ 20 ml
X = 4g = 4 000mg
𝒎𝒈
• = 𝒎𝑬𝒒
𝒑𝒆𝒔𝒐 𝒂𝒕ó𝒎𝒊𝒄𝒐
𝟒 𝟎𝟎𝟎𝒎𝒈
• = 𝟔𝟖. 𝟒𝟒 𝒎𝑬𝒒
𝟓𝟖.𝟒𝟒𝒎𝒈
RESULTADO: En una ampolla de 20 cc de ClNa al 20% hay 68.44 mEq.
b. cuantos mEq de K hay en una ampolla de 1g de ClK
• 1 g = 1 000 mg
7
� 𝒎𝒈
• 𝒑𝒆𝒔𝒐 𝒂𝒕ó𝒎𝒊𝒄𝒐
= 𝒎𝑬𝒒
𝟏 𝟎𝟎𝟎 𝒎𝒈
• = 𝟏𝟑. 𝟒𝟏 𝒎𝑬𝒒
𝟕𝟒.𝟓𝟓 𝒎𝒈
RESULTADO: En una ampolla de 1 gramo de CIK hay 13.41 mEq de potasio.
c. Cuantos mEq de bicarbonato existen en una ampolla de 20cc de
bicarbonato 8.4%
1) calcular la masa total de NaCl:
8,4 g HCO3 -------------- 100ml
X 20ml
X = 1,68g = 1680mg de HCO3/1(valencia) = 1680mg
2) Por último, calculamos el número de meq:
1 meq de NaCl ----------- 61 mg
X 1680mg
X = 27,55 mEq de HCO3
d. Cuantos mEq de calcio hay en una ampolla de 10cc de cloruro de calcio
al 10%
1) Calculamos la masa total de NaCl:
10g CaCl -------------- 100ml
X ------------------- 10ml
X = 1g = 1000mg de ClNa/1(valencia) = 1000mg
2) Calcular el número de meq:
1 meq de CaCl ------------- 110,98mg
X 1000mg
X = 9,01 meq de Ca
9,01 meq de Cl
3. Calcule la osmolaridad plasmática de un paciente con el siguiente perfil:
Sodio 148 mEq/l Potasio 3.5 mEq/l Cloro 105 mEq/l
Calcio 9.8 mEq/l Glucosa 380 mg% Urea 80 mg% Creatinina 0.5 mg%
𝒈𝒍𝒖𝒄𝒐𝒔𝒂 𝒖𝒓𝒆𝒂
𝟐𝑵𝒂 + +
𝟏𝟖 𝟐. 𝟖
𝒎𝑬𝒒 𝟑𝟖𝟎 𝒎𝒈% 𝟖𝟎𝒎𝒈%
𝟐 (𝟏𝟒𝟖 )+ +
𝒍 𝟏𝟖 𝟐. 𝟖
𝟐𝟗𝟔 + 𝟐𝟖. 𝟓𝟕 + 𝟐𝟏. 𝟏𝟏𝟏 = 𝟑𝟒𝟓. 𝟔𝟖 𝒎𝑶𝒔𝒎𝒐𝒍
Interpretación: El paciente presenta hiperosmolaridad, los valores normales
osmolares son de 280 a 295 mOsmol/L.
8
� CUESTIONARIO
1. ¿Cuál es la diferencia de osmolaridad plasmática y osmolalidad
plasmática?
La osmolaridad plasmática es la concentración molar de todas las partículas
osmóticamente activas en un litro de plasma.
La osmolalidad plasmática es esta misma concentración pero referida a 1 kg de
agua. Osmoralidad y osmolalidad son más o menos equivalentes para las
soluciones muy diluidas (1kg= 1 litro de disolución), lo que no es el caso del
plasma, ya que 1litro de plasma contiene 930 ml de agua (proteínas y lípidos:
7% del volumen plasmático).
2. ¿Los osmómetros de laboratorio pueden servir para medir la
osmolaridad?
Se denomina osmómetro a los aparatos utilizados para determinar la
osmolaridad de las soluciones, es decir las concentraciones efectivas de solutos
que causan la presión osmótica entre una solución y un solvente.
Consiste en un tubo transparente ensanchado por su parte inferior, cuya abertura
se halla tapada con una membrana semipermeable. La disolución que se ha de
medir se vierte en un tubo y este se sumerge en un recipiente que contenga
agua, la cual atraviesa la membrana y hace subir el nivel del líquido en el tubo
hasta que se establezca el equilibrio: la altura a la que se ha elevado dicho nivel
indica la presión osmótica de la disolución estudiada.
La osmolaridad plasmática se mide con el osmómetro; si esto no es posible se
puede calcular mediante fórmulas.
Podemos calcular la osmolaridad plasmática a través de las concentraciones
molares de los tres solutos mayores: Sodio, glucosa y urea, mediante la siguiente
fórmula.
9
�3. ¿Cuál es el principal reflejo de la hidratación intracelular?
• La osmolaridad plasmática es la concentración molar de todas las
partículas osmóticamente activas en un litro de plasma. El 95% de
su valor se debe a la natremia, principal reflejo de la hidratación
intracelular.
• Corresponde a la concentración en plasma de moléculas
osmóticamente activas, es decir, con capacidad de ejercer presión
osmótica (presión necesaria para detener el flujo de agua a través
de una membrana semipermeable).
• En el laboratorio, los osmómetros miden la osmolaridad, puesto
que suelen emplear el descenso crioscópico del plasma para su
determinación.
• La osmolaridad viene determinada por el número de
partículas por Kg de agua (mOsm / Kg).
• Los solutos no disociables, como glucosa o albúmina,
generan 1mOsm / mmol de partícula, las ventas
disociables, ej. ClNa, liberan 2 iones en solución y
generan 2 mOsm / mmol de sal.
• La osmolaridad de los fluidos corporales se mantiene
entre 280-295mOsm / Kg.
• Como los fluidos corporales fluyen hasta conseguir iso-
osmolaridad entre compartimentos, la osmolaridad
plasmática refleja la osmolaridad corporal.
4. ¿Qué solutos necesarios a la osmolaridad plasmática?
La osmolaridad plasmática está determinada por la relación entre los
solutos (básicamente sodio, cloro y otros iones) y el agua corporal. Los
mecanismos que determinan la osmolaridad plasmática son distintos a
aquellos envueltos en la regulación del volumen, si bien existe una
relación estrecha entre ambos.
10
�Los cambios en la osmolaridad plasmática, determinada primariamente
por la concentración de sodio, son sensados por osmorreceptores
ubicados en el hipotálamo. Estos temas la ingesta y excreción de agua a
través del mecanismo de la sed y de la secreción de hormona antidiurética
(ADH). La disminución en la osmolaridad plasmática inhibe fuertemente la
secreción de ADH, eliminándose agua libre por la orina.
Lo contrario o curre en situaciones de hiperosmolaridad, en que el
aumento en la permeabilidad de los tubos colectores del riñón inducido
por la ADH producir reabsorción de agua libre.
11
� CONCLUSIONES
✓ La osmolaridad es la cantidad de solutos que posee una solución por cada
litro de solución y la presión osmótica es la fuerza que se ejerce para
contrarrestarla ósmosis. Estos conceptos tienen funciones importantes en
el organismo en el manejo, absorción y filtración de agua en todo el medio
interno. Esto es usado para la determinación del medio híper, isotónico
donde la célula tendrá un comportamiento distinto.
✓ El cuerpo humano posee regulación de todos los procesos osmóticos,
donde posee una respuesta vital ante procesos fisiopatológicos como el
caso de los demás o la deshidratación. La regulación del agua está dada
por hormonas producidas desde el hipotálamo para el aumento de la sed
o para inhibición de las diuresis (ADH), además del sistema renal es capaz
de eliminar distintas concentraciones en la orina para poder regular el
equilibrio osmolar normal.
✓ El agua se distribuye p o el cuerpo entre dos compartimientos principales:
intracelular y extracelular. El compartimiento intracelular es el mayor, y
representa aproximadamente dos tercios del agua corporal. El
compartimento extracelular, que representa aproximadamente un tercio
del agua corporal incluye el líquido plasmático y el líquido intersticial.
Ambos compartimentos diferentes concentraciones de diferentes
sustancias como iones, proteínas, entre otros.
✓ La concentración osmolar de una solución se denomina osmolalidad
cuando la concentración se expresa en osmoles por Kg de agua; y se
llama osmolaridad cuando se expresa en osmoles por litro de solución
12
�REFERENCIAS BIBLIOGRÁFICAS
1. Herrera S, Egea M, Martínez S. Principios básicos de la ósmosis y la
presión oncótica. Cálculo de la osmolalidad plasmática (OSMP).
Fundación para la formación e investigaciones sanitarias.18 oct 2018
[citado 21 mayo 2021]. Disponible en:
http://www.ffis.es/volviendoalobasico/2principios_bsicos_de_la_smosis_
y_la_presin_onctica_clculo_de_la_osmolalidad_plasmtica_osmp.html#:~
:text=El%20desplazamiento%20del%20agua%20entre,una%20soluci%C
3%B3n%20se%20denomina%20osmolaridad.
2. Fernández N. Manual de laboratorio de Fisiología. 2021. [citado 21 mayo
2021]. Disponible en:
https://accessmedicina.mhmedical.com/book.aspx?bookid=1722&isMissi
ngChapter=true
3. Principios básicos de ósmosis y presión oncótica. Cálculo de la
osmolaridad plasmática. Internet. (Citado el 22 de Mayo de 2021).
Disponible en
http://www.ffis.es/volviendoalobasico/2principios_basicos_de_la_osmosi
s_y_la_presión_oncotica_calculo_de_la_osmolaridad_plasmática_osmp.
html.
4. Seom.org. Unidades. Fórmulas de conversión y principales electrolitos.
Pesos y medidas [citado el 22 de mayo de 2021]. Disponible en:
https://seom.org/seomcms/images/stories/recursos/infopublico/publicacio
nes/soporteNutricional/pdf/anexo_06.pdf
5. Guyton, A, Hall J. Compartimentos del líquido corporal: líquido
extracelular e intracelular; edema. “Tratado de Fisiología médica". 13ª Ed.
Madrid. Interamericana-McGraw-Hill; 2016.
6. Principios básicos del ósmosis y la presión oncótica. Cálculo de la
osmolaridad plasmática (OSMP) [Internet]. [citado el 22 ]. Disponible en:
http://www.ffis.es/volviendoalobasico/2principios_bsicos_de_la_smosis_
y_la_presin_onctica_clculo_de_la_osmolalidad_plasmtica_osmp.html
13