0% encontró este documento útil (0 votos)
83 vistas36 páginasFundamentos de la Combustión Química
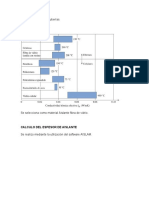
Este documento trata sobre las instalaciones térmicas y las reacciones químicas de la combustión. Explica que la combustión es una reacción química entre un combustible y el oxígeno que libera calor. Describe los diferentes tipos de combustibles como sólidos, líquidos y gases, e incluye ejemplos como el carbón, petróleo y gas natural. También cubre conceptos como el poder calorífico de los combustibles, la cantidad de calor liberada al quemarlos, y la cantidad de aire necesaria para una combustión comple
Cargado por
Bernardo EscorciaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
83 vistas36 páginasFundamentos de la Combustión Química
Este documento trata sobre las instalaciones térmicas y las reacciones químicas de la combustión. Explica que la combustión es una reacción química entre un combustible y el oxígeno que libera calor. Describe los diferentes tipos de combustibles como sólidos, líquidos y gases, e incluye ejemplos como el carbón, petróleo y gas natural. También cubre conceptos como el poder calorífico de los combustibles, la cantidad de calor liberada al quemarlos, y la cantidad de aire necesaria para una combustión comple
Cargado por
Bernardo EscorciaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd