Documentos de Académico
Documentos de Profesional
Documentos de Cultura
ACTIVIDAD 12 - Geomtria Quimica
Cargado por
Bel RHMTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
ACTIVIDAD 12 - Geomtria Quimica
Cargado por
Bel RHMCopyright:
Formatos disponibles
ACTIVIDAD 12: GOMETRIA MOLECULAR
INSTRUCIONES: Investigar los siguientes conceptos lo más completo posible en
4 cuartillas, apóyate de los siguientes videos, así como puedes consultar
algunas otras fuentes confiables, posteriormente agrega la información solicitada
en la tabla.
•Estructura de un compuesto con enlace iónico: los compuestos iónicos son
estables la estructura de los compuestos iónicos se basa en redes cristalinas las
cuales están formadas por iones de carga contraria unidos por fuerzas
electroestáticas si la atracción entre los elementos guionizados es fuerte se da
paso a la formación de sólidos cristalinos cuyo punto de fusión a temperatura para
pasar del estado sólido al líquido es elevado y por lo tanto son insolubles en agua
por el contrario si la atracción a existente es menor por lo general son solubles en
agua los compuestos iónicos tienen las siguientes características son sólidos a
temperatura ambiente tienen altos puntos de fusión y evaporación son buenos
conductores eléctricos al estar disueltos se rompen fácilmente se disuelven
fácilmente no conducen bien el calor.
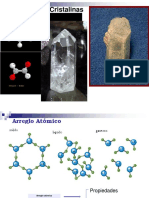
Estructura
La fórmula de los compuestos iónicos, indican la relación que existe entre los
iones que forman estos compuestos. Las sustancias iónicas, forman cristales de
diversas formas geométricas, en lo que las partículas fundamentales son iones,
que se mantienen unidos por fuerzas electrostáticas ejercidas en todas las
direcciones del espacio, desde cada ion en particular, a continuación se muestra
distintos tipos de estructuras iónicas.
Tipo de Tipo de
Coordinacion Ejemplos
estructura cristalización
Todos los haluros
Cúbica octaédrica
Cloruro de Anión: 6 de metales alcalinos y
(centrada en las
sodio (NaCl) Catión: 6 los óxidos y sulfuros de
caras)
metales Alcalinos-térreos
CsCl
Cloruro Anión: 8 Cúbica (centrada
CsBr
de cesio (CsCl) Catión: 8 en el cuerpo)
CsI
Blenda (Sulfuro Anión: 4 Tetraédrica Sulfuros, seleniuros,
telururos
dezinc, ZnS) Catión: 4
de cinc, cadmio y mercurio
Fluorita
Anión: 4 Difluoruros y dioxidos
(Sulfuro Cúbicatetraédrica
Catión: 8 metalicos
de calcio, CaF2)
SnO2
Rutilo (Óxido Anión: 3 Octaédrica
MnO2
de titanio, TiO2) Catión: 6 triangular
IrO2
•Estructura de un compuesto con enlace metálico
Los átomos de los metales se agrupan de forma muy cercana unos a otros, lo que
produce estructuras muy compactas. Se trata de redes tridimensionales que
adquieren estructuras tales como: la típica de empaquetamiento compacto de
esferas (hexagonal compacta ), cubica centrada en las caras o la cubica centrada
en el cuerpo en las tres dimensiones, por lo que quedan los núcleosodeados de
tales nubes.
En este tipo de estructura cada átomo metálico está rodeado por otros doce
átomos (seis en el mismo plano, tres por encima y tres por debajo).
Además, debido a la baja electronegatividad que poseen los metales, los
electrones de valencia son extraídos de sus orbitales y tienen la capacidad de
moverse libremente a través del compuesto metálico, lo que otorga a éste las
propiedades eléctricas y térmicas. Este enlace sólo puede presentarse en
sustancias en estado sólido.
Los elementos con un enlace metálico están compartiendo un gran número de
electrones de valencia, formando un mar de electrones rodeando un enrejado
gigante de cationes.
Muchos de los metales tienen puntos de fusión más altos que otros elementos no
metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los
distintos átomos que los componen. La vinculación metálica es no polar, apenas
hay diferencia de electronegatividad entre los átomos que participan en la
interacción de la vinculación (en los metales elementales puros) o muy poca (en
las aleaciones), y los electrones implicados en lo que constituye la interacción a
través de la estructura cristalina del metal.
•Geometría de un compuesto con enlace covalente
Geometría molecular o estructura molecular es la disposición tri-dimensional de
los átomos que constituyen una molécula. Determina muchas de las propiedades
de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo,
actividad biológica, etc. Dado que el movimiento de los átomos en una molécula
está determinado por la mecánica cuántica, uno debe definir el "movimiento" de
una manera cuántica.
Los movimientos cuánticos (externos) de traslación y rotación cambian
fuertemente la geometría molecular. (En algún grado la rotación influye en la
geometría por medio de la fuerza de Coriolis y la distorsión centrífuga, pero son
despreciables en la presente discusión).
Un tercer tipo de movimiento es la vibración, un movimiento interno de los átomos
en una molécula. Las vibraciones moleculares son armónicas (al menos en una
primera aproximación), lo que significa que los átomos oscilan en torno a su
posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero
absoluto todos los átomos están en su estado vibracional basal y muestran
movimiento mecánico cuántico de punto cero, esto es, la función de onda de un
modo vibraciones simple no es un pico agudo, sino un exponencial de ancho finito.
A temperaturas mayores, los modos vibraciones pueden ser excitados
térmicamente (en un interpretación clásica, esto se expresa al enunciar que "las
moléculas vibrarán más rápido"), pero siempre oscilan alrededor de una geometría
reconocible para la molécula.
La geometría molecular (GM) es la distribución tridimensional de los átomos de
una molécula.
La geometría que adopta una molécula es aquella en la que la repulsión
electrónica es mínima. La forma de una molécula se representa indicando las
posiciones de los átomos en el espacio prescindiendo de los pares solitarios que
pueda tener.
Este enfoque para estudiar la geometría molecular se denomina “Modelo de la
repulsión de los pares electrónicos de la capa de valencia” (RPECV) o (RPENV),
ya que explica la distribución geométrica de los pares electrónicos que rodean al
átomo central, en términos de la repulsión electrónica entre dichos pares. Es una
forma muy sencilla de predecir las formas de las especies que tienen elementos
de los grupos principales como átomos centrales. Según el modelo de repulsión
los pares de electrones estarán tan alejados entre sí en el espacio tridimensional
como sea posible
Este modelo propone que la forma de una molécula o ion se puede relacionar con
alguna de las cinco formas de acomodamientos de los pares de electrones
Para predecir la geometría molecular con el modelo RPECV se debe proceder de
la siguiente manera:
1) Escribir la estructura de Lewis de la molécula o ión.
2) Contar el número total de pares de electrones que rodean al átomo central
(contando los átomos y los pares no compartidos) y acomodarlos de modo tal que
se minimicen las repulsiones entre pares de electrones. Recordar que los pares no
compartidos ocupan más espacio que los compartidos.
3) Describir la geometría molecular en términos de la disposición angular de los
pares enlazantes.
4) Un doble o triple enlace se cuenta como un par enlazante al predecir la
geometría
COMPUESTO ESTRUCTURA DE GEOMETRIA ANGULO NOMBRE DE
LEWIS LA
GEOMETRIA
H2O Posee dos 105º Es molecular
enlaces simples angular
O - H y tiene dos
pares de
electrones no
enlazantes en el
átomo de
oxígeno.
NH3 Posee en el 107.3º Es piramidal
orbital superior trigonal
del tetraedro un
par de
electrones libres,
de no enlace,
uniéndose los
átomos de
hidrógeno al
nitrógeno en los
tres vértices
restantes del
tetraedro
CH4 Es apolar y 109º Tetraédrica
presenta
geometría
tetraédrica
formando 4
enlaces C-H que
son idénticos
entre sí.
BH3 Se combinan los 120º Plana
orbitales 2s y 2p triangular
del átomo de
boro para
producir tres
orbitales híbridos
sp2, de la misma
energía y
dirigidos en el
plano, desde el
átomo de boro,
hacia los vértices
de un triángulo
equilátero.
CO2 180° Lineal.
Para que los
pares de
electrones del
átomo central
estén lo más
apartados
posible, los
pares ligantes
correspondiente
s a los dos
dobles enlaces,
y por lo tanto los
dos átomos de
oxígeno, están
en posiciones
opuestas.
NaCl Se puede 90° tetraédrica
describir como
un empaquetado
cúbico compacto
de Na+ (o Cl-),
en el cual los Cl-
(o los Na+)
ocupan todas las
posiciones de
coordinación
octaédrica, es
decir, el centro
del cubo y los
centros de todas
las aristas.
También podría gustarte
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Enlace Iónico y CovalenteDocumento48 páginasEnlace Iónico y CovalenteLizet VeraAún no hay calificaciones
- Tarea N°7Documento10 páginasTarea N°7Daniel PaladinesAún no hay calificaciones
- 0sistema NerviosoDocumento27 páginas0sistema NerviosoalumnaAún no hay calificaciones
- Tallerr RecuperacionDocumento6 páginasTallerr RecuperacionOscar GomezAún no hay calificaciones
- Wa0079Documento31 páginasWa0079Sonidos RcaAún no hay calificaciones
- EnlaceDocumento39 páginasEnlaceIgnacioSotoCrisóstomoAún no hay calificaciones
- Compuestos de Coordinacion-Inorganica-sept - 2022Documento78 páginasCompuestos de Coordinacion-Inorganica-sept - 2022Cosas CuriosasAún no hay calificaciones
- Clase 9 SilicatosDocumento32 páginasClase 9 SilicatosSergio CordovaAún no hay calificaciones
- Características Del CarbonoDocumento2 páginasCaracterísticas Del CarbonoEliseo HuamanAún no hay calificaciones
- TAREA 2 - Geometría MolecularDocumento15 páginasTAREA 2 - Geometría MolecularJuan David Aparicio Valdes100% (1)
- Guia de Quimica 3Documento5 páginasGuia de Quimica 3nfmerqzAún no hay calificaciones
- PD 3Documento4 páginasPD 3Analy BcAún no hay calificaciones
- MA465 - S03 - S07 - CT03 - Enlace y Fuerzas IntermolecularesDocumento20 páginasMA465 - S03 - S07 - CT03 - Enlace y Fuerzas IntermolecularesPiero GonzagaAún no hay calificaciones
- 03 - Enlace y Fuerzas IntermolecularesDocumento20 páginas03 - Enlace y Fuerzas Intermolecularesalvaro santosAún no hay calificaciones
- Tarea de Ing de MaterialesDocumento11 páginasTarea de Ing de MaterialesSoyeth Jhoselyn Apaza SenciaAún no hay calificaciones
- Geometria de Los Compuestos OrganicosDocumento11 páginasGeometria de Los Compuestos OrganicosDanny Paredes LayzaAún no hay calificaciones
- PRINCIPALES CARACTERISTICAS DEL ATOMO PROPUESTO POR RutherfordDocumento9 páginasPRINCIPALES CARACTERISTICAS DEL ATOMO PROPUESTO POR RutherfordDaniel Erik Yang RevolloAún no hay calificaciones
- ACTIVIDAD 4 Estructura de Los Materiales (Parte 3) - T2Documento11 páginasACTIVIDAD 4 Estructura de Los Materiales (Parte 3) - T2Mejia Santiago Luis Guillermo N.L:23Aún no hay calificaciones
- CeramicosDocumento84 páginasCeramicosRojas S Edwin NAún no hay calificaciones
- Temas 1-2-3Documento6 páginasTemas 1-2-3Steve RamírezAún no hay calificaciones
- Modelos Moleculares - Informe 1Documento22 páginasModelos Moleculares - Informe 1Jvr Enriwell0% (3)
- Quimica Organica para Cuarto Grado de SecundariaDocumento10 páginasQuimica Organica para Cuarto Grado de SecundariaSute ChanchamayoAún no hay calificaciones
- Coordinación CompuestosDocumento48 páginasCoordinación CompuestosconriAún no hay calificaciones
- Teorias de Los Compuestos de Coordinación 2 MDocumento96 páginasTeorias de Los Compuestos de Coordinación 2 MDEYSI CATALINA HANAMPA SUMALAVEAún no hay calificaciones
- Formulacion y NomenclaturaDocumento33 páginasFormulacion y NomenclaturaMatias MatiasAún no hay calificaciones
- Adenda Cap 24 - Brown Lemay - Edicion 9Documento7 páginasAdenda Cap 24 - Brown Lemay - Edicion 9marisolAún no hay calificaciones
- Actividad #8Documento7 páginasActividad #8David JimenezAún no hay calificaciones
- Justifica Estas Afirmaciones FalsasDocumento9 páginasJustifica Estas Afirmaciones FalsasKevinJoshFernandez100% (1)
- Átomo de Carbono para Cuarto Grado de SecundariaDocumento9 páginasÁtomo de Carbono para Cuarto Grado de SecundariaMinisterio De Teatro Varones CcjAún no hay calificaciones
- Informe 8 Metales de TransicionDocumento14 páginasInforme 8 Metales de TransicionmelissaAún no hay calificaciones
- Ejercicios Del Tema 5: Uniones EntreDocumento5 páginasEjercicios Del Tema 5: Uniones Entreapi-26197440Aún no hay calificaciones
- Quimica Tema 4Documento7 páginasQuimica Tema 4Rodrigo GonzaAún no hay calificaciones
- PracticaDocumento15 páginasPracticaPamela RosarioAún no hay calificaciones
- SólidosDocumento27 páginasSólidossara gonzalezAún no hay calificaciones
- m2 - Quimica II TotalDocumento144 páginasm2 - Quimica II TotalYhair SifuentesAún no hay calificaciones
- Estructura Molecular - InteraccionesDocumento7 páginasEstructura Molecular - InteraccionesJHAROD ALEXIS CORTES FLORESAún no hay calificaciones
- Conceptos Basicos de QuimicaDocumento6 páginasConceptos Basicos de QuimicaFernando MoralesAún no hay calificaciones
- Corr Di NacionDocumento28 páginasCorr Di NacionHector RojasAún no hay calificaciones
- Tema 3 - Las Sustancias Quimicas - 3º Eso - Curso 2019-20Documento14 páginasTema 3 - Las Sustancias Quimicas - 3º Eso - Curso 2019-20Juan Carlos Contador Baladon100% (1)
- Curso Qo-1 PDFDocumento135 páginasCurso Qo-1 PDFRoberto PichardoAún no hay calificaciones
- Tratamientos TermicosDocumento55 páginasTratamientos Termicosmiguel angelAún no hay calificaciones
- Tema 2 ADocumento41 páginasTema 2 ALigia Dina SolisAún no hay calificaciones
- TEMA 9 Solidos Covalentes No MolecularesDocumento17 páginasTEMA 9 Solidos Covalentes No MolecularesTAMARAAún no hay calificaciones
- CLASE 3 Teoría Atómica, Nomenclatura y EstequiometríaDocumento46 páginasCLASE 3 Teoría Atómica, Nomenclatura y EstequiometríaDavid Martinez BravoAún no hay calificaciones
- Estructura Cristalina de Materiales IonicosDocumento8 páginasEstructura Cristalina de Materiales IonicosBrillit Alarcon QuirozAún no hay calificaciones
- Nucleo 4 - MineralesDocumento36 páginasNucleo 4 - MineralesAndrez HernandezAún no hay calificaciones
- 02 Apuntes Formulacion Organica-GUIADocumento59 páginas02 Apuntes Formulacion Organica-GUIArpd7vmmj28Aún no hay calificaciones
- Química Basica Di RisioDocumento5 páginasQuímica Basica Di RisioAgus ClusellaAún no hay calificaciones
- EstructuracristalinaDocumento104 páginasEstructuracristalinaSebastián Basilio Ortega López100% (1)
- Hibridación en ComplejosDocumento7 páginasHibridación en ComplejosMariana GarrónAún no hay calificaciones
- Solidos Ionicos PDFDocumento27 páginasSolidos Ionicos PDFEnrico169Aún no hay calificaciones
- La Fórmula Del Carácter Iónico de Un Compuesto Químico y Sus UsosDocumento3 páginasLa Fórmula Del Carácter Iónico de Un Compuesto Químico y Sus UsosMeilinMalfoyAún no hay calificaciones
- 2013 Solidos Ionicos2Documento90 páginas2013 Solidos Ionicos2Joyce PadillaAún no hay calificaciones
- 1 .1 Metales y Aleaciones MetálicasDocumento32 páginas1 .1 Metales y Aleaciones MetálicasJoanCastellóBelenguerAún no hay calificaciones
- Cap 1 Estructura CristalinaDocumento49 páginasCap 1 Estructura CristalinaSalvador AyalaAún no hay calificaciones
- Resumen Examen QuimicaDocumento10 páginasResumen Examen QuimicaScarlette Osorio MendozaAún no hay calificaciones
- 15 Introduccion A La Quimica Organica 2019Documento43 páginas15 Introduccion A La Quimica Organica 2019Leandro PorrasAún no hay calificaciones
- Visualización Camino de La PlayaDocumento1 páginaVisualización Camino de La Playamanuel fernandez cuarteroAún no hay calificaciones
- Estrella BinariaDocumento17 páginasEstrella BinariaJOAQUINAún no hay calificaciones
- ANALISIS - DE - ESTRUCTURAS - RETICULARES - Gere y Weaver PDFDocumento266 páginasANALISIS - DE - ESTRUCTURAS - RETICULARES - Gere y Weaver PDFFernando Carvajal100% (1)
- Cómo Iluminar Espacios Oscuros Con Luz NaturalDocumento20 páginasCómo Iluminar Espacios Oscuros Con Luz NaturalElitzaveruEryzoAún no hay calificaciones
- Cesar Macias Escamilla - Tarea Problema 9.4Documento7 páginasCesar Macias Escamilla - Tarea Problema 9.4Cesar MaciasAún no hay calificaciones
- VentiladoresDocumento29 páginasVentiladoresWilfredo RamirezAún no hay calificaciones
- PROCESO DE ESPECTROSCOPIA POR ABSORCIÓN ATÓMICA EN ATUN - Ggrupo - 12Documento23 páginasPROCESO DE ESPECTROSCOPIA POR ABSORCIÓN ATÓMICA EN ATUN - Ggrupo - 12Blesi AriasAún no hay calificaciones
- 15.cabina Cbii2a 36Documento53 páginas15.cabina Cbii2a 36ANGIE XIMENA BOLIVAR PRIETOAún no hay calificaciones
- 2011 Hoces Brugnoli y Jelvez RD3 ColoresDocumento4 páginas2011 Hoces Brugnoli y Jelvez RD3 ColoresJuan David Cortes LeonAún no hay calificaciones
- Pendientes Matematicas 1Documento31 páginasPendientes Matematicas 1sireohAún no hay calificaciones
- Cap 2 Progamacion de La GeneracionDocumento31 páginasCap 2 Progamacion de La GeneracionJhoamir Guzman DamianAún no hay calificaciones
- Diseno de GavionesDocumento1 páginaDiseno de Gavionesvictor enriqueAún no hay calificaciones
- T2 Abp3Documento3 páginasT2 Abp3Doris Gabriela NúñezAún no hay calificaciones
- Ingenieria Basica Del Puente UnocollaDocumento66 páginasIngenieria Basica Del Puente Unocollaerick mainarAún no hay calificaciones
- Pin Pon, Capacidades FisicasDocumento7 páginasPin Pon, Capacidades Fisicasadriana tamayAún no hay calificaciones
- Informe de Laboratorio Gases IdealesDocumento5 páginasInforme de Laboratorio Gases IdealesStiven Navarro OliveraAún no hay calificaciones
- 01 Solidos 2016 2 PDFDocumento4 páginas01 Solidos 2016 2 PDFPaul SalazarAún no hay calificaciones
- Plantilla Calculo Horas ExtrasDocumento8 páginasPlantilla Calculo Horas ExtrasMonica Romero VargasAún no hay calificaciones
- Informe de Trabajo AzocompuestosDocumento9 páginasInforme de Trabajo AzocompuestosJuan Carlos Alvarado FernándezAún no hay calificaciones
- Calculo de Caida de Tensión en Una CargaDocumento1 páginaCalculo de Caida de Tensión en Una CargaLeonardo MartinezAún no hay calificaciones
- Propiedades en Exceso 1Documento6 páginasPropiedades en Exceso 1Grecia Ali AlvaradoAún no hay calificaciones
- 2.guiatrabajo II P Fuerza ResultanteDocumento45 páginas2.guiatrabajo II P Fuerza ResultanteJohan Jose CapoteAún no hay calificaciones
- Ciencias Naturales 2022 - 2Documento43 páginasCiencias Naturales 2022 - 2Howard Duvan Sanchez GarciaAún no hay calificaciones
- FUNDAMENTOS DE ELECTRÓNICA Examen Parcial (2017-2018)Documento12 páginasFUNDAMENTOS DE ELECTRÓNICA Examen Parcial (2017-2018)matias fernando bengoecheaAún no hay calificaciones
- Unidad 3.5 Circuitos MultietapaDocumento25 páginasUnidad 3.5 Circuitos MultietapaLuis HinojosaAún no hay calificaciones
- Repartido 1 - 6toSHDocumento7 páginasRepartido 1 - 6toSHLourdesAún no hay calificaciones
- Trabajo Falla Tipo SerieDocumento26 páginasTrabajo Falla Tipo SerieJuan Velasco0% (1)
- Esfera Suspendida Sobre ParedDocumento2 páginasEsfera Suspendida Sobre ParedadminAún no hay calificaciones
- Quimica para El ConcretoDocumento122 páginasQuimica para El ConcretoRafaelAún no hay calificaciones
- Manual Filtros y Depósitos A Presión-02Documento12 páginasManual Filtros y Depósitos A Presión-02jose alberto sanchez torres100% (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Magia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioDe EverandMagia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Neurociencia en la escuela: Guía amigable (sin bla bla) para entender cómo funciona el cerebro durante el aprendizajeDe EverandNeurociencia en la escuela: Guía amigable (sin bla bla) para entender cómo funciona el cerebro durante el aprendizajeCalificación: 5 de 5 estrellas5/5 (5)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Había una vez el átomo: O cómo los científicos imaginan lo invisibleDe EverandHabía una vez el átomo: O cómo los científicos imaginan lo invisibleCalificación: 5 de 5 estrellas5/5 (3)
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- SNC - Soporte neurocrítico: De la urgencia a la terapia intensivaDe EverandSNC - Soporte neurocrítico: De la urgencia a la terapia intensivaAún no hay calificaciones
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- Cerebro y silencio: Las claves de la creatividad y la serenidadDe EverandCerebro y silencio: Las claves de la creatividad y la serenidadCalificación: 5 de 5 estrellas5/5 (2)
- El nuevo ser humano: Toque cuántico 2.0. Descubrir y evolucionarDe EverandEl nuevo ser humano: Toque cuántico 2.0. Descubrir y evolucionarCalificación: 4.5 de 5 estrellas4.5/5 (9)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)