Documentos de Académico
Documentos de Profesional
Documentos de Cultura
AMINOACIDOS
Cargado por
Diego RodriguezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
AMINOACIDOS
Cargado por
Diego RodriguezCopyright:
Formatos disponibles
AMINOACIDOS
¿Qué son los aminoácidos?
R// Un aminoácido es una molécula orgánica con un grupo amino y un grupo carboxilo.
Los aminoácidos son la base de las proteínas.
Funciones de los aminoácidos en el organismo: forman parte de las proteínas. actúan como
neurotransmisores o como precursores de neurotransmisores (sustancias químicas que
transportan información entre células nerviosas) ayudan a minerales y vitaminas a cumplir
correctamente su función.
Clases de aminoácidos
Dado que la secuencia de aminoácidos determina la configuración tridimensional final de
cada proteína, sus estructuras se analizan detalladamente en las siguientes cuatro
subsecciones. Los aminoácidos se pueden clasificar según su capacidad para interactuar con
el agua. Utilizando este criterio, pueden distinguirse cuatro clases: (1) apolares, (2) polares,
(3) ácidos y (4) básicos.
AMINOÁCIDOS APOLARES: Los aminoácidos apolares contienen principalmente
grupos R hidrocarbonados sin cargas positivas o negativas. Dado que interactúan poco con
el agua, los aminoácidos apolares (p. ej., hidrófobos) tienen un cometido importante en el
mantenimiento de la estructura tridimensional de las proteínas. En este grupo se encuentran
dos tipos de hidrocarburos en las cadenas R: las aromáticas y las alifáticas. Los
hidrocarburos aromáticos contienen estructuras cíclicas que los constituyen en una clase de
hidrocarburos insaturados con nubes electrónicas π conjugadas. El benceno es uno de los
hidrocarburos aromáticos más simples. El término alifático se refiere a hidrocarburos no
aromáticos, como el metano y el ciclohexano. La fenilalanina y el triptófano contienen
estructuras de anillo aromático. La glicina, la alanina, la valina, la leucina, la isoleucina y la
prolina poseen grupos R alifáticos. En las cadenas laterales alifáticas de la metionina hay
un átomo de azufre. La metionina contiene un grupo tioéter (—S—CH3) en su cadena
lateral. Su derivado, la adenosilmetionina S (SAM), es un importante metabolito que sirve
como donador de metilo en numerosas reacciones bioquímicas.
AMINOÁCIDOS POLARES Dado que los aminoácidos polares poseen grupos
funcionales capaces de formar enlaces (por puentes) de hidrógeno, interactúan de forma
sencilla con el agua (los aminoácidos polares se describen como “hidrófilos” o “afines al
agua”). Pertenecen a esta categoría, la serina, la treonina, la tirosina, la asparagina y la
glutamina. La serina, la treonina y la tirosina contienen un grupo hidroxilo polar, que les
permite participar en la formación de enlaces por puente de hidrógeno, un factor importante
en la estructura proteínica. Los grupos hidroxilo tienen otras funciones en las proteínas. Por
ejemplo, la formación del éster de fosfato de la tirosina es un mecanismo de regulación
habitual. Además, los grupos —OH de la serina y de la treonina son puntos de unión para
los carbohidratos. La asparagina y la glutamina son derivados amida de los aminoácidos
ácidos: del ácido aspártico y del ácido glutámico, respectivamente. Dado que el grupo
funcional amida es muy polar, la capacidad de formar enlaces por puente de hidrógeno de
la asparagina y de la glutamina posee un efecto significativo en la estabilidad proteínica. El
grupo sulfhidrilo (—SH) de la cisteína es muy reactivo y es un componente importante de
muchas enzimas. También se une con metales (p. ej., iones hierro y cobre) en las proteínas.
Además, los grupos sulfhidrilo de dos moléculas de cisteína se oxidan con facilidad en el
compartimento extracelular para formar un compuesto disulfuro llamado cistina.
AMINOACIDOS ACIDOS: En este grupo encontramos dos aminoácidos con cadenas
laterales de naturaleza ácida y sus amidas correspondientes. Estos son el ácido aspártico y
el ácido glutámico (a estos aminoácidos se les denomina normalmente aspartato y
glutamato par resaltar que sus cadenas laterales están cargadas negativamente a pH
fisiológico). Los derivados sin carga de estos dos aminoácidos son la asparragina y la
glutamina que contienen un grupo amida terminal en lugar del carboxilo libre.
AMINOÁCIDOS BÁSICOS Los aminoácidos básicos possen carga positiva a pH
fisiológico. Por lo tanto, pueden formar enlaces iónicos con los aminoácidos ácidos. La
lisina, que tiene un grupo amino en la cadena lateral, acepta un protón del agua para formar
el ácido conjugado (—NH3+). Cuando se oxidan y después se condensan las cadenas
laterales de las moléculas de lisina en las fibras de colágeno, un vital componente
estructural de los ligamentos y de los tendones, se forman fuertes enlaces cruzados
intramoleculares e intermoleculares. Debido a que el grupo guanidino de la arginina tiene
un intervalo de pKa de 11.5 a 12.5 en las proteínas, siempre está protonado a pH fisiológico
y, en consecuencia, no actúa en las reacciones ácido-base. Por otra parte, la cadena lateral
imidazol de la histidina, es una base débil porque sólo se ioniza de manera parcial en un pH
de 7, ya que su pKa es cercano a 6. Su capacidad, en condiciones fisiológicas, para aceptar o
donar protones como respuesta a los pequeños cambios en el pH tiene un papel importante
en la actividad catalítica de muchas enzimas.
LOS AMINOÁCIDOS SE CLASIFICAN SEGÚN SU CAPACIDAD PARA
INTERACTUAR CON EL AGUA.
Los aminoácidos esenciales son aquellos que el propio organismo no puede sintetizar por sí
mismo. Esto implica que la única fuente de estos aminoácidos en esos organismos es la
ingesta directa a través de la dieta.
Se llama aminoácidos no esenciales a todos los aminoácidos que el cuerpo puede sintetizar, y
que no precisa de ingesta directa en una dieta. En humanos se han descrito estos
aminoácidos no esenciales para la nutrición
También podría gustarte
- Guía 03. Método Cinetífico 2019BDocumento7 páginasGuía 03. Método Cinetífico 2019BDiego RodriguezAún no hay calificaciones
- DIGESTIVODocumento9 páginasDIGESTIVODiego RodriguezAún no hay calificaciones
- Trabajo EtnograficoDocumento4 páginasTrabajo EtnograficoDiego RodriguezAún no hay calificaciones
- Trabajo de EpidemiologiaDocumento1 páginaTrabajo de EpidemiologiaDiego RodriguezAún no hay calificaciones
- Adipocito Multi ACTDocumento3 páginasAdipocito Multi ACTDiego RodriguezAún no hay calificaciones
- Cuestionario Inmunologia ResueltoDocumento1 páginaCuestionario Inmunologia ResueltoBryan Gonzalez0% (1)
- Trabajo de EpidemiologiaaDocumento2 páginasTrabajo de EpidemiologiaaDiego RodriguezAún no hay calificaciones
- Adipocito Multi ACTDocumento3 páginasAdipocito Multi ACTDiego RodriguezAún no hay calificaciones
- Resumen PatologiaDocumento74 páginasResumen PatologiaDiego RodriguezAún no hay calificaciones
- Neurofibromatosis 1Documento12 páginasNeurofibromatosis 1Diego RodriguezAún no hay calificaciones
- TALLER DE PREGUNTAS Biologia Molecular 3Documento5 páginasTALLER DE PREGUNTAS Biologia Molecular 3Diego RodriguezAún no hay calificaciones
- Infografia Hipercolesterolemia FinalDocumento4 páginasInfografia Hipercolesterolemia FinalDiego RodriguezAún no hay calificaciones
- Guia de Laboratorio 14 HERENCIA MULTIFACTORIALDocumento4 páginasGuia de Laboratorio 14 HERENCIA MULTIFACTORIALDiego RodriguezAún no hay calificaciones
- Caso Clinico - Via de Las PentosasDocumento7 páginasCaso Clinico - Via de Las PentosasMarina Varillas VázquezAún no hay calificaciones
- LÍPIDOSDocumento20 páginasLÍPIDOSAlejandro Robles RocanoAún no hay calificaciones
- 4.10 Función de Transporte de Lípidos en La Sangre, Lipoproteínas, Estructura y Función de Quilomicrones, VLDL, LDL y HDL.Documento14 páginas4.10 Función de Transporte de Lípidos en La Sangre, Lipoproteínas, Estructura y Función de Quilomicrones, VLDL, LDL y HDL.Ilian Guzmán MendozaAún no hay calificaciones
- Taller CarbohidratosDocumento11 páginasTaller Carbohidratosjhonatan AlonsoAún no hay calificaciones
- 2A - Plaquetas 2022Documento32 páginas2A - Plaquetas 2022Erlin VargasAún no hay calificaciones
- 1 Ficha Respiración AeróbicaDocumento2 páginas1 Ficha Respiración AeróbicaLeila SalcedoAún no hay calificaciones
- GlucogenesisDocumento5 páginasGlucogenesisCarolina AlvarezAún no hay calificaciones
- RECEPTORESDocumento64 páginasRECEPTORESjose luis mirones andradeAún no hay calificaciones
- Metabolismo 2° SemestreDocumento24 páginasMetabolismo 2° SemestreJos� Manuel M��ozAún no hay calificaciones
- Guía de EstudioDocumento4 páginasGuía de EstudioVictoria FontanarrosaAún no hay calificaciones
- Tema 4 - ProteinasDocumento9 páginasTema 4 - ProteinasAntonio Matamalas ManosalvasAún no hay calificaciones
- Glucolisis y Ciclo de Krebs CorregidoDocumento28 páginasGlucolisis y Ciclo de Krebs CorregidoMayra Henriquez0% (1)
- X SOY 600 EspañolDocumento2 páginasX SOY 600 EspañolJosé AlmeaAún no hay calificaciones
- Estructura Molecular de Los Seres VivosDocumento2 páginasEstructura Molecular de Los Seres VivosDARWIN VALVERDEAún no hay calificaciones
- NATALIA PEREZ ENSAYO SisteminaDocumento4 páginasNATALIA PEREZ ENSAYO SisteminaNatt MejaiAún no hay calificaciones
- LÍPIDOS (Ejercicios)Documento2 páginasLÍPIDOS (Ejercicios)BlindAún no hay calificaciones
- CHICKTONICbsDocumento2 páginasCHICKTONICbsJosé coronado PerezAún no hay calificaciones
- Preguntas Pau ProteinasDocumento2 páginasPreguntas Pau ProteinasA.j. ElviraAún no hay calificaciones
- Productos Faciales: Lista de Precios Profesional - Enero 2023Documento4 páginasProductos Faciales: Lista de Precios Profesional - Enero 2023milagros garciaAún no hay calificaciones
- Guía de Estudio 3 - 2018Documento4 páginasGuía de Estudio 3 - 2018Pee Wee Martini100% (1)
- Codigos de LaboratorioDocumento1 páginaCodigos de LaboratorioResidentes Gastro AlmenaraAún no hay calificaciones
- Alfa AmilasaDocumento4 páginasAlfa AmilasaLuna LorenzoAún no hay calificaciones
- Metabolismo de AminoacidosDocumento5 páginasMetabolismo de Aminoacidosanon_609905353Aún no hay calificaciones
- Articulo BioqDocumento14 páginasArticulo BioqKevin Torres ValenciaAún no hay calificaciones
- Repaso Ef3Documento8 páginasRepaso Ef3Marcela EscobarAún no hay calificaciones
- 1.2 Cuadro ComparativoDocumento3 páginas1.2 Cuadro ComparativoDaniela EivetAún no hay calificaciones
- Seminario 05 - Proteínas DesordenadasDocumento3 páginasSeminario 05 - Proteínas DesordenadasVivian GarayAún no hay calificaciones
- Metabolismo de Nucleotidos PDFDocumento8 páginasMetabolismo de Nucleotidos PDFLrq Pancho SigchoAún no hay calificaciones
- 1r Parcial Cbcc6 2017Documento7 páginas1r Parcial Cbcc6 2017Marita Correa AbaloAún no hay calificaciones
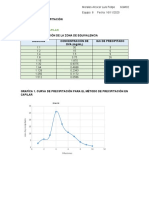
- Reaccines de PrecipitaciónDocumento4 páginasReaccines de PrecipitaciónLuis AlcocerAún no hay calificaciones