Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Art 06
Art 06
Cargado por
Cristian Calcina GutierrezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Art 06
Art 06
Cargado por
Cristian Calcina GutierrezCopyright:
Formatos disponibles
Información Tecnológica
Inactivación
Vol. Térmica
24(3), 41-50 de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum)
(2013) Maca
doi: 10.4067/S0718-07642013000300006
Inactivación Térmica de Pectinmetilesterasa en Tomate de
Árbol (Solanum betaceum)
Maira P. Maca, Oswaldo Osorio y Diego F. Mejía-España*
Universidad de Nariño, Facultad de Ingeniería Agroindustrial, Ciudad Universitaria Torobajo - Calle 18 Cr
50, San Juan de Pasto - Colombia (e-mail: mairap88@hotmail.com; osorio_oswaldo@hotmail.com;
diegomejiaes@udenar.edu.co)
* Autor a quien debe ser dirigida la correspondencia
Recibido Nov. 22, 2012; Aceptado Ene. 08, 2013; Versión final recibida Mar. 05, 2013
Resumen
El objetivo de esta investigación fue estudiar el efecto del procesamiento térmico a temperatura constante,
sobre la actividad residual de la enzima pectinmetilesterasa (PME), causante de la separación de fases en
néctar de tomate de árbol (Solanum betaceum). Se evaluó un rango de temperaturas entre 40 y 90°C y
tiempos de exposición entre los 5 y 20s. La actividad enzimática residual se midió por espectrofotometría a
una longitud de onda de 620 nm. Se determinó el contenido de proteína mediante el método de Bradford.
El tratamiento térmico aplicado a 60ºC durante 20 segundos de exposición redujo la actividad residual de
PME hasta un 10% evitando la separación de fases del néctar. Se concluye que el tratamiento aplicado
disminuyó el contenido de enzima en un 28% con respecto al testigo sin tratar.
Palabras clave: actividad residual, pectinmetilesterasa, tomate de árbol, tratamiento térmico, inactivación
térmica
Thermal Inactivation of Pectinmethylesterase in Tree Tomato
(Solanum betaceum)
Abstract
The effect of batch thermal processing on the residual activity of pectinmethylesterase enzyme (PME) in
tree tomato (Solanum betaceum) was studied. Batch processes were conducted at temperatures between
40 and 90°C and exposure times from 5 to 20s. Residual enzyme activity was spectrophotometrically
measured at 620 nm wavelength. The protein content was determined according to Bradford´s dye binding
method. The thermal treatment applied to 60°C for 20 seconds exposure time, reduced the residual activity
of PME to 10% avoiding phase separation. It is concluded that the thermal treatment applied caused a
decrease on enzyme content to 28% from initial content.
Keywords: residual activity, pectinmethylesterase, tree tomato, heat treatment, thermal inactivation
Información Tecnológica Vol. 24 Nº 3 – 2013 41
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
INTRODUCCIÓN
La PME (EC 3.1.1.11) es una enzima hidrolítica, que se encuentra de manera natural en la mayoría de las
frutas, ligada a la pared celular y es liberada en el momento de la extracción del zumo (Polydera et al.,
2004); cataliza la eliminación de los grupos metilo de la cadena de ácido poligalacturónico, lo que provoca la
liberación de metanol, pectinas de bajo metoxilo y formación de ácidos pécticos (Menéndez Aguirre et al.,
2006). Estos ácidos pueden reaccionar con iones calcio presentes en el medio para formar complejos
insolubles de pectato de calcio, dejando un mayor número de grupos carboxilo libres que pueden luego
enlazar cationes y formar pectinas reticuladas, las cuales pueden agregarse y asentarse (Anthon et al.,
2002; de Assis et al., 2001).
Los jugos contienen finas partículas compuestas por pectina, celulosa, hemicelulosa, proteínas y lípidos en
suspensión, lo cual se considera una característica deseable, ya que afecta favorablemente el sabor y el
color característico en estos productos (Carbonell et al., 2005). La clarificación por acción enzimática se
considera un defecto asociado con la pérdida de calidad de algunos jugos ricos en PME, como los de
cítricos y tomate de mesa (Solanum lycopersicum), causando separación de fases, pérdida de turbidez,
modificación de la textura, reducción en la viscosidad, pérdida de color y poca retención del sabor (Giner et
al., 2000), al igual que en el jugo de tomate de árbol. Estos problemas se han atribuido principalmente a la
actividad de la PME; por lo tanto, el control de su actividad es un importante punto de interés para obtener
productos de alta aceptación por los consumidores (Jolie et al., 2009).
Investigaciones realizadas en frutas han establecido que un proceso muy efectivo para la inactivación de
PME es la pasteurización (Polydera et al., 2004); este es un procedimiento relativamente suave, que
contribuye con el aumento de la vida útil del alimento sobre el que se aplica, siempre que se mantenga
posteriormente refrigerado o se complemente con otros métodos de conservación (Lewis y Heppell, 2000;
Luíz et al., 2007). Actualmente, los consumidores buscan alimentos no sólo con larga vida útil sino también
de alta calidad, con mínimas pérdidas en sus nutrientes y cualidades organolépticas; para satisfacer estas
exigencias, los fabricantes han buscado mejorar los procesos de conservación por calor, como la
pasteurización a altas temperaturas y tiempos cortos, los tratamientos a ultra alta temperatura (HTST y
UHT, respectivamente, por sus siglas en inglés) y el envasado aséptico (Cruz et al., 2006; Jolie et al., 2009;
Rivas et al., 2006)
Los jugos de fruta pasteurizados y refrigerados mantienen su calidad sensorial, nutritiva y funcional mejor
que los zumos esterilizados y son preferidos por los consumidores a pesar de la necesidad de
almacenamiento refrigerado y su corta vida comercial (Osorio et al., 2008). Se ha determinado que la
temperatura de inactivación de PME es variada y depende del sustrato donde se encuentre. En el proceso
de elaboración de sopas y jugos de tomate de mesa, el homogeneizado se calienta a temperaturas
cercanas a los 60°C; estos niveles retienen mejor los componentes de color y sabor y reducen la producción
de compuestos indeseables. Aunque no se inactiva completamente las enzimas PME y Poligalacturonasa
(PG), el proceso permite que estas enzimas descompongan algunas de las pectinas reduciendo la
viscosidad del jugo, lo cual afecta favorablemente su bombeo y evaporación (Anthon et al., 2002).
Diversos autores coinciden en que el porcentaje de actividad residual (%AR) de la enzima para zumos
tratados térmicamente debe ser de un 10%, para disminuir el riesgo de alterar las propiedades sensoriales,
fisicoquímicas y nutritivas del producto (Carbonell et al., 2005; Ingallinera et al., 2005; Osorio et al., 2008;
Sentandreu et al., 2005; Torres et al., 2008).
Si bien la PME ha sido estudiada en una gran cantidad de frutas no hay reportes de esta enzima en tomate
de árbol. En otros jugos de frutas, como la naranja, se ha recomendado ajustar las condiciones de
tratamiento térmico para reducir la actividad de PME (Giner et al., 2000). También se encuentran estudios
en maracuyá (Vivar-Vera et al., 2007), fresa (Osorio et al., 2008) y frambuesa (Jakób et al., 2009) entre
otras. El objetivo de esta investigación fue inactivar parcialmente la enzima PME, causante de la separación
de fases en el zumo de tomate de árbol. Asimismo, se cuantificó la cantidad de enzima presente antes y
después del tratamiento.
MATERIALES Y MÉTODOS
Materia prima
Los frutos de tomate de árbol (Solanum betaceum), fueron recolectados en 10 municipios del departamento
de Nariño, Colombia y procesados en la Planta Piloto de la Universidad de Nariño.
42 Información Tecnológica Vol. 24 Nº 3 - 2013
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
Extracción de pulpa
Los frutos se seleccionaron por su estado de sanidad, se pesaron y se clasificaron de acuerdo con su
estado de madurez de consumo, escogiendo solo los frutos en escala 5 y 6 acorde con la norma NTC 4105
(ICONTEC, 1997). En seguida se lavaron y desinfectaron por inmersión en una solución de hipoclorito de
sodio (50 ppm) durante 5 minutos y se enjuagaron con agua potable. Posteriormente se escurrieron, pelaron
y se sometieron a trituración en una licuadora industrial marca JAVAR LCT-15. La pulpa obtenida se filtró
para retirar las semillas, luego se homogenizó y empacó en bolsas herméticas de polietileno con capacidad
de 15 mL, las cuales se conservaron congeladas a -23°C, con el fin de evitar variabilidad en los resultados.
Extracción enzimática
El extracto enzimático se preparó diariamente, siguiendo el protocolo propuesto por Vicente (2004). A 5 g
de pulpa de tomate de árbol previamente descongelada, se agregaron 15 mL de solución de cloruro de
sodio (NaCl) 1M y 0,04 g de polivinilpirrolidona (PVPP). La suspensión obtenida se agitó por 1h a 200 rpm a
temperatura ambiente; el sobrenadante se centrifugó a 10.000 rpm por 1 hora a 4°C, en una centrífuga
Thermo IEC Multi RF, refrigerada. El precipitado fue desechado y el sobrenadante se utilizó como extracto
enzimático. Todos los reactivos utilizados fueron grado analítico.
Tratamiento térmico
Los tratamientos se hicieron utilizando la metodología desarrollada por Anthon y Barrett (2002): el extracto
enzimático se envasó en tubos capilares de vidrio tipo microhematocrito (Longitud 75 ± 1,5 mm; diámetro
interno 1,1-1,2 mm; diámetro externo 1,4 -1,6 mm; espesor de paredes 0,2 ± 0,02 mm; capacidad
volumétrica 75-80 µL). Esto permitió minimizar el tiempo de subida de la temperatura hasta que fue de 10
segundos y mejorar la transferencia de calor minimizando la degradación de los compuestos de interés
(Fellows, 1994).
Los tubos capilares se colocaron en un baño de agua termostatado marca Eyela OSB 2000 con capacidad
de 10 litros, y precisión de 0,1°C. La temperatura se midió con un lector de temperatura portátil (TECPEL
DTM-305), al cual se acopló un termopar tipo K.
Las muestras una vez calentadas por el tiempo especificado, se transfirieron inmediatamente a un baño de
agua-hielo a temperatura de 2°C con el fin de someterlas a un brusco choque térmico (Thongsook y Barrett,
2005).
Medida de la actividad enzimática
La actividad enzimática se midió utilizando un espectrofotómetro Genesys 10 (Thermo Scientific) UV-VIS
con escaneo de 6 celdas, aplicando la metodología reportada por Hagerman y Austin, (1986) y Giner et al.,
(2000). La mezcla de reacción contenía 95 µL de agua destilada, 1765 µL de pectina cítrica al 0,5% (w/v)
(>85% esterificación, Sigma®), 445 µL de azul de bromotimol al 0,01% en buffer fosfato de sodio al 0,006M
y 495 µL de extracto enzimático. Todos los reactivos se ajustaron a pH 7,5 con hidróxido de sodio (NaOH)
0,1N y 1N.
El cambio de color se midió a una longitud de onda de 620 nm. La pendiente de la parte lineal de la curva
(velocidad inicial de la reacción) se tomó como actividad enzimática (Rudra Shalini et al., 2008). Los
resultados se expresaron como el cambio en la densidad óptica por minuto (∆Abs/min).
La actividad residual enzimática (AR), se define como la relación entre la actividad de la enzima después del
tratamiento, a la actividad que tenía antes del mismo. Su cálculo se realiza utilizando la ecuación 1,
reportada por Tiwari et al., (2009) en términos de porcentaje.
(1)
Donde: At= Actividad enzimática del zumo tratado (pasteurizado)
A0= Actividad enzimática del zumo sin pasteurizar (testigo)
Información Tecnológica Vol. 24 Nº 3 – 2013 43
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
Diseño experimental
Se planteó un diseño estadístico factorial multinivel con metodología de superficie de respuesta, evaluando
dos factores, temperatura (entre 40ºC y 60ºC con 6 niveles) y tiempo de exposición (entre 5 y 20 segundos
con 3 niveles), para un total de 18 corridas por bloque. Posteriormente se planteó un diseño de composición
central con metodología de superficie de respuesta para encontrar el punto óptimo de inactivación
enzimática. Este diseño contó con 10 corridas por bloque. La variable de respuesta fue el porcentaje de
actividad residual. Todos los tratamientos se llevaron a cabo por cuadruplicado y siguiendo un orden
aleatorio. El análisis de datos se realizó en el software estadístico InfoStat versión 2011 (Di Rienzo et al.,
2010).
Medición de la Concentración de Proteínas
La concentración de proteína (enzima PME) se determinó mediante el método de Bradford, utilizando como
estándar albúmina de suero bovino (BSA) a una longitud de onda de 595 nm (Bradford, 1976). La curva de
calibración se realizó en un rango de proteína de 100 – 300 µg/mL. Se tomaron 50 µL de BSA o del extracto
enzimático de tomate de árbol, (para la curva de calibración o la cuantificación de la enzima PME,
respectivamente), se adicionó 1500 µL del reactivo de Bradford [Thermo Scientific, 2010], y se incubó
durante 10 min a temperatura ambiente; posteriormente se midió en el espectrofotómetro a 595 nm (Bollag
et al., 1996).
Preparación del néctar de tomate de árbol
Para comprobar la efectividad de los tratamientos se preparó un néctar con la pulpa previamente
pasteurizada, a la cual se agregó agua y azúcar y se envasó en botellas de vidrio estériles.
Seguimiento del néctar pasteurizado
Posterior a la pasteurización, el néctar se mantuvo en refrigeración (4°C) durante 42 días con el fin de medir
los cambios en la actividad enzimática y concentración de enzima en almacenamiento.
RESULTADOS Y DISCUSIÓN
Efecto de la aplicación de los tratamientos térmicos sobre la inactivación de PME
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil
a Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil
100 Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantilb Versión
b Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
b
Actividad Residual (%)
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión
c Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
67 c
c Versión
Versión Estudiantil Versión Estudiantil Versión Estudiantil Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil
33 Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
d d d
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil VersióneEstudiantil e Versión
f Estudiantil gVersión
g Estudiantil Versión Estudiantil
e f f g
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil
0
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Patrón
40°Cx5s
50°Cx5s
60°Cx5s
70°Cx5s
80°Cx5s
90°Cx5s
40°Cx12s
40°Cx20s
50°Cx20s
50°Cx12s
60°Cx12s
60°Cx20s
70°Cx12s
70°Cx20s
80°Cx20s
80°Cx12s
90°Cx20s
90°Cx12s
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Tratamientos
rsión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión EstudiantilVersión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Fig.1: Porcentaje de actividad residual a diferentes tiempos y temperaturas
El efecto de los tratamientos sobre la actividad de la enzima se muestra en la Figura 1. Los tratamientos
aplicados con temperaturas entre 40°C y 50°C, provocaron una disminución de la AR hasta un 74% y 62%,
44 Información Tecnológica Vol. 24 Nº 3 - 2013
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
respectivamente, en todos los tiempos de retención. A temperaturas superiores (60°C a 90°C), se nota un
rápido descenso en la actividad residual, llegando a niveles entre el 9% y 4% respectivamente. La
disminución de la actividad en la velocidad de reacción es probablemente el resultado de la
desnaturalización de la enzima por el calor.
Dado que el objetivo fue encontrar el tratamiento óptimo que permitiera llevar la actividad residual hasta un
10% de su actividad inicial, se hicieron pruebas dentro de un nuevo rango de temperaturas que variaron
entre 50°C y 60°C. En la figura 2 se observa que la actividad residual disminuye a medida que los factores
temperatura y tiempo se incrementan.
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil
A Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil
100
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Actividad Residual (%)
Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil
B C Versión
D Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
67
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
E Versión Estudiantil Versión Estudiantil Versión Estudiantil
F
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil F Versión Estudiantil Versión Estudiantil Versión Estudiantil
33 G
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
H VersiónHEstudiantil
H Versión Estudiantil
Versión Estudiantil Versión Estudiantil
0 Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Patrón
Versión Estudiantil Versión Estudiantil Versión Estudiantil
55ºCx12s.
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
48ºCx12s
50ºCx5s
50ºCx20s
55ºCx2s
55ºCx12s
55ºCx23s
60ºCx5s
60ºCx20s
62ºCx12s
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión EstudiantilTratamientos
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Medias con una letra común no son significativamente diferentes (p<= 0,05)
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Fig. 2: Porcentaje de actividad residual a Temperaturas entre 50°C y 60°C
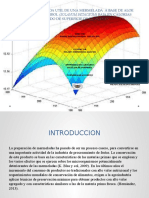
La gráfica de superficie de respuesta, obtenida mediante el diseño de composición central para las nuevas
temperaturas, determinó que el tratamiento que cumplía la restricción planteada fue a una temperatura de
60ºC durante 20s, como aparece en la figura 3. Esta combinación de factores logró mantener la actividad
residual en un 10% y evitó la separación de fases, lo que no se logró con el mismo tratamiento durante un
tiempo de retención de 5s.
Superficie de Respuesta Estimada
Actividad Residual
0,0
5,0
80
10,0
Actividad Residual
60 15,0
20,0
40 25,0
30,0
20 35,0
20 40,0
0 17
50 14 45,0
52 54 11
56 58 8 50,0
5 Tiempo
60 Texto.. 55,0
Temperatura Texto..
Fig. 3: Gráfica de Superficie de Respuesta Estimada para el rango de 50°C a 60°C 60,0
65,0
El tratamiento térmico establecido se encuentra dentro de los rangos de otros reportados70,0 para la
inactivación de PME en diferentes frutas. Stückrath et al. (1998), realizaron el análisis de termoestabilidad
75,0
de PME extraída de frambuesas var. Meeker y concluyeron que al someter la enzima durante un minuto a
80,0
distintas temperaturas en el rango de 40°C a 70°C la enzima es estable y de 70°C a 90°C es medianamente
85,0 a
sensible, con un valor z de 35,1°C, lo que indica que en este producto la enzima es muy termoestable,
diferencia de otros productos. En PME extraída de guanábana, Arbaisah et al., (1997), obtuvieron 90,0 una
disminución de la actividad enzimática de un 80% luego de un tratamiento a 60°C.
Información Tecnológica Vol. 24 Nº 3 – 2013 45
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
Osorio et al., (2008), reportaron que una pasteurización suave (75ºC por 15s) y una pasteurización severa
(90ºC por 20s) reducen la actividad de PME en purés de fresa en un 25,5% y 5,4% respectivamente.
Carbonell et al., (2005) mencionan que los tratamientos de 70ºC por 30s ó 74ºC por 10s disminuyeron la
actividad de PME en el zumo de mandarina por debajo del 10%, mientras que en los zumos de híbridos fue
necesario aplicar un tratamiento de 85ºC por 10s para lograr el mismo porcentaje de residualidad. Para el
tratamiento térmico de jugos de naranjas y mandarinas Sentandreu et al., (2005) lograron una actividad
residual de la enzima PME del 2% con un tratamiento de 85°C a 90°C durante 10s.
Estos resultados difieren a aquellos obtenidos por Vivar-Vera et al., (2007), quienes obtuvieron un
tratamiento de 80°C durante 10 minutos para inactivar completamente la enzima. Los autores explican que
este resultado se debe a la alta afinidad que tiene la enzima por el sustrato utilizado ya que las pruebas se
realizaron utilizando pectina extraída del fruto de tejocote en lugar de pectina cítrica.
Uno de los motivos de la discrepancia existente entre resultados es que la temperatura de inactivación de
esta enzima muestra un amplio rango [Arbaisah et al., 1997], debido al gran número de isoenzimas
reportadas. Seymour et al., (1991) estudiaron la termo estabilidad de PME en toronja var. Marsh y
observaron que la fracción termolábil y termoestable se inactivaron completamente a 65°C y 85°C,
respectivamente. Versteeg et al., (1980) reportaron que las isoenzimas PME I, PME II y la PME de alto peso
molecular de jugo de naranja fueron inactivadas rápidamente a 60°C, 70°C y 90°C, respectivamente.
Estudios realizados en otros vegetales de la familia de las solanáceas también presentan resultados
disímiles. Pressey y Avants, (1972) encontraron y aislaron cuatro isoenzimas de PME en el jugo de tomate
de mesa, con distintas características y diferente termoestabilidad. Las isoenzimas A y B de PME extraída
de tomate de mesa, fueron inactivadas mediante un calentamiento por 5 min a 63°C y 64°C, donde se logró
un 50% de inactivación, mientras que la temperatura de inactivación de la fracción C fue menor a 55°C
(Warrilow, Turner, y Jones, 1994). Los ensayos de termo estabilidad de PME aislada de papa var Alpha,
calentando durante 30 minutos, permitieron concluir que su actividad se incrementó sustancialmente hasta
los 60°C y posteriormente decreció hasta un 30% a 70°C y hasta un 70% a 90°C. Por lo tanto, la enzima se
considera termo estable (Sáenz y Téllez, 2000).
Otra razón de las diferencias observadas en distintos productos es la diferencia en el pH del jugo de cada
fruta. Para Anthon et al., (2002), esta diferencia es probablemente el resultado de la diferencia de pH en las
soluciones de reacción utilizadas, ya que la tasa de inactivación es fuertemente dependiente del pH a
valores entre 4 y 5. Esto significa que entre más ácido sea el jugo más rápidamente se logrará la
inactivación enzimática. Para el jugo de tomate de árbol, su pH varía entre 3,18 y 3,8 lo que podría explicar
la rápida tasa de inactivación lograda en este estudio.
Determinación de la Concentración de Proteínas
Con la aplicación de tratamientos térmicos se logró una reducción del 30% en la concentración de proteína
a una temperatura de 62ºC por 12s y de un 28% con la aplicación del tratamiento óptimo encontrado (60ºC
por 20s).
La figura 4 muestra la concentración de proteína (enzima PME) presente en el zumo de tomate de árbol y su
comportamiento bajo las diferentes condiciones de tiempo y temperatura. El análisis estadístico estableció
que la concentración de proteína se ve afectada con el incremento de los factores tiempo y temperatura.
La actividad residual y la concentración de proteína poseen una relación directamente proporcional, pues de
la cantidad de proteína activa (enzima activa) depende el porcentaje de actividad residual resultante. La
desnaturalización de enzimas por calor, suele a menudo ser irreversible debido a la ruptura de enlaces
covalentes y/o la agregación de proteínas desdobladas (Ly-Nguyen et al., 2003; Puppo et al., 2004).
Estudios realizados por Hirsch et al.,(2008) demuestran que la concentración de la enzima PME en jugo de
naranja disminuye con el incremento de temperatura, pues la enzima se desnaturaliza, lo que a su vez
mejora la retención de la turbidez del jugo.
46 Información Tecnológica Vol. 24 Nº 3 - 2013
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil
a Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
200
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
b
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Concentración de Proteina ( µg/mL)
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil
c Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
d Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
178
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
e Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión
f Estudiantil
f Versión Estudiantil Versión Estudiantil Versión Estudiantil
157 g
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
h Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil i
Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil j
Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
135
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Patrón
55°Cx12s.
50°Cx5s
55°Cx2s
60°Cx5s
48°Cx12s
50°Cx20s
55°Cx12s
55°Cx23s
60°Cx20s
62°Cx12s
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Tratamientos
sión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil Versión Estudiantil
Versión Estudiantil Versión Estudiantil Versión Estudiantil
Fig.4:Versión Estudiantil Versión Estudiantil
Cuantificación de proteína Versión Estudiantil Versión Estudiantil Versión Estudiantil
En el caso de los jugos de cítricos, por ejemplo, estos contienen múltiples formas de PME, por lo cual es
razonable esperar que la variación de las concentraciones de la enzima en jugos de distintas variedades
requeriría diversos tiempos y temperaturas para su pasteurización térmica (Chen y Wu, 2007). De aquí se
desprende el hecho de que no sea fácil comparar los resultados obtenidos con otros frutos similares.
Seguimiento del néctar pasteurizado durante almacenamiento refrigerado
Esta etapa se realizó con néctar preparado con pulpa previamente pasteurizada con el tratamiento óptimo
(60ºC por 20s). Los otros tratamientos no se consideraron en esta etapa del ensayo, puesto que los
resultados de pruebas sensoriales llevadas a cabo por un panel de evaluación entrenado, dieron como
resultado que los néctares preparados con pulpas tratadas a temperaturas superiores, producían un sabor a
“cocido”, que fue calificado como “desagradable” por los evaluadores (resultados no mostrados). Por ello se
procedió a trabajar solo con el néctar preparado con el tratamiento óptimo. Los resultados de las
evaluaciones para el seguimiento a la reactivación enzimática y la concentración de la enzima aparecen en
la figura 5 y 6, respectivamente.
205
100
Cantidad de Enzima ( g/mL)
Actividad Residual (%)
75 180
50
155
25
0 130
0 1 15 30 42
0 1 15 30 42
Tiempo (Días)
Tiempo (Días)
Fig.5: Actividad residual Fig.6: Concentración de enzima
Las figuras indican que el patrón difiere de la muestra tratada a 60°C por 20s y evaluada a 1, 15, 30 y 42
días, en donde a partir del día 1 posterior al tratamiento, la actividad residual y la cantidad de enzima
permanecen constantes. El contenido de proteína de los jugos tratados disminuyó un 28 – 30% y se
Información Tecnológica Vol. 24 Nº 3 – 2013 47
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
mantuvo durante el tiempo de almacenamiento, no observándose reactivación posterior. Estos resultados
coinciden con los obtenidos por Hirsch et al., (2008) quienes observaron una disminución del 50% en el
contenido de proteína de extractos de jugo de naranja pasteurizado durante su almacenamiento. Similares
resultados reportan Ochoa y Guerrero (2012), quienes afirman que la baja actividad de la enzima PME
durante el almacenamiento puede deberse a que esta no es muy eficiente en la degradación de la pectina
en Tuna Roja.
Finalmente es importante resaltar que las condiciones de pasteurización para la inactivación de PME
encontradas en esta investigación permiten conservar mayor cantidad de propiedades físicas, químicas y
organolépticas del producto que los tratamientos térmicos severos. Según Osorio et al., (2008) el aumento
de la intensidad de un tratamiento térmico destruye mayor cantidad de enzimas y microorganismos, pero
también existe mayor alteración en el aroma, sabor y nutrientes del alimento.
CONCLUSIONES
El tratamiento de pasteurización aplicado (60ºC por 20s) logra reducir la actividad enzimática hasta un 10%,
no reactivándose durante el periodo de tiempo estudiado y solucionando el problema de separación de
fases generado por la enzima.
AGRADECIMIENTOS
A la Vicerrectoría de Investigaciones, Postgrados y Relaciones Internacionales VIPRI de la Universidad de
Nariño, Colombia, por la financiación de esta investigación.
Al Grupo de Investigación Tecnologías Emergentes en Agroindustria TEA – Facultad de Ingeniería
Agroindustrial, Universidad de Nariño.
Al Ingeniero Francisco José Muñoz O., IAI, MSc., por su asesoría en el diseño estadístico.
REFERENCIAS
Anthon, G. E., y D. M. Barrett, Kinetic parameters for the thermal inactivation of quality-related enzymes in
carrots and potatoes, Journal of Agricultural and Food Chemistry, 50(14), 4119–4125 (2002).
Anthon, G. E., Y. Sekine, N. Watanabe, y D. M. Barrett, Thermal inactivation of pectin methylesterase,
polygalacturonase, and peroxidase in tomato juice, Journal of Agricultural and Food Chemistry, 50(21),
6153–6159 (2002).
Arbaisah, S. M., B. A. Asbi, A. H. Junainah, B. Jamilah, y J. F. Kennedy, Soursop pectinesterases:
thermostability and effect on cloud stability of soursop juice, Carbohydrate Polymers, 34(3), 177–182 (1997).
De Assis, S., D. Lima, y O. de F. Oliveira, Activity of pectinmethylesterase, pectin content and vitamin C in
acerola fruit at various stages of fruit development, Food Chemistry, 74, 2–6 (2001).
Bollag, D. M., M. D. Rozycki, y S. J. Edelstein, Protein methods, 2nd ed., Wiley, New York, NY (1996).
Bradford, M. M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing
the principle of protein-dye binding, Analytical Biochemistry, 72, 248–54 (1976).
Carbonell, J. V., P. Contreras, L. Carbonell, y J. L. Navarro, Pectin methylesterase activity in juices from
mandarins, oranges and hybrids, European Food Research and Technology, 222(1-2), 83–87(2005).
Chen, C., y M. Wu, Kinetic models for thermal inactivation of multiple pectinesterases in citrus juices, Journal
of Food Science, 63(5), 1–4 (2007).
Cruz, R. M. S., M. C. Vieira, y C. L. M. Silva, Effect of heat and thermosonication treatments on peroxidase
inactivation kinetics in watercress (Nasturtium officinale), Journal of Food Engineering, 72(1), 8–15 (2006).
Fellows, P., Tecnologia del procesado de los alimentos: Principios y practicas, Editorial Acribia S.A.,
Zaragoza, España (1994).
48 Información Tecnológica Vol. 24 Nº 3 - 2013
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
Giner, J., V. Gimeno, y A. Espachs, Inhibition of tomato ( Licopersicon esculentum Mill.) pectin
methylesterase by pulsed electric fields, Innovative Food Science & Emerging Technologies, 1(1) 57–67
(2000).
Hagerman, A. E., y Austin, P. J., Continuous spectrophotometric assay for plant pectin methyl
esterase. Journal of Agricultural and Food Chemistry,34(3), 440-444 (1986).
Hirsch, A. R., K. Förch, S. Neidhart, G. Wolf, y R. Carle, Effects of thermal treatments and storage on pectin
methylesterase and peroxidase activity in freshly squeezed orange juice, Journal of Agricultural and Food
Chemistry, 56(14), 5691–5699 (2008).
ICONTEC Instituto Colombiano de Normas Técnicas y Certificación, Norma Técnica Colombiana (NTC-
4105), Bogotá, D.C (1997).
Ingallinera, B., R. N. Barbagallo, G. Spagna, R. Palmeri, y A. Todaro, Effects of thermal treatments on
pectinesterase activity determined in blood oranges juices, Enzyme and Microbial Technology, 36(2-3), 258–
263 (2005).
Jakób, A., J. Bryjak, y M. Polakovič, Selection of a method for determination of activity of pectinolytic
enzymes in berry fruit materials, Chemical Papers, 63(6), 677–682 (2009).
Jolie, R. P., y seis autores más, Carrot pectin methylesterase and its inhibitor from kiwi fruit: Study of activity,
stability and inhibition, Innovative Food Science & Emerging Technologies, 10(4), 601–609 (2009).
Lewis, M. J., y N. Heppell, Continuous Thermal Processing of Foods : Pasteurization and UTH Sterilization,
Aspen, Gaithersburg, EUA (2000).
Luíz, R. C., T. A. M. Hirata, y E. Clemente, Cinética de inativação da polifenoloxidase e peroxidase de
abacate (Persea americana MILL.), Ciência e Agrotecnologia, 31(6), 1766–1773 (2007).
Ly-Nguyen, y ocho autores más, Mild-Heat and High-Pressure Inactivation of Carrot Pectin Methylesterase:
A Kinetic Study, Journal of Food Science, 68(4), 1377–1383 (2003).
Menéndez- Aguirre, O., y cinco autores más, Cambios en la actividad de a-amilasa, pectinmetilesterasa y
poligalacturonasa durante la maduración del Maracuyá Amarillo (Passiflora edulis var. Flavicarpa Degener),
Interciencia, 31(10), 728–733 (2006).
Ochoa, C. E., y J. A. Guerrero, Efecto del Almacenamiento a Diferentes Temperaturas sobre la Calidad de
Tuna Roja (Opuntia ficus indica (L.) Miller), Información tecnológica, 23(1), 117–128 (2012).
Osorio, O., N. Martinez-Navarrete, G. Moraga y J. V. Carbonell, Effect of Thermal Treatment on Enzymatic
Activity and Rheological and Sensory Properties of Strawberry Purees, Food Science and Technology
International, 14(5 suppl), 103–108 (2008).
Polydera, A. C., E. Galanou, N. G. Stoforos, y P. S. Taoukis, Inactivation kinetics of pectin methylesterase of
greek Navel orange juice as a function of high hydrostatic pressure and temperature process conditions,
Journal of Food Engineering, 62(3), 291–298 (2004).
Pressey, R., y J. K. Avants, Multiple forms of pectinesterase in tomatoes, Phytochemistry, 11(11), 3139–
3142 (1972).
Puppo, C., y seis autores más, Physicochemical modifications of high-pressure-treated soybean protein
isolates, Journal of Agricultural and Food Chemistry, 52(6), 1564–1571(2004).
Di Rienzo, y cinco autores más, InfoStat versión 2010, Grupo InfoStat FCA Universidad Nacional de
Córdoba Argentina (2010).
Información Tecnológica Vol. 24 Nº 3 – 2013 49
Inactivación Térmica de Pectinmetilesterasa en Tomate de Árbol (Solanum betaceum) Maca
Rivas, A., D. Rodrigo, A. Martínez, G. V. Barbosa-Cánovas, y M. Rodrigo, Effect of PEF and heat
pasteurization on the physical–chemical characteristics of blended orange and carrot juice, LWT - Food
Science and Technology, 39(10), 1163–1170 (2006).
Rudra Shalini, G., U. S. Shivhare, y S. Basu, Thermal inactivation kinetics of peroxidase in mint leaves,
Journal of Food Engineering, 85(1), 147–153 (2008).
Sentandreu, E., L. Carbonell, J. V. Carbonell, y L. Izquierdo, Effects of Heat Treatment Conditions on Fresh
Taste and on Pectinmethylesterase Activity of Chilled Mandarin and Orange Juices, Food Science and
Technology International, 11(3), 217–222 (2005).
Seymour, T. A., J. F. Preston, L. Wicker, J. A. Lindsay, y M. R. Marshall, Purification and properties of
pectinesterases of Marsh white grapefruit pulp, Journal of Agricultural and Food Chemistry, 39(6), 1080–
1085 (1991).
Stückrath, R., D. Díaz, y L. Trujillo, Purificación y caracterización de Pectinesterasa extraída de frambuesas
de la variedad Meeker, Información Tecnológica, 9(5), 45–48 (1998).
Sáenz, J., and A. Téllez, Purification and some properties of pectinesterase from potato (Solanum
tuberosum L.) Alpha cultivar, Brazilian Archives of Biology and Technology, 43(4) (2000).
Thermo Scientific, Instructions Coomassie Plus (Bradford) Assay Kit (23236), en línea,
http://www.piercenet.com/instructions/2160229.pdf. Acceso: 12 de abril (2010)
Thongsook, T., y D. M. Barrett, Purification and partial characterization of broccoli (Brassica oleracea Var.
Italica) peroxidases, Journal of Agricultural and Food Chemistry, 53(8), 3206–14 (2005).
Tiwari, B. K., K. Muthukumarappan, C. P. O’Donnell, y P. J. Cullen, Inactivation kinetics of pectin
methylesterase and cloud retention in sonicated orange juice, Innovative Food Science & Emerging
Technologies, 10(2), 166–171 (2009).
Torres, E. F., S. Bayarri, F. Sampedro, A. Martinez, y J. V. Carbonell, Improvement of the Fresh Taste
Intensity of Processed Clementine Juice by Separate Pasteurization of its Serum and Pulp, Food Science
and Technology International, 14(6), 525–529 (2008).
Versteeg, C., F. M. Rombouts, C. H. Spaansen, y W. Pilnik, Thermostability And Orange Juice Cloud
Destabilizing Properties Of Multiple Pectinesterases From Orange, Journal of Food Science, 45(4), 969–971
(1980).
Vicente, A. R., Efectos de tratamientos térmicos de alta temperatura sobre calidad y fisiología postcosecha
de frutillas (Fragaria x ananassa Duch), Universidad Nacional de la Plata, Agentina (2004).
Vivar-Vera, M. A., J. A. Salazar-Montoya, G. Calva-Calva, y E. G. Ramos-Ramírez, Extraction, thermal
stability and kinetic behavior of pectinmethylesterase from hawthorn (Crataegus pubescens) fruit, LWT -
Food Science and Technology, 40(2), 278–284 (2007).
Warrilow, A. G. S., R. J. Turner, y M. G. Jones, A novel form of pectinesterase in tomato, Phytochemistry,
35(4), 863–868 (1994).
50 Información Tecnológica Vol. 24 Nº 3 - 2013
También podría gustarte
- UF1356 - Control de la conservación de los alimentos para el consumo y distribución comercialDe EverandUF1356 - Control de la conservación de los alimentos para el consumo y distribución comercialAún no hay calificaciones
- Equipos para EsterilizaciónDocumento21 páginasEquipos para EsterilizaciónOscar Arango0% (1)
- Astrologia y Vidas PasadasDocumento2 páginasAstrologia y Vidas PasadasRo Bena100% (3)
- Pardeamiento ENZIMATICODocumento18 páginasPardeamiento ENZIMATICOAlex Jor AriasAún no hay calificaciones
- Tratamientos finales de conservación. INAV0109De EverandTratamientos finales de conservación. INAV0109Aún no hay calificaciones
- Evaluación Los Animales JunioDocumento4 páginasEvaluación Los Animales JunioAntonio Garzón Rodríguez100% (3)
- Tecnología de las conservas de frutas y vegetales. Segunda parteDe EverandTecnología de las conservas de frutas y vegetales. Segunda parteAún no hay calificaciones
- GUIA PRACTICA 05 Actividad ResidualDocumento9 páginasGUIA PRACTICA 05 Actividad ResidualYaKelín GómezAún no hay calificaciones
- Prácticas de Tecnología Alimentaria 2017-18-1Documento10 páginasPrácticas de Tecnología Alimentaria 2017-18-1Stephany Guijarro100% (1)
- Cap #3 EjerciciosDocumento8 páginasCap #3 EjerciciosRonyOlanoAún no hay calificaciones
- Actividad Enzimática en Las FrutasDocumento17 páginasActividad Enzimática en Las FrutashenryAún no hay calificaciones
- T P #9 Enzimas PécticasDocumento8 páginasT P #9 Enzimas Pécticaspablo_faccendiniAún no hay calificaciones
- Resultados Extracción de PectinasDocumento5 páginasResultados Extracción de PectinasEdward GuevaraAún no hay calificaciones
- Inactivacion de La PectinesterasaDocumento21 páginasInactivacion de La PectinesterasaMeneces GabrielaAún no hay calificaciones
- Prácticas Tecnología Alimentaria 22-23Documento12 páginasPrácticas Tecnología Alimentaria 22-23Aitana Varela ÁlvarezAún no hay calificaciones
- Uso y Manejo de Conservantes para La Conservación en Frío Las Rodajas de Manzanas Mediante El Uso de La LiofilizaciónDocumento13 páginasUso y Manejo de Conservantes para La Conservación en Frío Las Rodajas de Manzanas Mediante El Uso de La LiofilizacióngmoradAún no hay calificaciones
- Clarificacion de GranadillaDocumento7 páginasClarificacion de GranadillaJuan Anticona ZavaletaAún no hay calificaciones
- Informe Final de Proyecto de Tesis AngelitaDocumento50 páginasInforme Final de Proyecto de Tesis AngelitakarlosAún no hay calificaciones
- Estudio de La Actividad Enzimática de Poligalacturonasa en La Corteza de Pitaya AmarillaDocumento11 páginasEstudio de La Actividad Enzimática de Poligalacturonasa en La Corteza de Pitaya AmarillaAlexa SanchezAún no hay calificaciones
- Enzimas Ablandan Cascara de Pitahaya PDFDocumento10 páginasEnzimas Ablandan Cascara de Pitahaya PDFcarlosAún no hay calificaciones
- EscaldadoDocumento8 páginasEscaldadoSOLANLLY MONTOYA MARULANDAAún no hay calificaciones
- Enzimas Scielo PDFDocumento12 páginasEnzimas Scielo PDFChristian OliverosAún no hay calificaciones
- PROYECTO II - Gajos de Mandarina en La Elaboración de ConservasDocumento15 páginasPROYECTO II - Gajos de Mandarina en La Elaboración de Conservasmelodiatq100% (1)
- Extracción de PectinaDocumento7 páginasExtracción de PectinaJonny MoretaAún no hay calificaciones
- Extracción de Pectina A Partir de Residuos Generados en El Beneficio Del CaféDocumento7 páginasExtracción de Pectina A Partir de Residuos Generados en El Beneficio Del CaféJonny MoretaAún no hay calificaciones
- Mermelada de TamarilloDocumento15 páginasMermelada de TamarilloKeljo PasaAún no hay calificaciones
- Informe Factores Que Afectan La Actividad de La Enzimas CatecolasaDocumento15 páginasInforme Factores Que Afectan La Actividad de La Enzimas CatecolasaMANUEL ANTONIO CARO MOYAAún no hay calificaciones
- Articulo EspanishDocumento7 páginasArticulo EspanishRICHERSON HAROLD PISCOCHE CHINCHAYAún no hay calificaciones
- Articulo EspanishDocumento11 páginasArticulo EspanishRICHERSON HAROLD PISCOCHE CHINCHAYAún no hay calificaciones
- Banano Color y PHDocumento6 páginasBanano Color y PHJose Luis Diaz MedranoAún no hay calificaciones
- Evidencia 3 ConservacionDocumento8 páginasEvidencia 3 ConservacionKevin CanalesAún no hay calificaciones
- Ensayo Redactado Sobre La Extracción y Estabilización de BetalaínasDocumento10 páginasEnsayo Redactado Sobre La Extracción y Estabilización de BetalaínasGriselCruzPerccaAún no hay calificaciones
- Trabajo de Planta PilotoDocumento21 páginasTrabajo de Planta PilotoLuz Angelica Vera ChavezAún no hay calificaciones
- Pre Informe 1Documento2 páginasPre Informe 1Mariana BuitragoAún no hay calificaciones
- Revista de Ingeniería Biomédica y Biotecnología V2 N3 1Documento6 páginasRevista de Ingeniería Biomédica y Biotecnología V2 N3 1Javi KunAún no hay calificaciones
- Efectos Combinados BananaDocumento11 páginasEfectos Combinados BananaFelix Xndres Contreras GonzalezAún no hay calificaciones
- PolifenoloxidasaDocumento10 páginasPolifenoloxidasaAngellyAngelAún no hay calificaciones
- Evaluacion de Polvo de Jugo de Mandarina MicroencapsuladoDocumento8 páginasEvaluacion de Polvo de Jugo de Mandarina MicroencapsuladoLuis GabrielAún no hay calificaciones
- Jeffry XXX.Documento19 páginasJeffry XXX.Javier Alan Reategui ValdiviaAún no hay calificaciones
- Experimento S4 - BromatologíaDocumento10 páginasExperimento S4 - Bromatologíaavegayi espinozaAún no hay calificaciones
- Tesis AngelaDocumento40 páginasTesis AngelakarlosAún no hay calificaciones
- METODO DE EXTRACCION 3.1.1.11 At64 - 3-4 - BedoyaDocumento10 páginasMETODO DE EXTRACCION 3.1.1.11 At64 - 3-4 - BedoyaAngela Maria Bedoya GòmezAún no hay calificaciones
- Mango FinalDocumento16 páginasMango FinalLUIS ALEJANDRO PANTOJA VALLEJOAún no hay calificaciones
- Aplicación de Una Dextrana Como Recubrimiento Comestible enDocumento6 páginasAplicación de Una Dextrana Como Recubrimiento Comestible enMarlox CotacioAún no hay calificaciones
- Brócoli-2 0Documento7 páginasBrócoli-2 0Chava Hernandez100% (1)
- Alta Presion Hidrostatica Uss FinalDocumento52 páginasAlta Presion Hidrostatica Uss FinalMILCAR DELGADO REQUEJOAún no hay calificaciones
- Caracterización Química de La Pared Celular de La Pulpa de Mango BocadoDocumento10 páginasCaracterización Química de La Pared Celular de La Pulpa de Mango Bocadooscar.sumanomAún no hay calificaciones
- Inactivacion de EnzimasDocumento8 páginasInactivacion de EnzimasFatima Lizbeth Segura IslaAún no hay calificaciones
- AgroDocumento4 páginasAgroeddinssonn gonzales perezAún no hay calificaciones
- Practicas FYHDocumento26 páginasPracticas FYHFlor RosasAún no hay calificaciones
- Análisis de Resultados Pelado de Sosa CausticaDocumento3 páginasAnálisis de Resultados Pelado de Sosa Causticamichelle perezAún no hay calificaciones
- Trabajo de Investigacion Pure de FresaDocumento8 páginasTrabajo de Investigacion Pure de FresaRoger BernalAún no hay calificaciones
- Efecto Del Tostado de La Vaina de MezquiteDocumento4 páginasEfecto Del Tostado de La Vaina de MezquiteGiovannaJmzAún no hay calificaciones
- Inactivacion de Peroxidasa en Turiones de EsparragosDocumento5 páginasInactivacion de Peroxidasa en Turiones de EsparragosRoger Grimaldo ValenzuelaAún no hay calificaciones
- Informe 1 de Vegetales Pelado y EscaldadoDocumento12 páginasInforme 1 de Vegetales Pelado y EscaldadoCcacco50% (4)
- Practica 3 Intensidad Respiratoria en Frutos ClimatéricosDocumento10 páginasPractica 3 Intensidad Respiratoria en Frutos ClimatéricosLuz CoronadoAún no hay calificaciones
- Practica EscaldadoDocumento9 páginasPractica EscaldadoKenyo Navarro RoblesAún no hay calificaciones
- Articulos Fenomenos 2Documento7 páginasArticulos Fenomenos 2Diana Malqui RomeroAún no hay calificaciones
- Aplicación de Secado Osmótico para La Obtención de Un Producto de Humedad Intermedia de Tomate de Árbol (Solanum Betaceum Cav.)Documento11 páginasAplicación de Secado Osmótico para La Obtención de Un Producto de Humedad Intermedia de Tomate de Árbol (Solanum Betaceum Cav.)Rubén C. CamachoAún no hay calificaciones
- Vegetales Mínimamente ProcesadosDocumento10 páginasVegetales Mínimamente ProcesadosRodolfo HitchAún no hay calificaciones
- Ina 043 Tecnologia de La Conservacion de AlimentosDocumento8 páginasIna 043 Tecnologia de La Conservacion de AlimentosDenismanuhotmail.com Osorez OrtizAún no hay calificaciones
- IQ35Documento6 páginasIQ35FREDDY FORERO LONGASAún no hay calificaciones
- Estudio Del Proceso de Producción de Pulpas de Frutas Combinadas Pasteurizadas y Congeladas A Mediana EscalaDocumento6 páginasEstudio Del Proceso de Producción de Pulpas de Frutas Combinadas Pasteurizadas y Congeladas A Mediana EscalaFawllyn GuevaraAún no hay calificaciones
- BioetanolDocumento2 páginasBioetanolJUAN PABLO RUIZ CASTELLANOSAún no hay calificaciones
- Fundamentos de Buenas Prácticas de Manufactura en ColombiaDocumento21 páginasFundamentos de Buenas Prácticas de Manufactura en ColombiaOscar ArangoAún no hay calificaciones
- Estimación Vida Útil GuayabaDocumento9 páginasEstimación Vida Útil GuayabaOscar ArangoAún no hay calificaciones
- Respiración Maduración GuanabanaDocumento8 páginasRespiración Maduración GuanabanaOscar ArangoAún no hay calificaciones
- Plado QuimicoDocumento93 páginasPlado QuimicoRonald Nelson Iman RivasAún no hay calificaciones
- Actividad Antioxidante de Plantas de La Familia AnnonaceaeDocumento6 páginasActividad Antioxidante de Plantas de La Familia AnnonaceaeOscar ArangoAún no hay calificaciones
- Exposicion Sublevel Caving IvanDocumento12 páginasExposicion Sublevel Caving IvanRosember Romero AcuñaAún no hay calificaciones
- Música de Las Esferas.Documento2 páginasMúsica de Las Esferas.AngieAún no hay calificaciones
- Clase de Malezas Modo de CompatibilidadDocumento39 páginasClase de Malezas Modo de Compatibilidadapi-266095844Aún no hay calificaciones
- 5 Pruebas de HipótesiisDocumento39 páginas5 Pruebas de HipótesiisRey TiburonAún no hay calificaciones
- Iii. IdentificaciónDocumento128 páginasIii. IdentificaciónRony BustamanteAún no hay calificaciones
- Analisis Metodo de StodolaDocumento8 páginasAnalisis Metodo de StodolaAlexander Ap100% (1)
- Caolin 2Documento54 páginasCaolin 2Felix Alberto Barroso100% (2)
- LOS COMIENZOS DE LA ANTROPOLOGÍA: LA ANTROPOLOGÍA FÍSICA - Alberto Relancio Menéndez. IES Realejos y FCOHCDocumento25 páginasLOS COMIENZOS DE LA ANTROPOLOGÍA: LA ANTROPOLOGÍA FÍSICA - Alberto Relancio Menéndez. IES Realejos y FCOHCFundación Canaria Orotava de Historia de la CienciaAún no hay calificaciones
- APATITODocumento3 páginasAPATITOjhordy anthony gutierrezAún no hay calificaciones
- 5 Problemas Resueltos Analisis Estructuras Metodo Nudos1Documento94 páginas5 Problemas Resueltos Analisis Estructuras Metodo Nudos1Andy Barreto JamancaAún no hay calificaciones
- Resumen Neurociencias Capitulo 16Documento13 páginasResumen Neurociencias Capitulo 16Matías Nicolás Arriagada SepúlvedaAún no hay calificaciones
- Preguntas Plan Común BiologíaDocumento24 páginasPreguntas Plan Común BiologíaMaría TemucoAún no hay calificaciones
- Transporte de SolutosDocumento12 páginasTransporte de SolutosestherAún no hay calificaciones
- PS1055 - Informe Final. Meriendas y ZapatosDocumento51 páginasPS1055 - Informe Final. Meriendas y ZapatosAna Lucía Alvarado MéndezAún no hay calificaciones
- Practica 12-Citoquininas-Prueba de Expansion de Cotiledones de RabanoDocumento3 páginasPractica 12-Citoquininas-Prueba de Expansion de Cotiledones de RabanoJuanjo de la FuenteAún no hay calificaciones
- Fundamentos de Mecánica de Suelos. Aspectos Teóricos y PrácticosDocumento492 páginasFundamentos de Mecánica de Suelos. Aspectos Teóricos y PrácticosJessica Fabiola Brett ZavalaAún no hay calificaciones
- San Pablo de LípezDocumento19 páginasSan Pablo de LípezDanita Camargo100% (1)
- Taller de Nivelación-Física Once 2020-IDocumento4 páginasTaller de Nivelación-Física Once 2020-IAlëx D's DpV LeonAún no hay calificaciones
- Diplomado Morfologia Celular Hector Morante PDFDocumento27 páginasDiplomado Morfologia Celular Hector Morante PDFRenzo BassanAún no hay calificaciones
- Fisica Astronomia y AstrologiaDocumento2 páginasFisica Astronomia y AstrologiaErick Vill100% (1)
- Madera - IntroducciónDocumento5 páginasMadera - IntroducciónDanny F. Toledo AriasAún no hay calificaciones
- Hidraulica PresasDocumento4 páginasHidraulica PresasElias MartinezAún no hay calificaciones
- Problema NDocumento15 páginasProblema NSTEVEN KELLYAún no hay calificaciones
- Fallas en Pavimentos FlexibleDocumento17 páginasFallas en Pavimentos FlexibleJhobani Vasquez VelasquezAún no hay calificaciones
- Tesis de Grado 2010 - ScribdDocumento168 páginasTesis de Grado 2010 - ScribdBryan Edmundo Rado JanzicAún no hay calificaciones
- TONALITADocumento10 páginasTONALITApepichoAún no hay calificaciones