Documentos de Académico
Documentos de Profesional
Documentos de Cultura
PH y pOH
Cargado por
juan francisco gomez hernandezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
PH y pOH
Cargado por
juan francisco gomez hernandezCopyright:
Formatos disponibles
CORTE III
TEMA: pH y pOH
DOCENTE: OFELIA MEZA DIAZ
ASIGNATURA: QUIMICA ANALITICA
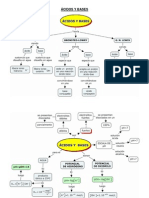
MARCO TEORICO
pH y pOH
El pH es una medida de la acidez o basicidad de una solución. El pH es la concentración de
iones hidronio [H3O+] presentes en determinada sustancia. La sigla significa "potencial de
hidrógeno". Este término fue acuñado por el químico danés Sørensen, quien lo definió como el
logaritmo negativo de base 10 de la actividad de los iones hidrógeno.
Para mirar el tema del pH es necesario recurrir a la expresión de disociación del agua, en
donde:
H2O ↔ H+ + OH-
Se sabe que a 25 ºC, la concentración de iones H+ y OH- es de 1x10-7 M respectivamente, lo
que indica que muy pocas moléculas de agua estarán disociadas.
Del producto iónico del agua se deduce que las concentraciones de H+ y OH- están
relacionadas de tal modo que conocida una de ellas se obtiene la otra de forma inmediata.
Para simplificar el manejo de magnitudes exponenciales se ha establecido el concepto de pH.
El pH es el logaritmo de la concentración de iones H+, con el signo cambiado:
Análogamente, se define pOH como el logaritmo de la concentración de iones OH -, con el signo
cambiado:
Se puede establecer la siguiente relación entre el pH y el pOH. Partiendo de la expresión del
producto iónico del agua (Kw):
VERSIÓN: Ofelia Meza Díaz FECHA: Semestre A -2020
tomando logaritmos:
y cambiando de signos se obtiene que:
o, lo que es lo mismo,
Así se puede calcular el pH de cualquier solución acuosa, si conocemos la concentración Molar
de H+
Consideremos lo siguiente:
Soluciones ácidas: [ H+] > [ OH-]
Soluciones neutras: [ H+] = [ OH-]
Soluciones básicas: [ OH-] > [ H+]
EJEMPLOS
1. Calcular la concentración de H+ y el pH de una solución de HCl 0.001M.
RTA/ Como este ácido se disocia completamente en agua, la concentración de protones y de
cloruro será igual a 0.001 M es decir 0.001 moles/litro.
Entonces pH = - log [ H+] = - log (0.001) = 3
2. Si tiene una solución 0.05 M de H2SO4, calcular el pH.
RTA/ En este caso, la disociación de un mol del ácido es:
H2SO4 2H + SO4 -2
Por cada mol de ácido sulfúrico se obtienen 2 moles de protones, por lo tanto el pH será:
pH = - log [ H+] = - log (2 x 0,05) = - log 0,1 = 1
VERSIÓN: Ofelia Meza Díaz FECHA: Semestre A -2020
3. Una solución 1.2 x 10-4 M de NaOH, ¿qué pH tendrá?
RTA/ La disociación de la base en agua es:
NaOH Na+ + OH-
Por cada mol de NaOH se obtiene un mol de OH-. Entonces por cada 1.2 x 10-4 M en NaOH,
tendremos una concentración de 1.2 x10-4 M en OH-. El pOH será:
pOH = - log [ OH-] = - log (1.2 x 10-4) = 3.92
como pH + pOH = 14, el pH será: pH = 14 - pOH = 14 - 3.92 = 10.08
EJERCICIOS PARA TRABAJAR EN CLASE
1. Hallar el pH de una solución de 0.01 M de ácido nítrico.
2.Calcular el pH de una solución de ácido cianhídrico al 0.01 M cuya constante de disociación
es de Ka= 4,9x10-10
3. Se mezclan 1.4 g de hidróxido potásico y 1 g de hidróxido sódico. La mezcla se disuelve en
agua y se diluye a 100 mL. Calcular el pH de la disolución.
VERSIÓN: Ofelia Meza Díaz FECHA: Semestre A -2020
También podría gustarte
- Calculos en Soluciones PH PDFDocumento4 páginasCalculos en Soluciones PH PDFMayra ScarletAún no hay calificaciones
- PH y Calculos en Soluciones Fin PDFDocumento4 páginasPH y Calculos en Soluciones Fin PDFariel yana morga100% (1)
- NjodgaDocumento6 páginasNjodgaJose Luis RodriguezAún no hay calificaciones
- Apuntes Equilibrio Ácido-BaseDocumento7 páginasApuntes Equilibrio Ácido-BaseIsraelAún no hay calificaciones
- Ejercicio 1Documento14 páginasEjercicio 1javier garciaAún no hay calificaciones
- Equilibrio IónicoDocumento9 páginasEquilibrio Iónicofrankgiper_17@hotmail.com100% (1)
- El PH y El pOHDocumento6 páginasEl PH y El pOHJose OrbegosoAún no hay calificaciones
- Marco TeóricoDocumento10 páginasMarco TeóricoMdyoriFlrsRmsAún no hay calificaciones
- Preparando Ejercicios Acido-BaseDocumento15 páginasPreparando Ejercicios Acido-BaseJhonatan HuarcaAún no hay calificaciones
- PH - PPT Nº3Documento21 páginasPH - PPT Nº3707002aAún no hay calificaciones
- PhoDocumento11 páginasPhobrandon donovan ortizAún no hay calificaciones
- La Escala de PHDocumento23 páginasLa Escala de PHHanael Perez CastañedaAún no hay calificaciones
- CÁLCULO DE PH y pOHDocumento5 páginasCÁLCULO DE PH y pOHAnita Duran100% (1)
- Ejercicios PHDocumento9 páginasEjercicios PHDavid Tunti AlanoccaAún no hay calificaciones
- Ejercicios Resueltos de Equilibrio QuímicoDocumento10 páginasEjercicios Resueltos de Equilibrio QuímicoMarcela Alvarado LondonoAún no hay calificaciones
- 8 Autoprotolisis - Celdas ElectroqxDocumento19 páginas8 Autoprotolisis - Celdas ElectroqxElmer SozaAún no hay calificaciones
- Equilibrio Ionico y PHDocumento4 páginasEquilibrio Ionico y PHJohano756Aún no hay calificaciones
- Cómo Calcular La Concentración de Iones de HidrógenoDocumento8 páginasCómo Calcular La Concentración de Iones de Hidrógenoelgione67% (3)
- El PH Solucion Es Acidas y BasicasDocumento37 páginasEl PH Solucion Es Acidas y BasicasnilsAún no hay calificaciones
- Acido y BaseDocumento63 páginasAcido y Basedarkwolf1003Aún no hay calificaciones
- Constantes de Disociacion para Acidos y BasesDocumento5 páginasConstantes de Disociacion para Acidos y Bases.:("*"BLacK BuLLeT"*"):.100% (1)
- Equilibrio Acido Base 1Documento31 páginasEquilibrio Acido Base 1Alejandra QuinteroAún no hay calificaciones
- MedicinaDocumento6 páginasMedicinaMariaXimenaBlancoAún no hay calificaciones
- Ácidos Bases y PH BioquimicaDocumento15 páginasÁcidos Bases y PH BioquimicaCarolina CopariAún no hay calificaciones
- PH TeoriaDocumento7 páginasPH Teoriaklissman Alvarado garciaAún no hay calificaciones
- Guia de Problemas Nº10Documento7 páginasGuia de Problemas Nº10Nahuel YurquinaAún no hay calificaciones
- Equilibrio IónicoDocumento5 páginasEquilibrio IónicoYvette CoronelAún no hay calificaciones
- Ácidos y BasesDocumento12 páginasÁcidos y BasesCarlos Alfonso Jara Benites100% (2)
- Resumen Ácido-BaseDocumento34 páginasResumen Ácido-Basearielstekel50% (2)
- Sistemas Ácido BaseDocumento65 páginasSistemas Ácido BaseAna HernándezAún no hay calificaciones
- Informe 10Documento12 páginasInforme 10Ramcés Ramos HinostrozaAún no hay calificaciones
- Guía Ác. Bas. 4º PH y pOH PDFDocumento3 páginasGuía Ác. Bas. 4º PH y pOH PDFTaMara XDAún no hay calificaciones
- Volumetría, Reacción Ácido - Base. Redox Y PhmetríaDocumento3 páginasVolumetría, Reacción Ácido - Base. Redox Y PhmetríagaboAún no hay calificaciones
- PH Practicas de FQB IIDocumento15 páginasPH Practicas de FQB IINihil RivasAún no hay calificaciones
- 10 Acidos y BasesDocumento32 páginas10 Acidos y BasesLilian OlvidoAún no hay calificaciones
- Tema 13. Equilibrio Iónico - Ácidos y Bases PDFDocumento39 páginasTema 13. Equilibrio Iónico - Ácidos y Bases PDFestefanoAún no hay calificaciones
- Ácidos y Bases - Química - 2022.dotxDocumento7 páginasÁcidos y Bases - Química - 2022.dotxMax ChazzAún no hay calificaciones
- Problemas Acido-BaseDocumento4 páginasProblemas Acido-BaseJesuAún no hay calificaciones
- Equilibrio Ionico AcidoDocumento8 páginasEquilibrio Ionico AcidoJean Danniel Montanares UlloaAún no hay calificaciones
- UnidadII EQUILIBRIOIONICODocumento17 páginasUnidadII EQUILIBRIOIONICOFranklin MadrizAún no hay calificaciones
- EJERCICIOS DE PHDocumento3 páginasEJERCICIOS DE PHGadiel Moises Molina ArenasAún no hay calificaciones
- Ácidos y BasesDocumento32 páginasÁcidos y Basesluisa niñoAún no hay calificaciones
- Indicadores y Titulación Ácido BaseDocumento25 páginasIndicadores y Titulación Ácido BaseMilagros V. InfanteAún no hay calificaciones
- Practica 2Documento9 páginasPractica 2pilar0% (1)
- Indicadores y Titulación Ácido BaseDocumento7 páginasIndicadores y Titulación Ácido BaseCarlitos Sánchez CallaAún no hay calificaciones
- Informe PHDocumento7 páginasInforme PHAndres Camilo GVAún no hay calificaciones
- Ácidos y BasesDocumento34 páginasÁcidos y BasesGiuliana Orduña Amado0% (1)
- PROBLEMAS DE PH y pOH - Docx (Recuperado)Documento2 páginasPROBLEMAS DE PH y pOH - Docx (Recuperado)JuanitoAún no hay calificaciones
- Acidos, Bases y Equilibrio IonicoDocumento39 páginasAcidos, Bases y Equilibrio Ionicoahsim67% (9)
- Equlibrio Quimico-UtpDocumento1 páginaEqulibrio Quimico-UtpguilverAún no hay calificaciones
- T - Sem 04 - Ses 08 - Ac Bs - Equilibrio Ionico - Micro Taller 04Documento1 páginaT - Sem 04 - Ses 08 - Ac Bs - Equilibrio Ionico - Micro Taller 04Brayam Stalyn Bonifacio AyalaAún no hay calificaciones
- P HDocumento26 páginasP Hgui1996Aún no hay calificaciones
- Autoinizacion Del AguaDocumento24 páginasAutoinizacion Del Aguaabigail0% (1)
- Reacciones Acido BaseDocumento31 páginasReacciones Acido BaselhistaAún no hay calificaciones
- Ejercicios Equilibrio IonicoDocumento1 páginaEjercicios Equilibrio IonicoclazojoseenriquAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Reseña Histórica UnipazDocumento5 páginasReseña Histórica Unipazjuan francisco gomez hernandezAún no hay calificaciones
- Taller de Clase Carga y CampoDocumento2 páginasTaller de Clase Carga y Campojuan francisco gomez hernandezAún no hay calificaciones
- Torque o Momento de TorsionDocumento2 páginasTorque o Momento de Torsionjuan francisco gomez hernandezAún no hay calificaciones
- Cationes y Aniones de Más UsoDocumento1 páginaCationes y Aniones de Más Usojuan francisco gomez hernandezAún no hay calificaciones
- Circular UniformeDocumento18 páginasCircular Uniformejuan francisco gomez hernandezAún no hay calificaciones
- Curva de Valoración Teórica Del Ácido AcéticoDocumento6 páginasCurva de Valoración Teórica Del Ácido AcéticoCésar ZamudioAún no hay calificaciones
- Practica AnhidridosDocumento2 páginasPractica AnhidridosCarlos Mamani60% (5)
- Amortiguadores CuestionarioDocumento3 páginasAmortiguadores CuestionariodagaAún no hay calificaciones
- Q6 PAU AcidosYBasesDocumento12 páginasQ6 PAU AcidosYBasesagurtzane.iturbeAún no hay calificaciones
- Informe de Laboratorio - Titulación de Soluciones - Equipo 2Documento16 páginasInforme de Laboratorio - Titulación de Soluciones - Equipo 2Adrian BautistaAún no hay calificaciones
- Actividad de Química - ExperimentoDocumento6 páginasActividad de Química - ExperimentoFernando RoblesAún no hay calificaciones
- Equilibrio QuimicoDocumento2 páginasEquilibrio QuimicoJOSUE RUBEN ORDINOLA AGURTOAún no hay calificaciones
- Ejercicios de Equilibrio QuímicoDocumento6 páginasEjercicios de Equilibrio QuímicoAlejandro Jimenez0% (1)
- Caso Del Agua2Documento6 páginasCaso Del Agua2Ovan IllAún no hay calificaciones
- Informe 01Documento15 páginasInforme 01Roy Cardenas ChaicoAún no hay calificaciones
- Equil. Iónicos 2017Documento34 páginasEquil. Iónicos 2017jorgeAún no hay calificaciones
- HidrolisisDocumento14 páginasHidrolisiscanva cuentaAún no hay calificaciones
- Une en Iso 9963 2 CarbonatoDocumento16 páginasUne en Iso 9963 2 Carbonatocristiancm1708Aún no hay calificaciones
- Titulacion de Un Acido DipróticoDocumento4 páginasTitulacion de Un Acido DipróticoMirsha Romina Jiménez GonzálezAún no hay calificaciones
- Unidad 10. Introducción Al Equilibrio QuímicoDocumento25 páginasUnidad 10. Introducción Al Equilibrio QuímicoJalverth OrtizAún no hay calificaciones
- AnalisisDocumento2 páginasAnalisisGabriela RonderosAún no hay calificaciones
- Guía de Práctica # 1Documento4 páginasGuía de Práctica # 1YefersonAún no hay calificaciones
- Metabolismo Del Ion HidrogenoDocumento1 páginaMetabolismo Del Ion Hidrogenogabrielita030987Aún no hay calificaciones
- Ficha de TrabajoDocumento3 páginasFicha de TrabajoDaniela Giuliana OLGUIN RAMOSAún no hay calificaciones
- Copia de EQUILIBRIO IONICODocumento20 páginasCopia de EQUILIBRIO IONICODayane CarolineAún no hay calificaciones
- Volumetrias Acido BaseDocumento27 páginasVolumetrias Acido BaseEvelyn PSAún no hay calificaciones
- Funcion Hidroxido para Segundo de SecundariaDocumento5 páginasFuncion Hidroxido para Segundo de SecundariaJHAZMIN ARACELI CARHUANCHO MORALESAún no hay calificaciones
- Clasificados 24-8Documento11 páginasClasificados 24-8LCMDPAún no hay calificaciones
- Ejercicios Resuelto Ácido BaseDocumento4 páginasEjercicios Resuelto Ácido Baseviviana jara tolozaAún no hay calificaciones
- Practico #8analitDocumento2 páginasPractico #8analitCarlos Cárdenas CastellónAún no hay calificaciones
- Guìa No 1 - Acido BaseDocumento3 páginasGuìa No 1 - Acido BaseJose Miguel Sequeira OportaAún no hay calificaciones
- Semana 2 ESENDocumento36 páginasSemana 2 ESENROSA LUCILA DEL CARPIO TORRESAún no hay calificaciones
- La Constante de Equilibrio K (Artículo) - Khan AcademyDocumento2 páginasLa Constante de Equilibrio K (Artículo) - Khan AcademyVictor AburtoAún no hay calificaciones
- Ejercicios Esteres - para ImprimirDocumento8 páginasEjercicios Esteres - para ImprimirWadir Flores tisnadoAún no hay calificaciones
- Informe Neutralizacion.Documento9 páginasInforme Neutralizacion.jennifer9hernande-18Aún no hay calificaciones