Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cementación Cobre Hierro
Cargado por
Jairo Bazan chavezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cementación Cobre Hierro
Cargado por
Jairo Bazan chavezCopyright:
Formatos disponibles
OPERACIONES Y PROCESOS
METALÚRGICOS
INFORME DE LABORATORIO DE OPERACIONES Y PROCESOS
METALÚRGICOS | SEMANA Nº 7 | CEMENTACIÓN DE COBRE EN
SOLUCIÓN|CICLO 2020-I MODALIDAD VIRTUAL
Robles Vergaray Jose Miguel | Pisco Jose Fernando | Jiménez Hugo
Alberto | Rimache Arotoma Jonathan | Bazán Chávez Jairo | viernes 25
Julio 2020
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
ÍNDICE
I- RESUMEN...........................................................................................................................2
II- INTRODUCCIÓN............................................................................................................2
III- MARCO TEÓRICO.........................................................................................................4
1. CEMENTACIÓN.............................................................................................................4
2. CEMENTACIÓN DE COBRE.........................................................................................4
3. PROCESOS QUÍMICOS DE LA CEMENTACIÓN DE COBRE...................................5
4. CINÉTICA DE LA REACCIÓN......................................................................................6
IV- MÉTODO Y MATERIALES...........................................................................................7
1. MATERIALES.................................................................................................................7
2. MÉTODO.........................................................................................................................7
V- CONSIDERACIONES EXPERIMENTALES.................................................................8
VI- PROCESAMIENTO DE DATOS EXPERIMENTALES.................................................9
VII- CONCLUSIONES Y RECOMENDACIONES..............................................................13
1. CONCLUSIONES..........................................................................................................13
2. RECOMENDACIONES................................................................................................13
VIII- BIBLIOGRAFIA........................................................................................................14
IX- ANEXOS........................................................................................................................14
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
I- RESUMEN
En esta práctica realizaremos un proceso de cementación de cobre utilizando virutas
de hierro
Partiremos de una solución de 250ml de CuSO4 con una concentración de 60gr Cu /
l para lo cual pesaremos 58.9 gr del compuesto hidratado CuSO4.H2O
Seguidamente pesaremos 5gr de virutas de hierro en 5 grupos de 1gr, procederemos
a agitar la solución con un agitador magnético e iremos añadiendo 1gr de fierro cada
10 minutos. En cada medida se anotará el potencial la celda usando un multímetro
(que es análogo a tomar lecturas de pH) y graficaran los datos de voltaje vs tiempo
II- INTRODUCCIÓN
La cementación de un metal a partir de una solución, depende de una reacción de
desplazamiento en la cual un metal menos noble reduce a los iones del metal por
precipitar al estado metálico. Entonces, éste sale de la solución, y los iones del metal
menos noble entran en la solución para substituirlos. Por ejemplo:
2 +¿¿
Cu 2+¿+Zn →Cu+Zn ¿
El metal utilizado debe tener un potencial de electrodo inferior al potencial del metal
que se desea precipitar. La reacción se produce a la superficie del metal, que se
agrega habitualmente en forma de polvo a la solución impura (Fig1).
Para alcanzar velocidades de reacción aceptables con impurezas que se encuentran
en bajas concentraciones, se tiene que agregar un exceso de metal, lo que conduce a
la obtención de cementos impuros. Además, estos cementos contienen todos los
metales de potencial superior al metal agregado.
El mejor metal utilizado para cementar las impurezas de una solución es
generalmente el mismo metal que se desea recuperar desde la solución pura.
Así, no se agrega otra impureza a la solución. Por ejemplo, el cadmio y el cobre
contenidos en las soluciones de lixiviación de concentrados de zinc se cementan con
polvo de zinc. Además de utilizarse como método de purificación de soluciones, la
cementación puede utilizarse para recuperar el metal valioso a partir de soluciones
diluidas (Ejemplo: cementación de cobre por chatarra de hierro)
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Cuando otros métodos no son aplicables, se pueden usar reactivos específicos de
precipitación. Estas reacciones son generalmente complejas, necesitan condiciones
de trabajo estrictas y consumen reactivos costosos. Por ejemplo, se usa el
nitrosobetanaphtol para precipitar el cobalto contenido en las soluciones de electro
obtención de zinc.
Se puede aplicar todas las reacciones que estudiaron en el ramo de química en la
enseñanza media tales como precipitación de sulfuros, formación de sales. Por
ejemplo:
Ag NO 3 + NaCl=¿ AgCl( precipitado)+ NaNO3
Es importante el fenómeno de envejecimiento de un precipitado, favorecido por una
temperatura alta y un tiempo de contacto solución-precipitados largo. El
envejecimiento consiste en la disolución de las partículas más finas y formación de
precipitados más gruesos, generalmente acompañado por un cambio en la estructura
cristalina de estos. Mejora la insolubilidad del precipitado y su posterior filtración.
La co-precipitación es cuando hay precipitación de dos o más elementos al mismo
tiempo. El elemento minoritario puede ser disuelto en la matriz cristalina del 14
elemento mayoritario, o absorbido en su superficie.
Esto puede ser ventajoso, ya que la concentración del elemento minoritario en la
solución puede bajar a niveles mucho más bajos que por precipitación de este
elemento en forma pura.
Por ejemplo, en la hidrometalurgia del zinc, impurezas como el Ge y el As
coprecipitan con un hidróxido de hierro, probablemente por absorción en la
superficie de los floculos de "hidróxido de hierro.: Existen varias formas de
precipitar el hierro: como jarosita, goetita, ...
Es común pensar en lixiviación como una simple disolución selectiva del metal
deseado, por ende, si tengo ácido y un mineral, los mezclo en proporciones
razonables y espero que el ácido haga su trabajo, por ende, lo que hasta el momento
me interesa es la masa del mineral, su ley, el volumen del ácido, su concentración y
el tiempo necesario para que la disolución sea completa y no perder más tiempo.
Pero si me interesa saber cómo ocurre la disolución, como la masa del Cu y
concentración del ácido va disminuyendo y como aumenta el catión Cu+ en la
solución, para poder predecir mediante un modelo los valores óptimos y hacer
proyecciones interpolando o extrapolando el modelo, entonces se debe monitorear el
proceso analizando muestras mediante la titulación, para poder calcular el ácido
libre, por ende el consumo de ácido, así como la concentración del metal en
solución, de acuerdo a estos valores puedo predecir el tiempo óptimo para el
proceso, mediante las curvas cinéticas
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
III- MARCO TEÓRICO
1. CEMENTACIÓN
La cementación es la precipitación de un metal desde una solución acuosa, que se
produce por efecto de la presencia de otro metal. En este proceso el metal
precipitado usualmente se deposita o "cementa" sobre el metal añadido.
En general, mientras mayor sea el potencial de celda de la reacción de cementación,
mayor será la tendencia a precipitar impurezas, ya que éstas se encontrarán
comprendidas con mayor probabilidad, en cierto rango de potenciales, por lo que se
verán favorecidas para precipitar en conjunto.
En el caso de la cementación de cobre mediante fierro, junto al cobre coprecipitan el
plomo, estaño, níquel y cobalto que se encuentran presentes en solución,
contaminando el producto. De igual modo, cualquier impureza insoluble presente en
el fierro, como los carburos, también contaminará el producto.
La cementación en fase líquida presenta las siguientes ventajas:
La reacción se produce con gran rapidez.
El precipitado puede separarse con facilidad sin contaminación.
Se puede reciclar la solución gastada final y proceder a devolverla a
su estado reducido anterior con algún otro proceso sencillo.
Presenta una gran economía de espacio y de costos de operación.
2. CEMENTACIÓN DE COBRE
La cementación del cobre en solución está descrita por la reacción:
Fe°: chatarra de hierro o retallas de fierro
Cu2+: cobre en solución como sulfato
Cu0: Precipitado de cobre metálico
Fe2+: Fierro en solución como sulfato ferroso
La ventaja principal de la cementación es su sencillez. Virtualmente se puede
remover todo el cobre de la solución en una serie corta de tanques o de canales de
contacto. Contra esta sencillez se debe considerar el hecho de que el producto de
cobre se purificará posteriormente. 20 El método más común de tratamiento del
cobre cementado es por fundición en hornos de fundición o convertidores a partir de
los cuales sigue la ruta estándar de electro refinación de ánodos. Otro método poco
usado, es disolver el cobre cementado en una solución acuosa básica y luego
reducirla con hidrógeno. La impureza de hierro precipita de la solución básica como
hidróxido férrico, mientras que el cobre es reducido por la reacción:
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Ilustración 1
3. PROCESOS QUÍMICOS DE LA CEMENTACIÓN DE COBRE
Cuando una pieza de fierro metálico es sumergida en una solución acuosa con
iones cobre, el hierro tiende a entrar en solución mientras que el cobre metálico
tiende a precipitar. La fuerza motriz para el proceso es el potencial electroquímico
de la reacción. Este potencial es la diferencia entre los potenciales de media celda
del cobre y del fierro, es decir
Estos potenciales están relacionados con los potenciales electroquímicos estándar y
las actividades de los iones en solución mediante la ecuación de Nernst:
La reacción procederá hasta que el potencial se aproxime a cero volt, condición en
la que los metales y iones han alcanzado el equilibrio. La relación de equilibrio
iónico puede calcularse con la condición de 0 volt aplicada a la ecuación. A 250C
la relación es 1025. Esta relación extremadamente grande indica que la reacción de
precipitación puede proceder hasta que casi todos los iones cobres precipitan de la
solución, lo cual está de acuerdo con la práctica de cementación industrial según la
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
cual más del 90% del cobre es retirado de las soluciones saturadas antes de que
sean recicladas al circuito de lixiviación.
La ecuación establece que 1 mol de fierro (55.85 kg) debe precipitar 1 mol de
cobre (63.54 kg), que equivale a 0.88 kg de hierro por kg de cobre. En la operación
industrial son necesarios 1.5 a 2.5 kg de hierro, en gran parte como consecuencia
de las dos reacciones secundarias:
El oxígeno atmosférico contribuye a que se consuma fierro en exceso porque lo
oxida directamente o puede producir iones Fe3+ que consumen hierro metálico
según la reacción. Alguna parte del cobre también se puede oxidar y disolver
nuevamente, lo cual hace necesaria una nueva precipitación.
4. CINÉTICA DE LA REACCIÓN
En la reacción de cementación se transfieren electrones entre el hierro que se
disuelve y el cobre que precipita. Esto hace que el cobre se deposite en la superficie
del fierro en vez de permanecer en la solución. Por consiguiente, es necesario que
las condiciones en el flujo de fluido y en la superficie del hierro sean las adecuadas
para que el precipitado sea fácil de separar de la superficie de éste. Parece no haber
una norma absoluta para la obtención de un depósito granular denso, pero parece
que las altas velocidades del flujo de la solución a través del acero y los bordes
pronunciados (aristas vivas) dan el mejor tipo de precipitación para su colección y
transporte.
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
IV- MÉTODO Y MATERIALES
1. MATERIALES
pHmetro
Voltímetro
Vaso precipitado de 200 ml
Agitador
Balanza
Matraz
2. MÉTODO
Se prepara una solución de sulfato de cobre con concentración de 60gr/l Cu,
para lo cual se pesa 50.9 gr de CuSO4.5H2O y se diluye en 250 ml de agua en
un matraz.
Se pesan 5 virutas de hierro de 1 gr cada una y se les da una forma compacta.
Se homogeniza la solución en el agitador durante 10 minutos y se mide el
voltaje inicial.
Se agrega cada viruta, una por una, en un intervalo de 10 minutos y se mide el
voltaje en cada secuencia.
Se observa la cementación del cobre en las virutas de hierro.
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
V- CONSIDERACIONES EXPERIMENTALES
En esta práctica se tuvo que pesar el sulfato de cobre pentahidratado para una
concentración de 40, 50, 60 y 70 gCu/l. esto se dará de la siguiente manera:
Para 40 gCu/l:
40 gr Cu
∗249.7 gr CuS O4 5 H 2 O
1l
g CuSO 4 5 H 2 O= ∗0.25 l=39.3 gr CuSO 4 5 H 2 O
63.5 grCu
Para 50 gCu/l:
50 gr Cu
∗249.7 gr CuSO 4 5 H 2 O
1l
g CuSO 4 5 H 2 O= ∗0.25 l=49.15 gr CuSO 4 5 H 2 O
63.5 grCu
Para 60 gCu/l:
60 gr Cu
∗249.7 gr CuS O4 5 H 2 O
1l
g CuSO 4 5 H 2 O= ∗0.25 l=58.9 gr CuS O 4 5 H 2 O
63.5 grCu
Para 70 gCu/l:
70 gr Cu
∗249.7 gr CuSO 4 5 H 2 O
1l
g CuSO 4 5 H 2 O= ∗0.25 l=68.8 gr CuS O4 5 H 2 O
63.5 grCu
Tabla 1: Datos experimentales del pH, voltaje y del tiempo
pH VOLTAJE(mV ) TIEMPO(en min)
40 gCu/l50 gCu/l60 gCu/l70 gCu/l40 gCu/l50 gCu/l60 gCu/l70 gCu/l40 gCu/l50 gCu/l60 gCu/l70 gCu/l
3.8 4.35 --- 3.13 --- -3.3 -3.5 89 0
3.97 4.20 --- 3.45 --- -4.4 -5.5 90 10
4.14 4.08 --- 3.49 --- -5.3 -7.5 92 20
3.96 4 --- 3.53 --- -6.4 -9 91 30
3.75 3.75 --- 3.55 --- -9.9 -12 92 40
3.92 3.61 --- 3.62 --- -11.8 -13.5 87 50
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
VI- PROCESAMIENTO DE DATOS EXPERIMENTALES
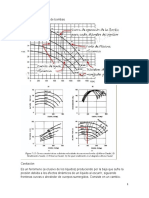
Graficaremos el voltaje con respecto al tiempo para cada concentración para
observar el decaimiento del voltaje debido a una disminución de ion cobre.
Ilustración 2: Gráfico voltaje vs tiempo en la concentración
de 50gCu/l
0
0 10 20 30 40 50 60
-2
Voltaje (en mV)
-4
-6
-8
-10
-12
-14
Tiempo (en min)
Ilustración 3:Gráfico voltaje vs tiempo en la
concentración de 60gCu/l
0
0 10 20 30 40 50 60
-2
-4
Voltaje (en mV)
-6
-8
-10
-12
-14
-16
Tiempo (en min)
Ilustración 4: Gráfico voltaje vs tiempo en la
93 concentración de 70gCu/l
92
91
Voltaje (en mV)
90
89
88
87
86
85
84
0 10 20 30 40 50 60
Tiempo (en min)
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Determinamos la constante K para cada concentración mediante interpolación lineal
Para 50gCu/l:
Graficaremos Ln V con respecto al tiempo y con la ecuación hallaremos la
constante.
Ilustración 5:Gráfico Ln V vs tiempo para 50gCu/l
2.5
f(x) = 0.03 x + 1.18
2
Ln Voltaje
1.5
0.5
0
0 10 20 30 40 50 60
Tiempo (en min)
En este grafico se hizo un ajuste, el cual trata de cambiar el valor del voltaje que era
negativo a positivo para así hallar el logaritmo neperiano y con ello la constante.
Obtuvimos como ecuación:
y=0.0257 x +1.1844
Debido a que hallamos con el valor absoluto entonces:
K=0.0257
ln Vo=1.1844
Vo=3.2687 mV
Con el valor de K podremos hallar la concentración en cada intervalo de tiempo
mediante la siguiente fórmula:
ln [ C u+2 ]=ln [ C u+2 ] 0−kt
Tabla 2
TIEMPO (EN MIN ) ln ¿ ¿
0 3.91202301 50
10 3.65502301 38.66841069
20 3.39802301 29.9049197
30 3.14102301 23.12751433
40 2.88402301 17.88608445
50 2.62702301 13.83252918
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Para 60gCu/l:
Graficaremos Ln V con respecto al tiempo y con la ecuación hallaremos la
constante.
3 Ilustración 6: Gráfico LnV vs tiempo para 60gCu/l
2.5 f(x) = 0.03 x + 1.38
2
Ln Voltaje
1.5
1
0.5
0
0 10 20 30 40 50 60
Tiempo (en min)
En este grafico se hizo un ajuste, el cual trata de cambiar el valor del voltaje que era
negativo a positivo para así hallar el logaritmo neperiano y con ello la constante.
Obtuvimos como ecuación:
y=0.0265 x +1.3806
Debido a que hallamos con el valor absoluto entonces:
K=0.0265
ln Vo=1.3806
Vo=3.9773 mV
Con el valor de K podremos hallar la concentración en cada intervalo de tiempo
mediante la siguiente fórmula:
ln [ C u+2 ]=ln [ C u+2 ] 0−kt
Tabla 3
TIEMPO (EN MIN ) ln ¿ ¿
0 4.09434456 60
10 3.82934456 46.032357
20 3.56434456 35.31629818
30 3.29934456 27.0948741
40 3.03434456 20.78734862
50 2.76934456 15.94817755
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Para 70gCu/l:
Graficaremos Ln V con respecto al tiempo y con la ecuación hallaremos la
constante.
Ilustración 7:Gráfico Ln V vs tiempo para 70gCu/l
4.54
4.52
4.5
Ln Voltaje
f(x) = − 0 x + 4.51
4.48
4.46
4.44
4.42
0 10 20 30 40 50 60
Tiempo (en min)
Obtuvimos como ecuación:
y=−0.0002 x +4.5057
Debido a que hallamos con el valor absoluto entonces:
K=0.002
ln Vo=4.5057
Vo=90.5317 mV
Con el valor de K podremos hallar la concentración en cada intervalo de tiempo
mediante la siguiente fórmula:
ln [ C u+2 ]=ln [ C u+2 ] 0−kt
Tabla 4
TIEMPO (EN MIN ) ln ¿ ¿
0 4.24849524 70
10 4.24649524 69.86013991
20 4.24449524 69.72055925
30 4.24249524 69.58125748
40 4.24049524 69.44223404
50 4.23849524 69.30348836
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
VII- CONCLUSIONES Y RECOMENDACIONES
1. CONCLUSIONES
En la gráfica voltaje vs tiempo se observa que el voltaje decrece debido a que la
concentración de Fe aumenta por las virutas. Esto hace que el potencial de la celda
aumente negativamente y la gráfica tienda hacia abajo
El Cu precipita de color marrón en la superficie de las virutas de hierro mientras que
este pasa a solución como ion Fe +2 debido a que en la serie electroquímica de las
reacciones establecidas el potencial de reducción del Cu es menor que la del hierro
por lo que el proceso es termodinámicamente espontaneo o favorable
−¿→Cu Eºred=+0.15 V ¿
Cu 2+¿+2 e ¿
−¿Eºoxid =+ 0.44 V ¿
Fe → Fe 2+¿+2 e ¿
El medio sulfato es favorable para disolver muchos metales y es el preferido para
procesos de cementación de metales
Para esta práctica se pudo haber usado cualquier otro metal cuyo potencial estándar
de reducción sea superior al del Cu para precipitarlo (como el Sn, Pb, Cd, etc.) ya
que al igual que el Fe pasaría a solución, pero el inconveniente seria de que no todos
son totalmente solubles en medio sulfato y también por cuestiones de prácticas de
facilidad de contar con virutas de Fe.
2. RECOMENDACIONES
Añadir polvo de Fe a la solución en vez de virutas de metal enrollado para acelerar la
cinética de reacción ya que uno de los factores que afecta la velocidad de reacción es
el tamaño de partícula (mientras más pequeña sea esta más rápida será la cinética)
Tomar medidas de pH usando un pH metro para contrastar gráficamente nuestros
datos tabulados (pH análogo al potencial)
Cuando usemos el agitador tener 2 imanes, uno que gire en el centro de la base del
vaso de precipitados y otros para ayudar a colocar y sacar el primer imán para evitar
rajar el material de laboratorio por impacto
Almacenar cuidadosamente las virutas de metal y no dejarlas expuestas al exterior
por mucho tiempo ya que se puede formar una ligera capa superficial de óxido lo
cual dificultaría la cinética de reacción.
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
VIII- BIBLIOGRAFIA
https://www.monografias.com/trabajos94/cemento-cobre/cemento-cobre.shtml
https://unac.edu.pe/documentos/organizacion/vri/cdcitra/Informes_Finales_Inve
stigacion/IF_DICIEMBRE_2012/IF_SUERO
%20IQUIAPAZA_FIQ/FINAL.pdf
http://sisbib.unmsm.edu.pe/bibvirtual/publicaciones/geologia/v13_n26/pdf2/a07
v13n26.pdf
http://repositorio.uncp.edu.pe/bitstream/handle/UNCP/2217/Reina%20Orosco
%20-%20Rey%20Delgadillo.pdf?sequence=1&isAllowed=y
IX- ANEXOS
Ilustración 8: Agitador
Ilustración 9: Dilución de la muestra
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
CEMENTACIÓN DE COBRE EN DILUSIÓN – SEMANA Nº 7 – UNMSMM - FIGMMG
Ilustración 10: Agitación de la muestra
Ilustración 11: Pesado de virutas de hierro
Ilustración 12: Virutas sumergidas en solución Ilustración 13: Cementación del cobre
acuosa de Cu
INFORME DE PRÁCTICA Nº 7 – OPERACIONES Y PROCESOS METALÚRGICOS
También podría gustarte
- Diseño de máquina prototipo para rebordar fondos esféricosDocumento202 páginasDiseño de máquina prototipo para rebordar fondos esféricosobseman100% (1)
- Quimica y Cinetica de La TostacionDocumento5 páginasQuimica y Cinetica de La TostacionSheila Allende Aguilar100% (1)
- Pirometalurgia Del HierroDocumento6 páginasPirometalurgia Del HierroMarcelo SepulvedaAún no hay calificaciones
- TRANSMISOR 3095MV Multivariable HartDocumento48 páginasTRANSMISOR 3095MV Multivariable HartRicardoCarreño100% (1)
- Ajuste de Un Carburador StrombergDocumento13 páginasAjuste de Un Carburador StrombergAdrian Gimenez100% (1)
- Proceso Centro Metalúrgico La OroyaDocumento9 páginasProceso Centro Metalúrgico La OroyaJavier GRAún no hay calificaciones
- Metalurgia General PirometalurgiaDocumento21 páginasMetalurgia General PirometalurgiaLuis Quintanilla100% (1)
- Secado y TostacionDocumento57 páginasSecado y TostacionPF100% (2)
- Metalurgia Del CobreDocumento12 páginasMetalurgia Del CobreDante J Garcia NeyraAún no hay calificaciones
- Cinetica de La Reaccion de Tostacion OkDocumento143 páginasCinetica de La Reaccion de Tostacion OkRey Daniel Apolonio MoralesAún no hay calificaciones
- Lixiviacion Del ZNDocumento28 páginasLixiviacion Del ZNwera RoncaglioloAún no hay calificaciones
- 2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoDocumento19 páginas2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoJORDAN LEONCIO OLIVARES SEGOVIAAún no hay calificaciones
- Balance Tostacion EjercicioDocumento12 páginasBalance Tostacion Ejerciciomichael alanya100% (1)
- Tostacion CloruranteDocumento104 páginasTostacion Cloruranteduvanp920% (1)
- Ejercicio Tostacion PiritaDocumento3 páginasEjercicio Tostacion PiritaCamila SilvaAún no hay calificaciones
- Caracterización y Técnicas de Muestreo - TerminadoDocumento9 páginasCaracterización y Técnicas de Muestreo - TerminadoRoyni Ramirez CcantoAún no hay calificaciones
- 3 - Diagramas de EllinghamDocumento44 páginas3 - Diagramas de EllinghamNicolas Enrique Sanchez Aspee100% (1)
- Curso Metalurgia 2 Capitulo I 2010Documento80 páginasCurso Metalurgia 2 Capitulo I 2010Sebastian Acosta Cheuquepan100% (1)
- Proceso Del ZincDocumento20 páginasProceso Del ZincDavidCPAún no hay calificaciones
- DiagramasKellogOxidacionSulfurosDocumento19 páginasDiagramasKellogOxidacionSulfurosMacarena Paz Salinas AguilarAún no hay calificaciones
- Separata #09 Diagramas de KelloggDocumento9 páginasSeparata #09 Diagramas de KelloggJesus Noel Mendoza VenturaAún no hay calificaciones
- Corrosión acero gotas salinaDocumento18 páginasCorrosión acero gotas salinaAnthony Rafael QuirozAún no hay calificaciones
- Tesis Liiiiiiiiiiiiiiiiiixiviacion AlcalinaDocumento64 páginasTesis Liiiiiiiiiiiiiiiiiixiviacion AlcalinaRaulAún no hay calificaciones
- Refinacion Del PBDocumento4 páginasRefinacion Del PBFranklin Roosevelt Gonzalo RojasAún no hay calificaciones
- Proceso plomo: extracción, propiedades, usosDocumento7 páginasProceso plomo: extracción, propiedades, usosdaert14Aún no hay calificaciones
- Trabajo Final - Eliminacion Del Arsenico y Mercurio de Los Concentrados de CobreDocumento28 páginasTrabajo Final - Eliminacion Del Arsenico y Mercurio de Los Concentrados de CobreMarkos Arratea BarrigaAún no hay calificaciones
- Esfalerita o BlendaDocumento8 páginasEsfalerita o BlendadiegodiegodiegodiegoAún no hay calificaciones
- Preguntas y Respuestas HidrometalurgiaDocumento4 páginasPreguntas y Respuestas HidrometalurgiaJheferson Yauyo MallquiAún no hay calificaciones
- Practica N 5 FiltracionDocumento4 páginasPractica N 5 FiltracionRonald Alarcon RomaniAún no hay calificaciones
- Procesamiento de metales y sus etapasDocumento34 páginasProcesamiento de metales y sus etapasNilton Flavio Benites QuispeAún no hay calificaciones
- Laboratorio 7 de Hidro y Electrometalurgia-Preci (Itación Por CementaciónDocumento13 páginasLaboratorio 7 de Hidro y Electrometalurgia-Preci (Itación Por CementaciónPjanoo1989Aún no hay calificaciones
- LIXIVIACIONDocumento12 páginasLIXIVIACIONemersonmonzonAún no hay calificaciones
- Regla de Fases - Sulfato de CuDocumento31 páginasRegla de Fases - Sulfato de CuVictor V IeAún no hay calificaciones
- Metalurgia Del ZincDocumento22 páginasMetalurgia Del ZincDavid RodriguezAún no hay calificaciones
- Metalurgia Del Plomo Refinado PBDocumento34 páginasMetalurgia Del Plomo Refinado PBErikaToribioVicenteAún no hay calificaciones
- Termodinamica - Mario SanchezDocumento8 páginasTermodinamica - Mario SanchezSaul Omar Fernandez RojasAún no hay calificaciones
- Cálculo equilibrios Ag-H2ODocumento14 páginasCálculo equilibrios Ag-H2OLS Emanuel DiegoAún no hay calificaciones
- TostacionDocumento31 páginasTostacionSteven Tremol100% (1)
- Tarea de Lectura N°7Documento3 páginasTarea de Lectura N°7Hugo JimenezAún no hay calificaciones
- Tostacion Sulfatante SelectivaDocumento5 páginasTostacion Sulfatante SelectivaRosaliaFernandezGutierrezAún no hay calificaciones
- Proceso de Refinacion Del CobreDocumento26 páginasProceso de Refinacion Del Cobremau_fumarolo5337Aún no hay calificaciones
- Cinetica de Los Procesos ElectrometalurgicosDocumento47 páginasCinetica de Los Procesos ElectrometalurgicosRoger Rojas PadillaAún no hay calificaciones
- Curso Hidrometalurgia 2021-I: Balance metalúrgico de zinc y diagrama de flujo de lixiviaciónDocumento3 páginasCurso Hidrometalurgia 2021-I: Balance metalúrgico de zinc y diagrama de flujo de lixiviaciónNicole Flores GenebrozoAún no hay calificaciones
- Aglomeración ExpoDocumento31 páginasAglomeración ExpoYesenia Felix33% (3)
- Electrorefinacion de MolibdenoDocumento19 páginasElectrorefinacion de MolibdenoCamila Ludeña RiveraAún no hay calificaciones
- Zinc2 PDFDocumento10 páginasZinc2 PDFAlejandroAún no hay calificaciones
- TostacionDocumento31 páginasTostacionAlejandro Barrientos MuñozAún no hay calificaciones
- Refinación química de la plata: procesos y etapasDocumento7 páginasRefinación química de la plata: procesos y etapasMarco C. PumaAún no hay calificaciones
- Introducción y Lixiviación de Metales PreciososDocumento44 páginasIntroducción y Lixiviación de Metales PreciososRonald Alarcon RomaniAún no hay calificaciones
- Hidrometalurgia TiO2Documento31 páginasHidrometalurgia TiO2Miguel Angel LòpezAún no hay calificaciones
- Lixiviación de concentrado de plomo-plata usando NaNO3 a 130°CDocumento8 páginasLixiviación de concentrado de plomo-plata usando NaNO3 a 130°CRoberto Zárate100% (1)
- ELECTROMETALURGIADocumento38 páginasELECTROMETALURGIAAdriana LópezAún no hay calificaciones
- Modelo cinético de cementación del cobreDocumento8 páginasModelo cinético de cementación del cobreMiguel Angel MontoyaAún no hay calificaciones
- Cementacion de CobreDocumento29 páginasCementacion de CobrePaul Acosta Mamani100% (1)
- J.L. Precipitacion IONICADocumento7 páginasJ.L. Precipitacion IONICATacachiri Chocamani JaimeAún no hay calificaciones
- Lab 3 Piro 2Documento8 páginasLab 3 Piro 2Oscar Salazar MorenoAún no hay calificaciones
- Cementacion Del CobreDocumento9 páginasCementacion Del CobreLuvinca Daniela Plata AlconAún no hay calificaciones
- Planta de Merrill Crowe - Grupo#7Documento29 páginasPlanta de Merrill Crowe - Grupo#7Cinthia Gonzales DominguezAún no hay calificaciones
- ElectrodeposicionDocumento12 páginasElectrodeposicionNils RomeroAún no hay calificaciones
- Cementación CobreDocumento17 páginasCementación CobreMario Antonio Torrelio Aguilar100% (1)
- Informe Cementacion CobreDocumento17 páginasInforme Cementacion CobreJoselinaSosaZavala100% (1)
- Merrill Crowe - (Nauduan, Palleres, Frez)Documento36 páginasMerrill Crowe - (Nauduan, Palleres, Frez)Daniel Nauduan FloresAún no hay calificaciones
- Elq Lab 1Documento10 páginasElq Lab 1Williams ChoqueAún no hay calificaciones
- Ractica Calificada de Laboratorio NDocumento8 páginasRactica Calificada de Laboratorio NJairo Bazan chavezAún no hay calificaciones
- Propiedades y SoldaduraDocumento20 páginasPropiedades y SoldaduraJairo Bazan chavezAún no hay calificaciones
- Precipitación química y adsorción para tratar efluentes con metalesDocumento2 páginasPrecipitación química y adsorción para tratar efluentes con metalesJairo Bazan chavezAún no hay calificaciones
- Operaciones Metalurgicas 1Documento3 páginasOperaciones Metalurgicas 1Jairo Bazan chavezAún no hay calificaciones
- Método de Newton ProgresivoDocumento3 páginasMétodo de Newton ProgresivoJairo Bazan chavezAún no hay calificaciones
- Practica Calificada de Laboratorio 5Documento3 páginasPractica Calificada de Laboratorio 5Jairo Bazan chavezAún no hay calificaciones
- Cementación Cobre HierroDocumento18 páginasCementación Cobre HierroJairo Bazan chavezAún no hay calificaciones
- Minera Huaron Expo FinalDocumento18 páginasMinera Huaron Expo FinalJairo Bazan chavezAún no hay calificaciones
- Labo Semana 7Documento11 páginasLabo Semana 7Jairo Bazan chavezAún no hay calificaciones
- Examen Experimental Bloque 2 Edison BazanDocumento8 páginasExamen Experimental Bloque 2 Edison BazanJairo Bazan chavezAún no hay calificaciones
- Informe 6 Sedimentacion de PulpaDocumento18 páginasInforme 6 Sedimentacion de PulpaJairo Bazan chavez0% (1)
- Energ Libre Fe2o3 Reduc H-GDocumento2 páginasEnerg Libre Fe2o3 Reduc H-GJairo Bazan chavezAún no hay calificaciones
- Practica de Labopratorio 4Documento6 páginasPractica de Labopratorio 4Jairo Bazan chavezAún no hay calificaciones
- Informe 4 Grupo de BazanDocumento15 páginasInforme 4 Grupo de BazanJairo Bazan chavezAún no hay calificaciones
- Evaluación de Lectura 3Documento2 páginasEvaluación de Lectura 3Jairo Bazan chavezAún no hay calificaciones
- Solucion Problema #2Documento3 páginasSolucion Problema #2Jairo Bazan chavezAún no hay calificaciones
- GRUDO DE JOSE MIGUEL ROBLES Y JAIRO BAZAN 4.5 Tarea 4 Problema Tostación CuSDocumento2 páginasGRUDO DE JOSE MIGUEL ROBLES Y JAIRO BAZAN 4.5 Tarea 4 Problema Tostación CuSJairo Bazan chavezAún no hay calificaciones
- DiferenciaPotencialEléctricaDocumento3 páginasDiferenciaPotencialEléctricaKhriztianJuarez100% (1)
- Tarea 01 - Operaciones Con ConductoresDocumento15 páginasTarea 01 - Operaciones Con ConductoresDavid Grimaldo Mendoza CruzAún no hay calificaciones
- Calculo Del Espesor Del Pavimento.Documento28 páginasCalculo Del Espesor Del Pavimento.juanca3509Aún no hay calificaciones
- Estatuto Del CIPDocumento54 páginasEstatuto Del CIPLUIS MIGUEL LARICO CAMAAún no hay calificaciones
- Tarifa 2011 - 01 - 27Documento16 páginasTarifa 2011 - 01 - 27VEMATELAún no hay calificaciones
- Evidencia de AlgorismoDocumento1 páginaEvidencia de Algorismolineth oyolaAún no hay calificaciones
- Trabajo Escalonado de Construccion I I 2015 - IDocumento2 páginasTrabajo Escalonado de Construccion I I 2015 - ILuis Salazar CAún no hay calificaciones
- CavitaciónDocumento6 páginasCavitaciónRaul KantunAún no hay calificaciones
- Estructura Básica de Un Programa en Mikroc Pro (Sin Funciones)Documento14 páginasEstructura Básica de Un Programa en Mikroc Pro (Sin Funciones)Gerardo Treviño GarciaAún no hay calificaciones
- Solucionario de PC2 de Mecánica de FluidosDocumento8 páginasSolucionario de PC2 de Mecánica de FluidosNoel Kevin HuancachoqueAún no hay calificaciones
- Promotruper AbrilDocumento10 páginasPromotruper AbrilEduardo Carreón100% (1)
- Ondas y ElectricidadDocumento2 páginasOndas y ElectricidadPablo Flores TorresAún no hay calificaciones
- Diseño estructural sismo resistente en hormigón armado de un edificio de cuatro plantasDocumento95 páginasDiseño estructural sismo resistente en hormigón armado de un edificio de cuatro plantasJavierAún no hay calificaciones
- PDFDocumento3 páginasPDFJose Oswaldo Sierra MatheusAún no hay calificaciones
- Identificacion de Peligros y Evaluacion de Riesgos en SecadoDocumento7 páginasIdentificacion de Peligros y Evaluacion de Riesgos en SecadoDiana Belén StuardoAún no hay calificaciones
- Bujías IncandescentesDocumento4 páginasBujías IncandescentesA-t Hector100% (4)
- Cuestionario Unidad 5Documento6 páginasCuestionario Unidad 5Liam MartzAún no hay calificaciones
- Fábre Trujillo - U3.A1 2Documento9 páginasFábre Trujillo - U3.A1 2lucia salazarrAún no hay calificaciones
- Informe de Avaluo Sociedad Mercantil HPDocumento38 páginasInforme de Avaluo Sociedad Mercantil HPJose Alberto Nuñez RodiguezAún no hay calificaciones
- Arquitectura de Principios Del Siglo XX La Perfección de La UtilidadDocumento10 páginasArquitectura de Principios Del Siglo XX La Perfección de La UtilidadLAún no hay calificaciones
- Reforzamiento de Puentes con Materiales Compuestos FRPDocumento62 páginasReforzamiento de Puentes con Materiales Compuestos FRPMauricio TovarAún no hay calificaciones
- Como Funciona Un Minisplit InverterDocumento4 páginasComo Funciona Un Minisplit InverterOscar GutierrezAún no hay calificaciones
- Proyecto Investigativo El Ceibal Sanitaria IDocumento37 páginasProyecto Investigativo El Ceibal Sanitaria IGabriela Zambrano Moreira0% (3)
- Raychem Terminal Termocontractyl Catalogo-Hvt-J-Y-SjDocumento1 páginaRaychem Terminal Termocontractyl Catalogo-Hvt-J-Y-SjAbinadad Negrete VegaAún no hay calificaciones
- HidrostaticaDocumento68 páginasHidrostaticaAlexito Melgarejo GuillermoAún no hay calificaciones
- Busqueda No Informada - IADocumento8 páginasBusqueda No Informada - IAFran PulidoAún no hay calificaciones
- Capacitacion Cables DesarrolloDocumento10 páginasCapacitacion Cables DesarrollojhulinobAún no hay calificaciones