Documentos de Académico
Documentos de Profesional
Documentos de Cultura
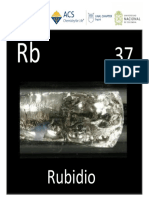
Rubidio
Cargado por
jesus lopezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Rubidio
Cargado por
jesus lopezCopyright:
Formatos disponibles
Rubidio
Ir a la navegaci�nIr a la b�squeda
Kript�n ? Rubidio ? Estroncio
Lattice body centered cubic.svg Capa electr�nica 037 Rubidio.svg
37 Rb
Tabla completa � Tabla ampliada
Rb,37.jpg
Plateado blanquecino
Informaci�n general
Nombre, s�mbolo, n�mero Rubidio, Rb, 37
Serie qu�mica Metales alcalinos
Grupo, per�odo, bloque 1, 5, s
Masa at�mica 85,4678 u
Configuraci�n electr�nica [Kr]5s1
Dureza Mohs 0,3
Electrones por nivel 2, 8, 18, 8, 1 (imagen)
Propiedades at�micas
Radio medio 235 pm
Electronegatividad 0,82 (escala de Pauling)
Radio at�mico (calc) 265 pm (radio de Bohr)
Radio covalente 211 pm
Radio de van der Waals 303 pm
Estado(s) de oxidaci�n 1
�xido Base fuerte
1.� energ�a de ionizaci�n 403,0 kJ/mol
2.� energ�a de ionizaci�n 2633 kJ/mol
3.� energ�a de ionizaci�n 3860 kJ/mol
4.� energ�a de ionizaci�n 5080 kJ/mol
5.� energ�a de ionizaci�n 6850 kJ/mol
6.� energ�a de ionizaci�n 8140 kJ/mol
7.� energ�a de ionizaci�n 9570 kJ/mol
8.� energ�a de ionizaci�n 13120 kJ/mol
9.� energ�a de ionizaci�n 14500 kJ/mol
10.� energ�a de ionizaci�n 26740 kJ/mol
Propiedades f�sicas
Estado ordinario S�lido
Densidad 1532 kg/m3
Punto de fusi�n 312,46 Kelvin (39 �C)
Punto de ebullici�n 961 Kelvin (688 �C)
Entalp�a de vaporizaci�n 72,216 kJ/mol
Entalp�a de fusi�n 2,192 kJ/mol
Presi�n de vapor 1,56�10-4 Pa a 312,6 K
Varios
Estructura cristalina C�bica centrada en el cuerpo
N.� CAS 7440-17-7
N.� EINECS 231-126-6
Calor espec�fico 363 J/(K�kg)
Conductividad el�ctrica 7,79�106 S/m
Conductividad t�rmica 58,2 W/(K�m)
Velocidad del sonido 1300 m/s a 293,15 K (20 �C)
Is�topos m�s estables
Art�culo principal: Is�topos del rubidio
iso AN Periodo MD Ed PD
MeV
85Rb 72,168% Estable con 48 neutrones
87Rb 27,835% 4,88 � 1010 a �- 0,283 87Sr
Valores en el SI y condiciones normales de presi�n y temperatura, salvo que se
indique lo contrario.
[editar datos en Wikidata]
El rubidio es un elemento qu�mico de la tabla peri�dica cuyo s�mbolo es el Rb y su
n�mero at�mico es 37.
�ndice
1 Caracter�sticas principales
2 Aplicaciones
3 Historia
4 Abundancia y obtenci�n
5 Is�topos
6 Precauciones
7 Referencias
8 Enlaces externos
Caracter�sticas principales
El rubidio es un metal alcalino blando, de color plateado blanco brillante que
empa�a r�pidamente al aire, muy reactivo. Al igual que los dem�s elementos del
grupo 1 puede arder espont�neamente en aire con llama de color violeta amarillento,
reacciona violentamente con el agua desprendiendo hidr�geno y forma amalgama con
mercurio. Puede formar aleaciones con oro,los dem�s metales alcalinos, y
alcalinot�rreos, antimonio y bismuto.
Al igual que los dem�s metales alcalinos presenta un �nico estado de oxidaci�n (+1)
y reacciona con di�xido de carbono, hidr�geno, nitr�geno, azufre y hal�genos.
Su obtenci�n tiene el lugar 16 dentro de los metales m�s abundantes en la corteza
terrestre.
Aplicaciones
El rubidio se puede ionizar con facilidad por lo que se ha estudiado su uso en
motores i�nicos para naves espaciales, aunque el xen�n y el cesio han demostrado
una mayor eficacia para este prop�sito. Se utiliza principalmente en la fabricaci�n
de cristales especiales para sistemas de telecomunicaciones de fibra �ptica y
equipos de visi�n nocturna. Otros usos son:
Recubrimientos fotoemisores de telurio-rubidio en c�lulas fotoel�ctricas y
detectores electr�nicos.
Afinador de vac�o, getter, (sustancia que absorbe las �ltimas trazas de gas,
especialmente ox�geno) en tubos de vac�o para asegurar su correcto funcionamiento.
Componente de fotorresistencias (o LDR, Light dependant resistors, resistencias
dependientes de la luz), resistencias en las que la resistencia el�ctrica var�a con
la iluminaci�n recibida.
En medicina para la tomograf�a por emisi�n de positrones, el tratamiento de la
epilepsia y la separaci�n por ultracentrifugado de �cido nucleicos y virus.
Fluido de trabajo en turbinas de vapor.
El RbAg4I5 tiene la mayor conductividad el�ctrica conocida a temperatura ambiente
de todos los cristales i�nicos y podr�a usarse en la fabricaci�n de bater�as en
forma de delgadas l�minas entre otras aplicaciones el�ctricas.
Se estudia la posibilidad de emplear el metal en generadores termoel�ctricos
basados en la magnetohidrodin�mica de forma que los iones de rubidio generados a
alta temperatura sean conducidos a trav�s de un campo magn�tico generando una
corriente el�ctrica.
Sirve para conseguir el color p�rpura en los fuegos artificiales.
En muchas aplicaciones puede sustituirse por el cesio (o el compuesto de cesio
correspondiente) por su semejanza qu�mica.
Historia
El rubidio (del lat�n rubidus, rojo oscuro1?) fue descubierto en 1861 por Robert
Bunsen y Gustav Kirchhoff en la lepidolita utilizando un espectroscopio al detectar
las dos rayas rojas caracter�sticas del espectro de emisi�n de este elemento y que
son la raz�n de su nombre. Son pocas las aplicaciones industriales de este elemento
que en 1920 empez� a usarse en c�lulas fotoel�ctricas habi�ndose usado sobre todo
en actividades de investigaci�n y desarrollo, especialmente en aplicaciones
qu�micas y electr�nicas.
Abundancia y obtenci�n
A pesar de no ser un elemento muy abundante en la corteza terrestre ya que se
encuentra entre los 56 elementos que engloban conjuntamente un 0,05% del peso de la
misma, no puede considerarse escaso. Representando del orden de 78 ppm en peso, es
el 23.er elemento m�s abundante y el 16.� de los metales superando a otros metales
comunes como el cobre, el plomo y el zinc de los que se extraen miles de toneladas
anuales frente a las tres del rubidio. Es adem�s 30 veces m�s abundante que el
cesio y 4 que el litio metales de cuya obtenci�n se extrae como subproducto. La
raz�n de tal disparidad estriba en que no se conocen minerales en los que el
rubidio sea el elemento predominante y que su radio i�nico es muy similar al del
potasio (2000 veces m�s abundante) sustituy�ndole �en �nfimas cantidades� en sus
especies minerales donde aparece como impureza.
Se encuentra en diversos minerales como leucita, polucita y zinnwaldita. La
lepidolita contiene un 1,5% de rubidio (puede superar en ocasiones el 3,15%) y es
de donde se obtiene el metal en su mayor�a; tambi�n otros minerales de potasio y
cloruro de potasio contienen cantidades significativas de rubidio como para
permitir su extracci�n rentable, as� como los dep�sitos de polucita (que pueden
contener hasta un 1,35% de rubidio) entre los que destacan los del lago Bernic en
Manitoba, (Canad�).
El metal se obtiene, entre otros m�todos, reduciendo el cloruro de rubidio con
calcio en vac�o, o calentando su hidr�xido con magnesio en corriente de hidr�geno.
Peque�as cantidades pueden obtenerse calentando sus compuestos con cloro mezclados
con �xido de bario en vac�o. La pureza del metal comercializado var�a entre 99 y
99,8%.
Is�topos
Se conocen 24 is�topos de rubidio y existiendo en la naturaleza tan s�lo dos, el
Rb-85 y el radioactivo Rb-87. Las mezclas normales de rubidio son ligeramente
radiactivas.
El is�topo Rb-87, que tiene un periodo de semidesintegraci�n de 48,8 � 10 9 a�os,
se ha usado mucho para la dataci�n radiom�trica de rocas. El Rb-87 decae a Sr-87
estable emitiendo una part�cula beta negativa. Durante la cristalizaci�n
fraccionada, el estroncio tiende a concentrarse en la plagioclasa quedando el
rubidio en la fase l�quida, de modo que la raz�n Rb/Sr en el magma residual se
incrementa a lo largo del tiempo. Las mayores razones �de 10 � m�s� se hallan en
las pegmatitas. Si la cantidad inicial de estroncio es conocida o puede
extrapolarse, midiendo las concentraciones de Rb y Sr y el cociente Sr-87/Sr-86
puede determinarse la edad de la roca. Evidentemente la edad medida ser� la de la
roca si �sta no ha sufrido alteraciones despu�s de su formaci�n.
La frecuencia de resonancia del �tomo de Rb-87 se usa como referencia en normas y
osciladores utilizados en transmisores de radio y televisi�n, en la sincronizaci�n
de redes de telecomunicaci�n y en la navegaci�n y comunicaci�n v�a sat�lite. El
is�topo se emplea adem�s en la construcci�n de relojes at�micos.
El is�topo Rb-82 se utiliza en la obtenci�n de im�genes del coraz�n mediante
tomograf�a por emisi�n de positrones. Debido a su corto periodo de
semidesintegraci�n (1,273 minutos) se sintetiza, antes de su administraci�n, a
partir de estroncio-82 ya que en tan s�lo un d�a se desintegra pr�cticamente por
completo
Precauciones
El rubidio reacciona violentamente con el agua pudiendo provocar la inflamaci�n del
hidr�geno desprendido en la reacci�n:
2 Rb + 2 H2O ? 2 RbOH + H2
Para asegurar la pureza del metal y la seguridad en su manipulaci�n se almacena
bajo aceite mineral seco, en vac�o o en atm�sfera inerte.
Referencias
�WebElements Periodic Table � Rubidium � the essentials�. www.webelements.com.
Consultado el 5 de mayo de 2019.
Enciclopedia Libre
Los Alamos National Laboratory
US Geological Survey
Office of Nuclear Energy, Science and Technology
Enlaces externos
Wikimedia Commons alberga una categor�a multimedia sobre Rubidio.
WebElements.com - Rubidium
EnvironmentalChemistry.com - Rubidium
También podría gustarte
- RubidioDocumento3 páginasRubidiopmartinez1972 MartinezAún no hay calificaciones
- Rub IdioDocumento3 páginasRub Idiojose angel flores velezAún no hay calificaciones
- RubidioDocumento9 páginasRubidioChristopher López CarrilloAún no hay calificaciones
- METALES AGUA PICPDocumento22 páginasMETALES AGUA PICPsaphkielAún no hay calificaciones
- Rubidio: Propiedades, usos e isótopos del metal alcalinoDocumento6 páginasRubidio: Propiedades, usos e isótopos del metal alcalinoCristian BurgosAún no hay calificaciones
- AlcalinosDocumento10 páginasAlcalinosA Galvez RamosAún no hay calificaciones
- Laboratorio de Quimica Organica LL PRACTDocumento17 páginasLaboratorio de Quimica Organica LL PRACT34 Erick PorrasAún no hay calificaciones
- PUCV Facultad de Ingeniería Escuela de Ingeniería Química Laboratorio de Análisis Industrial RenioDocumento31 páginasPUCV Facultad de Ingeniería Escuela de Ingeniería Química Laboratorio de Análisis Industrial Renios_badiAún no hay calificaciones
- Rub IdioDocumento4 páginasRub IdioJorge FyhyhAún no hay calificaciones
- RubidioDocumento7 páginasRubidioUlises Sol HAún no hay calificaciones
- MercurioDocumento10 páginasMercuriojimenahdAún no hay calificaciones
- Técnicas de GeocronologíaDocumento24 páginasTécnicas de Geocronologíadj_blade_07Aún no hay calificaciones
- Estructura cúbica centrada en caras del oro (AuDocumento4 páginasEstructura cúbica centrada en caras del oro (AuMateo CardonaAún no hay calificaciones
- ARSENICIODocumento10 páginasARSENICIOMaria IsabelAún no hay calificaciones
- Elementos Utilizados en RadioterapiaDocumento9 páginasElementos Utilizados en RadioterapiaOskar RecinosAún no hay calificaciones
- Tierras RarasDocumento56 páginasTierras RarasarieldeboedoAún no hay calificaciones
- EstroncioDocumento11 páginasEstroncioJhojan FernandezAún no hay calificaciones
- Proyecto Tabla PeriodicaDocumento256 páginasProyecto Tabla PeriodicaPadilla MostAún no hay calificaciones
- MercurioDocumento8 páginasMercuriostevenAún no hay calificaciones
- Berilio y RadioDocumento14 páginasBerilio y RadioVanesa DominguezAún no hay calificaciones
- MercurioDocumento7 páginasMercuriogtrevi_oAún no hay calificaciones
- ZincDocumento26 páginasZincSorianys RodiguezAún no hay calificaciones
- ISOTOPOSDocumento13 páginasISOTOPOSDaniel AlejandroAún no hay calificaciones
- Síntesis de nitrobenceno a partir de bencenoDocumento13 páginasSíntesis de nitrobenceno a partir de bencenoMichelle BallesterosAún no hay calificaciones
- PraseodimioDocumento6 páginasPraseodimioestefanoAún no hay calificaciones
- Grupo11 12Documento82 páginasGrupo11 12Antonella SantaellaAún no hay calificaciones
- Tarea TooxicDocumento2 páginasTarea TooxicJose CastroAún no hay calificaciones
- El RubidioDocumento2 páginasEl Rubidiojulian1296Aún no hay calificaciones
- Descubrimiento del rubidioDocumento3 páginasDescubrimiento del rubidioLaura Alonso PerezAún no hay calificaciones
- NiobioDocumento6 páginasNiobioVictorAún no hay calificaciones
- Cuestionario LaboratorioDocumento7 páginasCuestionario LaboratorioMary Angeles RemacheAún no hay calificaciones
- El RuDocumento12 páginasEl RusantosdiazAún no hay calificaciones
- 5 - Carac QF - 10Documento72 páginas5 - Carac QF - 10Sergio Parra MartiAún no hay calificaciones
- Sustancias RadioactivasDocumento10 páginasSustancias RadioactivasOmarx PerezAún no hay calificaciones
- Elementos de La Tabla PeriodicaDocumento29 páginasElementos de La Tabla Periodica•Carolina - Ortiz•Aún no hay calificaciones
- Gamma RayDocumento69 páginasGamma RayalejandrobarbosahAún no hay calificaciones
- El FrancioDocumento9 páginasEl FrancioOchoa Rojas EliseoAún no hay calificaciones
- Métodos radiométricos para datación de rocasDocumento11 páginasMétodos radiométricos para datación de rocaswualdo20Aún no hay calificaciones
- Diapositivas RubidioDocumento9 páginasDiapositivas RubidioEfrain Trujillo ChambiAún no hay calificaciones
- Propiedades y usos del elemento rubidioDocumento7 páginasPropiedades y usos del elemento rubidioEfrain Trujillo ChambiAún no hay calificaciones
- KriptonDocumento3 páginasKriptonJän Çärlös MörälësAún no hay calificaciones
- Recuperacion de Plata en Residuos de Fotografia.Documento10 páginasRecuperacion de Plata en Residuos de Fotografia.Mauricio AnneseAún no hay calificaciones
- 16 y 17Documento65 páginas16 y 17جابریل جابریلAún no hay calificaciones
- TP N 5 Calcinado NaranjaDocumento7 páginasTP N 5 Calcinado NaranjaC21$70Aún no hay calificaciones
- Anfigenos - Rojas Landeon IrmaDocumento28 páginasAnfigenos - Rojas Landeon Irmairma rojas landeonAún no hay calificaciones
- Aplicaciones y Posibles Peligros Del CobaltoDocumento6 páginasAplicaciones y Posibles Peligros Del CobaltoDianytha Rivera67% (3)
- Tarea 1Documento15 páginasTarea 1Oskar RecinosAún no hay calificaciones
- cataLOGO DE LS ELEMENTOSDocumento70 páginascataLOGO DE LS ELEMENTOSAdan Vicente HernándezAún no hay calificaciones
- Metales AlcalinosDocumento7 páginasMetales AlcalinosLuis Leonardo Carreño Torres100% (1)
- LAURENCIODocumento9 páginasLAURENCIOjohn ThompsonAún no hay calificaciones
- El Carbono Es Un Elemento Químico de Número Atómico 6 y Símbolo CDocumento4 páginasEl Carbono Es Un Elemento Químico de Número Atómico 6 y Símbolo CDMichelle FragosoAún no hay calificaciones
- Practica #01 - Analisis Del Primer Grupo de Cationes.Documento10 páginasPractica #01 - Analisis Del Primer Grupo de Cationes.Kido JazzAún no hay calificaciones
- Procesos de Tratamiento para Residuos de Pilas Que Contienen MercurioDocumento17 páginasProcesos de Tratamiento para Residuos de Pilas Que Contienen MercurioArnaldo AgurtoAún no hay calificaciones
- CESIODocumento7 páginasCESIOCarlos Alexander Valdez MegoAún no hay calificaciones
- DisprosioDocumento14 páginasDisprosioJesús JaazielAún no hay calificaciones
- 1 Ensayo La Flama y Perlas de BoraxDocumento9 páginas1 Ensayo La Flama y Perlas de BoraxEduardo Zamarron MuñozAún no hay calificaciones
- Determinación de Plomo y Cadmio en Tinta de Impresora por Voltamperometría de Redisolución AnódicaDocumento13 páginasDeterminación de Plomo y Cadmio en Tinta de Impresora por Voltamperometría de Redisolución AnódicaReyes ElmerAún no hay calificaciones
- Determinación Voltamperométrica Desprendimiento de Mercurio (II) Basado en Electrodo de OroDocumento15 páginasDeterminación Voltamperométrica Desprendimiento de Mercurio (II) Basado en Electrodo de OroRoberto MoralesAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Francisco Bolognesi, héroe de la defensa de AricaDocumento10 páginasFrancisco Bolognesi, héroe de la defensa de Aricajesus lopezAún no hay calificaciones
- Tesis Fiorella Martinez Gil4 PDFDocumento77 páginasTesis Fiorella Martinez Gil4 PDFEmìlìà TàfùrAún no hay calificaciones
- Examen DopDocumento5 páginasExamen Dopjesus lopezAún no hay calificaciones
- Diseño de un Plan de Seguridad y Salud en el Trabajo para AUTODISADocumento100 páginasDiseño de un Plan de Seguridad y Salud en el Trabajo para AUTODISASolanther23Aún no hay calificaciones
- Pedro PauletDocumento4 páginasPedro Pauletjesus lopezAún no hay calificaciones
- Autos ElectricosDocumento6 páginasAutos ElectricosdiegoAún no hay calificaciones
- Raúl Porras Barrenechea: Historiador, diplomático y político peruanoDocumento4 páginasRaúl Porras Barrenechea: Historiador, diplomático y político peruanojesus lopezAún no hay calificaciones
- Francisco Bolognesi, héroe de la defensa de AricaDocumento10 páginasFrancisco Bolognesi, héroe de la defensa de Aricajesus lopezAún no hay calificaciones
- San FernandoDocumento92 páginasSan Fernandojesus lopezAún no hay calificaciones
- San FernandoDocumento92 páginasSan Fernandojesus lopezAún no hay calificaciones
- Sesión 1 CALIDADDocumento25 páginasSesión 1 CALIDADJuan Luis Porras SalcedoAún no hay calificaciones
- METEOROLOGIADocumento7 páginasMETEOROLOGIAjesus lopezAún no hay calificaciones
- Caracterización Del ProcesoDocumento8 páginasCaracterización Del ProcesoMonicaAún no hay calificaciones
- Diagrama de Bloque Shampoo SabilaDocumento2 páginasDiagrama de Bloque Shampoo Sabilajesus lopez100% (1)
- Mama OclloDocumento2 páginasMama Ocllojesus lopezAún no hay calificaciones
- MINICARGADORADocumento1 páginaMINICARGADORAjesus lopezAún no hay calificaciones
- Diagrama de Bloque Shampoo SabilaDocumento2 páginasDiagrama de Bloque Shampoo Sabilajesus lopez100% (2)
- Sesión 3Documento23 páginasSesión 3jesus lopezAún no hay calificaciones
- Trabajo ShampooDocumento30 páginasTrabajo Shampoojesus lopezAún no hay calificaciones
- Lois JeansDocumento1 páginaLois Jeansjesus lopezAún no hay calificaciones
- Huayna CapacDocumento9 páginasHuayna Capacjesus lopez100% (1)
- PREVENCION2Documento117 páginasPREVENCION2jesus lopezAún no hay calificaciones
- LACOSTEDocumento2 páginasLACOSTEjesus lopezAún no hay calificaciones
- Avance de MetodologíaDocumento9 páginasAvance de Metodologíajesus lopezAún no hay calificaciones
- Dirección Estratégica de Operaciones Unidad 2: Introducción a la Dirección de OperacionesDocumento3 páginasDirección Estratégica de Operaciones Unidad 2: Introducción a la Dirección de Operacionesjesus lopezAún no hay calificaciones
- BarometroDocumento3 páginasBarometrojesus lopezAún no hay calificaciones
- Dirección Estratégica de Operaciones Unidad 2: Introducción a la Dirección de OperacionesDocumento3 páginasDirección Estratégica de Operaciones Unidad 2: Introducción a la Dirección de Operacionesjesus lopezAún no hay calificaciones
- Sesión 1 CALIDADDocumento25 páginasSesión 1 CALIDADJuan Luis Porras SalcedoAún no hay calificaciones
- BiometriaDocumento7 páginasBiometriajesus lopezAún no hay calificaciones
- Caso Ford y FirestoneDocumento11 páginasCaso Ford y Firestonejesus lopezAún no hay calificaciones
- Empresa Estuquera Cayara Exportó Cal Viva A Perú PDFDocumento1 páginaEmpresa Estuquera Cayara Exportó Cal Viva A Perú PDFWilly Diego Del CastilloAún no hay calificaciones
- Formulaciones de Productos Del HogarDocumento5 páginasFormulaciones de Productos Del HogarMaribel Hernández GaraboteAún no hay calificaciones
- 2035Documento13 páginas2035karishakyAún no hay calificaciones
- Estequiometria de Reacciones de NeutralizacionDocumento11 páginasEstequiometria de Reacciones de NeutralizacionhugoahvaguilaAún no hay calificaciones
- PDJ para Grifos y EessDocumento19 páginasPDJ para Grifos y EessRosario Ramos MedinaAún no hay calificaciones
- AceitesDocumento27 páginasAceiteseddie2166Aún no hay calificaciones
- Geologia Genesis de Las Rocas enDocumento111 páginasGeologia Genesis de Las Rocas enRicardo Noé Ágreda PalominoAún no hay calificaciones
- Determinación de La Potencia Util de AgitaciónDocumento6 páginasDeterminación de La Potencia Util de AgitaciónFernando Arauz Justiniano0% (1)
- Propiedades-glicoles-deshidratación-gas-naturalDocumento4 páginasPropiedades-glicoles-deshidratación-gas-naturalL.S./16// one/nell/Aún no hay calificaciones
- La Tyndallization Es Un Proceso Que Data Del Siglo XIX para Esterilizar SustanciasDocumento5 páginasLa Tyndallization Es Un Proceso Que Data Del Siglo XIX para Esterilizar SustanciasYEIFRI RODRIGUEZ BTC100% (1)
- Calculo de Soldadura Por Metro LinealDocumento59 páginasCalculo de Soldadura Por Metro LinealWingston Guanta70% (10)
- Sistemas de Enfriado de CervezaDocumento6 páginasSistemas de Enfriado de CervezaNicolás Ezequiel Würtz0% (1)
- Semana 14 - PRÁCTICA - Extracción Del ADNDocumento18 páginasSemana 14 - PRÁCTICA - Extracción Del ADNrodrigo blanco barrantesAún no hay calificaciones
- Gunbarrel tanques: principios y diseño de separación de agua y aceiteDocumento9 páginasGunbarrel tanques: principios y diseño de separación de agua y aceiteJuniior GarzonAún no hay calificaciones
- Taller de Productividad de Pozos Capítulo SPEDocumento250 páginasTaller de Productividad de Pozos Capítulo SPEHosanna GuevaraAún no hay calificaciones
- Reconocimiento de Reactivos Solidos y Liquidos 1Documento6 páginasReconocimiento de Reactivos Solidos y Liquidos 1juan carlosAún no hay calificaciones
- Comparativo de taninos y cromoDocumento3 páginasComparativo de taninos y cromoCarlos Correa FloreAún no hay calificaciones
- PresostatosDocumento31 páginasPresostatosMiguel Angel Requejo DiazAún no hay calificaciones
- 8-Tabla Calores de Formación y CombustiónDocumento3 páginas8-Tabla Calores de Formación y CombustiónThalia Ramirez LopezAún no hay calificaciones
- Taller GlúcidosDocumento2 páginasTaller GlúcidosJuan Diego Arismendy RamirezAún no hay calificaciones
- Farmacologia CuadrosDocumento3 páginasFarmacologia CuadrosJenyfer Laurel Velasquez100% (3)
- Quà Mica General y Estequiometrã ADocumento4 páginasQuà Mica General y Estequiometrã ACarla Pascual EsclapezAún no hay calificaciones
- M - 001 Manual de Calidad e Inocuidad de COFRUTARIDocumento15 páginasM - 001 Manual de Calidad e Inocuidad de COFRUTARIJaime René Flores LeytónAún no hay calificaciones
- Bombeo Cavidades ProgresivasDocumento41 páginasBombeo Cavidades ProgresivasWilliam Alexander OrtizAún no hay calificaciones
- Grifo Rural Nuevo ChirimotoDocumento19 páginasGrifo Rural Nuevo ChirimotojdiaztuestajaAún no hay calificaciones
- Teoría de La Doble CapaDocumento1 páginaTeoría de La Doble CapaGatiika MorilloAún no hay calificaciones
- Especificaciones Tecnicas Obra CivilDocumento178 páginasEspecificaciones Tecnicas Obra CivilraulicoAún no hay calificaciones
- Tesis IDocumento5 páginasTesis IjameshardeyAún no hay calificaciones
- Trabajo Independiente - I Corte MatemáticasDocumento17 páginasTrabajo Independiente - I Corte MatemáticasZARA CASTAÑO BUITRAGOAún no hay calificaciones