Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reporte 082
Cargado por
Gab OCTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Reporte 082
Cargado por
Gab OCCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
FACULTAD DE QUÍMICA.
LABORATORIO DE QUÍMICA GENERAL II 1211.
REPORTE PRÁCTICA:” INFLUENCIA DE LA TEMPERATURA EN EL
EQUILIBRIO QUÍMICO”.
PROFESOR: MARCO ANTONIO TAFOYA RODRIGUEZ.
GRUPO: 11.
HORARIO: MIÉRCOLES 9:00-13:00.
LABORATORIO: C-6.
ALUMNA: ORTEGA CARABANTES GABRIELA ITZEL
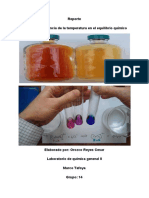
RESULTADOS Y EVIDENCIA EXPERIMENTAL
En la primer parte de la
práctica, al obtener el gas, se
aisló en dos tubos de
ensaye.
Marcados con los números 1 y
2. El tubo uno, se calentó en
baño María, mientras que el
tubo dos, se colocó en un
baño de hielo. En un análisis
a simple vista, se aprecia la
concentración de coloración
(café-rojiza) en el tubo que
se calentó, mientras que, en
el
tubo que se colocó en el Ilustración 1. Almacenamiento del
dióxido
baño de hielo, se aprecia una
tenue
disminución de la
concentración del color.
Ilustración 2. Enfriamiento
En la segunda parte de la práctica, se llevó a cabo la reacción:
(Co(H2O)6)2+ (ac) + 4 Cl- (exceso) (CoCl4)2- (ac) + 6 H2O (l)
El procedimiento experimental fue similar al de la primera parte, teniendo tres tubos,
dos de prueba y uno testigo, se sometió a un cambio de temperatura. Obteniendo que
la coloración de la muestra era lila, mientras que al aumentar la temperatura en el baño
María, la coloración se tornó azul, y rosa, al disminuir la misma.
Ilustración de. Muestras iniciales
Ilustración de. Muestra sometida a calentamiento
Ilustración 5. Comparación de las tres muestras
CUESTIONARIO
Primera parte
Tabla 1. Interconversión 2NO2 N2O4
Al calentar el tubo 1 en baño María.
Aumentó la concentración de la coloración inicial del gas, es decir, se tornó más
intensa la coloración café-rojiza.
Al enfriar el tubo 2 en baño de hielo.
Disminuye la concentración de la coloración inicial, obteniendo un gas, de
coloración café-rojizo muy tenue. (Teóricamente, debería tornarse incoloro)
Al comparar los tubos 1 y 2 con el tubo testigo.
El tubo 1, tiene una coloración café-rojiza muy intensa y concentrada, a
comparación del tubo 2, que tiene una coloración más tenue.
Cuando los tres tubos tienen la misma temperatura.
La coloración café-rojiza, es prácticamente igual en las tres muestras, con una
concentración de coloración muy parecida.
Al enfriar el tubo 1 en baño de hielo y calentar el tubo 2 en baño María.
En el tubo 1, ahora la coloración se torna muy tenue, mientras que, en el tubo 2, la
coloración ser torna más intensa.
1. Tomando en cuenta que la formación de dimerización del NO2 para
formar N2O4 implica únicamente la formación de un enlace, balancea la
siguiente ecuación química e indica con una X si esta reacción
corresponde a una reacción endotérmica o exotérmica. Incluye al calor
(Q) en el lugar correcto, de acuerdo con tu clasificación, (del lado de los
productos o de los reactivos):
2 NO2 N2O4 + Q
Exotérmica
2. Escribir la ecuación química de disociación del N2O4 incluyendo al calor
(Q) en el lugar correcto de la ecuación (reactivos o productos).
N2O4 + Q 2 NO2
¿Se trata de una reacción endotérmica o exotérmica?
Endotérmica
¿Por qué puede saberse esto con seguridad?
Porque podemos establecer que, para la para el rompimiento de un enlace
químico, en este caso, de un compuesto, se necesita de energía para llevarlo a
cabo. De esta forma, la reacción es endotérmica, e inversa, al proceso de la
reacción original. Es por esto, que al aumentar la temperatura del tubo incoloro
(con N2O4), se obtiene una coloración café-rojiza de nuevo.
3. Completar los siguientes enunciados:
Si el sistema en equilibrio A + B + Q ⇆ C es endotérmico, un aumento en la
temperatura provocará que en el sistema se incremente la concentración de:
Los productos, ya que el equilibrio se desplaza favoreciendo al aumento de su
concentración.
Cuando se aumenta la temperatura en el siguiente sistema en equilibrio: D + E
⇆ F + G, se observa un incremento en las cantidades de D y E, se puede
asegurar que la reacción es (endotérmica o exotérmica):
Exotérmica
Segunda parte
Anota lo que sucede Temperatura Color final de la
cuando: (Aumenta o disolución (Azul
disminuye) o rosa)
El tubo 1 lo colocas en
Aument Azul (ión cloruro)
baño María.
a
El tubo 2 lo colocas en baño
Disminu Rosa (ión cobalto
de hielo.
ye hexahidratado)
El tubo 1 en baño El tubo 2 en baño de Tubo testigo
María La disolución se hielo La disolución se Permanece en una
torna de coloración azul, torna de una coloración rosa
medianamente intensa. coloración rosa, tenue. intenso.
Cuando los tres tubos alcanzan la misma
temperatura
El color es igual para los 3 tubos, es decir, se
mantienen en color rosa.
El tubo 1 en baño de El tubo 2 en baño Tubo testigo
hielo La disolución se María La disolución se Permanece en una
torna de una torna de coloración azul, coloración rosa
coloración rosa, tenue. medianamente intensa. intenso.
CUESTIONARIO
1. Indicar el color de las disoluciones acuosas de cloruro de cobalto (II)
hexahidratado con ácido clorhídrico a temperatura ambiente, a
temperatura inferior a la ambiente (baño de hielo) y a temperatura
superior a la ambiente (baño María):
A temperatura ambiente: Rosa
intenso.
A baja temperatura: Rosa tenue.
A alta temperatura (baño María): Azul medianamente intenso.
2. Escribir la ecuación química para la disociación del HCl en agua:
HCl (ac) + H2O H3O + + Cl -
3. Con respecto a la pregunta 2, ¿Se encuentra presente algún ion
que produzca color a la disolución?
El ión cloruro presenta la coloración a la disolución.
4. Escribir la ecuación química para la disociación del [Co(H 2O)6]Cl2 en
agua:
[Co(H2O)6]Cl2 (ac) [Co(H2O)6]2+ (ac) + 2 Cl – (ac)
5. De la pregunta 4, ¿Qué especie es la que provoca color en la disolución?
El ión de cobalto II hexahidratado (Co(H 2O)62+)
6. Cuando se hace reaccionar a temperatura ambiente a una disolución de
[Co(H2O)6]Cl2 con una disolución concentrada de HCl, se establece un
equilibrio entre los iones complejos Co(H2O)62+ y [CoCl42-] ¿Qué color
tiene esta disolución? Lila
7. De acuerdo con el siguiente equilibrio químico, que se estableció
previamente en la introducción:
(Co(H2O)6)2+ (ac) + 4 Cl- (exceso) (CoCl4)2- (ac) + 6 H2O (l) se puede
decir que en los tubos 1, 2 y 3 se encuentran presentes tanto la especie
[Co(H2O)6]2+ como la especie [CoCl4]2-, ¿A qué temperatura predomina
cada uno de estos iones complejos?
[Co(H2O)6]2+ : Temperatura baja
[CoCl4]2- : Temperatura alta
8. Completar los siguientes enunciados:
Al suministrar calor al equilibrio químico entre las especies de cobalto(II) se
incrementa la cantidad de CoCl42- (Co(H2O)62+, CoCl42-), por lo que podemos
decir que la reacción en ese sentido es endotérmica (exotérmica,
endotérmica).
9. Analizando la formación o ruptura de enlaces, las siguientes dos
ecuaciones químicas (hipotéticas) ¿serían endotérmicas o exotérmicas?
[Co(H2O)6]2+ + Q Co2+ + 6 H2O Endotérmica
[CoCl4]2- + Q Co2+ + 4 Cl- Endotérmica
Ya que se debe administrar energía a la reacción para que se rompa el
enlace del compuesto y se obtenga la disociación de los productos.
10. Si se denomina X1 a la reacción de formación del ión [CoCl 4]2- a partir de
la especie Co2+ y iones Cl- y X2 a la reacción de formación del ión
[Co(H2O)6]2+, a partir de la especie Co2+ y moléculas de H2O, escribe las
ecuaciones químicas balanceadas para X 1 y X2 y determina si requiere
calentarse o enfriarse para ser más cuantitativa (para que se forme una
mayor cantidad de producto).
X1: Co2+ + 4 Cl- [CoCl4]2- + Q Exotérmica, y para que sea más cuantitativa
debe enfriarse
X2: Co2+ + 6 H2O [Co(H2O)6]2+ + Q Exotérmica. Y para que sea más
cuantitativa debe enfriarse.
PREGUNTAS FINALES
1. ¿Qué sucede con las concentraciones de los productos cuando en una
reacción química exotérmica se incrementa la temperatura?
El equilibrio de la reacción se favorece hacia los reactivos, por lo que
aumenta la concentración de los mismos.
2. ¿Qué sucede con las concentraciones de los reactivos cuando en una
reacción química endotérmica se incrementa la temperatura?
El equilibrio de la reacción se favorece hacia los productos, por lo que
aumenta la concentración de los mismos.
ANÁLISIS DE RESULTADOS Y CONCLUSIONES
Como se había analizado en la práctica anterior, el cociente de reacción (Q) de
una reacción reversible, puede verse influido por diversos factores, como la
presión, el volumen, la cantidad estequiometria de reactivos o productos, pero,
solamente la temperatura puede influir en la constante de equilibrio (Ke) de una
reacción reversible.
Para determinar la influencia de la temperatura en la constante de equilibrio de
una reacción reversible, se debe relacionar directamente con la entalpia de la
reacción (ΔH°). Debido a la combinación de átomos para la formación de un
enlace químico, la reacción libera energía, de esta forma, se determina que la
reacción es exotérmica, y su entalpia de reacción es negativa, pues el sistema
cede la energía. Sucede lo contrario con el rompimiento de un enlace químico,
que necesita de una gran suministración de energía para la obtener la
disociación del compuesto, esta reacción es endotérmica, y su entalpia de
reacción es positiva, puesto que el sistema necesita energía para que se logre
la ruptura del enlace.
En el caso de la primera reacción (2NO2 N2O4), se observó que, cuando se
suministraba energía al sistema, aumentaba la concentración del dióxido de
nitrógeno, que se podía reconocer por su coloración intensa (café-rojiza).
Pero, al disminuir la temperatura del sistema, se observó que la coloración
disminuyó notoriamente, sabiendo que gas tetraóxido de dinitrógeno es
incoloro, se puede afirmar que la concentración de este mismo, aumentó. Por
lo que, al analizar la reacción, podemos determinar que esta es una reacción
exótermica. Puesto que, al aumentar la temperatura, se favorece al incremento
de la concentración del reactivo (dióxido de nitrógeno), y al disminuirla, se
favorece al aumento de la concentración del producto (tetraóxido de
dinitrógeno). Mientras que cuando el sistema se encontraba a temperatura
ambiente, la coloración se tornó de una intensidad media.
En el caso de la segunda reacción ((Co(H2O)6)2+ (ac) + 4 Cl- (exceso)
(CoCl4)2- (ac) + 6 H2O (l)), se observó que cuando la reacción se encontraba a
temperatura ambiente, la coloración era lila intenso. Al aumentar la
temperatura, la coloración se tornó azul intenso, mientras que, al disminuirla, la
coloración se tornaba rosa. Sabiendo que la especie favorecida en la
coloración azul era el (CoCl4)2-, y que la especie favorecida en la coloración
rosa, era ((Co(H2O)6)2+, podemos determinar que la reacción es endotérmica,
puesto que al aumentar la temperatura, la concentración de los productos se ve
favorecida, mientras que al disminuirla, la concentración de los reactivos, se ve
favorecida.
Así, se concluye que, al aumentar la temperatura, en una reacción endotérmica
reversible, la concentración de los reactivos se ve favorecida, y la constante de
equilibrio es mucho más cuantitativa. Al aumentar la temperatura en una
reacción exotérmica, la concentración de los productos se ve favorecida, y la
constante de equilibrio, es menos cuantitativa
BIBLIOGRAFÍA
No aplica.
También podría gustarte
- Practica 8Documento4 páginasPractica 8ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Informe 8Documento5 páginasInforme 8Ale GaskarthAún no hay calificaciones
- Práctica 08 REPORTE.Documento7 páginasPráctica 08 REPORTE.Wendy JoselineAún no hay calificaciones
- Practica 8 PDFDocumento7 páginasPractica 8 PDFCesar OrozcoAún no hay calificaciones
- Practica 8Documento7 páginasPractica 8Eduardo TrejoAún no hay calificaciones
- Reporte Practica 8Documento6 páginasReporte Practica 8ANDREA MARTINEZ BECERRILAún no hay calificaciones
- Reporte - Práctica 8Documento6 páginasReporte - Práctica 8jimenaAún no hay calificaciones
- Práctica 08. Influencia de La Temperatura en El Equilibrio Quã - MicoDocumento7 páginasPráctica 08. Influencia de La Temperatura en El Equilibrio Quã - MicoiarjcrashAún no hay calificaciones
- Práctica 8.SDocumento7 páginasPráctica 8.SDaniel MeloAún no hay calificaciones
- Practica 8Documento4 páginasPractica 8Fernando PilónAún no hay calificaciones
- Previo Practica 8Documento7 páginasPrevio Practica 8victoriaAún no hay calificaciones
- Previo Practica 8Documento7 páginasPrevio Practica 8Claudia Fdez75% (4)
- Influencia de La Temp en El EquilibrioDocumento3 páginasInfluencia de La Temp en El EquilibrioMiguel CoriolanoAún no hay calificaciones
- Practica 6 ReportDocumento3 páginasPractica 6 ReportMayra Janette Jane SkłodowskaAún no hay calificaciones
- Práctica 8 QG2Documento4 páginasPráctica 8 QG2Dianne VanAún no hay calificaciones
- Practica 8 Quimica General IIDocumento11 páginasPractica 8 Quimica General IIusuarin9575% (4)
- QGII Equilibrio QuímicoDocumento6 páginasQGII Equilibrio QuímicoJose SaltosAún no hay calificaciones
- Influencia de La Temperatura en El Equilibrio Químico: Experimento 1 ProblemaDocumento4 páginasInfluencia de La Temperatura en El Equilibrio Químico: Experimento 1 Problemaelias2222Aún no hay calificaciones
- INFOQI7Documento3 páginasINFOQI7Roxana MendozaAún no hay calificaciones
- Repor Práctica 8 Influencia de La TemDocumento3 páginasRepor Práctica 8 Influencia de La TemAlexia LunaAún no hay calificaciones
- Reporte 8 Influencia de La Tem.Documento3 páginasReporte 8 Influencia de La Tem.Andres ImmorminoAún no hay calificaciones
- Informe General 2 Practica 8Documento5 páginasInforme General 2 Practica 8Luis Piruca MorenoAún no hay calificaciones
- QGII Equilibrio QuímicoDocumento4 páginasQGII Equilibrio QuímicoGreys ChuquimarcaAún no hay calificaciones
- IDENTIFICACIÓN DE BIOMOLÉCULAS TerminadaDocumento3 páginasIDENTIFICACIÓN DE BIOMOLÉCULAS Terminadaambar bonifacioAún no hay calificaciones
- Identificación de BiomoléculasDocumento5 páginasIdentificación de BiomoléculasLia SolerAún no hay calificaciones
- Identificación de BiomoléculasDocumento5 páginasIdentificación de BiomoléculasLia SolerAún no hay calificaciones
- 2023-4-12 - Colegio Universitario Central - TAP 2 - TAM. UNIDAD I. QCADocumento5 páginas2023-4-12 - Colegio Universitario Central - TAP 2 - TAM. UNIDAD I. QCAsilvina dominguezAún no hay calificaciones
- Laboratorio Cinetica QuimicaDocumento10 páginasLaboratorio Cinetica QuimicaDani CVAún no hay calificaciones
- Equilibrio Químico InformeDocumento5 páginasEquilibrio Químico InformeIsa BerronesAún no hay calificaciones
- Informe Equilibrio QuimicoDocumento5 páginasInforme Equilibrio QuimicoYuleisy EscobarAún no hay calificaciones
- Practiva de Laboratorio N°7Documento11 páginasPractiva de Laboratorio N°7Jeffry RodriguezAún no hay calificaciones
- Práctica 08 PREVIO PDFDocumento10 páginasPráctica 08 PREVIO PDFWendy JoselineAún no hay calificaciones
- P6 - Influencia de La TemperaturaDocumento5 páginasP6 - Influencia de La Temperaturamynilut78Aún no hay calificaciones
- Equilibrio Quimico y Principio de Le Chatelier 1Documento5 páginasEquilibrio Quimico y Principio de Le Chatelier 1Pedro Alejandro Moncada VelandiaAún no hay calificaciones
- Identificación de Biomoléculas 2Documento3 páginasIdentificación de Biomoléculas 2rachell mozeAún no hay calificaciones
- Practica 7-8 GIIDocumento12 páginasPractica 7-8 GIIJuárez Garduño Edgar JosuéAún no hay calificaciones
- Informe 13 EquilibrioDocumento3 páginasInforme 13 EquilibrioAlejandraSequeiraAún no hay calificaciones
- Talleres de Recuperacion II Per NSR EstequiometriaDocumento3 páginasTalleres de Recuperacion II Per NSR EstequiometriaJmnz DanjoAún no hay calificaciones
- Talleres de Recuperacion II Per NSR EstequiometriaDocumento3 páginasTalleres de Recuperacion II Per NSR EstequiometriaJmnz DanjoAún no hay calificaciones
- Talleres de Recuperacion II Per NSR EstequiometriaDocumento3 páginasTalleres de Recuperacion II Per NSR EstequiometriaAna Sofia Alzate GómezAún no hay calificaciones
- Fisicoquimica I Practica 8 Equilibrio Químico Efecto Del Cambio de TemperaturaDocumento5 páginasFisicoquimica I Practica 8 Equilibrio Químico Efecto Del Cambio de Temperaturaivan calderonAún no hay calificaciones
- Balance de Ecuaciones RedoxDocumento7 páginasBalance de Ecuaciones RedoxnanodelgadoAún no hay calificaciones
- Informe de Quimica #1Documento9 páginasInforme de Quimica #1guinima0% (1)
- Taller 11º 02 (Quimico)Documento3 páginasTaller 11º 02 (Quimico)jamir pastranaAún no hay calificaciones
- Práctica 6 - Relaciones de Masa en Los Procesos QuímicosDocumento4 páginasPráctica 6 - Relaciones de Masa en Los Procesos QuímicosJoseMorilloAún no hay calificaciones
- Informe 04Documento11 páginasInforme 04VALERIA MICHELLE PERDOMO ESPINOZAAún no hay calificaciones
- Laboratorio EquilibrioDocumento9 páginasLaboratorio EquilibrioLuis Angel Trujillo MendozaAún no hay calificaciones
- Informe Práctica #8 Lab QG LLDocumento4 páginasInforme Práctica #8 Lab QG LLAzul HernándezAún no hay calificaciones
- Lab. Equilibrio Químico..Documento8 páginasLab. Equilibrio Químico..Shadia Peña RojasAún no hay calificaciones
- Informe P1 EquilibrioDocumento9 páginasInforme P1 EquilibrioJORGE LEONARDO FRASSER QUIÑONESAún no hay calificaciones
- Informe de Reacciones QuimicasDocumento5 páginasInforme de Reacciones QuimicasJeimy CubaAún no hay calificaciones
- Explicación de La Práctica 8, Influencia de La Temp en El EQ - 2022-2Documento5 páginasExplicación de La Práctica 8, Influencia de La Temp en El EQ - 2022-2Luis Mario 607 Vasquez RomeroAún no hay calificaciones
- T.P. Laboratorio N°3Documento6 páginasT.P. Laboratorio N°3Agustin PallardóAún no hay calificaciones
- Guía LaboratorioDocumento2 páginasGuía LaboratorioveraAún no hay calificaciones
- Prac 7 TermoquímicaDocumento8 páginasPrac 7 TermoquímicaPam Diana100% (1)
- Equilibrio QuímicoDocumento2 páginasEquilibrio QuímicoHaydee LiraAún no hay calificaciones
- Valores Del PHDocumento4 páginasValores Del PHJULIO FERNANDO DIAZ MAMANIAún no hay calificaciones
- Previo Parctica 8Documento11 páginasPrevio Parctica 8Alfre Contreras RamírezAún no hay calificaciones
- CICLO ESTRAL Y MENSTRUAL - FisioDocumento4 páginasCICLO ESTRAL Y MENSTRUAL - FisioGab OCAún no hay calificaciones
- Reporte 12 QgiiDocumento5 páginasReporte 12 QgiiGab OCAún no hay calificaciones
- Fuerzas Intermoleculares y SolubilidadDocumento6 páginasFuerzas Intermoleculares y SolubilidadJazmin Mosqueda90% (10)
- Portada de PsicologíaDocumento6 páginasPortada de PsicologíaGab OCAún no hay calificaciones
- Serie 4 PDFDocumento4 páginasSerie 4 PDFGab OCAún no hay calificaciones
- Practica 1 QGIIDocumento10 páginasPractica 1 QGIIGab OC0% (1)
- Función RespiratoriaDocumento11 páginasFunción RespiratoriaGab OCAún no hay calificaciones
- Reporte 13 QgiiDocumento7 páginasReporte 13 QgiiGab OCAún no hay calificaciones
- Experiencia Al ClienteDocumento4 páginasExperiencia Al ClienteGab OCAún no hay calificaciones
- Experiencia Al ClienteDocumento4 páginasExperiencia Al ClienteGab OCAún no hay calificaciones
- Reporte 14 QgiiDocumento5 páginasReporte 14 QgiiGab OCAún no hay calificaciones
- COMDocumento5 páginasCOMGab OCAún no hay calificaciones
- Reflejo Plantar... - 1291312103Documento4 páginasReflejo Plantar... - 1291312103Gab OCAún no hay calificaciones
- CICLO ESTRAL Y MENSTRUAL - FisioDocumento4 páginasCICLO ESTRAL Y MENSTRUAL - FisioGab OCAún no hay calificaciones
- Práctica Fisiologia. Reflejos en El HumanoDocumento2 páginasPráctica Fisiologia. Reflejos en El HumanoGab OCAún no hay calificaciones
- Vías de AdministraciónDocumento3 páginasVías de AdministraciónGab OCAún no hay calificaciones
- R. 6 GiiDocumento6 páginasR. 6 GiiGab OCAún no hay calificaciones
- Basicidad de Los OxoanionesDocumento5 páginasBasicidad de Los OxoanionesGab OCAún no hay calificaciones
- Reflejo Palatino INFORMEDocumento4 páginasReflejo Palatino INFORMEGab OCAún no hay calificaciones
- Función RespiratoriaDocumento11 páginasFunción RespiratoriaGab OCAún no hay calificaciones
- Vías de AdministraciónDocumento3 páginasVías de AdministraciónGab OCAún no hay calificaciones
- P.1 InorgánicaDocumento7 páginasP.1 InorgánicaGab OCAún no hay calificaciones
- Práctica 7 QgiiDocumento8 páginasPráctica 7 QgiiGab OCAún no hay calificaciones
- Previo 5 QgiiDocumento11 páginasPrevio 5 QgiiGab OCAún no hay calificaciones
- Ácido Acético GlacialDocumento2 páginasÁcido Acético GlacialGab OCAún no hay calificaciones
- Practica 1 QGIIDocumento10 páginasPractica 1 QGIIGab OC0% (1)
- Previo 12 QgiiDocumento26 páginasPrevio 12 QgiiGab OCAún no hay calificaciones
- Práctica 7 QgiiDocumento8 páginasPráctica 7 QgiiGab OCAún no hay calificaciones
- Practica 1 QGIIDocumento10 páginasPractica 1 QGIIGab OC0% (1)
- Termodinámica Tema 1Documento55 páginasTermodinámica Tema 1Donovan RamirezAún no hay calificaciones
- Ramrez Navas Problemas CongelacinDocumento22 páginasRamrez Navas Problemas CongelacinNelly Huarina MirandaAún no hay calificaciones
- Clase 6. Reactor de Conversion, de Gibbs y de EquilibrioDocumento19 páginasClase 6. Reactor de Conversion, de Gibbs y de EquilibrioKarla FelixAún no hay calificaciones
- Guía de Actividades y Rúbrica de Evaluación - Tarea 3 - Equilibrio y Cinética PDFDocumento21 páginasGuía de Actividades y Rúbrica de Evaluación - Tarea 3 - Equilibrio y Cinética PDFYurasit OvallosAún no hay calificaciones
- III Examen Parcial Fundamentos Química I - 2019 RespuestasDocumento15 páginasIII Examen Parcial Fundamentos Química I - 2019 RespuestasJeifer VarelaAún no hay calificaciones
- PRÁCTICA Entalpia de Fusion Del AguaDocumento3 páginasPRÁCTICA Entalpia de Fusion Del AguaSod Neron0% (2)
- Leyes de Migración de HumedadDocumento52 páginasLeyes de Migración de HumedadYenifer Muñoz CortesAún no hay calificaciones
- OPU 2023-1 Guía 3 - Balance de EnergíaDocumento18 páginasOPU 2023-1 Guía 3 - Balance de EnergíaOscar Eduardo Cabrera Gutierrez100% (1)
- Entalpia de CombustionDocumento14 páginasEntalpia de CombustionWilliam Anderson Muñoz OcampoAún no hay calificaciones
- Laboratorio Fisicoquimica 5Documento9 páginasLaboratorio Fisicoquimica 5cristian peñarandaAún no hay calificaciones
- Informe Calorimetria FinalDocumento14 páginasInforme Calorimetria FinalJOELAún no hay calificaciones
- Tema01 Termoquimica Ejercicios PDFDocumento61 páginasTema01 Termoquimica Ejercicios PDFAngel RosalesAún no hay calificaciones
- S01.s1 Material 1Documento47 páginasS01.s1 Material 1Cesar Rojas BordaAún no hay calificaciones
- Taller Fisicoquimica Termoquimica AmbientalDocumento3 páginasTaller Fisicoquimica Termoquimica AmbientalFrancia SotoAún no hay calificaciones
- Informe 2 ReactoresDocumento39 páginasInforme 2 ReactoresAlvaro Ignacio Moya UlloaAún no hay calificaciones
- Presentación Propiedades Sustancias Puras - PPT - 1Documento31 páginasPresentación Propiedades Sustancias Puras - PPT - 1Camilo RuizAún no hay calificaciones
- Trabajo de Las TurbinasDocumento4 páginasTrabajo de Las Turbinaschristian caicedoAún no hay calificaciones
- Materia y EnergiaDocumento22 páginasMateria y EnergiaJohn Steven Fasabi PerezAún no hay calificaciones
- Manual de Procesos 2016 IIDocumento68 páginasManual de Procesos 2016 IIAnderson IpanaqueAún no hay calificaciones
- 100000NI22 Fisicoquimica RDocumento6 páginas100000NI22 Fisicoquimica RMiguel BaldeonAún no hay calificaciones
- Ejercicios Propuestos, Primera Ley - Sustancias Puras, Termofluidos, 2022-2Documento4 páginasEjercicios Propuestos, Primera Ley - Sustancias Puras, Termofluidos, 2022-2Alejandro MeloAún no hay calificaciones
- Cap IIDocumento10 páginasCap IILuz AlvarezAún no hay calificaciones
- GIBSSDocumento15 páginasGIBSSAnee MéndezAún no hay calificaciones
- Practica 6 Quimica 2Documento12 páginasPractica 6 Quimica 2Gabriel Ricardo Gutierrez VivancoAún no hay calificaciones
- Laboratorio Nicolas TorresDocumento23 páginasLaboratorio Nicolas TorresAlejandro BallesterosAún no hay calificaciones
- Inf N°3 - PQ223 - Carbajal FloresDocumento21 páginasInf N°3 - PQ223 - Carbajal FloresJhandy Carlos Octavio Martinez CondorAún no hay calificaciones
- Interfases y Superficies.Documento8 páginasInterfases y Superficies.marianaAún no hay calificaciones
- Tema 6 TermoquimicaDocumento51 páginasTema 6 TermoquimicaJose Luis Gutierrez GonzalezAún no hay calificaciones
- Propiedades de Las Sustancias PurasDocumento10 páginasPropiedades de Las Sustancias PurasInma OrtigosaAún no hay calificaciones