0% encontró este documento útil (0 votos)
1K vistas11 páginasPráctica 7 Principios
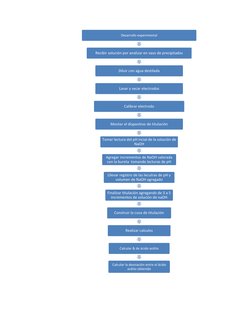
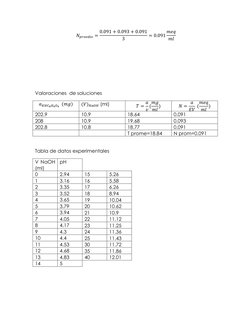
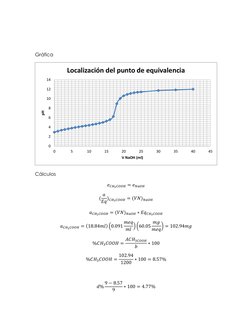
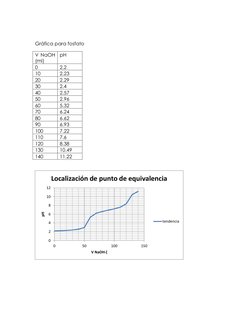
Este documento describe un experimento para determinar el contenido de ácido acético en una muestra mediante titulación potenciométrica con hidróxido de sodio. Se medirá el pH de la solución titulada para construir la curva de titulación y determinar el punto equivalente. Se realizarán cálculos para calcular el porcentaje de ácido acético en la muestra utilizando el volumen equivalente de NaOH en el punto de equivalencia.
Cargado por
Hugo Enrique J De DiosDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas11 páginasPráctica 7 Principios
Este documento describe un experimento para determinar el contenido de ácido acético en una muestra mediante titulación potenciométrica con hidróxido de sodio. Se medirá el pH de la solución titulada para construir la curva de titulación y determinar el punto equivalente. Se realizarán cálculos para calcular el porcentaje de ácido acético en la muestra utilizando el volumen equivalente de NaOH en el punto de equivalencia.
Cargado por
Hugo Enrique J De DiosDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd