Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Experimento Unificador de Cinetica y Termodinamica: Ley de Velocidad Energía de Activación y Constante de Equilibrio de La Disociación de La Ferroína
Cargado por
Fernanda S LunaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Experimento Unificador de Cinetica y Termodinamica: Ley de Velocidad Energía de Activación y Constante de Equilibrio de La Disociación de La Ferroína
Cargado por
Fernanda S LunaCopyright:
Formatos disponibles
Laboratorio de Fisicoquímica
Informe de Trabajo
EXPERIMENTO UNIFICADO DE CINÉTICA Y
TERMODINÁMICA: LEY DE VELOCIDAD;
ENERGÍA DE ACTIVACIÓN Y CONSTANTE
Fecha: 06/02/2020 DE EQUILIBRIO DE LA DISOCIACIÓN DE LA
FERROÍNA.
Nombre del Alumno: Muñoz Soriano Oscar, Santiago Luna
Diana Fernanda y Vazquez Cruz Efrain Alan
Profesores: Gabriela Valdés y Leonardo Salgado.
Resumen: En esta práctica se unifico el término de cinética y termodinámica.
Se obtuvo que la energía de activación es de 99.89 KJmol -1, en donde la
energía de activación es la energía necesaria para que una reacción comience,
y al ser de tipo endotérmica favorece a los productos.
Baño térmico, espectrofotómetro spectronic 20.
Introducción
La cinética química estudia las velocidades de las reacciones químicas
y los mecanismos a través de los cuales estas se producen. La
velocidad de reacción es la velocidad con la que se desciende la
concentración de un reactivo o aumenta la de un producto en el
curso de una reacción.1 La velocidad de una reacción depende de la
concentración de los reactivos, la temperatura y los catalizadores. La
ley de velocidad es una ecuación que expresa la velocidad en función
de las concentraciones de las sustancias que toman parte en la
reacción, que a su vez estará afectada por la temperatura a la cual
estas reacciones se llevan a cabo.2
Figura 1.- Baño térmico.
En la figura 1 se muestra un ejemplo de un baño térmico, este equipo
Experimental se utiliza para regular la temperatura y mantenerla constante.
Reactivos.
Para este experimento se ocupa: ácido sulfúrico concentrado Procedimiento.
(H2SO4) marca Merck, ferroina (C36H24FeN62) marca Aldrich, Sección A.
ortofenantrolina (C12H8N2) marca Hycel, sulfato de hierro (FeSO4)
marca J.T. Baker, ácido clorhídrico (HCl) marca J.T. Baker, agua Se preparan 50 mL de H2SO4 0.50 M (solución A), a partir de esta
destilada. solución se preparan 50 mL de una solución de H2SO4 0.05 M
(solución B), también se preparan 50 mL de una solución
Material. [Fe(phen)32+] 7.5x10-5 M (solución C)
Pipeta volumétrica (2.00±0.01) mL marca PYREX, pipeta graduada
(5.00±0.03) mL marca PYREX, pipeta graduada (10.00±0.05) mL Experimento 1
marca PYREX, termómetro, cronometro, vaso de precipitado (50±5) En una celda se mezclan 3 mL de la solución A con 3 mL de solución
mL marca PYREX, micro espátula, agitador de vidrio, matraz C, se registra la absorbancia, con ƛ = 510 nm, en intervalos de 3
volumétrico (50.0±0.1) mL marca PYREX, piceta, propipeta, celdas minutos durante 50 minutos.
para espectrofotómetro. Experimento 2.
Equipo.
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 190 | 1
ARTICLE Journal Name
En una celda se mezclan 3 mL de la solución B con 3 mL de la solución
C y de igual manera se registra la absorbancia, ƛ = 510 nm, por
intervalos de 3 minutos por 50 minutos.
Sección B
Se realizó el mismo procedimiento para la sección A con la diferencia
de que las soluciones se mantienen a una temperatura constante de
30°C, 40°C y 50°C, en cada caso. Se cambia el intervalo a 30 segundos
para el caso de las temperaturas de 50°C y 40°C.
Se determina la energía de activación.
Sección C
Se preparan 50 mL de FeSO4 2.5x10-5 M y 50 mL de o-fenantrolina
5.0x10-4 M y se mezclan 3 mL de cada solución. Como la reacción es
muy lenta a temperatura ambiente, después de una semana se debe Figura 3. Gráfica de orden de reacción 1 para el experimento 1.
medir la absorbancia de esa reacción en ƛ = 510 nm.
En la figura 3 se presenta el gráfico adecuado para el experimento 1.
Con el criterio de R2 más cercano a 1 se determinó que la reacción es
Se realiza una curva de calibración con 4 concentraciones diferentes
de orden 1 con respecto a la ferroina.
de [Fe(phen)32+] dentro del intervalo 3.0-7.5x10-5 M.
Donde K´1=0.0057
Resultados y discusión
Experimento 2.
Sección A
Experimento 1
Figura 4.- Gráfico de órdenes de reacción para el experimento 2.
En la figura 2 se muestra el gráfico para determinar el orden de
reacción del experimento 2, dando como resultado que el orden de
reacción para este experimento es de orden 1 con R2=0.9996
Figura 2.- Gráfico de órdenes de reacción para el experimento 1.
En la figura 2 se muestra el gráfico para determinar el orden de
reacción del experimento 1, dando como resultado que el orden de
reacción para este experimento es de orden 1 con R2=0.9997.
Figura 5. Gráfica de orden de reacción 1 para el experimento 2.
En la figura 5 se presenta el gráfico adecuado para el experimento 2.
2 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
Journal Name ARTICLE
Con el criterio de R2 más cercano a 1 se determinó que la reacción es
de orden 1 con respecto a la ferroina. 𝛥𝑡 = Diferencia de tiempo
Donde
A partir de la ley de Lambert-Beer.
K2’=0.0066
Experimento K [H2SO4] [Ferroina] 𝐴= 𝜉𝑙𝐶
1 0.0057 0.25 0.0000375
donde:
2 0.0066 0.025 0.0000375
𝜉 = Cte. de absortividad
Tabla 1.- Datos de los experimentos 1 y 2.
𝐴= Absorbancia
En la tabla 1 se muestra la K, la [H 2SO4] y la [Ferroina] para cada
experimento realizado.
.
𝑙 = Longitud de la celda.
Sabiendo que:
k’1=K[H2SO4]1b, k’2=K[H2SO4]2b
𝐶= Concentración.
se tiene la relación de que
k’1=19/22(k2’) Para conocer el valor de la cte. de absortividad se hace lo siguiente:
Despejando de la ley de Lambert-Beer se tiene que la cte. de
por lo que: absortividad es:
19
𝐾[𝐻2 𝑆𝑂4 ]1𝑏 = 𝐾[𝐻2 𝑆𝑂4 ]𝑏2 𝐴
22 𝜉=
𝑙𝐶
[𝐻2 𝑆𝑂4 ]1 19
( )𝑏 =
[𝐻2 𝑆𝑂4 ]2 22
Al inicio de la reacción se tiene que:
𝐿𝑛(0.86)
𝑏= = −0.06 ∼ 0
𝐿𝑛(10)
𝑙 = 1 cm.
Para determinar la velocidad de reacción.
Ai = 0.384 uA ti= 0 min (Tabla 3).
𝛥𝐶
𝑉 = 𝛥𝑡
Donde: Ci = 3.75x10-3 M (Tabla 1).
𝛥𝐶= Diferencia de concentraciones.
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 18I | 3
ARTICLE Journal Name
0.384 𝑢𝐴 𝑉
𝜉= = 102.4 uA/cmM. 𝐾=
(1 𝑐𝑚) (3.75𝑥10−3 𝑀) [𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎]𝑎 [𝐻2 𝑆𝑂4 ]𝑏
−1.94𝑥10−5 𝑀/𝑚𝑖𝑛 1 𝑚𝑖𝑛
𝐾= = 0.0345 s-1.
[3.75𝐸−5 𝑀]𝑎 [0.25 𝑀]𝑏 60 𝑠
Está cte. de absortividad será la misma al inicio y al final de la
reacción, por lo que para conocer la concentración final de ferroina Sección B
se despeja la C de la ecuación de Lambert-Beer.
𝐴
𝐶=
𝑙𝜉
Al final de la reacción se tiene que:
𝜉= 102.4 uA/cmM Figura 6.- Grafico de ln(A) vs t a una temperatura de 20 °C.
𝑙 = 1 cm
Af = 0.283 uA tf = 51 min
0.283 𝑢𝐴
Cf = (1 𝑐𝑚) (102.4 𝑢𝐴/𝑐𝑚𝑀)= 2.76x10-3 M.
Figura 7.- Grafico de ln(A) vs t a una temperatura de 32 °C.
Una vez teniendo las concentraciones sustituimos en la ecuación de
velocidad.
𝐶𝑓 − 𝐶𝑖 2.76𝑥10−3 𝑀 − 3.75𝑥10−3 𝑀
𝑉 = 𝑡𝑖 − 𝑡𝑓
= 51 𝑚𝑖𝑛 − 0 𝑚𝑖𝑛
= - 1.94x10-5 M/min.
La ley de velocidad de reacción es:
𝑉 = 𝐾 [𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎]𝑎 [𝐻2 𝑆𝑂4 ]𝑏
Para la determinación de K
Figura 8.-Grafico de ln(A) vs t a una temperatura de 40 °C.
4 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
Journal Name ARTICLE
−𝐸𝑎
−12012𝐾 =
𝑅
𝑘𝐽 𝑘𝑗
𝐸𝑎 = 8.314𝑥10−3 (12012𝐾) = 99.87
𝐾𝑚𝑜𝑙 𝑚𝑜𝑙
Sección C.
Muestra [ferroina]/M A/uA
Figura 9.-Grafico de ln(A) vs t a una temperatura de 50 °C.
Blanco 0.00E+00 0
T(°C) T(K) k 1/T Lnk
1 3.50E-05 0.395
20 293.15 0.0001 0.0034112 -9.2103404 2 4.50E-05 0.482
32 305.15 0.0004 0.0032771 -7.824046 3 5.50E-05 0.558
4 6.50E-05 0.659
40 313.15 0.0013 0.0031934 -6.8124451
5 7.50E-05 0.787
50 323.15 0.0046 0.0030945 -5.381699
Tabla 3.- Datos para la curva de calibración de ferroina.
En la tabla 3 se muestran las concentraciones y las absorbancias para
Tabla 2.- Datos para la reacción de Ferroina con H2SO4 a diferentes la construcción de la curva de calibración de la ferroina.
Temperaturas.
En la tabla 2 se muestran los valores de T(K), k, 1/T (K--1) y ln k Para la
reacción de Ferroina con H2SO4 a 20°C, 32 °C, 40 °C y 50 °C. Estos
datos son necesarios para calcular la energía de activación de la
reacción.
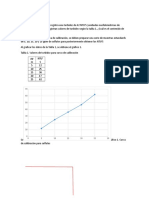
Figura 11.- Curva de calibración para el sistema de ferroina.
En la figura 11 se muestran los datos de la pendiente, la ordenada al
origen y el valor R2 de la curva de calibración realizada a partir de las
diluciones de la tabla 3.
Pasando 1 semana se mide la absorbancia de la solución de FeSO4 y
Figura 10.- Gráfico para la determinación de la energía de activación.
O-fenantrolina la cual es:
En la figura 10 se muestra la gráfica linealizada, los valores de la
pendiente y la ordenada al origen los cuales son -12012 K y 31.66
respectivamente.
A = 0.159 uA
Determinando la energía de activación
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 18I | 5
ARTICLE Journal Name
Utilizando el método de mínimos cuadrados se determina la Las dos nos dan una relacion entre la formacion de los
concentración y la desviación estándar de la solución. productos y la desaparicion de los reactivos dependiendo del
sistema a considerar, en equilibrio.
𝐴𝑖𝑛𝑡 − 𝑏 0.159 𝑢𝐴 − 0.0133 𝑢𝐴
[Ferroina] =
𝑚
=
10230 𝑢𝐴/𝑀
= 1.44x10-5 M.
2.- Si se tiene una solución A con una concentración de
3.5X10-3 M y se quieren preparar 25mL de una solución de
S = 1.41x10-6 M. 6.0X10-5 M, ¿Qué volumen de solución A se debe usar?
[Ferroina] = (14x10-6±1x10-6) M. Se determina mediante la ecuacion C1V1=C2V2
Despejando V1 de la ecuacion y sustituyendo valores, se
A partir de la reacción:
obtiene un volumen de 0.43mL
Fe2+(ac) + 3 phenH+(ac) + 3 H2O(l) ⇋ Fe(phen)32+ (ac) + 3 H3O+(ac) 3.- Según la ley de Beer la concentración de una solución
coloreada es proporcional a la absorbancia. Si la reacción a
estudiar es de primer orden, ¿Qué gráfico me proporcionará
Se determinan las concentraciones al equilibrio con X = [Ferroina] = la constante de velocidad?. Explica.
14x10-6 M.
[FeSO4]/M [H+]/M [PhenH+]/ [Fe(phen)3 Una linea recta ya que es de primer orden y relacion
M 2+]/M
proporcional entre la variable dependiente e independiente.
Inicio 2.5x10-5 5.0x10-4 0 0
4.- ¿El orden experimental coincidió con el dado en la
Reacciona 2.5x10-5-X 3(5.0x10-4- 3X X literatura? En caso de que no, ¿a que se lo atribuyen? Si
X) coincidió, en orden 1.
Equilibrio 1.1x10-5 1.46x10-3. 4.2x10-5 14x10-6
Tabla 4.- Datos de concentraciones. 5.- ¿La linearidad de las gráficas fue determinante para
En la tabla 4 se muestran las concentraciones al inicio y al equilibrio decidir sobre el orden con respecto a la ferroína? Expliquen.
de la reacción de FeSO4 con O-fenantrolina. SÍ, ya que se utilizo el metodo de minimos cuadrados y el
criterio de R2 .
Conclusiones
La diferencia entre la constante de equilibrio y la constante de 6.- ¿Qué otro método podría aplicar para la determinación
velocidad es que a medida que aumenta la temperatura esta de la constante de velocidad?
constante crecerá de la misma forma, la constante de velocidad
depende de la reacción, de los catalizadores (cuando se usan) y de la
temperatura, su valor indica si la reacción es rápida o lenta y sus Aproximación del estado estacionario, preequilibrio, vida
unidades dependen del orden de la reacción. Para la constante de media, orden de reacción con dependencia en la
equilibrio las concentraciones de los reactivos y productos temperatura.
permanecen constantes en determinadas condiciones de presión y
temperatura y este valor también depende de la temperatura. La
energía de activación es la energía necesaria para que se lleve a cabo 7.- A partir de los órdenes obtenidos para la ferroína y para
una reacción sin esta no se llevaría a cabo una reacción. En este caso el ácido súlfurico, ¿Podrian decir que la reaccion se lleva a
la energía de activación fue de 99.89KJ/mol siendo de tipo cabo en una sola etapa? Expliquen.
endotérmica indicando que la reacción favorece a productos.
No sé lleva en una sola etapa ya que el equilibrio de la
Cuestionario reacción indica que debe comenzar la reacción con un paso
lento y determinante de la reacción y un paso rápido.
1.- ¿Como se relaciona la constante de equilibrio y las
constantes de velocidad en un reacción reversible? 8.- ¿El valor de la energía de activación coincidió con el dato
en la literatura? ¿En qué porcentaje varió?
6 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
Journal Name ARTICLE
No coincide con el de la literarura. Nuestra Ea= 99.87kJ/mol,
mientras que en la literatura se reporta Ea= 127±15 kJ/mol V =50 mL.
considerando a Ea= 112kJ/mol varia en un porcentaje del
10.9%.
Pureza = 0.1 %
Anexo V=(0.05Lmuestra)(7.5x10-
𝑚𝑜𝑙 𝒇𝒆𝒓𝒓𝒐𝒊𝒏𝒂 𝑔 𝑓𝑒𝑟𝑟𝑜𝑖𝑛𝑎 100 %
)(692.5286𝑚𝑜𝑙 𝑓𝑒𝑟𝑟𝑜𝑖𝑛𝑎 )( 0.1 % )
𝐿 𝑚𝑢𝑒𝑠𝑡𝑟𝑎
Solución de H2SO4 0.50 M (Sol. A). V = 2.59 mL de ferroína.
V= 50 mL
Solución de 2.5x10-5 M.
𝑔
⍴ = 1.84 𝑚𝐿
v = 50 mL.
Pureza = 96 % Masa molar = 278.02
𝑔
.
𝑚𝑜𝑙
𝑔
Masa molar = 98.08
𝑚𝑜𝑙 Pureza = 99.9%.
𝑚𝑜𝑙 𝑯𝟐𝑺𝑶𝟒 𝑔 𝐻2𝑆𝑂4 𝑚𝐿 100 % 𝑚𝑜𝑙 𝑭𝒆𝑺𝑶𝟒
V=(0.05Lmuestra)(0.5 𝐿 𝑚𝑢𝑒𝑠𝑡𝑟𝑎 )(98.08𝑚𝑜𝑙 𝐻2𝑆𝑂4)(1.84 𝑔 𝐻2𝑆𝑂4)( 96 % ) m=(0.05Lmuestra)(2.5x10-5 𝐿 𝑚𝑢𝑒𝑠𝑡𝑟𝑎 )(278.02
𝑔 𝑭𝒆𝑺𝑶𝟒 100 % 1000 𝑚𝑔
)( )( )
𝑚𝑜𝑙 𝑭𝒆𝑺𝑶𝟒 99.9 % 1𝑔
V = 1.388 mL H2SO4.
m = 0.34787 mg de FeSO4.
Solución de H2SO4 0.05 M (Sol. B).
Solución de o-fenantrolina 5.0x10-4 M.
𝑉1 𝐶1 = 𝑉2 𝐶2
𝑉2 𝐶2 v = 50 mL.
𝑉1 =
𝐶1
𝑔
Masa molar = 198.23 𝑚𝑜𝑙 .
(50 𝑚𝐿 ) (0.05 𝑀)
𝑉1 = = 5 mL de sol. A.
(0.5 𝑀)
𝑚𝑜𝑙 𝒐−𝒇𝒆𝒏𝒂𝒏𝒕𝒓𝒐𝒍𝒊𝒏𝒂
m=(0.05Lmuestra)(5.0x10-4 𝐿 𝑚𝑢𝑒𝑠𝑡𝑟𝑎
)(278.02
𝑔 𝒐−𝒇𝒆𝒏𝒂𝒏𝒕𝒓𝒐𝒍𝒊𝒏𝒂 1000 𝑚𝑔
𝑚𝑜𝑙 𝒐−𝒇𝒆𝒏𝒂𝒏𝒕𝒓𝒐𝒍𝒊𝒏𝒂
)( 1𝑔
)
Solución de ferroina 7.5x10-5 M (Sol. C).
m = 4.9 mg de o-fenantrolina.
𝑔
Masa molar = 692.5286 .
𝑚𝑜𝑙
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 18I | 7
ARTICLE Journal Name
Concentraciones iniciales.
( 7.5𝑥10−5 𝑀) (3 𝑚𝐿)
[𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑓𝑖𝑛𝑎𝑙 ] = = 3.75x10-5 M
Para el experimento 1 se añadieron 3 mL de H2SO4 con una 𝟔 𝒎𝑳
concentración de 0.5 M y 3 mL de Ferroina con una concentración de
7.5x10-5 M. Experimento 1.
Tiempo/min A/uA
A partir de
0 0.384
𝐶1 𝑉1 = 𝐶2 𝑉2
3 0.372
[𝐻2 𝑆𝑂4 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 ] 𝑉𝐻2𝑆𝑂4 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = [𝐻2 𝑆𝑂4 𝑓𝑖𝑛𝑎𝑙 ]𝑉𝑇𝑜𝑡𝑎𝑙 6 0.364
9 0.358
[𝐻2 𝑆𝑂4 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 ] 𝑉𝐻2𝑆𝑂4 𝑖𝑛𝑖𝑐𝑖𝑎𝑙
[𝐻2 𝑆𝑂4 𝑓𝑖𝑛𝑎𝑙 ] =
𝑽𝑻𝒐𝒕𝒂𝒍 12 0.352
15 0.346
(0.5 𝑀) (3 𝑚𝐿)
[𝐻2 𝑆𝑂4 𝑓𝑖𝑛𝑎𝑙 ] = = 0.25 M.
𝟔 𝒎𝑳
18 0.34
[𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 ] 𝑉𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = [𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑓𝑖𝑛𝑎𝑙 ]𝑉𝑇𝑜𝑡𝑎𝑙 21 0.334
24 0.329
[𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 ] 𝑉𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙
[𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑓𝑖𝑛𝑎𝑙 ]=
𝑽𝑻𝒐𝒕𝒂𝒍
27 0.323
( 7.5𝑥10−5 𝑀) (3 𝑚𝐿) 30 0.318
[𝐹𝑒𝑟𝑟𝑜𝑖𝑛𝑎 𝑓𝑖𝑛𝑎𝑙 ] = = 3.75x10-5 M.
𝟔 𝒎𝑳
33 0.312
Para el experimento 2 se añadieron 3 mL de H2SO4 con una
36 0.307
concentración de 0.05 M y 3 mL de Ferroina con una concentración
de 7.5x10-5 M. 39 0.302
42 0.297
(0.05 𝑀) (3 𝑚𝐿)
[𝐻2 𝑆𝑂4 𝑓𝑖𝑛𝑎𝑙 ] = = 0.025 M.
𝟔 𝒎𝑳
8 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
Journal Name ARTICLE
45 0.292 39 0.295
48 0.287 42 0.289
51 0.283 45 0.284
Tabla 5.- Datos experimentales para la reacción 1.
48 0.279
En la tabla - se muestran los datos experimentales de tiempo y
absorbancia para la reacción de ácido sulfúrico 0.5 M y ferroina.
Experimento 2.
51 0.274
Tiempo/min A/uA
Tabla 6.- Datos experimentales para la reacción 2.
En la tabla 4 se muestran los datos experimentales de tiempo y
0 0.384 absorbancia para la reacción de ácido sulfúrico 0.05 M y ferroina.
Sección B
3 0.375
Tiempo/ s A/uA
6 0.368
9 0.36
0 0.384
12 0.353
180 0.375
15 0.346
360 0.368
18 0.34
540 0.36
21 0.333
720 0.353
24 0.327
900 0.346
27 0.32
1080 0.34
30 0.313
1260 0.333
33 0.307
1440 0.327
36 0.3
1620 0.32
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 18I | 9
ARTICLE Journal Name
1800 0.313 1080 0.178 -1.72597
1980 0.307 1260 0.164 -1.80789
2160 0.3 1440 0.152 -1.88387
2340 0.295 1620 0.142 -1.95193
2520 0.289 1800 0.131 -2.03256
2700 0.284 1980 0.123 -2.09557
2880 0.279 2520 0.096 -2.34341
3060 0.274 2700 0.090 -2.40795
Tabla 7.- Datos experimentales para la reacción de ferroina con 2880 0.086 -2.45341
H2SO4 a 20°C.
En la tabla 6 se muestra el tiempo (s) y la absorbancia que se obtuvo
de la reacción de ferroina con H2SO4 a 20°C. 3060 0.080 -2.52573
T=32°C 510nm Columna1 Tabla 8.- Datos experimentales para la reacción de ferroina con
H2SO4 a 32°C.
En la tabla 7 se muestra el tiempo (s) y la absorbancia que se obtuvo
de la reacción de ferroina con H2SO4 a 32°C.
tiempo/seg A/uA LnA
40°C 510nm Columna1
0 0.314 -1.15836
Tiempo A/uA LnA
/seg
180 0.276 -1.28735
0 0.3 -1.20397
360 0.251 -1.3823
180 0.219 -1.51868
540 0.229 -1.47403
360 0.172 -1.76026
720 0.211 -1.5559
540 0.121 -2.11196
900 0.197 -1.62455
10 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
Journal Name ARTICLE
720 0.101 -2.29263 150 0.135 -2.00248
900 0.083 -2.48891 180 0.111 -2.19823
1080 0.071 -2.64508 210 0.098 -2.32279
1260 0.061 -2.79688 240 0.086 -2.45341
1440 0.051 -2.97593 270 0.077 -2.56395
1620 0.044 -3.12357 300 0.074 -2.60369
1800 0.032 -3.44202 330 0.063 -2.76462
1980 0.029 -3.54046 360 0.061 -2.79688
2460 0.017 -4.07454 450 0.034 -3.38139
2700 0.012 -4.42285 480 0.026 -3.64966
Tabla 9.- Datos experimentales para la reacción de ferroina con
510 0.034 -3.38139
H2SO4 a 40°C.
En la tabla 8 se muestra el tiempo (s) y la absorbancia que se obtuvo
de la reacción de ferroina con H2SO4 a 40°C.
540 0.037 -3.29684
T=50°C 510nm 30
570 0.033 -3.41125
Tiempo/ A/uA Ln(A) 600 0.018 -4.01738
min
630 0.031 -3.47377
30 0.244 -1.41059
660 0.022 -3.81671
60 0.203 -1.59455
690 0.019 -3.96332
90 0.17 -1.77196
720 0.026 -3.64966
120 0.148 -1.91054
Tabla 10.- Datos experimentales para la reacción de ferroina con
H2SO4 a 50°C.
En la tabla 9 se muestra el tiempo (s) y la absorbancia que se obtuvo
de la reacción de ferroina con H2SO4 a 50°C.
Universidad Autónoma Metropolitana-Iztapalapa Laboratorio de fisicoquímica, Trimestre 18I | 11
ARTICLE Journal Name
Referencias
1 Lee T. S., Kolthoff I.M., and Leussing D.L.,
J.Am.Chem.Soc.70, 2348 (1948).
2 S. Sattar, J. Chem. Ed., XX, Doc. 10.1021/ed100797s
(2011). 50
3 Cinética química, Silvia E. Castillo; Facultad de química de
la UNAM.
12 | Laboratorio de fisicoquímica, Trimestre 18I Universidad Autónoma Metropolitana-Iztapalapa
También podría gustarte
- Lab III Equilibrio QuímicoDocumento12 páginasLab III Equilibrio QuímicoSofía Flores SantilliAún no hay calificaciones
- Práctica2 Equilibrio Químico IónicoDocumento17 páginasPráctica2 Equilibrio Químico IónicoJavier Rodriguez50% (2)
- PRACTICA #1 QII Influencia de La Naturaleza de Las Sustancias en La VelocidadDocumento4 páginasPRACTICA #1 QII Influencia de La Naturaleza de Las Sustancias en La VelocidadCamila RodriguezAún no hay calificaciones
- Calor de Reacción de NeutralizaciónDocumento1 páginaCalor de Reacción de NeutralizaciónJUAN PABLO DIAZ CATACOLYAún no hay calificaciones
- Informe 3 FisicoquimicaDocumento5 páginasInforme 3 FisicoquimicaValentina Soto ValenciaAún no hay calificaciones
- Guiones de Praxcticas QFV 2016Documento21 páginasGuiones de Praxcticas QFV 2016Gabriel SanjurjoAún no hay calificaciones
- BUHOS Evidencia7Documento18 páginasBUHOS Evidencia7Angel ZarateAún no hay calificaciones
- Informe Lab 3 - Orden de ReaccionDocumento9 páginasInforme Lab 3 - Orden de ReaccionHILARIO JUNIOR CACERES MEDINAAún no hay calificaciones
- CCQ G1 E1 PrácticaDocumento10 páginasCCQ G1 E1 PrácticaCamilo PerezAún no hay calificaciones
- Equilibrio QuimicoDocumento9 páginasEquilibrio QuimicoLyann Yesenia Gorena VacaAún no hay calificaciones
- Practica 6. Reaccion de Segundo OrdenDocumento6 páginasPractica 6. Reaccion de Segundo OrdenAngelesTorresAún no hay calificaciones
- Practica de Carbón ActivadoDocumento7 páginasPractica de Carbón ActivadoIleana MPAún no hay calificaciones
- Pre5 Termo2Documento4 páginasPre5 Termo2Valeria AlpucheAún no hay calificaciones
- Formato Informe 6 Ley de Velocidad de Una ReacciònDocumento6 páginasFormato Informe 6 Ley de Velocidad de Una ReacciònMARÍA JOSÉ AMARIS PÉREZ Amaris perezAún no hay calificaciones
- Informe de Cinetica QuimicaDocumento4 páginasInforme de Cinetica QuimicaEvelyn Stheicy Carmona DiazAún no hay calificaciones
- Informe Calor de Reaccion de NeutralizacionDocumento4 páginasInforme Calor de Reaccion de NeutralizacionPablo CesarAún no hay calificaciones
- Practica 5Documento7 páginasPractica 5Alejandro de la RosaAún no hay calificaciones
- Pre Informe 2Documento10 páginasPre Informe 2DanielAún no hay calificaciones
- Informe METODOS DE LAS VELOCIDADES INICIALESDocumento5 páginasInforme METODOS DE LAS VELOCIDADES INICIALESjohanaAún no hay calificaciones
- Laboratorio N°8 Equilibrio QuímicoDocumento6 páginasLaboratorio N°8 Equilibrio QuímicoJean Pierre BosquezAún no hay calificaciones
- Estequiometria 2Documento6 páginasEstequiometria 2Juldor ReiranAún no hay calificaciones
- Le Chatier. InorganicaDocumento5 páginasLe Chatier. InorganicaDiana MonteroAún no hay calificaciones
- GRUPO 2 INFORME Equilibrio QuímicoDocumento11 páginasGRUPO 2 INFORME Equilibrio QuímicoPorfirio AlcántaraAún no hay calificaciones
- Informe Entalpia Acido-Base LaboratorioDocumento7 páginasInforme Entalpia Acido-Base LaboratorioAbel de Jesús Rivera100% (1)
- INFORME DE LABORATORIO DE FISICOQUIMICA Practica 5..Documento13 páginasINFORME DE LABORATORIO DE FISICOQUIMICA Practica 5..miguelAún no hay calificaciones
- Practica#9, Elaine GeorgeDocumento5 páginasPractica#9, Elaine GeorgeElaine GeorgeAún no hay calificaciones
- Cambio de Entalpia de Una Reaccion de NeutralizacionDocumento3 páginasCambio de Entalpia de Una Reaccion de NeutralizacionJorge LizcanoAún no hay calificaciones
- 12 Informe de Laboratorio de Quimica (LUIS CARLOS MERCADO CASTRO)Documento5 páginas12 Informe de Laboratorio de Quimica (LUIS CARLOS MERCADO CASTRO)luis carlosAún no hay calificaciones
- Informe #Calor de NeutralizacionDocumento12 páginasInforme #Calor de NeutralizacionOliver Ch CAún no hay calificaciones
- Informe EntalpíaDocumento3 páginasInforme EntalpíainsantamariatAún no hay calificaciones
- Previo-5-Efecto de La Temperatura en La Rapidez de Una ReaccionDocumento9 páginasPrevio-5-Efecto de La Temperatura en La Rapidez de Una ReaccionDavid Ramirez Torres100% (4)
- Reporte de PrácticaDocumento5 páginasReporte de PrácticaSANTIAGO ROMERO GARCIAAún no hay calificaciones
- Practica Lab-Cinetica QuimicaDocumento4 páginasPractica Lab-Cinetica QuimicaPaul UsquianoAún no hay calificaciones
- Informe 4Documento5 páginasInforme 4Anonymous V77GRshu10Aún no hay calificaciones
- Luis Yupa Informe Laboratorio Nº1. Word.Documento10 páginasLuis Yupa Informe Laboratorio Nº1. Word.LuisYupaAún no hay calificaciones
- Practica 5. Equilibrio Quimico PDFDocumento5 páginasPractica 5. Equilibrio Quimico PDFJimmy Edgar Erazo ManitioAún no hay calificaciones
- Cinética Química Reporte LabDocumento32 páginasCinética Química Reporte LabLUIS ANGEL RAMIREZ TREJOAún no hay calificaciones
- Calor de Formacion Etanol y AspirinaDocumento4 páginasCalor de Formacion Etanol y AspirinaValentina Cabal RestrepoAún no hay calificaciones
- Efecto de La Concentración y La Temperatura Sobre La Velocidad de ReacciónDocumento4 páginasEfecto de La Concentración y La Temperatura Sobre La Velocidad de Reacciónanon_50632150Aún no hay calificaciones
- Guia N°2 Cinética QuímicaDocumento10 páginasGuia N°2 Cinética QuímicaChrystian Richard Llancuani RojasAún no hay calificaciones
- Informe Equilibrio QuimicoDocumento11 páginasInforme Equilibrio QuimicoBriggitte RodríguezAún no hay calificaciones
- Pactica 9 Efecto de La Temperautra en La Rapidez de ReaccionDocumento17 páginasPactica 9 Efecto de La Temperautra en La Rapidez de Reaccionbrandon moralesAún no hay calificaciones
- Quimicapr 4Documento6 páginasQuimicapr 4Eduardo BeltranAún no hay calificaciones
- Reporte de Practica 3Documento15 páginasReporte de Practica 3Cintly EspinalAún no hay calificaciones
- Reporte 3 - Reacciones A MicroescalaDocumento12 páginasReporte 3 - Reacciones A MicroescalaMichael Marquez CamouAún no hay calificaciones
- Clase-11 - EstequiometriaDocumento4 páginasClase-11 - EstequiometriaWilfredo Condori Mamany100% (1)
- Informe 2Documento6 páginasInforme 2julian realpeAún no hay calificaciones
- Practica 4 Energia CineticaDocumento12 páginasPractica 4 Energia CineticaGerrard Cardenas AlonsoAún no hay calificaciones
- Oxidación Ión FerrosoDocumento4 páginasOxidación Ión FerrosoErikaMurilloAún no hay calificaciones
- Practica N° 12Documento12 páginasPractica N° 12Wilfredo Gutierrez AllpaccaAún no hay calificaciones
- Informe N°15 - Cinética QuímicaDocumento8 páginasInforme N°15 - Cinética QuímicaDevra GomezAún no hay calificaciones
- Problema MaximizaciónDocumento18 páginasProblema MaximizaciónfernandaAún no hay calificaciones
- TERMOQUIMICADocumento24 páginasTERMOQUIMICAfernando hectorAún no hay calificaciones
- Manual Practica Laboratorio IiiDocumento7 páginasManual Practica Laboratorio IiiManuel CortesAún no hay calificaciones
- Antología de QuímicaDocumento63 páginasAntología de QuímicaArturo ChavezAún no hay calificaciones
- Reporte 8 .-Valoración EspectrofotométricaDocumento13 páginasReporte 8 .-Valoración EspectrofotométricaJorge Adrian Pérez TrejoAún no hay calificaciones
- Informe Práctica 2Documento9 páginasInforme Práctica 2Alejandro AlvearAún no hay calificaciones
- Informe de Laboratorio N°8 - Villa Luna ErickDocumento3 páginasInforme de Laboratorio N°8 - Villa Luna ErickErick VillaAún no hay calificaciones
- Prueba de Lixiviacion de OroDocumento16 páginasPrueba de Lixiviacion de OroNereida Yesica Olortigue HuamanAún no hay calificaciones
- Sección A. Equilibrio Químico y Constantes de EquilibrioDocumento17 páginasSección A. Equilibrio Químico y Constantes de EquilibriojorgeAún no hay calificaciones
- Calculo Preparar Solucion de AgNO3 01 NormalDocumento2 páginasCalculo Preparar Solucion de AgNO3 01 NormalMarcel ChevalierAún no hay calificaciones
- #4 ONCESESCALA DE PH para 16 Octubre PDFDocumento17 páginas#4 ONCESESCALA DE PH para 16 Octubre PDFklaverly alzamoraAún no hay calificaciones
- Informe Lab 5Documento14 páginasInforme Lab 5angela100% (2)
- EJERCICIOSDocumento10 páginasEJERCICIOSJhoisy AguilarCaseuxAún no hay calificaciones
- Tema-2-Metodos-ClasicosDocumento9 páginasTema-2-Metodos-ClasicosaanitahpAún no hay calificaciones
- Laboratorio #1Documento6 páginasLaboratorio #1MIMBELA, GEISELAún no hay calificaciones
- Diseno Experimental 1 LCB-IIDocumento10 páginasDiseno Experimental 1 LCB-IIOscar Palacios HuicocheaAún no hay calificaciones
- Metodo de Ponchon SavaritDocumento19 páginasMetodo de Ponchon SavaritVanessa RuizAún no hay calificaciones
- Titulación de Ácido MuriáticoDocumento14 páginasTitulación de Ácido MuriáticoHarrietAún no hay calificaciones
- Capitulo Viii VVDocumento15 páginasCapitulo Viii VVManuel Diego PerezAún no hay calificaciones
- 11 CB Química Electrolitos Fuertes y DebilesDocumento7 páginas11 CB Química Electrolitos Fuertes y Debilesjose francisco gomez cazares100% (1)
- GravimetriaDocumento20 páginasGravimetriaAna Karina Gutierrez AnayaAún no hay calificaciones
- Ejercicios Laborales So2Documento1 páginaEjercicios Laborales So2edwinAún no hay calificaciones
- ALEN CAL VAL 5 160 Lote 821 t6 t12 t9Documento3 páginasALEN CAL VAL 5 160 Lote 821 t6 t12 t9Laura Carolina Garzon RodriguezAún no hay calificaciones
- Ionización de Ácidos y BasesDocumento6 páginasIonización de Ácidos y BasesJexsyAún no hay calificaciones
- Equilibrio QuimicoDocumento38 páginasEquilibrio QuimicoPaola Gonzales FarfanAún no hay calificaciones
- Criterio Segunda DerivadaDocumento5 páginasCriterio Segunda DerivadaLaura BrandAún no hay calificaciones
- Tema 1. Introducción A Las Separaciones CromatográficasDocumento14 páginasTema 1. Introducción A Las Separaciones Cromatográficasgau3koAún no hay calificaciones
- Carrasco Yana Grover Josue Carlos - 1419120032, PDF 17Documento144 páginasCarrasco Yana Grover Josue Carlos - 1419120032, PDF 17Matamoros De La Cruz JorgeAún no hay calificaciones
- Guía de Cromatografía en Capa Fina y Por ColumnaDocumento7 páginasGuía de Cromatografía en Capa Fina y Por ColumnaJose LuisAún no hay calificaciones
- Solucionario de Preguntas 3, 13 y 15Documento4 páginasSolucionario de Preguntas 3, 13 y 15Jorge San MartinAún no hay calificaciones
- Sesión 7 - UIII - Ejercicos Extracción Líquido LíquidoDocumento3 páginasSesión 7 - UIII - Ejercicos Extracción Líquido Líquidobastian jorquera mondacaAún no hay calificaciones
- Informe 7 Acido BaseDocumento8 páginasInforme 7 Acido Basebrayan triviño quinteroAún no hay calificaciones
- LABO 2 - Comprobacion de La Ley de Beer LambertDocumento14 páginasLABO 2 - Comprobacion de La Ley de Beer LambertyosuartAún no hay calificaciones
- Cap 6 SolucionesDocumento49 páginasCap 6 Solucionesjuan oltAún no hay calificaciones
- Guia de Ejercicios CromatografiaDocumento2 páginasGuia de Ejercicios CromatografiaSantiagoRivasAún no hay calificaciones