Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe de Laboratorio N°2 Fisica
Cargado por
Luna MndzDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe de Laboratorio N°2 Fisica
Cargado por
Luna MndzCopyright:
Formatos disponibles
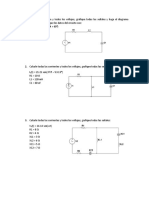
PRÁCTICA DE LABORATORIO N°2
-DETERMINACIÓN DE CARGA ELÉCTRICA ELEMENTAL-
I.- OBJETIVOS
1.1. Determinar experimentalmente el valor de la carga eléctrica elemental.
1.2. Analizar cualitativamente la conducción eléctrica en una solución electrolítica.
II.- EQUIPO Y ESQUEMA
a. Electrodos de cobre h. Vasos de 1000 ml
b. Resistencia variable(reóstato) i. Balanza
c. Cronometro j. Calibre
d. Amperímetro (A) k. Solución de sulfato de cobre
(CuSO4)
e. Fuente DC
l. Papel lijar
f. Cables de conexión
m. Interruptor (S)
g. Pinzas cocodrilo
III.- PROCEDIMIENTO EXPERIMENTAL
3.1. Con el calibre mida las longitudes de los electrodos
3.2. Proceda a pulir los electrodos con el papel lijar, de tal manera a que queden
completamente limpios de impurezas u oxido.
3.3. Enjuague y deje secar los electrodos tomando en cuenta de no tocarlos con los
dedos.
3.4. Una vez completamente secos, mida la masa de cada electrodo (𝑚𝑖 ).
3.5. Vierta en el vaso solución de sulfato de cobre (CuSO4)
3.6. Instale el circuito como se muestra en el esquema y conecte la fuente a la toma de
la red, después de la verificación respectiva.
3.7. Luego de cerrar el interruptor (S), desplace el cursor del reóstato, para regular el
valor de la intensidad de la corriente de 1 A.
3.8. Luego, tome el tiempo de 25 minutos, desde el momento en que se regula la
corriente de 1 A.
3.9. Transcurrido el tiempo de 25 minutos, abra el interruptor (S) y desconecte la fuente
de la toma de la red.
3.10. Saque los electrodos de la solución, enjuáguelos y séquelos.
3.11. Mida la masa final de los electrodos (𝑚𝑓 ).
3.12. Mida las longitudes de la región sumergida de cada uno de los electrodos con el
calibre.
IV.- ANÁLISIS DE DATOS EXPERIMENTALES
4.1.- Calcule el área sumergida de cada electrodo.(3.1)
4.2.- Calcule la variación de la masa de cada electrodo. (3.1)
4.3.- Calcule el valor de ℯ, utilizando la ecuación (3.1).
4.4.- Calcule el error en el valor de ℯ: 𝛿ℯ
𝑑𝑒 𝑑𝛪 𝑑𝛥𝑚 𝑑𝛥𝑡
= + +
𝑒 𝛪 𝑚 𝛥𝑡
𝑑𝑒 0.04 0.1 0.01
−19
= + +
1.7497x10 1 0.47 1500
−19
𝑑𝑒 = 0.44267x10
4.5.- Exprese el resultado experimental, según: ℯ = ℯ̅ ± 𝛿ℯ (C)
4.6.- Calcule el espesor de cobre acumulado en el cátodo.
o 𝐸= 95.61 x 10−19 m
TABLA 3.1
Electrodo 𝒎𝒊 (kg) 𝒎𝒇 (kg) ∆𝒎 (kg) A (m2) ℯ̅ ± 𝛿ℯ
Cátodo 95.14x10−3 95.61x10−3 +0.47x10−3 8.005x10−3 (1.750 ±0.443)x10−19
Ánodo 102.15x10−3 101.58x10−3 -0.57x10−3 8.003x10−3 (1.492 ±0.443)x10−19
V.- COMPARACIÓN Y EVALUACIÓN EXPERIMENTAL
1.602177 × 10−19 − 1.7497 × 10−19
%𝐶 = ( ) 100%
1.602177 × 10−19
%𝐶 =9.208%
VI.- CONCLUSIONES
Mis conclusiones de este tema son los siguientes:
o Los electrodos de cobre en este caso, tienen un espesor que en una cierta parte
está compuesto por protones, los cuales al efectuar el experimento fueron atraídos
por el Ánodo por estar cargado con carga positiva y cambiando ambos espesores
de los electrodos.
o La solución de Sulfato de cobre facilita en buena parte la transfusión de cargas
entre electrones.
o Los electrones atraen con más fuerza a los protones porque su masa es mucho
mayor y es por eso que el Cátodo aumenta su espesor.
También podría gustarte
- Astm C 702Documento4 páginasAstm C 702Alberto Falconi Tapia100% (4)
- MÉTODOS DE ENSAYO DE UNIDADES DE ALBAÑILERÍADocumento20 páginasMÉTODOS DE ENSAYO DE UNIDADES DE ALBAÑILERÍAjose81% (16)
- Informe Ley de OhmDocumento11 páginasInforme Ley de OhmDiego EnriqueAún no hay calificaciones
- Beneficio Pollo Trabaja FaseI Torres ZevallosDocumento14 páginasBeneficio Pollo Trabaja FaseI Torres Zevallosfernando miguel torres zevallosAún no hay calificaciones
- Rayos cósmicos y partículas en campos magnéticosDocumento1 páginaRayos cósmicos y partículas en campos magnéticosRaquelAún no hay calificaciones
- Busqueda y Uso Adecuado de BuscadoresDocumento7 páginasBusqueda y Uso Adecuado de BuscadoresCarlosCaracelaMinaya100% (1)
- Metodos NumericosDocumento151 páginasMetodos NumericosVictor Sumire Mamani100% (1)
- Informe de Laboratorios de Fenomenos de Transporte 2Documento65 páginasInforme de Laboratorios de Fenomenos de Transporte 2HERMAN JR.50% (2)
- Informe 8 Vol 2Documento8 páginasInforme 8 Vol 2carlosAún no hay calificaciones
- Tarea 3 Estudio Del TrabajoDocumento5 páginasTarea 3 Estudio Del TrabajoJonathan GoOmezAún no hay calificaciones
- Informe 5 EstudioDocumento9 páginasInforme 5 EstudioFernando TorresAún no hay calificaciones
- Informe Tratamientos TérmicosDocumento17 páginasInforme Tratamientos TérmicosGiuliana GarcíaAún no hay calificaciones
- Informe 12 - Carga y Descarga de Un CapacitorDocumento5 páginasInforme 12 - Carga y Descarga de Un CapacitorRosiTaMaldonadoSolórzanoAún no hay calificaciones
- Ensayo DurezaDocumento24 páginasEnsayo DurezaAntony Diego Atauje Pacheco0% (1)
- Ensayo de ChispaDocumento5 páginasEnsayo de ChispacarolinaAún no hay calificaciones
- Informe 9Documento7 páginasInforme 9daryany medinaAún no hay calificaciones
- Documento Sin TítuloDocumento23 páginasDocumento Sin TítuloMartin ZuñigaAún no hay calificaciones
- Lab 4Documento8 páginasLab 4Fred MercuryAún no hay calificaciones
- Guía de Prácticas 8Documento12 páginasGuía de Prácticas 8XiomaraAún no hay calificaciones
- Informe 5 - MaterialesDocumento6 páginasInforme 5 - MaterialesNadia ApazaAún no hay calificaciones
- Soladura por arco eléctricoDocumento36 páginasSoladura por arco eléctricoNickoll Chávez SilvaAún no hay calificaciones
- Informe N12 FisicaDocumento11 páginasInforme N12 FisicaFernando TorresAún no hay calificaciones
- Dap Detallado - Balones de GasDocumento8 páginasDap Detallado - Balones de GasDanitza Abarca MartinezAún no hay calificaciones
- Circuitos eléctricos cálculos métodosDocumento5 páginasCircuitos eléctricos cálculos métodosrenato briceñoAún no hay calificaciones
- Universidad Católica de Santa MaríaDocumento12 páginasUniversidad Católica de Santa MaríaaleszandroAún no hay calificaciones
- Informe N-03 Electrotecnia IndustrialDocumento16 páginasInforme N-03 Electrotecnia IndustrialStefanyCornejoVildosoAún no hay calificaciones
- Circuitos Electricos Corriente DirectaDocumento10 páginasCircuitos Electricos Corriente DirectaJOSEPH ALFREDO GALINDO OVIEDOAún no hay calificaciones
- Informe N°8-Estudio de TiemposDocumento23 páginasInforme N°8-Estudio de TiemposAlexandra GaldosAún no hay calificaciones
- El LimadoDocumento16 páginasEl LimadoSolansh Arlet Ledezma PazAún no hay calificaciones
- Transformador MonofásicoDocumento8 páginasTransformador MonofásicoGrace ValdeiglesiasAún no hay calificaciones
- Informe N°2-DOPDocumento9 páginasInforme N°2-DOPErnesto Vic Holg QuispeAún no hay calificaciones
- Ensayo de AtraccionDocumento24 páginasEnsayo de AtraccionMilagros Valeria Silva ChávezAún no hay calificaciones
- Describa y Analice La Operación Del Circuito RLC Cuando Está Configurado en SerieDocumento5 páginasDescriba y Analice La Operación Del Circuito RLC Cuando Está Configurado en Seriecinthya13750% (2)
- Práctica 02 - Leyes de Ohm y Leyes de KirchoffDocumento14 páginasPráctica 02 - Leyes de Ohm y Leyes de KirchoffValeria Colque GómezAún no hay calificaciones
- Ex-1 Termo Ing. Ind. Ucsm 2021-Par Sustancia PuraDocumento3 páginasEx-1 Termo Ing. Ind. Ucsm 2021-Par Sustancia PuraGiancarlo Rivas U100% (1)
- ExIOI 2020 FIII Resuelto para El ExamenDocumento3 páginasExIOI 2020 FIII Resuelto para El ExamenOscar Quispe0% (1)
- Informe 9Documento7 páginasInforme 9daryany medinaAún no hay calificaciones
- Informe de TaladradoDocumento9 páginasInforme de TaladradoRENZO ALEXANDER HANCCO CUTIAún no hay calificaciones
- Informe N°2Documento10 páginasInforme N°2Edison JhonAún no hay calificaciones
- Informe 10 - MaterialesDocumento7 páginasInforme 10 - MaterialesNadia ApazaAún no hay calificaciones
- Guia11 - Movimientos Menores PDFDocumento3 páginasGuia11 - Movimientos Menores PDFLucia Bocangel RuizAún no hay calificaciones
- GUIA 3 - Enfoque CVUDocumento4 páginasGUIA 3 - Enfoque CVUCielo FloridaAún no hay calificaciones
- INFORME 10: INDUCCIÓN ELECTROMAGNÉTICADocumento6 páginasINFORME 10: INDUCCIÓN ELECTROMAGNÉTICAdaryany medinaAún no hay calificaciones
- Examen FaseDocumento3 páginasExamen FaseJorge PumacotaAún no hay calificaciones
- Examen Ioi Seguna FaseDocumento2 páginasExamen Ioi Seguna FaseRodrigo Vilca SanchezAún no hay calificaciones
- Segundo Examen de Procesos IDocumento4 páginasSegundo Examen de Procesos IJoaquin AlvarezAún no hay calificaciones
- Ensayo de CharpyDocumento14 páginasEnsayo de CharpyJose Elias Ojeda HerreraAún no hay calificaciones
- Caso Productividad 02 PDFDocumento2 páginasCaso Productividad 02 PDFJuan LunaAún no hay calificaciones
- Informe 10 LectrotecniaDocumento9 páginasInforme 10 LectrotecniaNadia ApazaAún no hay calificaciones
- Práctica 5 - Ensayo Dureza BrinellDocumento14 páginasPráctica 5 - Ensayo Dureza BrinellAlessandra LazoAún no hay calificaciones
- Informe N°11-Diagrama BimanualDocumento8 páginasInforme N°11-Diagrama BimanualErnesto Vic Holg QuispeAún no hay calificaciones
- Examen Ing Plantas 5-12-2022Documento8 páginasExamen Ing Plantas 5-12-2022Giancarlo Rivas UAún no hay calificaciones
- Tratamientos TermicosDocumento4 páginasTratamientos Termicosdiego valenzuelaAún no hay calificaciones
- Informe Procesos LimadoDocumento12 páginasInforme Procesos LimadoNadia ApazaAún no hay calificaciones
- 3 Er Examen Est Trab CronometrajeDocumento1 página3 Er Examen Est Trab CronometrajeBrenda LuciaAún no hay calificaciones
- Ensayo BrinellDocumento8 páginasEnsayo BrinellRodrigo Calderon LopezAún no hay calificaciones
- Informe Laboratorio #7 - Procesos IndustrialesDocumento21 páginasInforme Laboratorio #7 - Procesos IndustrialesKathia Lucia Llamoca AranzamendiAún no hay calificaciones
- 0109 Ejercicios2 PDFDocumento1 página0109 Ejercicios2 PDFFrank Postigo SaxiAún no hay calificaciones
- Informe 7 FinalDocumento10 páginasInforme 7 Finalcesar canalesAún no hay calificaciones
- Estudio de TiemposDocumento7 páginasEstudio de Tiemposfernando miguel torres zevallosAún no hay calificaciones
- Magdalena Meza (Capacitancia)Documento5 páginasMagdalena Meza (Capacitancia)magdalenaAún no hay calificaciones
- Ingeniería Económica UCSMDocumento10 páginasIngeniería Económica UCSMFernando TorresAún no hay calificaciones
- Determinación de La Carga Electrica FundamentalDocumento9 páginasDeterminación de La Carga Electrica FundamentalFranco Salinas Vargas100% (1)
- Reporte 4Documento5 páginasReporte 4DENISSE PLATA ESPINOZAAún no hay calificaciones
- Coordenadas y ElevacionesDocumento9 páginasCoordenadas y ElevacionesLuna MndzAún no hay calificaciones
- Ejercicios Fluidos Links PDFDocumento5 páginasEjercicios Fluidos Links PDFLuna MndzAún no hay calificaciones
- E-050 - RM 406-2018-ViviendaDocumento47 páginasE-050 - RM 406-2018-ViviendaJhomaAún no hay calificaciones
- Porfidos ActualDocumento20 páginasPorfidos ActualLuna MndzAún no hay calificaciones
- Ejercicios de Ec. DiferencialesDocumento2 páginasEjercicios de Ec. DiferencialesLuna Mndz0% (1)
- Porfidos 2019Documento21 páginasPorfidos 2019Luna MndzAún no hay calificaciones
- Porfidos ActualDocumento20 páginasPorfidos ActualLuna MndzAún no hay calificaciones
- Aplicación Del Sistema Sin Rieles en Una Mina SubterráneaDocumento1 páginaAplicación Del Sistema Sin Rieles en Una Mina SubterráneaLuna MndzAún no hay calificaciones
- Trabajo MinasDocumento4 páginasTrabajo MinasLuna MndzAún no hay calificaciones
- Platon y AristotelesDocumento20 páginasPlaton y AristotelesLuna MndzAún no hay calificaciones
- DCL Reacción Cuerpo Rigidos 2d y 3dDocumento6 páginasDCL Reacción Cuerpo Rigidos 2d y 3dLuna MndzAún no hay calificaciones
- Norma Tecnica Peruana Tres 400.017Documento14 páginasNorma Tecnica Peruana Tres 400.017Cristhian Alonzo TsakimAún no hay calificaciones
- Aplicacion Del Sistema Sin Rieles MinasDocumento2 páginasAplicacion Del Sistema Sin Rieles MinasLuna MndzAún no hay calificaciones
- Norma Tecnica Peruana UnoDocumento10 páginasNorma Tecnica Peruana Unolamuerte2012100% (1)
- Cuestionario Final ParteDocumento2 páginasCuestionario Final ParteLuna MndzAún no hay calificaciones
- FormularioDocumento1 páginaFormularioLuna MndzAún no hay calificaciones
- Cuestionario Final MinasDocumento3 páginasCuestionario Final MinasLuna MndzAún no hay calificaciones
- Vamo PerúDocumento2 páginasVamo PerúLuna MndzAún no hay calificaciones
- Conexiones o Apoyos Estructuras ImportanteDocumento25 páginasConexiones o Apoyos Estructuras ImportantegeosnovaAún no hay calificaciones
- PreguntasDocumento1 páginaPreguntasLuna MndzAún no hay calificaciones
- Cuestionario Previo N°9Documento2 páginasCuestionario Previo N°9Luna MndzAún no hay calificaciones
- Pintura Indice PDFDocumento34 páginasPintura Indice PDFDennys OviedoAún no hay calificaciones
- Villegas MCDocumento287 páginasVillegas MCHuaman Chavez Jesus Angel100% (1)
- PRACTICA DE LABORATORIO N°12dfDocumento3 páginasPRACTICA DE LABORATORIO N°12dfLuna MndzAún no hay calificaciones
- PRACTICA DE LABORATORIO N°12dfDocumento3 páginasPRACTICA DE LABORATORIO N°12dfLuna MndzAún no hay calificaciones
- Historia Arquifinal2Documento32 páginasHistoria Arquifinal2Luna MndzAún no hay calificaciones
- Cultivo de ArvejaDocumento19 páginasCultivo de ArvejaMarcosAún no hay calificaciones
- Draft EnsayoDocumento2 páginasDraft EnsayoMora LudueñaAún no hay calificaciones
- Determinación de la actividad enzimática de la alfa amilasa vegetalDocumento4 páginasDeterminación de la actividad enzimática de la alfa amilasa vegetalJose David Medina Moreno50% (2)
- Compresores de Gas UDABOLDocumento18 páginasCompresores de Gas UDABOLHugo EscobedoAún no hay calificaciones
- Bayfolan 250 SLDocumento5 páginasBayfolan 250 SLAlexAún no hay calificaciones
- CAP.15 Estruccion y Estirado de MetalesDocumento28 páginasCAP.15 Estruccion y Estirado de MetalesRonald Gomez Orellana50% (4)
- Precesado de Jamon Curado y CocidoDocumento20 páginasPrecesado de Jamon Curado y CocidoWaleed V BreakerAún no hay calificaciones
- Evaluacion General Ciclo ViDocumento4 páginasEvaluacion General Ciclo ViDIEGO FELIPE GOMEZ MORALESAún no hay calificaciones
- Uve de GowinDocumento11 páginasUve de GowinRuth EvelynAún no hay calificaciones
- Especificaciones Técnicas AndenesDocumento6 páginasEspecificaciones Técnicas AndenesAlex CalderonAún no hay calificaciones
- SISTEMA HIDRÁULICO DE BAJO COSTODocumento7 páginasSISTEMA HIDRÁULICO DE BAJO COSTOAngel Cordova100% (2)
- Elaboración de mermelada de oca y manzanaDocumento152 páginasElaboración de mermelada de oca y manzanaSoledad Sayuri MendozaAún no hay calificaciones
- Verduras y FrutasDocumento10 páginasVerduras y FrutasCecilia Gabrieala Cajaleon ArizaAún no hay calificaciones
- Investigacion AzucarDocumento22 páginasInvestigacion AzucarLuz McCreeryAún no hay calificaciones
- Actividades Bloque V Quimica IDocumento15 páginasActividades Bloque V Quimica IVictor CoronaAún no hay calificaciones
- Electromagnetismo Capitulo 1Documento4 páginasElectromagnetismo Capitulo 1Mylomar NievaAún no hay calificaciones
- MAIZ MORADO-INTRODUCCION-ofDocumento5 páginasMAIZ MORADO-INTRODUCCION-ofJOHN SANTOSAún no hay calificaciones
- Nte Inen Iso 9229extractoDocumento7 páginasNte Inen Iso 9229extractoalialansitoAún no hay calificaciones
- Ejercicios SemiconductoresDocumento2 páginasEjercicios SemiconductoresIñaki García RodríguezAún no hay calificaciones
- Instrumentos y Materiales Utilizados para La Terapia EndodónticaDocumento14 páginasInstrumentos y Materiales Utilizados para La Terapia Endodóntica95Joel10Aún no hay calificaciones
- Ampicilina - Sulbactam, Polvo para Solución Inyectable 1,5 G.Documento11 páginasAmpicilina - Sulbactam, Polvo para Solución Inyectable 1,5 G.valeska ceaAún no hay calificaciones
- Manual diseño ducto GLPDocumento10 páginasManual diseño ducto GLPLitoju IngaAún no hay calificaciones
- Transcripción de Levitador MagnéticoDocumento4 páginasTranscripción de Levitador MagnéticoLuis VfAún no hay calificaciones
- Laboratorio 1 - QuimicaDocumento3 páginasLaboratorio 1 - QuimicaKaren Yubitza Cuzcano MoreyraAún no hay calificaciones
- Prueba isocronal modificada para determinar AOFDocumento11 páginasPrueba isocronal modificada para determinar AOFAnonymous mj1iTZIZ4Z100% (1)
- CorreasDocumento5 páginasCorreasJose Luis AnayaAún no hay calificaciones
- M1 T4 TextoDocumento23 páginasM1 T4 TextoHeinrichKrauseAún no hay calificaciones
- Unidad 4 InvestigacionDocumento16 páginasUnidad 4 InvestigacionJose Manuel ArmentaAún no hay calificaciones
- Medidores de FlujoDocumento24 páginasMedidores de FlujoLuis FrancoAún no hay calificaciones