Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Experiencia N°2 - LABO 3 INO
Cargado por
Alfredo IvanTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Experiencia N°2 - LABO 3 INO
Cargado por
Alfredo IvanCopyright:
Formatos disponibles
Experiencia N°2:
a) Observaciones experimentales:
Cuando realizamos la experiencia con mis compañeros de grupo de laboratorio, nos
percatamos que al momento de mezclar las 2 soluciones de NaOH y HCl en el
calorímetro preparado respectivamente con algunos de los instrumentos dados, el
color y la consistencia final no variaba a la vista normal, parecía como si fueran las
mismas soluciones.
La temperatura que variaba en cada mezcla sucesivamente era algo mínimo, casi
siempre tendía a 20°C, y la prof. de laboratorio presente nos dio la razón y nos dijo que
sería de 20°C, por lo cual si hubieran porcentajes de error, pues sería lo mínimo.
b) Diagrama de flujo:
(Deja 1 hoja para esto y mañana lo archivamos)
c) Ecuaciones Químicas:
La ecuación química que se usó en la experiencia actual fue:
NaOH(ac) + HCl(ac) -> NaCl(ac) + H2O(l) + calor
d) Cálculos y resultados:
Lo hallaremos por el Método de la Variaciones Continuas (MVC) o método de JOB.
La temperatura final aprox. en la cual ambas soluciones se mezclaban era: 20°C
Mezcla n° NaOH 0.8M HCl 0.2M Temperatura final (°C) Variación de temperatura (°C)
1 5 ml 45 ml 20 0
2 10 ml 40 ml 20.5 0.5
3 21 ml 29 ml 21 1
4 29 ml 21 ml 20.5 0.5
5 33 ml 17 ml 20 0
6 39 ml 11 ml 19.8 0.2
7 41 ml 9 ml 20 0
8 45 ml 5 ml 19.8 0.2
Mezcla n° XNaOH XHCl Reactivo Limitante Reactivo en Exceso
1 0.1 0.9 NaOH HCl
2 0.2 0.8 NaOH HCl
3 0.42 0.58 NaOH HCl
4 0.58 0.42 HCl NaOH
5 0.66 0.34 HCl NaOH
6 0.78 0.22 HCl NaOH
7 0.82 0.18 HCl NaOH
8 0.9 0.1 HCl NaOH
(Deja 1 hoja para archivar la hoja milimetrada con el gráfico y sus ecuaciones y el
punto y mañana lo juntamos)
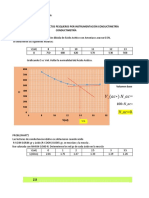
1.2
0.8
Variación de T
0.6
y = 1.1404x + 0.1294
y = -1.7513x + 1.5309
0.4
0.2
0
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
-0.2
XA
El punto estequiometrico igualando ambas ecuaciones es XA=0.48 y variación T=0.68
e) Explicación e interpretación de resultados:
Para desarrollar los cálculos teníamos que tener en cuenta que en la ecuación química
la proporción de ambas soluciones estaban de 1 a 1, por lo que hallamos la XA, y por
último las variaciones de temperatura que son pequeñas en la mayoría de casos.
Al tener ambas ecuaciones de las rectas, entonces podremos hallar dicho punto
estequiométrico igualando las 2 ecuaciones.
f) Observaciones finales:
Como vemos, en nuestro gráfico, nos salió una forma de “V” invertida, y por lo general
nos debería salir una “V” invertida, en lo que podemos apreciar que no hubo mucho
error experimental.
g) Comentarios y/o apreciaciones:
Para que nos pueda salir un gráfico bien, en cuanto a la parte experimental,
deberemos tomar en cuenta muchas cosas, ya sea en el tiempo en el cual haremos la
mezcla de ambas soluciones, tener en cuenta también el tiempo en el que estemos
haciendo esperar ambas soluciones antes de hacer dicha mezcla, etc.
h) Conclusiones:
El método que hemos usado, que es el MVC o JOB, nos muestra y ofrece resultados
muy precisos.
También podría gustarte
- Problemario de QuimicaDocumento60 páginasProblemario de QuimicaAlejandra González50% (2)
- Curva de TitulacionDocumento2 páginasCurva de TitulacionJONATHAN CASTILLEJOS LARAAún no hay calificaciones
- Balance de Materia y Energia Reklaitis Original PDFDocumento335 páginasBalance de Materia y Energia Reklaitis Original PDFCristian Diaz100% (1)
- Matriz de Evaluación de RiesgosDocumento1 páginaMatriz de Evaluación de RiesgosAlfredo IvanAún no hay calificaciones
- Articulo de Coeficientes de ActividadDocumento5 páginasArticulo de Coeficientes de ActividadYuriko BoringAún no hay calificaciones
- Práctica 10 QG2Documento5 páginasPráctica 10 QG2Daniel MeloAún no hay calificaciones
- Reporte No 1 - Constante Cinética y Orden de Reacción en Un Reactor BatchDocumento23 páginasReporte No 1 - Constante Cinética y Orden de Reacción en Un Reactor BatchJimena AlvaradoAún no hay calificaciones
- Informe Practica 10Documento7 páginasInforme Practica 10Roberto SánchezAún no hay calificaciones
- Metodo de Eficiencia de JOBDocumento5 páginasMetodo de Eficiencia de JOBJULIANA MARTINEZAún no hay calificaciones
- 2015 CineticaDocumento18 páginas2015 CineticaAnonymous JUZFQ6GAoAún no hay calificaciones
- Reporte p5 - Lab Qa1 - JCHC - JDRRDocumento8 páginasReporte p5 - Lab Qa1 - JCHC - JDRRDaniel RodriguezAún no hay calificaciones
- Practica Nro 5 InstrumentalDocumento5 páginasPractica Nro 5 InstrumentalAlvaro CalderonAún no hay calificaciones
- Cinetica QuimicaDocumento18 páginasCinetica QuimicajuanAún no hay calificaciones
- Ingeniería Quimica: Química AnalíticaDocumento12 páginasIngeniería Quimica: Química Analíticaangel gabrielAún no hay calificaciones
- Examfinqmc1206 22021 OficialDocumento7 páginasExamfinqmc1206 22021 OficialDANNER ARANIBARAún no hay calificaciones
- Copia de Calculos Del Laboratorio de Quimica 2Documento9 páginasCopia de Calculos Del Laboratorio de Quimica 2Rox ClienteAún no hay calificaciones
- Cinética de La Saponificación Del Acetato de Etilo en Medio BásicoDocumento4 páginasCinética de La Saponificación Del Acetato de Etilo en Medio BásicoDaniel Marcelo VelasquezAún no hay calificaciones
- Informe de Determinacion de La Constante de AcidezDocumento8 páginasInforme de Determinacion de La Constante de AcidezNadia AuzsaAún no hay calificaciones
- Practica10 Lab31Documento8 páginasPractica10 Lab31Dany BuendiaAún no hay calificaciones
- Remedial QuimicaDocumento11 páginasRemedial QuimicaYimi Salcedo AvilaAún no hay calificaciones
- Informe de Laboratorio - P6. Método de JobDocumento9 páginasInforme de Laboratorio - P6. Método de JobLuisa FernandaAún no hay calificaciones
- Potenciometría-Y-Titulación-Ácido Practica 2Documento5 páginasPotenciometría-Y-Titulación-Ácido Practica 2carlosAún no hay calificaciones
- Diagrame Los Resultados de Las Ganancias y Pérdidas de Peso Usando La Ecuación de Vant HoffDocumento3 páginasDiagrame Los Resultados de Las Ganancias y Pérdidas de Peso Usando La Ecuación de Vant HoffSaraMartinesAún no hay calificaciones
- Lab - QG II Repor Práctica 3Documento4 páginasLab - QG II Repor Práctica 3Ezequiel MedinaAún no hay calificaciones
- R - Curvas de TitulaciónDocumento5 páginasR - Curvas de TitulaciónDaniel Santana ReynaAún no hay calificaciones
- Tablas P4 BQDocumento1 páginaTablas P4 BQFernanda CabreraAún no hay calificaciones
- Práctica 12. Coeficiente de Difusión Efectivo en Un GelDocumento10 páginasPráctica 12. Coeficiente de Difusión Efectivo en Un GelItzel Daniela Solis TinocoAún no hay calificaciones
- Calcule La Concentración Del Persulfato de PotasioDocumento2 páginasCalcule La Concentración Del Persulfato de PotasioubaldoAún no hay calificaciones
- Problema 1Documento11 páginasProblema 1Jonathan Vargas100% (1)
- Práctica 3. Eq. Ác-Base PDFDocumento13 páginasPráctica 3. Eq. Ác-Base PDFJennifer GuadarramaAún no hay calificaciones
- Práctica II Equilibrio HeterogeneoDocumento10 páginasPráctica II Equilibrio HeterogeneoMarcela MoralesAún no hay calificaciones
- Informe Valoracion Potenciometrica Acido-BaseDocumento16 páginasInforme Valoracion Potenciometrica Acido-BasePaola Valverde100% (1)
- Informe Práctica 8Documento11 páginasInforme Práctica 8VALENTINA LOPEZ LOPEZAún no hay calificaciones
- Rerporte Practica1q4Documento15 páginasRerporte Practica1q4Daniel Josue Hernandez SalazarAún no hay calificaciones
- Acido Base IiDocumento13 páginasAcido Base IiZamira RiveraAún no hay calificaciones
- Práctica 8. Informe.Documento4 páginasPráctica 8. Informe.Janet QuirozAún no hay calificaciones
- Informe Método de JobDocumento4 páginasInforme Método de JobYojan HenaoAún no hay calificaciones
- Cálculos de ConductividadDocumento4 páginasCálculos de ConductividadRONDAN LOPEZ ELIAN PIEROAún no hay calificaciones
- Refraccion - MeyDocumento8 páginasRefraccion - MeyJose murciaAún no hay calificaciones
- Guia Problemas Qac 2018Documento24 páginasGuia Problemas Qac 2018Teresa MuchaAún no hay calificaciones
- Informe Experimento #13 Equilibrio de Tres ComponentesDocumento6 páginasInforme Experimento #13 Equilibrio de Tres ComponentesferiteAún no hay calificaciones
- Parcial #1.Documento7 páginasParcial #1.Deivis GutierrezAún no hay calificaciones
- CALORDocumento15 páginasCALORMariela CoyoAún no hay calificaciones
- Practica 8 BrisaDocumento10 páginasPractica 8 BrisaBRISA ESTEFANIA HERNANDEZ CARRILLOAún no hay calificaciones
- Cuantitativa 5Documento11 páginasCuantitativa 5Jean Pierre Cirilo SosaAún no hay calificaciones
- Informe 7 - AnaliticaDocumento18 páginasInforme 7 - AnaliticaTeffy LokitaAún no hay calificaciones
- Practica #08 Acidos y Bases en VolumetriaDocumento4 páginasPractica #08 Acidos y Bases en VolumetriamiguelringoAún no hay calificaciones
- Trabajo Final de Cáculo IIDocumento22 páginasTrabajo Final de Cáculo IILuis CoaquiraAún no hay calificaciones
- Diagrama de FaseDocumento9 páginasDiagrama de FaseJaider DeulufeutAún no hay calificaciones
- Reporte No 2 - Constante Cinética y Orden de Reacción en Un Reactor Batch A Distinta TemperaturaDocumento23 páginasReporte No 2 - Constante Cinética y Orden de Reacción en Un Reactor Batch A Distinta TemperaturaJimena AlvaradoAún no hay calificaciones
- Resultados - Pract4 - 1Documento7 páginasResultados - Pract4 - 1Chris QCAún no hay calificaciones
- Reporte 8 Coeficiente de Distribucion FiDocumento5 páginasReporte 8 Coeficiente de Distribucion FiJhonny MaraviAún no hay calificaciones
- Preg 4 AnalDocumento3 páginasPreg 4 AnalJULIUS JELIUSAún no hay calificaciones
- PRACTICA 3 FenomrnosDocumento14 páginasPRACTICA 3 FenomrnosZuñiga Vazquez LeonardoAún no hay calificaciones
- Inf. Nro 2-2019 - Res-Cues.Documento9 páginasInf. Nro 2-2019 - Res-Cues.Aylin JudithAún no hay calificaciones
- R. 6 GiiDocumento6 páginasR. 6 GiiGab OCAún no hay calificaciones
- Práctica N 6Documento3 páginasPráctica N 6Ja VikiõAún no hay calificaciones
- Practica Volumen Molar ParcialDocumento6 páginasPractica Volumen Molar Parcialdiego fernandezAún no hay calificaciones
- Informe 5Documento12 páginasInforme 5Brandon RodriguezAún no hay calificaciones
- Anlisis Intrumental Tare 11 ConducDocumento14 páginasAnlisis Intrumental Tare 11 ConducAndrea del AguilaAún no hay calificaciones
- L4 Mezcla Acetona - Cloroformo Con Tablas y GraficasDocumento10 páginasL4 Mezcla Acetona - Cloroformo Con Tablas y GraficasMinerva AguilarAún no hay calificaciones
- Reactor Químico. Gonzalez Garcia Diana ItzelDocumento7 páginasReactor Químico. Gonzalez Garcia Diana ItzelHorus CastilloAún no hay calificaciones
- Tarea Problema Agitacion B EDocumento2 páginasTarea Problema Agitacion B EAlfredo IvanAún no hay calificaciones
- Informe Lab #1 Agitación - Grupo FDocumento43 páginasInforme Lab #1 Agitación - Grupo FAlfredo IvanAún no hay calificaciones
- Taller Práctico 2 PS PI555A Grupo XXDocumento1 páginaTaller Práctico 2 PS PI555A Grupo XXAlfredo IvanAún no hay calificaciones
- SocratesDocumento4 páginasSocratesAlfredo IvanAún no hay calificaciones
- Estoicismo Listo Pa EntregarDocumento21 páginasEstoicismo Listo Pa EntregarAlfredo IvanAún no hay calificaciones
- Sem 7 - Creacion y Aniquilacion de ParesDocumento11 páginasSem 7 - Creacion y Aniquilacion de ParesAlfredo IvanAún no hay calificaciones
- (536796440) Evaluacion Final Proyecto Termodinamica (1) .Documento10 páginas(536796440) Evaluacion Final Proyecto Termodinamica (1) .cleotizo100% (1)
- Trabajo de Investigacion de QuimicaDocumento3 páginasTrabajo de Investigacion de Quimicachucho 21120% (1)
- Los Gases y Las Leyes de Los GasesDocumento28 páginasLos Gases y Las Leyes de Los GasesNany HeddrichAún no hay calificaciones
- Cuarto Año 1er Trimestre Q-IiiDocumento21 páginasCuarto Año 1er Trimestre Q-IiiFRANCELYAún no hay calificaciones
- Silabo - Quimica Inorganica - 100826 - Ma-Epia - 2022-1 Ing. Roxana Aparicio-VfDocumento10 páginasSilabo - Quimica Inorganica - 100826 - Ma-Epia - 2022-1 Ing. Roxana Aparicio-VfAna Maria Hernandez FarfanAún no hay calificaciones
- Temario 1,2,3 SecundariaDocumento5 páginasTemario 1,2,3 SecundariajoseAún no hay calificaciones
- Informe de La Obtencion de Gas de SintesisDocumento16 páginasInforme de La Obtencion de Gas de SintesisCristianRivasMatiasAún no hay calificaciones
- Practica No. 5Documento10 páginasPractica No. 5Carolina BurneoAún no hay calificaciones
- Estequiometria (Ejercicios) - 3er AñoDocumento2 páginasEstequiometria (Ejercicios) - 3er AñoYonel Chumbes VeramendiAún no hay calificaciones
- Banco Qui MicaDocumento9 páginasBanco Qui MicaE HernándezAún no hay calificaciones
- Temario Quimica 2 Bachillerato ValenciaDocumento11 páginasTemario Quimica 2 Bachillerato ValenciaMerche García SáezAún no hay calificaciones
- Indicadores Estequiometricos Basados en Una Reaccion Quimica PDFDocumento28 páginasIndicadores Estequiometricos Basados en Una Reaccion Quimica PDFVirginia DavisAún no hay calificaciones
- Apuntes Reacciones Químicas 4º ESODocumento17 páginasApuntes Reacciones Químicas 4º ESOkacperkrukowski2018Aún no hay calificaciones
- Cuadernillo de Ejercicios de Estequiometría Química MetalúrgicaDocumento2 páginasCuadernillo de Ejercicios de Estequiometría Química MetalúrgicaMartha MartínezAún no hay calificaciones
- Grupo 7b Informe n0 3 Estequiometria de Una ReaccionDocumento29 páginasGrupo 7b Informe n0 3 Estequiometria de Una ReaccionALATA GARCIA JOSE MANUEL MAXAún no hay calificaciones
- Química General (ICI-113) Facultad de Ingeniería Universidad de ValparaísoDocumento9 páginasQuímica General (ICI-113) Facultad de Ingeniería Universidad de ValparaísocarlosmcdAún no hay calificaciones
- Guía 2022-1 QuímicaDocumento54 páginasGuía 2022-1 QuímicaJesus MontiAún no hay calificaciones
- Método Por PrecipitaciónDocumento5 páginasMétodo Por PrecipitaciónKevin CarlosAún no hay calificaciones
- Relación Estequiometría Por CategoríasDocumento8 páginasRelación Estequiometría Por Categoríasraultrevelez9876Aún no hay calificaciones
- Tarea Semana 11Documento4 páginasTarea Semana 11Fabricio SacaAún no hay calificaciones
- Estequiometría Parte 1Documento16 páginasEstequiometría Parte 1Jesse LopezAún no hay calificaciones
- Pap de Química de 3 Periodo 10°Documento6 páginasPap de Química de 3 Periodo 10°Quimica Sebastiana0% (1)
- Ejercicios de Ecuaciones Velocidad LevenspielDocumento2 páginasEjercicios de Ecuaciones Velocidad LevenspielAyleen MayorgaAún no hay calificaciones
- Estequiometria ResueltosDocumento54 páginasEstequiometria ResueltosJorge Canales Niño-deGuzmán100% (8)
- Bases TeóricasDocumento3 páginasBases TeóricasRonal QuispeAún no hay calificaciones
- EstequiometriaDocumento35 páginasEstequiometriaCarlos Rubio VAún no hay calificaciones
- Relaciones EstequiometricasDocumento11 páginasRelaciones EstequiometricasnelialkysAún no hay calificaciones
- Importancia de Las Reacciones QuímicasDocumento10 páginasImportancia de Las Reacciones QuímicasValeriita Marisol BasantesAún no hay calificaciones