Documentos de Académico
Documentos de Profesional
Documentos de Cultura
La Homeostasis Del Hierro y Una Hormona - La Hepcidina PDF
Cargado por
Anonymous YIvVKHTR0TDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
La Homeostasis Del Hierro y Una Hormona - La Hepcidina PDF
Cargado por
Anonymous YIvVKHTR0TCopyright:
Formatos disponibles
20
REVISIN BIBLOGRFICA
La homeostasis del hierro y una hormona: la hepcidina.
Yubire Barrios1, Edgar Acosta1, Milagros Espinoza2, Andrena Melndez1, Daliana Mndez1
RESUMEN
ABSTRACT
La hepcidina es un pptido, procedente del gen HAMP, rica en cisteina, producida en el hgado y considerada como un elemento clave
en la regulacin de la absorcin y cintica del hierro en el organismo. Por esta razn, se le ha dado un valor de primer orden en la
homeostasis del hierro, lo que ha permitido definir su sobrecarga,
por el dficit y la anemia inflamatoria por el exceso. La sntesis de
hepcidina por los hepatocitos, se inicia tras la liberacin de citoquinas en los sinusoides hepticos, activados por microorganismos y/o
saturacin elevada de transferrina, y adems inhibe la absorcin
del hierro en el duodeno y su liberacin por los macrfagos. Esta
molcula se presenta como una candidata atractiva como mediadora en la anemia de los procesos crnicos y en otros trastornos del
metabolismo frrico, lo que le confiere un futuro prometedor en el
diagnstico y tratamiento de estos estados patolgicos. Esto lleva
a admitir la hiptesis de que la hemocromatosis es una enfermedad
endocrina, en la que la insuficiente produccin de hepcidina por el
hgado provoca una hiperabsorcin crnica de hierro por parte del
intestino, con la consecuente sobrecarga de hierro. Por consiguiente, se propone la utilizacin de hepcidina, de sus agonistas o de
sustancias que estimulen su produccin, como posible tratamiento
de las enfermedades que cursen con sobrecarga de hierro, tanto
primaria como secundaria. Contrariamente, los antagonistas de la
hepcidina, podran ser utilizados en el tratamiento de las anemias
inflamatorias, resistentes frecuentemente a eritropoyetina.
Hepcidin is a cystein-rich peptide from the HAMP gene. It is produced
in the liver and is considered as a key element in the regulation,
absorption and kinetics of iron in the organism. For this reason, it
has been recently given preferential value in iron homeostasis. This
has permitted to define iron overcharge due to hepcidin deficit, and
inflammatory anemia due to excess of it. Hepcidin synthesis by
epatocytes begins after liberation of cytokines in the hepatic sinusoids,
activated by microorganisms and/or by an elevated saturation of
transferrin. It also inhibits iron absorption in the duodenum and its
liberation by macrophages. This molecule looks as an attractive
candidate as a mediator in anemia due to chronic processes and in
other dysfunctions of ferric metabolism, which confers it a promising
future for the diagnosis and treatment of such pathologic conditions.
This leads to admit the hypothesis that hemochromatosis is an
endocrine disease. In this pathology insufficient production of
hepcidin by the liver causes a chronic hyperabsortion of iron
from the intestine, resulting in an iron overcharge. Consequently,
the use of hepcidin, its agonists or other substances that stimulate
its production, are suggested for the treatment of disorders resulting
from excess of primary or secondary iron. Inversely, hepcidine
antagonists could be used in the treatment of inflammatory anemias,
which are often resistant to erithropoyetin.
Palabras claves: Homeostasis del hierro, hepcidina, anemia,
hemocromatosis, inflamacin.
Iron homeostasis and a hormone: hepcidin
Key Words: Iron homeostasis, hepcidin, anemia, hemochromatosis, inflammation.
INTRODUCCIN
Universidad de Carabobo. Facultad de Ciencias de la Salud.
Escuela de Bioanlisis-Carabobo.
Departamento de Ciencias Bsicas.
Universidad de Carabobo. Facultad de Ciencias de la Salud.
Escuela de Bioanlisis-Carabobo.
Departamento de Investigacin y Desarrollo Profesional
Correspondencia: Y. Barrios
E-mail: ybarrios1@uc.edu.ve, eacosta1@uc.edu.ve,
mespinoza@uc.edu.ve
Tel.: +58-412-3407110;
+58-412-8897353; +58-414-1427780
Recibido: Marzo 2007
Aceptado: Junio 2007
El hierro es un elemento esencial para los organismos vivientes. En soluciones acuosas puede encontrarse en dos estados de oxidacin estables conocidos como ferroso (Fe+2) y frrico (Fe+3), propiedad que le permite participar en reacciones
que abarcan gran parte de la bioqumica. En el organismo, el
hierro se encuentra formando parte de dos compartimientos:
uno funcional y otro de depsito. El transporte de hierro unido
a transferrina permite el intercambio del metal entre ambos
compartimientos, mientras que su exceso se deposita intracelularmente como ferritina o hemosiderina (1). En condiciones
fisiolgicas, el hierro se encuentra asociado a una protena,
ya que su presencia en forma aislada puede producir daos
graves en los tejidos. Esta toxicidad se debe a la habilidad del
hierro libre de generar especies reactivas de oxgeno. Dado
que tanto la deficiencia como la sobrecarga de este metal
esencial son perjudiciales, su absorcin, concentracin y estado redox deben ser regulados cuidadosamente (2,3,4,52).
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
La homeostasis del hierro y una hormona: la hepcidina.
Hasta hace unos aos, solamente se conocan tres protenas
que intervenan en el metabolismo de este mineral, ellas eran
la transferrina, la ferritina y el receptor de la transferrina (5).
Sin embargo, en los ltimos aos, la visin clsica del metabolismo del hierro, ha cambiado, debido al uso de las tcnicas
de biologa molecular y del uso de modelos de animales transgnicos o genticamente modificados, que han hecho que
se hayan descubierto nuevas molculas que participan en la
homeostasis del mismo, como es el caso, del receptor de la
transferrina 2, el transportador de los metales divalentes 1, la
protena ferroportina-1, la hefaestina, el citocromo b duodenal
(CITB-D), la protena HEF, la hemojuvelina, y la que probablemente sea la ms interesante de todas, la hepcidina (6,7,53).
La hepcidina y su estructura. El gen localizado en el cromosoma 19, codifica un propptido de 84 aminocidos (aa) del
que por accin enzimtica derivan las formas activas C-terminal con 20, 22 y 25 aa que son ricos en cisteina. La hepcidina
mayor es un pptido catinico con 25 aa y 4 puentes de disulfuro que unen los 8 residuos de cistena y que determinan su
actividad en los 17 aa que delimitan (5,7,8). Fue denominada
as en el 2000 al aislarse en orina y plasma humano, y un ao
ms tarde se correlacion en el metabolismo del hierro junto
a otros genes y protenas, por lo que recientemente se le ha
dado un valor de primer orden en la homeostasis de este mineral, lo que ha permitido definir la sobrecarga de hierro por su
dficit y la anemia inflamatoria por su exceso (3, 4,10,53).
Como se ha reportado por espectrometra de resonancia magntica nuclear (8), la hepcidina es una lmina torcida beta (),
rica en ocho aa de cisteina, con una vuelta de espiral simple,
cuyos brazos estn unidos por cuatro puentes de disulfuro,
cuya configuracin se asemeja a una escalera. Existe adems, una unin disulfrica inusual entre dos cisteinas adyacentes al final del espiral del pptido, cuya caracterstica llama
la atencin dado que quizs podra relacionarse con su funcin antimicrobiana. Ahora bien, al comparar esta unin con
los de los puentes de disulfuro comunes, se observa que es
tensa y podran tener una gran reactividad qumica. Estos estudios estructurales tambin han indicado que la hepcidina de
20 aa, existe como un monmero en solucin, mientras que la
hepcidina de 25 aa, forma con facilidad agregados (8,9).
Por otra parte, el gen de la hepcidina en humanos (HAMP)
est localizado en el brazo largo del cromosoma 19 (19q13),
como ya se mencion (25,26). El HAMP de 2,5 kb contiene
dos intrones, tres exones y transcribe un ARNm de 0,4 kb, que
es trasladado al aminocido 84 del precursor de la hepcidina.
En el humano solo hay una copia del gen, mientras que en
los ratones hay dos genes duplicados conocidos como hepc1
y hepc 2, que se encuentran en el cromosoma 7. La porcin
de la hepc1 y de la hepc2 tienen homologa con la hepcidina
humana de un 58% al 76% respectivamente. Segn estudios,
la hepc 2 no est relacionado con el metabolismo del hierro y
probablemente tenga alguna otra funcin (9-13).
21
Sntesis y degradacin de la hepcidina: La hepcidina se
expresa predominantemente en el hgado, pero una baja expresin ha sido detectada en el rin, corazn, msculo esqueltico y cerebro. Otra secuencia se puede detectar tambin en el pulmn, testculos, estmago y pncreas (14)
Es sintetizada en los hepatocitos, como una prohormona
conocida como prohepcidina, tras la liberacin de las citoquinas en los sinusoides hepticos activados por los microorganismos y/o la saturacin elevada de la transferrina, dividindose en el pptido catinico respectivo y transportado al
torrente sanguneo a travs de la membrana basolateral del
hepatocito (11,14). La exacta localizacin del proceso final
que sufre la prohormona para convertirse en propptido es
desconocido, podra ocurrir en la sangre, en las membranas
celulares o en los capilares (15).
Uno de los factores que intervienen en la sntesis de esta
hormona son la anemia y la hipoxia (16,54) y hasta ahora,
no hay informacin confiable disponible de los niveles normales de la hepcidina como pptido de 20, 22 y 25 aa. No
obstante, concentraciones sricas fcilmente detectables de
la prohepcidina o del propptido de 84 aa es de 106 ng/mL
en pacientes sanos (15).
En estados de anemia, la concentracin de la hemoglobina
y el transporte de oxgeno a los tejidos disminuye, lo que
trae como consecuencia la hipoxia, la cual produce a su
vez, una disminucin en la sntesis de la hepcidina, debido
a que muchas enzimas en las rutas de utilizacin del oxgeno son dependientes del hierro (16,54). Por lo tanto, la
sntesis de la hepcidina pudiera reflejar el contenido total
de hierro corporal (17), debido a que la saturacin de la
transferrina (Tf) con hierro, es considerado una seal clave
que refleja la cantidad de depsitos corporales de hierro.
En este sentido, de acuerdo a la mayora de las hiptesis
generadas (18), la sntesis de la hepcidina es regulada en
respuesta a la saturacin de transferrina, por una seal en
cascada por parte de una protena llamada HEF, que se
encuentra en la superficie de las clulas.
Bajo un exceso de hierro, la transferrina se encuentra altamente saturada de este y no compite con la protena HEF,
por lo que esta ltima en su forma libre, impulsa una cascada
de seales que conlleva a incrementar la sntesis de la hepcidina. Ahora bien, en la deficiencia de hierro donde la saturacin de la transferrina es baja, la mayora de protenas HEF
estn unidas a los receptores de la transferrina y ninguna
seal es trasmitida al ncleo celular para que ocurra la sntesis de la hepcidina. Consecuentemente, esto puede explicar,
el porqu en la hemocromatosis causada por las mutaciones
en los genes que codifican a la protena HEF, hay una paradjica cada en la sntesis de la hepcidina, a pesar de existir
un alto contenido de hierro en los depsitos (19).
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
22
Yubire Barrios, Edgar Acosta, Milagros Espinoza, Andrena Melndez, Daliana Mndez
Mecanismo de accin de la hepcidina. Publicaciones recientes (17, 19), revelan conjuntamente, una relacin interesante entre la hepcidina y otra molcula del metabolismo del
hierro, llamada ferroportina-1 (FPN-1), que tambin funciona
como receptor de la hepcidina (20-22). La FPN-1 es una protena transmembrana, que se localiza en la superficie basolateral del enterocito, de donde transporta al hierro en estado
ferroso, del interior de la clula a la circulacin portal. Asimismo, la FPN-1 se expresa en gran cantidad en macrfagos
reticuloendoteliales del hgado, bazo y mdula sea, lo que
sugiere que esta protena interviene como un transportador
del hierro en las clulas que reciclan el hierro, a partir de los
glbulos rojos envejecidos (23).
La homeostasis del hierro y la hepcidina. La homeostasis del hierro a nivel del organismo, se basa en un estricto
control, tanto de la absorcin intestinal del mineral, como
del reciclaje de este, por los macrfagos. En este sentido,
se plantea que la comunicacin entre las reservas hepticas de hierro, los enterocitos duodenales y los macrfagos,
est mediada por la hepcidina (27), lo que ha generado que
a esta hormona se le asigne un valor de primer orden en
el metabolismo del hierro, que ha permitido definir en primer lugar la sobrecarga del hierro, cuando hay un dficit
de hepcidina, como por ejemplo en la hemocromatosis y
en segundo lugar, la anemia inflamatoria, cuando exista un
exceso de la misma (11).
Por otra parte, la hepcidina inhibe la salida del hierro de la
clula debido a que se fija a la FPN-1, e induce su internalizacin en la clula y luego su degradacin lisosomal, trayendo
como resultado que el hierro en su estado ferroso, se quede
en el interior de los enterocitos y macrfagos y consecuentemente, la absorcin y movilizacin de los depsitos de hierro
provenientes del hgado y de los macrfagos se reduzcan,
causando disminucin del hierro disponible a nivel srico, lo
que podra traducirse en una anemia por deficiencia de hierro (24). En contraposicin, si los niveles de hepcidina son
bajos, la absorcin de hierro se incrementa, lo que genera
en una enfermedad severa de sobrecarga de hierro, llamada
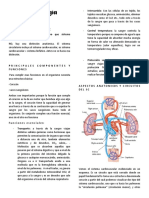
hemocromatosis juvenil, la cual es causada por una mutacin en el gen de la hepcidina humana (25,26,52). Fig. 1
La implicacin de la hepcidina en el metabolismo del hierro,
fue sugerida inicialmente por el aumento del ARNm heptico de este pptido durante una sobrecarga del hierro y que
inhibe la absorcin de hierro en el duodeno y su liberacin
por los macrfagos (11). As como la eliminacin urinaria
de hepcidina, est aumentada en pacientes con sobrecarga de hierro, infecciones y enfermedades inflamatorias y se
correlaciona con los niveles sricos de ferritina que dispone, respondiendo as a los niveles totales de hierro corporal
(11,12,14,28,29,30,31).
La hemocromatosis y la hepcidina. La hemocromatosis es
una enfermedad gentica, frecuente en la poblacin humana de origen caucsico, la cual se define como un trastorno
hereditario del metabolismo del hierro, que condiciona un aumento de su absorcin intestinal y posterior depsito progresivo en clulas parenquimatosas (32). Se han identificado,
durante las ltimas dcadas los genes especficos responsables de esta patologa, cuya forma clnica ms frecuentes
corresponde a la tipo 1, debido a mutaciones del gen HEF,
siendo sta autosmica recesiva y predominante descrita en
el adulto del sexo msculino (31).
La hepcidina participa en la patognesis de la hemocromatosis tipo 1 y se ha descrito que el dficit del gen HEF determina
una produccin insuficiente de este pptido y puede modular
adems, la expresin de otros genes y mutaciones en el resto
de las enfermedades con sobrecarga de hierro no asociadas
al gen HEF (12,35), por lo que se concluye que ambos genes
y este pptido pudieran estar relacionados (25).
Fig. 1: La hepcidina es un pptido, producto del gen HAMP,
producido por las clulas hepticas en respuesta a la infeccin y
a la sobrecarga de hierro. La Hemojuvelina, la proteina HEF y el
receptor 2 de la transferrina (TfR2) tambin contribuye a aumentar la
produccin de la hepcidina. Esta frena el paso de hierro a travs de
los enterocitos (absorcin intestinal) y la salida de hierro presente en
los macrfagos. El hierro de estas clulas procede de la degradacin
de los hemates viejos fagocitados por estas. Se ha sugerido que
estos efectos los realiza la hepcidina para internalizar en las clulas
la ferroportina-1 (FP-1) (25,26,56).
Se han identificado adems, otro tipo de esta enfermedad, de
carcter autosmica recesiva, pero debida a mutaciones en un
gen no identificado, localizado en el cromosoma 1q de la hepcidina, que en pacientes homocigotos causa un fenotipo ms
severo que determina una nueva forma de hemocromatosis juvenil, conocida como tipo 2, que afecta tanto a mujeres, como
a hombres en etapa juvenil (36,37). Ahora bien, se han localizado adems mutaciones menos frecuentes, como las observadas en el receptor 2 de la transferrina (TfR2), que causan un
fenotipo similar a la de tipo 1, descrita como la tipo 3. Otro tipo
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
La homeostasis del hierro y una hormona: la hepcidina.
de hemocromatosis encontrada, es la tipo 4, que difiere de las
otras, dado que causa una sobrecarga de hierro en las clulas
de Kupffer, y se caracteriza por ser dominante autosmica, debido a mutaciones del gen de la ferroportina (38).
Con el descubrimiento de la hepcidina, se ha esclarecido
la causa de las diferentes formas de hemocromatosis, que
quizs puedan deberse a alteraciones de la estructura o
de la sntesis de esta hormona, ya que conociendo que el
dficit de la misma, asociado al del gen HEF, contribuye
a la sobrecarga de hierro (11,39,40,41), al mismo tiempo
que el reestablecimiento de su produccin en ratones con el
gen HEF inactivado, evita el depsito del mineral, se admite
entonces, la hiptesis de que la hemocromatosis es una
enfermedad endocrina, en la que la insuficiente produccin
por parte del hgado de la hepcidina, provoca una hiperabsorcin crnica de hierro por el intestino y por lo tanto, una
sobrecarga del mismo, indicando a su vez que el gen HEF
se requiere para la regulacin normal de la sntesis de la
hepcidina (40). No obstante, en la sobrecarga de hierro de
tipo no gentica adquirida, debido a transfusiones frecuentes, la sntesis y la excrecin de la hepcidina por la orina, se
encuentra aumentada (41).
La anemia inflamatoria y la hepcidina. La anemia inflamatoria, ligada a enfermedades crnicas, es la segunda
causa de anemia por la prdida de hierro, y se origina como
consecuencia de la activacin de citoquinas que median
la respuesta inflamatoria e inmune, lo que ocasiona una
disminucin de la disponibilidad del hierro para la eritropoyesis (30,42,43). En este sentido, recientemente se ha
definido a la hepcidina como un reactante de fase aguda
tipo II, mediador de la anemia inflamatoria y de la inmunidad innata (11,43).
Por otra parte, se ha descrito que en pacientes con hepcidinomas, es decir, con adenoms hepticos que segregan
hepcidina de forma inapropiada, suelen cursar con una anemia hipocrmica de tipo inflamatorio, por deficiencia de hierro, la cual se resuelve espontneamente tras la reseccin
de los adenoms (34).
Se han publicado trabajos en los ltimos aos (41), que
han revelado la importancia de estudiar la relacin existente, entre la hepcidina y las citoquinas. Estudios posteriores,
han demostrado que la interleuquina 6 (IL-6) se encuentra
asociada con la produccin de la hepcidina (43,45,46). Karsume y cols, demostraron que la IL-6 acta directamente
en los hepatocitos para estimular la produccin de la hepcidina. Asimismo, explicaron que los anticuerpos que actan
en contra de la IL-6 bloquean la induccin de la hepcidina y
que otras citoquinas inflamatorias, como el caso del factor
de necrosis tumoral (TNF-), no estimulan la produccin de
esta hormona (47).
23
Otras implicaciones fisiolgicas de la hepcidina. Investigaciones al respecto, demuestran que esta hormona tiene
actividad antifngica y antimicrobiana, muy parecida a los
pptidos antimicrobianos ricos en cisteinas involucrados en
la defensa y proteccin del husped (9,10,47). La hepcidina
regula adems, los niveles de hierro srico de pacientes con
cncer (42), esto se explica, debido a que bajo esta condicin patolgica, las concentraciones de hepcidina se elevan,
lo que conduce a la disminucin de las concentraciones del
hierro srico, permitiendo as la invasin de las clulas tumorales (45,47).
Se ha demostrado igualmente, que el rin est envuelto en
la homeostasis del hierro y en este sentido, recientemente
se ha desarrollado estudios de gran inters que han permitido relacionar los indicadores del metabolismo del hierro y
la hepcidina, en pacientes hemodializados con insuficiencia
renal, observndose que las concentraciones sricas de la
hepcidina en el suero de estos pacientes, aumentan cuando
declina su funcin renal (48,49,53).
Aplicaciones mdicas. Las concentraciones de hepcidina
srica y urinaria, pueden ser indicadores valiosos de anemia
por deficiencia de hierro o en el diagnstico de la hemocromatosis (49). Este parmetro puede fiablemente reflejar la
cantidad total de hierro corporal y podra complementar el
diagnstico, al utilizarse junto con otras determinaciones sricas, tales como hierro, ferritina, el receptor de transferrina y
el porcentaje de saturacin de ste. En concordancia con lo
anterior, al considerar a la hepcidina y a drogas relacionadas,
como un posible tratamiento, se ha comprobado que la misma es efectiva, tanto para los casos de deficiencia de hierro,
como en el de sobrecarga (19).
La hemocromatosis juvenil es tratada actualmente por flebotoma, pero posiblemente esta terapia podra ser complementada con un reemplazo de la hepcidina, usando bien sea
este mismo pptido, o un agonista de la misma. Asimismo, la
droga a base de hepcidina, podra tambin prevenir o corregir la sobrecarga de hierro observada en esta patologa, as
como en otras formas de sobrecarga de hierro (19).
En pacientes anmicos con insuficiencia renal crnica, donde la produccin de eritropoyetina es deficiente, los antagonistas de la hepcidina podran ser de gran utilidad como suplemento de la terapia con eritropoyetina, especialmente en
pacientes con una respuesta baja a la eritropoyetina recombinante (45). En este mismo orden de ideas, la sobreproduccin de hepcidina tiene un rol clave en la fisiopatologa de la
anemia durante la inflamacin y las enfermedades crnicas,
por lo que el desarrollo de un antagonista de la hepcidina podra jugar un papel importante, para el tratamiento de estas
enfermedades, por facilitar la redistribucin del hierro de los
macrfagos o eritroblastos, ya que al estar bloqueada la hepcidina, los depsitos corporales de hierro podran ser movili-
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
24
Yubire Barrios, Edgar Acosta, Milagros Espinoza, Andrena Melndez, Daliana Mndez
zados. Conjuntamente, estos antagonistas tambin podran
ser utilizados como terapia de suplementacin (19).
En relacin a los procesos inflamatorios donde la hepcidina
causa hipoferremia, sera lgico predecir que la inhibicin
de la expresin gentica de esta hormona o de su actividad,
pudiese mejorar la anemia por inflamacin. Pero esto sera
ventajoso quizs, particularmente en desrdenes inflamatorios no infecciosos (36,50), no siendo as, en procesos
infecciosos y malignos, dado que la disminucin del hierro
srico, contribuye con la invasin de patgenos y de clulas tumorales, por lo que en este caso la hepcidina pudiese
desempear su funcin antimicrobiana. Es por esta razn,
que si los antagonistas de la hepcidina estuviesen disponibles, deberan ser requeridas a la industria farmacutica,
cuidadosas pruebas para lograr definir las indicaciones de
sus usos.
BIBLIOGRAFA
1.
Crichton RR, Wilmet S, Legssyer R y Ward RJ. Molecular
and cellular mechanisms of iron homeostasis and toxicity in
mammalian cells. J Inorg Biochem 2002; 91: 9-18.
2.
Roy CN y Enns CA. Iron homeostasis: new tales from the crypt.
Blood 2000; 96(13): 4020-7.
3.
Meneghini, R. Iron homeostasis, oxidative stress, and DNA
damage. Free Radic Biol Med 1997; 23: 783-792.
4.
Gonzlez, B y Demple, B. Genetic responses to free radicals.
Homeostasis and gene control. Ann NY Acad Sci 2000; 899:
69-87.
5.
Forrellat BM, Gautier du Dfaix GH y Fernndez DN. Metabolismo del hierro. Rev Cubana Hematol Inmunol Hemoter
2000;16(3):149-60
6.
Cazzola, M. Novel genes, proteins and inherited disorders of
iron overload: iron metabolism is less boring than thought. Haematologica 2002; 87 (2):115-6.
7.
Beaumont, C. Molecular mechanisms of iron homeostasis. Med
Sci 2004; 20 (1):68-72.
8.
Brissot P, Troadee MB y Loreal O. The clinical relevance of new
insights in iron transport and metabolism. Curr Hematol Rep
2004; 3 (2):107-15.
9.
Hunter HN, Fulton DB, Ganz T y Vogel HJ. The solution
structure of human hepcidin, and peptide hormone with
antimicrobial activity that is involved in iron uptake and
hereditary hemochomatosis. J Biol Chem 2002; 277:
37597-37603.
10. Park CH, Valore EV, Waring AJ y Ganz T. Hepcidin, an urinary
antimicrobial peptide synthesized in the liver. J Biol Chem 2001;
276: 7806-7810.
11. Krause A, Neitz S, Mgert HJ, Schultz A, Forssmann WG,
Schulz-Knappe P y Aderman K. LEAP-1, a novel highly
disulfide-bonded human peptide, exhibits antimicrobial
activity. FEBS Letters 2000; 480: 147-150.
12. Ganz, T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood 2003; 102: 783-8.
14. Lou G, Nicolas JC, Lesbordes L, Viatte G, Grimber M.F,
Szanjnert T et al. Functional differences between hepcidin
1 and 2 in transgenic mice. Blood 2003;103: 2816-2821.
15. Pigeon C, Ilyin G, Courselaud B, Leroyer P, Turlin B, Brissot
P y Loreal O. A new mouse liver-specific gene, encoding a
protein homologous to human antimicrobial peptide hepcidin,
is overexpressed during iron overload. J Biol Chem 2001;
276:7811-19.
16. Kulaksiz G, Gehrke A., Janetzko D, Rost T, Bruckner B,
Kallinowski D et al. Pro-hepcidin: Expresin and cell specif
localisation in the liver and its regulation in hereditary
haemochromatosis, chronic renal insufficiency and renal
anaemia. Gut 2004; 53:735-43.
17. Nicolas G, Chauvet L, Viatle JL, Danan X, Bigard N, Devaux I
et al. The gene enconding the iron regulatory peptide hepcidin
is regulated by anemia, hypoxia and inflammation. J Clin Invest
2002; 110:1037-44.
18. Safran M. y Kaelin WG. HIF hydroxylation and the mammalian
oxygen-sensing pathway. J Clin Invest 2003; 111:779-83.
19. Frazer DM. y Anderson GJ. The orchestration of body iron
intake: How and where do enterocytes receive their cues?.
Blood Cells Mol Dis 2003; 30(3):288-97.
20. Vyoral D y Petrak J. Hepcidina: A direct link between iron
metabolism and immnunity. Int J Biochem Cell Biol 2005;
37:1768-1773.
21. Nemeth MS, Tuttle J, Powelson MB, Vaughn A, Donovan B,
Ward DM. et al. Hepcidin regulates iron efflux by binding to
ferroportin and inducing its internalization. Science 2004; 306
(5704):2090-3.
22. McKie AT, Marciani P y Rolfs A. A novel duodenal iron-regulated
transporter, IREG1, implicated in the basolateral transfer of iron
to the circulation. Mol Cell 2000; 5(2): 299-309.
23. Frazer DM, Wilkins SJ y Becker EM. Hepcidin expression
inversely correlates with the expression of duodenal iron
transporters and iron absorption in rats. Gastroenterology
2002; 123(3): 835-44.
24. Rivera S, Nemeth E, Gabayan V, Lopez MA, Farshidi D y
Ganz T. Synthetic hepcidin causes rapid dose-dependent
hypoferremia and is concentrated in ferroportin containing.
Blood 2005; 106(6): 2196-9.
25. Knutson MD, Oukka LM, Koss F, Aydemir C y Wessling R. Iron
release from macrophages alter erythrophagocytosis is up regulated by ferroportin 1 overexpression and down-regulated
by hepcidin. Proc Natl Acad Sci USA 2005; 102:1324-28.
26. Nicolas G, Kahn A y Vaulont S. Lhepcidine, chef dorchestre de
lhomostasie du fer. Presse Med 2003; 32: 1395-96.
27. Loreal O y Brissot P. Lhepcidine: petite molcule, grands
desseins. Rev Med Int 2003; 24: 213-5.
28. Forrellat M y Fernndez N. Hepcidina: nueva molcula, nuevos horizontes. Rev Cubana Hematol Inmunol Hemoter 2004;
(20):3, 0-0.
29. Merryweather-Clarke AT, Cadet E, Bomford A, Capron D,
Viprakasit V, Miller A et al. Digenic inheritance of mutations in
HAMP and HFE results in different types of haemochromatosis.
Hum Mol Genet 2003; 12:2241-2247.
30. Ziga A y Orera MA. Gentica de las sobrecargas frricas. An
Med Interna (Madrid) 2002; 19:195-201.
31. Dallalio G, Fleury T y Means RT. Serum hepcidin in clinical
specimens. Br J Haematol 2003; 122: 996-1000.
13. Bridle KR, Frazer DM, Wilkins SJ, Dixon JL, Purdie DM,
Crawford DHG et al. Disruptede hepcidin regulation in HFEassociated haemochromatosis and the liver as a regulator of
body iron homeostasis. Lancet 2003; 361: 667-9.
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
25
La homeostasis del hierro y una hormona: la hepcidina.
32. Lee PL, Gelbart T, West C, Halloran C, Felitti V y Beutler
E. A study of genes that may modulate the expression
of hereditary hemochromatosis: transferring receptor-1,
ferroportin, ceruloplasmin, ferritin light and heavy chains,
iron regulatory proteins (IRP)-1 and -2, and hepcidin.
Blood Cells Mol Dis 2001; 27 (5): 783-802.
33. De Portugal, J. Hemocromatosis: del genotipo al fenotipo. An
Med Interna (Madrid) 2002; 19: 163-65.
44. Nemeth E. Hepcidin, a putative mediator of anemia of inflammation,
is a type II acute-phase protein. Blood. 2003; 101:24612463.
45. Nemeth E, Riviera S, Gabayan V, Keller C, Taudorf S, Pedersen B
et al. IL-6 mediates hypoferremia of inflammation by inducing the
synthesis of the iron regulatory hormone hepcidin. J Clin Invest
2004; 113:12711276.
34. Fleming RE y Sly WS. Mechanisms of iron accumulation
in hereditary hemochromatosis. Annu Rev Physiol 2002;
64:663-80.
46. Kulaksiz H, Gehrke SG, Janetzko A, Rost D, Bruckner T, Kallinowski
B y Stremmel W. Pro-hepcidin: expresin and cell specific
localisation in the liver and its regulation in hereditary
haemochromatosis, chronic renal insufficiency, and renal
anaemia. Gut 2004; 53:735-743.
35. Del Castillo A, Lpez JA y De Portugal, J. Hemocromatosis hereditaria. Diagnstico clnico: manifestaciones precoces, procesos
relacionados y formas atpicas. An Med Interna (Madrid) 2002;
19:251-56.
47. Karsume A., Saito H., Yamada Y., Yorosu K., Ueda O., Akamatsu
KI et al. Anti-interleukin 6 (IL-6) receptor antibody suppresses
Castlemans disease like symptoms emerged in IL-6 transgenic
mice. Cytokine 2002; 20:304-311.
36. Gehrke SG, Kulaksiz H, Herrmann T, Riedel H-D, Bents K,
Veltkamp C y Stremmel W. Expression of hepcidin in hereditary
hemochromatosis: evidence for a regulation in response to the
serum transferring saturation and non-transferrin-bound iron.
Blood 2003; 102: 371-76.
48. Andrews NC. Anemia of inflammation: The cytokine-hepcidin
link. J Clin Invest 2004; 113: 1251-1253.
37. Roetto A. Mutant antimicrobial peptide hepcidin is associated with
severe juvenile hemochromatosis. Nat Genet 2003; 33:218.
38. Majore S, Binni F, Ricerca BM, Brioli G y Grammatico P. Absence of hepcidin gene mutations in 10 italian patients with primary
iron overload. Haematologica 2002; 87(2):221-25.
39. Nicolas G, Viatte L, Lou DQ, Bennoun M, Beamont C, Kahn A
et al. Constitutive hepcidin expression prevents iron overload in
a mouse model of hemochromatosis. Nat Genet 2003; 34:97101.
40. Pietrangelo, A. Physiology of iron transport and the
hemochromatosis gene. Am J Physiol Gastrointest Liver
Physiol 2002; 282;G403-14.
41. Philpott, C. Molecular aspects of iron absorption: insights into
the role of HFE in hemochromatosis. Hepatology 2002; 35:9931001.
49. Taes YE, Wuyts B, Boelaert JR, De Vriese AS y Delanghe JR.
Prohepcidin accumulates in renal insufficiency. Clin Chem Lab
Med 2004; 42(4):387-9.
50. Ganz, T. Hepcidin a regulator of intestinal iron absorption and
iron recycling by macrophages. Best Pract Res Clin Haematol
2005; 18: 171-182.
51. Nicolas G, Bennoun M, Devaux I, Beaumont C, Grandchamp B,
Kahn A, et al. Lack of hepcidin gene expression and severe tissue
iron overload in upstream stimulatory factor 2 (USF2) knockout
mice. Proc Natl Acad Sci USA 2001; 98: 87808785.
52.
Oates PS. The role of hepcidin and ferroportin in iron
absorption. Histol Histopathol 2007;22(7):791-804.
53. Loreal O, Troadec MB, Camberlein E, Fatih N, Ropert M, Brissot
P. Iron metabolism. Rev Prat. 2006;56(19):2111-7.
54.
Merle U, Fein E, Gehrke SG, Stremmel W, Kulaksiz H. The
iron regulatory Peptide hepcidin is expressed in the heart
and regulated by hypoxia and inflammation. Endocrinology
2007;148(6):2663-8.
42. Anderson, GJ. Powel LW. HFE and non-HFE hemochromatosis.
Int J Hematol 2002;76: 203-7.
43. Weinstein CN, Roy MD, Fleming MF, Loda JI y Wolfsdorf NC.
Inappropriate expression of hepcidina is associated with iron
refractory anemia: Implications for the anemia of chronic
disease. Blood 2002; 100:3776-3781.
Revista de la Facultad de Ciencias de la Salud. Universidad de Carabobo. Diciembre 2007 Vol. 11 N 3
También podría gustarte
- Angulo de FaseDocumento2 páginasAngulo de Faseheberto sierraAún no hay calificaciones
- Clase 8 EA Evaluación Nutricional.2010Documento25 páginasClase 8 EA Evaluación Nutricional.2010Amelia PomaAún no hay calificaciones
- ARTICULO 1 ¿Por Qué Un Nutriologo Necesita Conocer de Interacción Farmaco-NutrienteDocumento2 páginasARTICULO 1 ¿Por Qué Un Nutriologo Necesita Conocer de Interacción Farmaco-NutrientePatricia González Aguilar100% (1)
- Manual ENIDocumento38 páginasManual ENIMelissa JustoAún no hay calificaciones
- Hiperplasia Suprarrenal Congenita: Una Guia Para Los PadresDe EverandHiperplasia Suprarrenal Congenita: Una Guia Para Los PadresCalificación: 5 de 5 estrellas5/5 (1)
- PDF Farmacodinamia Capitulo 3 GoodmanDocumento12 páginasPDF Farmacodinamia Capitulo 3 GoodmanAlexandra AbreuAún no hay calificaciones
- CaquexiaDocumento6 páginasCaquexiaMartin GonzalezAún no hay calificaciones
- FAVISMODocumento11 páginasFAVISMOWilliam Jesus Ronda RivadeneiraAún no hay calificaciones
- Valoración Global SubjetivaDocumento5 páginasValoración Global Subjetivaani55Aún no hay calificaciones
- Norma MalnutricionDocumento36 páginasNorma MalnutricionKatty PerezAún no hay calificaciones
- Nutricion Hospitalaria Suplementos PDFDocumento87 páginasNutricion Hospitalaria Suplementos PDFNicole FZAún no hay calificaciones
- Practica 3Documento20 páginasPractica 3YESSICA NICOLE VALVERDE ROSARIOAún no hay calificaciones
- Nutrición Basada en EvidenciaDocumento4 páginasNutrición Basada en EvidenciaEliud50% (2)
- Nutrición en DiálisisDocumento40 páginasNutrición en DiálisisValentina Sofía Toro Montaño100% (1)
- Cap 1 Composicion Corporal y Su DeterminacionDocumento8 páginasCap 1 Composicion Corporal y Su Determinacionchinagarcia100% (4)
- Hipotiroidismo SubclinicoDocumento4 páginasHipotiroidismo SubclinicoRodolfo LunaAún no hay calificaciones
- Diabetes en El AdultoDocumento16 páginasDiabetes en El AdultoKenshi007Aún no hay calificaciones
- Sindrome de RealimentacionDocumento10 páginasSindrome de Realimentacionpawerade100% (2)
- CASO CLÍNICO Cirrosis DescompensadaDocumento16 páginasCASO CLÍNICO Cirrosis DescompensadaDiana MaytaAún no hay calificaciones
- H e R R A M I e N T A S D e S C R e e N I N GDocumento10 páginasH e R R A M I e N T A S D e S C R e e N I N GMaría JoséAún no hay calificaciones
- Manual Pra Ctico de Nutricio N eDocumento212 páginasManual Pra Ctico de Nutricio N eClaudia CoronelAún no hay calificaciones
- Abordaje Nutricional-Nefropatía DiabéticaDocumento11 páginasAbordaje Nutricional-Nefropatía DiabéticaPablo CauichAún no hay calificaciones
- Efectos Fisiológicos Entrenamiento AlturaDocumento4 páginasEfectos Fisiológicos Entrenamiento AlturaJavier AraAún no hay calificaciones
- Formulas para Estimar El Consumo CaloricoDocumento4 páginasFormulas para Estimar El Consumo CaloricoeduardocgbAún no hay calificaciones
- Cirugía Bariátrica Qué Papel Juegan Las Hormonas GastrointestinalesDocumento12 páginasCirugía Bariátrica Qué Papel Juegan Las Hormonas GastrointestinalesefallxAún no hay calificaciones
- INOTROPICOSDocumento25 páginasINOTROPICOSWilson Ramirez TorresAún no hay calificaciones
- Manejo de Fosforo en ERDocumento31 páginasManejo de Fosforo en ERMariela MartinezAún no hay calificaciones
- Clase 1 RB-PD 2022Documento20 páginasClase 1 RB-PD 2022VaniaAún no hay calificaciones
- Clase 2. Metabolismo y Digestion de CarbohidratosDocumento49 páginasClase 2. Metabolismo y Digestion de CarbohidratosRoxy L.GAún no hay calificaciones
- Clase N°9. Antrop Hospitalizados Parte 2. 201820Documento20 páginasClase N°9. Antrop Hospitalizados Parte 2. 201820Daniel HernandezAún no hay calificaciones
- Nutricion BasicaDocumento3 páginasNutricion BasicaFernanda Cabrera LópezAún no hay calificaciones
- Historia Clinica Obstetrica Labor y ExpulsionDocumento1 páginaHistoria Clinica Obstetrica Labor y ExpulsionMiriam JassoAún no hay calificaciones
- Indicaciones de Soporte NutricionalDocumento14 páginasIndicaciones de Soporte Nutricionalmariosan81Aún no hay calificaciones
- 33 GPC Pancreatitis Aguda HPN 2014 MARYDocumento35 páginas33 GPC Pancreatitis Aguda HPN 2014 MARYJonatan AveigaAún no hay calificaciones
- SEMANA 5 Dietopediatrica DM 2017 1Documento99 páginasSEMANA 5 Dietopediatrica DM 2017 1valentina100% (1)
- Geriatría Indice de Riesgo NutricionalDocumento10 páginasGeriatría Indice de Riesgo NutricionalXuuba JmzAún no hay calificaciones
- Formulario para Informe Final Nutrición I - QA2012Documento9 páginasFormulario para Informe Final Nutrición I - QA2012Carmen Margarita Ladriere IglesiasAún no hay calificaciones
- FistuloclisisDocumento24 páginasFistuloclisiswillyeverp100% (2)
- Introducción A La Cineantropometría PDFDocumento10 páginasIntroducción A La Cineantropometría PDFiantracysAún no hay calificaciones
- Dieta HiperproteicaDocumento7 páginasDieta HiperproteicaKevin Alcocer100% (1)
- Introducción A La Fisiopatología, Unidad 1Documento26 páginasIntroducción A La Fisiopatología, Unidad 1sarai2reyes2fortunyAún no hay calificaciones
- Cirrosis 2018 UpTodate - En.esDocumento25 páginasCirrosis 2018 UpTodate - En.esWilliam LopezAún no hay calificaciones
- SOAP GastritisDocumento2 páginasSOAP GastritisPamela RodriguezAún no hay calificaciones
- Presentacion AntidopingDocumento24 páginasPresentacion AntidopingAltar MinisteriosAún no hay calificaciones
- CarbohidratosDocumento8 páginasCarbohidratosHugo Glez PradoAún no hay calificaciones
- Efecto de La Suplementación Con B Alanina Sobre Rendimiento-RevisionDocumento20 páginasEfecto de La Suplementación Con B Alanina Sobre Rendimiento-RevisionLuis Castro Xtrm100% (1)
- Veganismo Asociación Americana de Dietética 2009Documento17 páginasVeganismo Asociación Americana de Dietética 2009Oscar Vilca RomeroAún no hay calificaciones
- Taller Medidas AntropometricasDocumento4 páginasTaller Medidas AntropometricasJosé Ignacio Araya CastroAún no hay calificaciones
- Guias ASPEN 2009 (Sintesis Traducida Al Espanol)Documento7 páginasGuias ASPEN 2009 (Sintesis Traducida Al Espanol)Santiago PachecoAún no hay calificaciones
- Elaboracion de Una DietaDocumento5 páginasElaboracion de Una DietaErnesto LopezAún no hay calificaciones
- Actualización en Fórmulas LácteasDocumento40 páginasActualización en Fórmulas Lácteasgabrielasofia23Aún no hay calificaciones
- Dieta en Trasplante RenalDocumento12 páginasDieta en Trasplante RenalGranja Tres RojasAún no hay calificaciones
- Antropometria Del Adulto MayorDocumento51 páginasAntropometria Del Adulto MayorPiero Jair CF100% (1)
- Diaeta 171-Final2Documento64 páginasDiaeta 171-Final2jorgeAún no hay calificaciones
- NUTRIGENOMICADocumento35 páginasNUTRIGENOMICAKeny Hans Aburto RamosAún no hay calificaciones
- Caso Clinico 2 AdultoDocumento7 páginasCaso Clinico 2 AdultoAngie TobarAún no hay calificaciones
- Estimacion de Talla PDFDocumento7 páginasEstimacion de Talla PDFAna BiancaAún no hay calificaciones
- Nutricion Cardiopata PDFDocumento6 páginasNutricion Cardiopata PDFCarlos J. SanchezAún no hay calificaciones
- Guia de Uso Terapeutico de Nutricion en LactantesDocumento30 páginasGuia de Uso Terapeutico de Nutricion en LactantesArturo Laura100% (1)
- Act 10 Aciduria Glutárica Tipo 1-Alim. y Nut. en Circunstancias EspecialesDocumento20 páginasAct 10 Aciduria Glutárica Tipo 1-Alim. y Nut. en Circunstancias EspecialesPaola Bejarano100% (1)
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleAún no hay calificaciones
- 2° Ficha 4 Conceptos de Genética y HerenciaDocumento2 páginas2° Ficha 4 Conceptos de Genética y HerenciaOlesi MayerliAún no hay calificaciones
- Taller - Fase 4 - Fundamentos Radiobiológicos - Juan Diego Mateuz AportesDocumento11 páginasTaller - Fase 4 - Fundamentos Radiobiológicos - Juan Diego Mateuz AportesOscar GuerreroAún no hay calificaciones
- Tema Comunicación Intraneuronal e InterneuronalDocumento2 páginasTema Comunicación Intraneuronal e InterneuronalANA KARINA EALO OLEAAún no hay calificaciones
- Replicación Viral PDFDocumento6 páginasReplicación Viral PDFPau MesaAún no hay calificaciones
- 01 - 02 - BIO-002 - U02 - Mecanismos de Transporte A Travã©s de Las Membranas Biolã GicasDocumento13 páginas01 - 02 - BIO-002 - U02 - Mecanismos de Transporte A Travã©s de Las Membranas Biolã GicasErnesto CamachoAún no hay calificaciones
- Taller de CelulasDocumento2 páginasTaller de CelulasEduardo José Hernández Guevara100% (2)
- Términos ClaveDocumento6 páginasTérminos ClaveJosue Abril VargasAún no hay calificaciones
- Examenes 2Documento1 páginaExamenes 2CHRISTIAN MENAAún no hay calificaciones
- PolinucleotidosDocumento7 páginasPolinucleotidosInma ZabalaAún no hay calificaciones
- Manual 16 17 de HistologíaDocumento73 páginasManual 16 17 de HistologíaDenichi HernándezAún no hay calificaciones
- Biologia ES1Documento3 páginasBiologia ES1Rebeca DiazAún no hay calificaciones
- Vasoconstricción Pulmonar HipóxicaDocumento17 páginasVasoconstricción Pulmonar HipóxicaLuis ArdilaAún no hay calificaciones
- Estructura y Función de Las Moléculas OrgánicasDocumento19 páginasEstructura y Función de Las Moléculas Orgánicasnegritagb57% (14)
- PROTEINASDocumento4 páginasPROTEINASValeria AguilarAún no hay calificaciones
- MICRODocumento4 páginasMICROKELLY JULIANA PULGAR BALLESTAAún no hay calificaciones
- Informe de Laboratorio Biología Celular y MolecularDocumento90 páginasInforme de Laboratorio Biología Celular y MolecularLinda Katherine Vargas100% (2)
- Classificació Dels Gens Del CàncerDocumento6 páginasClassificació Dels Gens Del CàncerDerek Kuksa FerchukAún no hay calificaciones
- Mapa Conceptual de La Replicacion Del AdnDocumento4 páginasMapa Conceptual de La Replicacion Del AdnVictoria Zuñiga EscateAún no hay calificaciones
- Resumen Fisio 2Documento83 páginasResumen Fisio 2Diego AbarcaAún no hay calificaciones
- NEOPLASIASDocumento3 páginasNEOPLASIASmarAún no hay calificaciones
- Crucigramas y Sopas de Letras Ciencias Naturales BiologíaDocumento8 páginasCrucigramas y Sopas de Letras Ciencias Naturales Biologíajuan jose castro marquezAún no hay calificaciones
- Taller de BiomoleculasDocumento8 páginasTaller de BiomoleculasAnuar Romero MaceaAún no hay calificaciones
- Artículo de Revisión Enfermedad de WolmanDocumento9 páginasArtículo de Revisión Enfermedad de WolmannoeliavlaAún no hay calificaciones
- Es Una Guía para Que Poder Realizar Un Informe de IndagaciónDocumento5 páginasEs Una Guía para Que Poder Realizar Un Informe de IndagaciónAlex UchihaAún no hay calificaciones
- Fisiologia-Necesidades de AprendizajeDocumento9 páginasFisiologia-Necesidades de AprendizajeAlison DayanaAún no hay calificaciones
- Proteinas de La Carne de CerdoDocumento4 páginasProteinas de La Carne de CerdoRAMOS RAMOS YULIANA 201865408Aún no hay calificaciones
- Reproduccion Celular Generalidades 7Documento25 páginasReproduccion Celular Generalidades 7DIANA PATRICIA ROCHA-ACEVEDOAún no hay calificaciones
- Metabolismo y AbsorcionDocumento14 páginasMetabolismo y AbsorcionThalia AguileraAún no hay calificaciones
- MicrosDocumento3 páginasMicrosHarry Jackson Lixcano SalguedoAún no hay calificaciones