Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cinetica Química Vania
Cargado por
Kiyoshi Atsushi ZmeuDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cinetica Química Vania
Cargado por
Kiyoshi Atsushi ZmeuCopyright:
Formatos disponibles
VALTIERRA DIAZ VANIA SEMIRAMIS TERMODINAMICA
CINETICA QUMICA
La velocidad de reaccin corresponder a la rapidez con que tiene lugar una reaccin; durante el
cambio, la concentracin de los reactantes disminuir, mientras que la concentracin de los
productos aumentar. La velocidad media, entonces, se medir a travs del cambio de
concentracin en un periodo determinado de tiempo.
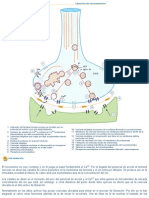
A partir de una reaccin A B, donde A est representado por las esferas rojas y B por las
esferas azules, en la figura se ilustra cmo cambian las concentraciones a medida que transcurre
el tiempo.
En el tiempo cero, en el primer tiesto de capacidad de un litro, se considera que hay un mol de A.
Transcurridos 20 segundos, la cantidad de moles de A disminuy a 0,54 y la cantidad de moles
formada de B es 0,46.
A los 40 segundos, la cantidad de moles de A es 0,3 y los moles de B son 0,7.
La siguiente tabla lustra las concentraciones de A y B en diferentes tiempos.
VALTIERRA DIAZ VANIA SEMIRAMIS TERMODINAMICA
Las teoras que permiten explicar la cintica de una
reaccin son las siguientes:
Teora de las colisiones efectivas
Segn esta teora, para que ocurra una reaccin qumica es necesario que existan choques entre
las molculas de reactantes. Las colisiones, en tanto, deben cumplir con dos condiciones:
Las molculas de reactantes deben poseer la energa suficiente para que pueda ocurrir el
rompimiento de enlaces, reordenamiento de los tomos y posteriormente la formacin de los
productos. Si no se dispone de la energa suficiente, las molculas rebotan sin formar los
productos.
Los choques entre las molculas deben efectuarse con la debida orientacin.
Si el choque entre las molculas cumple con estas condiciones, se dice que las colisiones son
efectivas y ocurre la reaccin entre los reactantes.
Teora del complejo activado
Segn esta teora, al aproximarse los reactantes se produce la formacin de un estado intermedio
de alta energa y corta duracin que se denomina complejo activado. La energa de activacin es
la energa que se necesita suministrar a los reactantes para que se forme el complejo activado.
Cuanto mayor sea la energa de activacin, en general, menor ser la velocidad de la reaccin.
De acuerdo al cambio neto de energa, es decir, la diferencia entre la energa de los productos y de
VALTIERRA DIAZ VANIA SEMIRAMIS TERMODINAMICA
los reactantes, las reacciones se clasifican en endergnicas si se requiere energa,
y exergnicas si se libera. Cuando la energa se manifiesta como calor, las reacciones se
denominarn endotrmicas y exotrmicas respectivamente.
Diagrama de energa para reacciones con energa de activacin
Reaccin exotrmica con energa de activacin:
E < 0
La energa liberada corresponde a la diferencia de energa entre los productos y los reactantes.
Como la energa de los productos es menor a la energa de los reactantes, se libera energa en el
proceso.
Reaccin endotrmica con energa de activacin:
También podría gustarte
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- El Estudio Del MiedoDocumento6 páginasEl Estudio Del MiedoMaria Paula CostaAún no hay calificaciones
- Como Realizar Un Examen Proctologico.Documento2 páginasComo Realizar Un Examen Proctologico.sheylliciousp100% (1)
- Pae SarampionDocumento25 páginasPae Sarampiondaniel gomez menesesAún no hay calificaciones
- Teoría Del Complejo Activado y de ColisionesDocumento3 páginasTeoría Del Complejo Activado y de ColisionesSanti SosaAún no hay calificaciones
- Cinetica QuimicaDocumento10 páginasCinetica QuimicaAnghi BCAún no hay calificaciones
- Ley de Reacción de Las MasasDocumento6 páginasLey de Reacción de Las Masasapi-19916045Aún no hay calificaciones
- Teoría Del Complejo Activado y de ColisionesDocumento2 páginasTeoría Del Complejo Activado y de ColisionesRafaelAún no hay calificaciones
- Índice de La Unidad 3Documento84 páginasÍndice de La Unidad 3Soledad ChiroqueAún no hay calificaciones
- Introduccion A La Molaridad y Estequiometria (RESUMEN)Documento11 páginasIntroduccion A La Molaridad y Estequiometria (RESUMEN)Leonel LopzAún no hay calificaciones
- Rapidez QuimicaDocumento15 páginasRapidez Quimicabriam jose burgos fernandezAún no hay calificaciones
- Teórico - Teoría Del Complejo Activado y de ColisionesDocumento4 páginasTeórico - Teoría Del Complejo Activado y de ColisionesTi Rex Rex100% (1)
- Teoria de Las Reacciones Quimicas PDFDocumento19 páginasTeoria de Las Reacciones Quimicas PDFElenaAún no hay calificaciones
- Energia de ActivacionDocumento3 páginasEnergia de Activacionines martinezAún no hay calificaciones
- Cinética Química. Velocidad de ReacciónDocumento4 páginasCinética Química. Velocidad de ReacciónAbdelouahid SamadiAún no hay calificaciones
- Tema 4 Química 22-23Documento12 páginasTema 4 Química 22-23Sofía Ruiz GudeAún no hay calificaciones
- Cinética y EquilibrioDocumento29 páginasCinética y Equilibriojdiazgall9395100% (1)
- Cinetica QuimicaDocumento10 páginasCinetica QuimicaGracielaAún no hay calificaciones
- Cálculos de Pureza de ReactivosDocumento7 páginasCálculos de Pureza de ReactivosKuuzzed LeoAún no hay calificaciones
- Guía de Cinética QuimicaDocumento13 páginasGuía de Cinética Quimicafelipe jaraAún no hay calificaciones
- Las Ecuaciones Termoquímicas Son Aquel5to - TERMOQUIMICA 2Documento37 páginasLas Ecuaciones Termoquímicas Son Aquel5to - TERMOQUIMICA 2Belen Vitale100% (2)
- Resumen Capitulo 16Documento3 páginasResumen Capitulo 16Manuel Felipe FrancoAún no hay calificaciones
- Cinetica QuimicaDocumento5 páginasCinetica Quimicacarlos alberto garduño pachecoAún no hay calificaciones
- Practica 2 Determinacion de Parametros Cineticos de Una Reaccion..Documento21 páginasPractica 2 Determinacion de Parametros Cineticos de Una Reaccion..Tati Salazar Plaza100% (1)
- Laboratorio Imanol Sebastian Orihuela ZevallosDocumento16 páginasLaboratorio Imanol Sebastian Orihuela ZevallosRenzo ZAún no hay calificaciones
- Reaccion ExotermicaDocumento11 páginasReaccion ExotermicaFLORENZIA SIN NOMBRE PALMA LOPEZAún no hay calificaciones
- Módulo 4 Termoquímica I-1-1Documento12 páginasMódulo 4 Termoquímica I-1-1Alexander ColqeAún no hay calificaciones
- Módulo 4 Termoquímica I-1-1Documento12 páginasMódulo 4 Termoquímica I-1-1Alexander ColqeAún no hay calificaciones
- La Cinética QuímicaDocumento12 páginasLa Cinética QuímicaNicholas GarzaAún no hay calificaciones
- Energia de ActivacionDocumento2 páginasEnergia de ActivacionHector Manuel Tapia QuilodranAún no hay calificaciones
- Cinética y Equilibrio QuímicoDocumento47 páginasCinética y Equilibrio QuímicoLjubenko GagliuffiAún no hay calificaciones
- QF3 - Teoría de Las Velocidades Absolutas de Reacción. Grupo IDocumento22 páginasQF3 - Teoría de Las Velocidades Absolutas de Reacción. Grupo ICARLOS RAÚL ALCÁNTARA RAMÍREZAún no hay calificaciones
- La Energía de ActivaciónDocumento4 páginasLa Energía de ActivaciónMery RHdezAún no hay calificaciones
- Trabajo de QuimicaDocumento13 páginasTrabajo de QuimicaNorwis GonzalezAún no hay calificaciones
- Orden de ReacciónDocumento3 páginasOrden de ReaccióncarlosAún no hay calificaciones
- CINÉTICA MOLECULAR Equilibrio Químico 3Documento9 páginasCINÉTICA MOLECULAR Equilibrio Químico 3Khrriz CastilloAún no hay calificaciones
- Las Reacciones QuímicasDocumento5 páginasLas Reacciones QuímicasCristian rofiAún no hay calificaciones
- Velocidad DE ReacciónDocumento23 páginasVelocidad DE ReacciónBrianna “Brianna” graellAún no hay calificaciones
- Cinética Química. Teoría. UNIDADES DE R CORREGIDASDocumento10 páginasCinética Química. Teoría. UNIDADES DE R CORREGIDASmartaAún no hay calificaciones
- Velocidad de ReacciónDocumento8 páginasVelocidad de ReacciónALFONSO HERNANDEZAún no hay calificaciones
- Guia 4 Quimica Décimo Tercer PeriodoDocumento3 páginasGuia 4 Quimica Décimo Tercer PeriodoDaniela HernandezAún no hay calificaciones
- Equilibrio y Velocidad de ReacciónDocumento25 páginasEquilibrio y Velocidad de Reacciónafrunp5186Aún no hay calificaciones
- GuiadecineticaquimicaDocumento17 páginasGuiadecineticaquimicaTheJerexD JAún no hay calificaciones
- Guia 3 QUIMICA-1Documento9 páginasGuia 3 QUIMICA-1JJ MenesesAún no hay calificaciones
- Cinética QuímicaDocumento7 páginasCinética QuímicaVíctor Manuel Pérez RomeroAún no hay calificaciones
- Actividad 7 QuimicaDocumento18 páginasActividad 7 QuimicaWilliam Velasquez ReyesAún no hay calificaciones
- Organica Entropia de ReacciónDocumento19 páginasOrganica Entropia de ReacciónAleReyesAún no hay calificaciones
- Copia de PPT 5to SM Cap 16 Teoria 2022Documento19 páginasCopia de PPT 5to SM Cap 16 Teoria 2022Briana Mariana Victoria Romero CosioAún no hay calificaciones
- Reacciones Quc3acmicas 2020Documento22 páginasReacciones Quc3acmicas 2020Ana Sofia Martinez GarciaAún no hay calificaciones
- T. Selectos Quimica. Camila PeregrinoDocumento15 páginasT. Selectos Quimica. Camila PeregrinoGladis Ethel Madrigal HernándezAún no hay calificaciones
- Cinética Química Resumen para IsiDocumento4 páginasCinética Química Resumen para IsiNot easy CodeAún no hay calificaciones
- S4 Reacciones Quimicas y EstequiometríaDocumento33 páginasS4 Reacciones Quimicas y EstequiometríaMarino GuerreroAún no hay calificaciones
- Desarrollo de Taller de Quimica GeneralDocumento6 páginasDesarrollo de Taller de Quimica GeneralDANIELA FORERO RAMÍREZ0% (1)
- TP - Clase 7 - QuímicaDocumento15 páginasTP - Clase 7 - QuímicaValle TejerinaAún no hay calificaciones
- Velocidad de ReacciónDocumento8 páginasVelocidad de Reaccióndanae jimenezAún no hay calificaciones
- ObjetivosDocumento13 páginasObjetivosArquimides Rafael Vasquez MendesAún no hay calificaciones
- Guía 4 Energía en Las Reacciones QuímicasDocumento10 páginasGuía 4 Energía en Las Reacciones Químicasgallardo04Aún no hay calificaciones
- El Catalizador, Animador de La FiestaDocumento10 páginasEl Catalizador, Animador de La FiestaEd DiAún no hay calificaciones
- Marco TeoricoDocumento2 páginasMarco TeoricoNicolay VillaAún no hay calificaciones
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108De EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108Aún no hay calificaciones
- UF0565 - Eficiencia energética en las instalaciones de calefacción y ACS en los edificiosDe EverandUF0565 - Eficiencia energética en las instalaciones de calefacción y ACS en los edificiosAún no hay calificaciones
- Mantenimiento del sistema de carga con alternador. TMVG0209De EverandMantenimiento del sistema de carga con alternador. TMVG0209Calificación: 3.5 de 5 estrellas3.5/5 (8)
- Ejemplario: Ecuaciones Diferenciales OrdinariasDe EverandEjemplario: Ecuaciones Diferenciales OrdinariasAún no hay calificaciones
- ReordenarDocumento2 páginasReordenarKiyoshi Atsushi ZmeuAún no hay calificaciones
- Guia Identificacion y Evaluacion de Aspectos AmbientalesDocumento20 páginasGuia Identificacion y Evaluacion de Aspectos AmbientalesLezly SantanaAún no hay calificaciones
- 2 Parcial EjerciciosDocumento14 páginas2 Parcial EjerciciosKiyoshi Atsushi Zmeu100% (1)
- Verbos Pasado Presente y FuturoDocumento1 páginaVerbos Pasado Presente y FuturoKiyoshi Atsushi ZmeuAún no hay calificaciones
- Autores y Obras Del RealismoDocumento3 páginasAutores y Obras Del RealismoKiyoshi Atsushi ZmeuAún no hay calificaciones
- Cap2 Psicología de Los Grupos RAFAEL PRADADocumento6 páginasCap2 Psicología de Los Grupos RAFAEL PRADAcorpus delictiAún no hay calificaciones
- Manual Bomba en EspañolDocumento7 páginasManual Bomba en EspañolIpesa Gases MedicinalesAún no hay calificaciones
- Revisar: Genes de Resistencia A Antibióticos en Aguas ResidualesDocumento9 páginasRevisar: Genes de Resistencia A Antibióticos en Aguas ResidualesKEVIN DANIEL LLANOS VARGASAún no hay calificaciones
- Aire en Combustible (4021592) Qsk19, Qsk19 Cm850 Mcrs y Qsk19 Cm2150 Mcrs Manual de ServicioDocumento4 páginasAire en Combustible (4021592) Qsk19, Qsk19 Cm850 Mcrs y Qsk19 Cm2150 Mcrs Manual de ServicioLuis Jose LlobanAún no hay calificaciones
- Desafío en El Consumo de Frutas y VerdurasDocumento21 páginasDesafío en El Consumo de Frutas y VerdurasAdriana SosaAún no hay calificaciones
- Eón ProterozoicoDocumento8 páginasEón Proterozoicowilliam leight lopez lopezAún no hay calificaciones
- Aportes A La Biologia CientificosDocumento12 páginasAportes A La Biologia CientificosPedro MartinezAún no hay calificaciones
- Trabajo Practico N°4Documento5 páginasTrabajo Practico N°4Damián GonzálezAún no hay calificaciones
- Provincia de AraniDocumento19 páginasProvincia de Aranidjc100% (1)
- Concepto de Intemperismo y ErosiónDocumento3 páginasConcepto de Intemperismo y ErosiónSaúl NavaAún no hay calificaciones
- Evaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICODocumento4 páginasEvaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICOCamila Paz Farias CorreaAún no hay calificaciones
- Calendario 2023-31x45cm - 221221 - 073955Documento15 páginasCalendario 2023-31x45cm - 221221 - 073955Jose M. Villalonga (Txem)Aún no hay calificaciones
- Ciencias Presentacion Act FinalDocumento16 páginasCiencias Presentacion Act FinalDaniel ArenasAún no hay calificaciones
- Nota Urgencias 33Documento1 páginaNota Urgencias 33Luis NoriegaAún no hay calificaciones
- Triptico RespiraciónDocumento2 páginasTriptico RespiraciónAnly MendozaAún no hay calificaciones
- Triptico ClorofilaDocumento2 páginasTriptico ClorofilaOnayda Fabiola Salazar AriasAún no hay calificaciones
- Silabo Medicina I 2010-IIDocumento28 páginasSilabo Medicina I 2010-IIAnonymous mv3B7mp1TYAún no hay calificaciones
- Complejo SnareDocumento2 páginasComplejo SnareJavier Eduardo Aravena VelasquezAún no hay calificaciones
- Ensayo Evolucion Psicologia EducativaDocumento6 páginasEnsayo Evolucion Psicologia EducativaTejada YelitzaAún no hay calificaciones
- Agitadores Tipo Turbina de Paletas Rectas Cortas Verticales Con DiscoDocumento4 páginasAgitadores Tipo Turbina de Paletas Rectas Cortas Verticales Con DiscoMarvil Raul Cieza CastilloAún no hay calificaciones
- CRANEO DalexDocumento10 páginasCRANEO DalexDalex amilkar RojasAún no hay calificaciones
- Formato de Evaluacion de PRMsDocumento4 páginasFormato de Evaluacion de PRMsmariaAún no hay calificaciones
- Ensayo de FilosofiaDocumento5 páginasEnsayo de Filosofiamonica leichtleAún no hay calificaciones
- Recetario Magistral EDFDocumento78 páginasRecetario Magistral EDFPaula Alejandra Guzmán GonzálezAún no hay calificaciones
- Bodegas 5 y 6 - Plano SanitarioDocumento1 páginaBodegas 5 y 6 - Plano SanitarioJose PradaAún no hay calificaciones
- Caso Clinico DifteriaDocumento25 páginasCaso Clinico DifteriaINVERSIONES EL PODEROSOAún no hay calificaciones
- TIF Josefina Benitez PDFDocumento104 páginasTIF Josefina Benitez PDFEmanuel CostarelliAún no hay calificaciones