P
T
e
r
m
o
d
i
n
a
m
i
c
a
-
0
2
de Cdiz
Universidad
Pasividad
ASPECTOS TERMODINAMICOS DE
LOS PROCESOS DE CORROSION.
-2
-1
0
1
2
0 7 14
Laboratorio de Corrosin y Proteccin
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
PROCESOS CORROSIVOS
CRITERIOS DE CLASIFICACION
Medio Agresivo
Sector Industrial
Morfologa del Ataque
Mecanismo
Corrosin Seca
Corrosin Hmeda
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
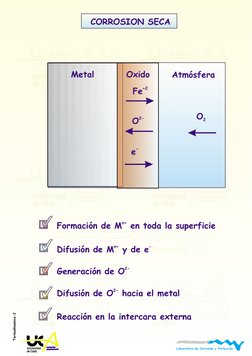
CORROSION SECA
Formacin de M en toda la superficie
Difusin de M
Generacin de O
Difusin de
n+
2-
n+ -
2-
y de e
O hacia el metal
Reaccin en la intercara externa
Metal Oxido
Fe
+2
O
2
O
2-
e
-
Atmsfera
T
e
r
m
o
d
i
n
a
m
i
c
a
-
3
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
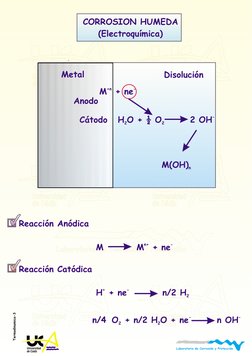
CORROSION HUMEDA
(Electroqumica)
Reaccin Andica
M M + ne
Reaccin Catdica
H + ne n/2 H
n/4 O + n/2 H O + ne n OH
n+ -
+ -
- -
2
2 2
Metal
Anodo
Ctodo
M + ne
+n -
M(OH)
n
H O + O 2 OH
2 2
-
Disolucin
T
e
r
m
o
d
i
n
a
m
i
c
a
-
4
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
REACTIVIDAD
ASPECTOS TERMODINMICOS
ASPECTOS CINTICOS
Espontaneidad de los procesos
Velocidad de los procesos
T
e
r
m
o
d
i
n
a
m
i
c
a
-
5
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
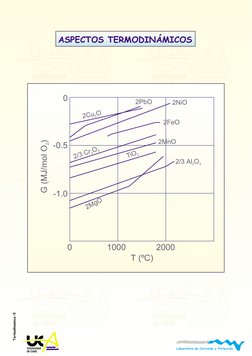
0
-1.0
-0.5
0
2
C
u
O
2
2
M
g
O
2
/
3
C
r
O
2
3
2/3 Al O
2 3
T
i
O2
2NiO
2FeO
2MnO
2PbO
G
(
M
J
/
m
o
l
O
)
2
T (C)
1000 2000
ASPECTOS TERMODINMICOS
T
e
r
m
o
d
i
n
a
m
i
c
a
-
6
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
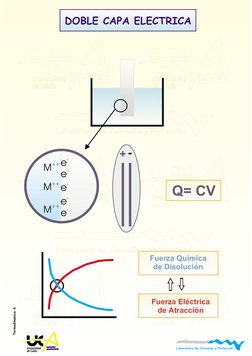
DOBLE CAPA ELECTRICA
+
-
Q= CV
M
++
M
++
M
++
e
-
e
-
e
-
e
-
e
-
Fuerza Qumica
de Disolucin
Fuerza Elctrica
de Atraccin
T
e
r
m
o
d
i
n
a
m
i
c
a
-
7
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
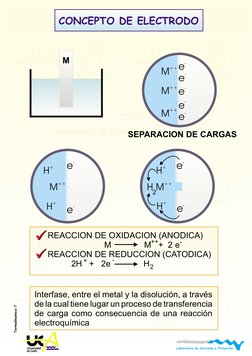
CONCEPTO DE ELECTRODO
M
++
H
+
H
+
e
-
e
-
SEPARACION DE CARGAS
M
++
M
++
M
++
e
-
e
-
e
-
e
-
e
-
H M
++
e
-
e
-
Interfase, entre el metal y la disolucin, a travs
de la cual tiene lugar un proceso de transferencia
de carga como consecuencia de una reaccin
electroqumica
H
+
H
+
2
M
REACCION DE OXIDACION (ANODICA)
M M + 2 e
REACCION DE REDUCCION (CATODICA)
2H + 2e H
++
-
-
+
2
T
e
r
m
o
d
i
n
a
m
i
c
a
-
8
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
REACCIONES DE REDUCCION EN MEDIO ACUOSO
REDUCCION DE PROTONES ( E H /H = 0 V)
Medio Bsico 2H O + 2 e H + 2OH
Medio Neutro
Medio Bsico O + 2H O + 4e 4 OH
Medio Neutro
+
- -
- -
2
2 2
2 2
REDUCCION DE OXIGENO (E O /H O= -1.23 V)
2 2
Medio Acido: 2H + 2 e H
Medio Acido: O + 4H + 4e 2 H O
+ -
+ -
2
2 2
T
e
r
m
o
d
i
n
a
m
i
c
a
-
9
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Tendencia a la
ionizacin en agua
Au/Au
+
Cu/Cu
++
Fe/Fe
++
Zn/Zn
++
Na/Na
+
2H /H
+
2
Noble
Activo
Escala experimental de
potenciales de metales en agua
Es posible medir el potencial
absoluto de un electrodo?
H
2
Zn
Zn
++
H
+
0.0 V
S
i
g
n
o
p
o
s
i
t
i
v
o
S
i
g
n
o
n
e
g
a
t
i
v
o
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
0
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Metal Resistencia
a la
Corrosin
Fecha de
Utilizacin
Indefinida 10.000 AC
Buena 7.000 AC
Escasa 1.300 AC
Muy baja 1.500 DC
Au Au + e
+ -
Cu Cu + 2e
++ -
Fe Fe + 2e
++ -
Zn Zn + 2e
++ -
Na Na + e
+ -
Explosivo 1.800 DC
Metal
Au Au + e
+ -
Cu Cu + 2e
++ -
Fe Fe + 2e
++ -
Zn Zn + 2e
++ -
Na Na + e
+ -
Tendencia a la
ionizacin en agua
Au/Au
+
Cu/Cu
++
Fe/Fe
++
Zn/Zn
++
Na/Na
+
2H /H
+
2
Noble
Activo
Escala experimental de
potenciales de metales en agua
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
1
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Tendencia a la
ionizacin en agua
Au/Au
+
Cu/Cu
++
Fe/Fe
++
Zn/Zn
++
Na/Na
+
2H /H
+
2
Noble
Activo
Escala experimental de
potenciales de metales en agua
Cu Zn
Zn
++
Cu
++
CELDAS ELECTROQUIMICAS
Cu Zn
Zn
++
Cu
++
e
-
(-) (+)
1 V
Zn + Cu Zn + Cu
++ ++
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
2
-
1
3
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Potenciales estndar de electrodo vs SHE
Au + 2e = Au +1.498
Pt + 2e = Pt +1.200
O + 2H O + 2e = 4OH (pH = 7) +0.820
Ag + e = Ag +0.799
Hg + 2e = 2Hg +0.788
3+ -
3+ -
- -
+ -
2+ -
Cl + 2e = 2Cl +1.358
Fe + e = Fe +0.711
Cu + 2e = Cu +0.337
Sn + 2e = Sn +0.150
2H +2e =H 0
Sn + 2e = Sn -0.136
Ni + 2e = Ni -0.250
Co + 2e = Co -0.277
Fe + 2e = Fe -0.440
Cr + 3e = Cr -0.744
Zn + 2e = Zn -0.763
Al + 3e = Al -1.662
Mg + 2e = Mg -2.363
Na + e = Na -2.714
K + e = K -2.925
2
2
- -
3+ - 2
2+ -
4+ - 2+
+ -
2+ -
2+ -
2+ -
2+ -
3+ -
2+ -
3+ -
2+ -
+ -
+ -
2 2
2
Noble
Activo
Reaccin e (volts)
o
Electrodos de referencia secundarios
Mercurio Sulfato de Mercurio (I) Hg SO + 2e = 2Hg + SO + 0.615
Cobre Sulfato de Cobre Cu SO + 2e = Cu + SO + 0.318
Calomelano Hg Cl + 2e = 2Hg + 2Cl + 0.241
Plata Cloruro de Plata Ag Cl + e = Ag + Cl + 0.222
SHE 2H + 2e = H 0.000
2 4 4
4 4
2 2
2
- 2-
- 2-
- -
- -
+ -
Nombre Reaccin semicelda e (SHE)
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
4
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
POTENCIALES NORMALES DE REDUCCIN
CRITERIO DE SIGNOS
G = - nF E
Reaccin espontnea : Zn + 2 H Zn + H
Potencial experimental: 0.76 V +/-?
Semirreacin andica (1): Zn + 2 e Zn G = - 2F E (Zn /Zn)
Semirreaccin catdica (2): 2 H + 2e H G = - 2F E (2H /H )
Reaccin global: R2 - R1
G = G - G = - nF E =- 2F E (2H /H ) - (-2F E (Zn /Zn))
CONVENIO: E (2H /H ) = 0
G = 2F E (Zn /Zn)) < 0
E (Zn /Zn)) < 0
E (Zn /Zn)) = - 0.76 V
Reaccin espontnea : Cu + H Cu + H
Potencial experimental: 0.34 V +/-?
Semirreacin andica (1): Cu + 2 e Cu G = - 2F E (Cu /Cu)
Semirreaccin catdica (2): 2 H + 2e H G = - 2F E (2H /H )
Reaccin global: R1 - R2
G = G - G = - nF E =- 2F E (Cu /Cu) - (- 2F E (2H /H ))
CONVENIO: E (2H /H ) = 0
G = - 2F E (Cu /Cu)) < 0
E (Cu /Cu)) > 0
E (Cu /Cu)) = 0.34 V
+ +2
+2 - +2
+ - +
+ +2
+
+2
+2
+2
+2 +
+2 - +2
+ - +
+2 +
+
+2
+2
+2
2
1
2 2 2
R 2 1 R 2
2
R
2
1
2 2 2
R 1 2 R 2
2
R
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
5
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Ecuacin de Nernst
G= G + RT ln
Red
Oxi
G= - nF
-nF = - nF + RT ln
Red
Oxi
= + ln
Red
Oxi RT
nF
Cu / Cu
2 +
= + ln
Cu 2 + /Cu
Cu
2 +
RT
nF
C.E. Cu = 1M = +0,34 V
2 +
Cu < 1M < +0,34 V
2 +
Cu > 1M > +0,34 V
2 +
0,34 V
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
6
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
0.34
0.0
Cu
Metlico
Cu
Corrosin
++
H
Estable
2
H
Estable
+
0.34
0.0
H
Estable
2
Cu
Corrosin
++
H
Estable
+
Cu
Metlico
- 0.44
0.0
H
Estable
2
H
Estable
+
0.0
-0.44
H
Estable
+
Fe
Corrosin
++
Fe
Metlico
Fe
Corrosin
++
H
Estable
2
Fe
Metlico
0.34
1.23
H O
Estable
2
O
Estable
2
Cu
Corrosin
++
Cu
Metlico
1.23
0.34
O
Estable
2
Cu
Corrosin
++
H O
Estable
2
Cu
Metlico
H O
Estable
2
Cu
Corrosin
++
Cu
Metlico
H
Estable
+
H
Estable
2
Fe
Corrosin
++
E
mixto
E
mixto
E
mixto
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
7
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Potencial de electrodo en
funcin de la concentracin de Cu
++
Cu
++
E
Cu /Cu
++ log Cu
++
1
10
-2
10
-4
10
-6
0.34
0.28
0.22
0.16
0
- 2
- 4
- 6
0.34
0.28
0.22
0.16
0
- 2
- 4
- 6
Noble
Activo
0.34
0.16
Cu
Metlico
Cu
Corrosin
++
Cu
Metlico
Cu
Corrosin
++
Cu
Cu
++
Cu
++
Cu
10
-2
10
-6
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
8
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Efecto de la Concentracin en el Potencial de Electrodo
a m n b d
nFe
G G RT
e e
e e
e e
A + H + e = B + H O ,
G = -
Ecuacin de Nernst:
- = ln ,
= - ln ,
= + log ,
= + log - 0.059 pH
2H + 2e = H ,
e = e - 0.059 pH,
(H ) = p = 1 atm.
+ -
o o
o
+ -
o
2
2
H / H H / H
2 H
o
o
o
(B) (H O)
b d
2
(B) (H O)
b d
2
RT
nF
nF
(A) (H )
a + m
(A) (H )
a + m
(B) (H O)
b d
2
(A) (H )
a + m
2.3 RT
n n
m
0.059
(A)
a
(B)
b
+ +
2
2
2
T
e
r
m
o
d
i
n
a
m
i
c
a
-
1
9
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
DIAGRAMAS DE POURBAIX
(Potencial/pH)
REDUCCION DE PROTONES ( E H /H = 0 V)
Medio Bsico 2H O + 2 e H + 2OH
Medio Neutro
E H /H = E H /H -0.059 pH
REDUCCION DE OXIGENO (E O /H O= -1.23 V)
Medio Bsico O + 2H O + 4e 4 OH
Medio Neutro
E O /H O= E O /H O - 0.059 pH
+
-
+ +
- -
2
2 2
2 2
2 2
2 2
2 2 2 2
-
Medio Acido: 2H + 2 e H
Medio Acido: O + 4H + 4e- 2 H O
+ -
+
2
2 2
-2
-1.6
-1.2
-0.8
-0.4
0.0
0.4
0.8
1.2
1.6
0 2 4 6 8 10 12 14 16
H
2
H O
2
O
2
P
o
t
e
n
c
i
a
l
(
V
)
pH
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
0
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
DIAGRAMAS DE POURBAIX
(Potencial/pH)
Construccin para el Aluminio
Al Al + 3 e
E Al/Al =-1.66 + 0.059 log Al
+3 -
+3 +3
-2
-2.0
-1.9
-1.8
-1.7
-1.6
-1.5
-1.4
-1.3
-1.2
0 2 4 6 8 10 12 14 16
Al = 1 M
+3
Al = 10 M
+3 -6
P
o
t
e
n
c
i
a
l
(
V
)
pH
3
Al
Al
+3
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
1
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
DIAGRAMAS DE POURBAIX
(Potencial/pH)
Construccin para el Aluminio
Al + 3 H O Al O + 6 H + 6 e
E Al/Al O = -1.55 - 0.059 log pH
2 2 3
+ -
2 3
-2
-2.0
-1.9
-1.8
-1.7
-1.6
-1.5
-1.4
-1.3
-1.2
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Al
Al
+3
Al O
2 3
2 Al + 3 H O Al O + 6 H
+3 +
2 2 3
pH = 3.8
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
2
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
DIAGRAMAS DE POURBAIX
(Potencial/pH)
Construccin para el Aluminio
Al + 2 H O AlO + 4 H + 3 e
E Al/AlO = -1.26 - 0.079 log pH + 0.020 log AlO
2 2
2 2
- + -
- -
-2
-3.0
-2.8
-2.6
-2.4
-2.2
-2.0
-1.8
-1.6
-1.4
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Al
Al
+3
Al O + H O AlO + 2 H
2 3 2 2-
+
pH = 8.6
AlO
2
-
Al O
2 3
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
3
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
DIAGRAMAS DE POURBAIX
(Potencial/pH)
Construccin para el Aluminio
Al + 2 H O AlO + 4 H + 3 e
E Al/AlO = -1.26 - 0.079 log pH + 0.020 log AlO
2 2
2 2
- + -
- -
-2
-3.0
-2.8
-2.6
-2.4
-2.2
-2.0
-1.8
-1.6
-1.4
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Al
Al
+3
Al O + H O AlO + 2 H
2 3 2 2-
+
pH = 8.6
AlO
2
-
Al O
2 3
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
4
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
-2
-2.4
-2.0
-1.6
-1.2
-0.8
-0.4
0.0
0.4
0.8
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Inmunidad
C
o
r
r
o
s
i
n
C
o
r
r
o
s
i
n
P
a
s
i
v
a
s
i
n
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
5
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
-2
-2.4
-2.0
-1.6
-1.2
-0.8
-0.4
0.0
0.4
0.8
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Inmunidad
Corrosin Corrosin Pasivasin
H
2
Al
+3
Al O
2 3
AlO
2
-
H
+
2 Al + 6 H 2 Al + 3 H
+ +3
2
2 Al + 3 H 0 Al O + 3 H
2 2 3 2
2 Al + 4 H 0 2AlO + 3 H + 2 H
2 2 2
-
+
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
6
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
-2
-2.4
-2.0
-1.6
-1.2
-0.8
-0.4
0.0
0.4
0.8
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
(
V
)
pH
Inmunidad
C
o
r
r
o
s
i
n
C
o
r
r
o
s
i
n
P
a
s
i
v
a
s
i
n
-2
0
10
20
30
40
50
60
70
80
0 2 4 6 8 10 12 14 16
V
e
l
o
c
i
d
a
d
d
e
c
o
r
r
o
s
i
n
(
m
i
l
s
/
y
)
pH
Acido actico
Acido fluorhdrico
Acido clorhdrico
Carbonato sdico
Hidrxido sdico
Hidrxido amnico
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
7
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
-2
-2
-2
-2
-1
-1
-1
-1
0
0
0
0
Oro Iridio Platino Rodio Rutenio Paladio
1
1
1
1
2
2
2
2
0 7 14 0 7 14 0 7 14
Mercurio Plata Polonio Teluro Selenio Osmio
0 7 14 0 7 14 0 7 14
0 7 14 0 7 14
-2
-1
0
1
2
Zirconio
0 7 14
-2
-1
0
1
Aluminio
0 7 14
Hafnio
0 7 14
Magnesio
0 7 14
Berilio
0 7 14
Titanio
0 7 14
-2
-1
0
Galio
1
2
0 7 14
Carbono Arsenico Antimonio Bismuto Cobre Tecnecio
Niquel Renio Plomo
2
Cadmio Talio Cobalto
Cinc
0 7 14
Niobio
0 7 14
0 7 14 0 7 14 0 7 14 0 7 14
Wolframio
0 7 14
Molibdeno
0 7 14
Indio
0 7 14
Germanio
0 7 14
Estao
0 7 14
Hierro
0 7 14
Cromo
0 7 14
Vanadio
0 7 14
Manganeso
0 7 14
0 7 14 0 7 14 0 7 14 0 7 14 0 7 14 0 7 14
0 7 14 0 7 14 0 7 14 0 7 14 0 7 14 0 7 14
Diagramas de Pourbaix
Pasividad Corrosin Inmunidad
T
e
r
m
o
d
i
n
a
m
i
c
a
-
2
8
Laboratorio de Corrosin y Proteccin
de Cdiz
Universidad
Pasividad
Iridio Platino Rodio Rutenio Paladio
0 7 14 0 7 14
Osmio
0 7 14 0 7 14 0 7 14
0 7 14
Oro
0 7 14
Plata
0 7 14
Zirconio
0 7 14
Aluminio
0 7 14
Hafnio
0 7 14
Berilio
0 7 14
Titanio
0 7 14
-2
-2
-2
-2
-1
-1
-1
-1
0
0
0
0
1
1
1
1
2
2
2
2
Galio
0 7 14
0 7 14
Niobio
Indio
0 7 14
Estao
0 7 14
Cromo
0 7 14
Metales Resistentes al agua
Pasividad Corrosin Inmunidad
Condiciones: pH 7 25C para potenciales
comprendidos entre -0.8 y +0.7 V