Documentos de Académico
Documentos de Profesional
Documentos de Cultura
16 Manual QQ-112-Q
Cargado por
Eduardo CamposDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
16 Manual QQ-112-Q
Cargado por
Eduardo CamposCopyright:
Formatos disponibles
Universidad Nacional Autnoma de Honduras 1 Manual de Laboratorio
Qumica Medica II QQ-112 Qumica Orgnica General QQ-214
Universidad Nacional Autnoma de Honduras
Facultad de Qumicas y Farmacia
Universidad Nacional Autnoma de Honduras 2 Manual de Laboratorio
Practica No. 1
NORMAS DE SEGURIDAD
OBJETIVOS
a) b) c) El alumno conocer y aprender el reglamento interno, y reconocer que su acatamiento har ms seguro su trabajo en todo laboratorio de qumica. El alumno conocer las principales causas de incendios y explosiones. El alumno estudiar el pequeo anexo de primeros auxilios.
INTRODUCCIN
Debido a los riesgos que implica la manipulacin cotidiana de sustancias perjudiciales al organismo humano, el qumico debe siempre comportarse respetuoso de los peligros inherentes a su actividad, y ejercer las mayores precauciones. Es igualmente importante que conozca el dao que estas sustancias, mal tratadas o mal desechadas, pueden ocasionar a sus semejantes y al ecosistema. Por lo anterior, consideramos que es indispensable que todo profesional de la qumica y de carreras afines conozca e intrprete adecuadamente el reglamento bsico al que debe ajustarse su comportamiento. El respeto de dicho reglamento lo ayudar a preservar su salud e integridad fsica, lo sensibilizar sobre el hecho de que su labor conlleva un riesgo para sus semejantes y su medio ambiente, y le permitir desarrollar el sentido crtico necesario para enfrentar aquellas situaciones imprevistas para las que este reglamento no es suficiente. Sugerimos que este reglamento se lea y analice cuidadosamente antes de iniciar cualquier actividad en el laboratorio de Qumica Orgnica.
Universidad Nacional Autnoma de Honduras 3 Manual de Laboratorio
1. Reglamento bsico
A continuacin se presenta una serie de reglas bsicas que deben seguirse en el laboratorio de Qumica Orgnica. 1. Conocer bien las propiedades fsicas, qumicas y toxicolgicas de las sustancias que se van a utilizar. Nunca trabajar solo en el laboratorio. 2. Usar siempre bata. 3. Usar lentes protectores y guantes cuando sea necesario. 4. Manipular el equipo caliente con guantes de asbesto o pinzas, para evitar quemaduras. 5. Mantener libre de objetos innecesarios la zona de trabajo. 6. Nunca perder de vista los reactivos y el sistema con que se est trabajando. 7. No comer, fumar o jugar dentro del laboratorio. 8. Utilizar todo el material de laboratorio limpio y seco. 9. Nunca pipetear los reactivos lquidos con la boca. 10. Nunca devolver al envase original los remanentes de reactivos no utilizados. 11. Lavarse bien las manos al final de cada sesin de laboratorio. 12. Antes de usar un reactivo, verificar los datos anotados en la etiqueta y 13. consultar sus propiedades fsicas, qumicas y toxicolgicas para manejarlo adecuadamente. 14. Nunca probar el sabor u olor de ningn producto, a menos que sea estrictamente necesario y seguro. 15. Para oler una sustancia, sta no debe ponerse directamente debajo de la nariz; por el contrario, se mueve la mano sobre ella para percibir su aroma sin peligro. 16. Los productos qumicos nunca se tocan directamente con las manos, especialmente aquellos que, adems de su toxicidad, pueden producir quemaduras graves. Todo manejo se har mediante esptulas. 17. Todo compuesto voltil o que desprenda humos o vapores txicos deber manejarse en las campanas o permanecer en un lugar ventilado. 18. Si se derrama cido sobre la mesa, se debe recoger inmediatamente y lavar la superficie con agua varias veces. 19. No debe mirarse dentro de un tubo o matraz que contenga una reaccin o sustancia que se est calentando. 20. Las soluciones concentradas de lcalis o cidos deben neutralizarse antes de ser desechadas por el desage. 21. No se deben tirar por la tarja lquidos inflamables, irritables o lacrimgenos. 22. Cuando utilice cidos, hgalo en la campana de extraccin y siempre protegido con guantes y lentes de seguridad. 23. Para preparar una solucin diluida de cido se debe aadir, lentamente, con agitacin y con enfriamiento externo, el cido al agua, nunca el agua sobre el cido ya que la reaccin es muy exotrmica y puede proyectarse violentamente. 24. Antes de poner a calentar lquidos, stos deben estar bien mezclados (si son miscibles; en caso contrario, al hervir el de menor punto de ebullicin puede proyectarse o explotar. Los de bajo punto de ebullicin no se deben calentar nunca en recipientes de cuello corto). 25. En una destilacin no se deben obstruir los condensadores ni los tubos de evacuacin.
Universidad Nacional Autnoma de Honduras 4 Manual de Laboratorio
2. Incendios
Las razones ms comunes de incendio son: 1. Hacer hervir un disolvente voltil o inflamable con un mechero y sin un condensador 2. Mantenerlo cerca de alguna fuente de calor o chispa. 3. Arrojar reactivos y los desechos de reacciones exotrmicas u organometlicas en la tarja. 4. Mezclar sustancias que al reaccionar generan vapores o gases inflamables. 5. No respetar las condiciones de almacenamiento de reactivos inestables, voltiles o que pueden reaccionar violentamente con: temperatura, agua, cidos, bases, agentes oxidantes, reductores o compuestos de elementos pesados. Las precauciones que se deben de tomar son las siguientes: 1. Conocer bien la toxicidad de cada reactivo y las precauciones de necesarias al usarlo. 2. Evitar el uso de mecheros; en su lugar se usarn baos de agua, parrillas de calentamiento o canastillas. 3. Ser muy cuidadoso al utilizar disolventes inflamables y voltiles. 4. Conocer la temperatura de ignicin espontnea de las sustancias.
3. Explosiones
Las explosiones pueden ocurrir en las siguientes situaciones: 1. Una reaccin exotrmica no controlable (que provoca explosin y fuego) 2. Una reaccin de residuos de perxidos al concentrarse soluciones etreas a sequedad. 3. Una explosin por calentamiento, secado, destilacin o golpe de compuestos inestables. 4. Mezclar sustancias incompatibles que generan vapores o gases inflamables o explosivos. 5. Para evitar explosiones, una regla esencial es conocer las condiciones de almacenamiento y uso de cada sustancia.
4. Primeros auxilios
En caso de incendio, aljese rpidamente y permita que su asesor lo apague con el extinguidor que debe haber en el laboratorio. Si esto ya no es posible, salga
Universidad Nacional Autnoma de Honduras 5 Manual de Laboratorio
rpidamente del laboratorio. Si el luego afecta ya a algn compaero, trate de quitarle las prendas que se estn consumiendo y retrelo de la zona del siniestro. En caso de explosin, salga inmediatamente del laboratorio y si le es posible, ayude a sus compaeros afectados. Avise al resto del personal de laboratorio para que presten auxilio. Si se salpica la piel con cidos, lvese inmediatamente con agua abundante y aplquese una disolucin de bicarbonato sdico. Si una sustancia lo salpica sobre los ojos, enjuguese inmediatamente con el lavaojos o bien con agua abundante y despus con una solucin de brax (que debe existir en el botiqun del laboratorio). Si persisten las molestias, consulte al mdico. Cuando se ingiere un cido fuerte, se puede neutralizar con melox o su equivalente. Cuando se ingiere una base se neutraliza con jugo de naranja o de uva, o con vinagre. Cuando se haya ingerido una sustancia venenosa o txica y sea necesario provocar vmito, utilice un emtico.
Emtico: es una mezcla de sustancias que sirven para producir el vmito y liberar al estmago del veneno. Algunos emticos son: -Agua con mostaza: se agrega una cucharadita de t de mostaza a un vaso de agua caliente. Se administra una cuarta parte del contenido. -Agua salada: se disuelven dos cucharaditas de sal en agua caliente y se toma la dilucin a intervalos de un minuto hasta suministrar ms o menos cuatro vasos. -Agua con jabn: se agita un pedazo de jabn en agua caliente. Nota: Los emticos no deben administrarse nunca cuando el paciente est: a) Inconsciente o con convulsiones b)Incapacitado para deglutir c) Lastimado por haber tragado un veneno corrosivo Para neutralizar el efecto de una sustancia venenosa o txica, debe administrarse un antdoto. Antdoto: es una sustancia que se suministra para hacer inofensivo un veneno o para retardar su accin.
Universidad Nacional Autnoma de Honduras 6 Manual de Laboratorio
Antdoto universal: esta mezcla se prepara con dos partes de carbn activado, una de xido de magnesio y una de cido tnico. Se homogeniza totalmente y se guarda en seco. Para administrar se disuelven 15 g en medio vaso de agua caliente. Si es necesario, se practica un lavado estomacal. Cuando la piel haya estado en contacto con una sustancia venenosa o haya sufrido alguna quemadura, despus de lavar la zona afectada aplique un emoliente
Emoliente: sirve para quitar el dolor de los tejidos y membranas inflamadas, por ejemplo la clara de huevo, la leche y el agua de cebada. Se administra despus de eliminar el veneno.
5. Botiqun de primeros auxilios
El botiqun de primeros auxilios debe existir en todo laboratorio de qumica y debe contener: Material de curacin Gasas Apsitos Torundas Hisopos Tela adhesiva Instrumental Tijeras de punta Pinza de diseccin sin dientes Jeringas de varios tamaos Un torniquete vendas Antispticos Alcohol Agua oxigenada Merthiolate Benzal Violeta de genciana vinagre Bicarbonato de sodio cido brico (brax) melox
Universidad Nacional Autnoma de Honduras 7 Manual de Laboratorio
CUESTIONARIO
Describa brevemente las normas bsicas de conducta que se deben observar en todo laboratorio. 1. Antes de manipular una sustancia, qu es lo que debe conocer de ella? 2. Cules son las causas ms frecuentes de incendio en un laboratorio de qumica? 3. Qu son un antdoto y un emtico? 4. Si un compaero ha ingerido una sustancia corrosiva y sta le ha afectado la garganta, la trquea, etc., por qu no debe provocarle el vmito? 5. Cmo se prepara el antdoto universal?
Universidad Nacional Autnoma de Honduras 8 Manual de Laboratorio
Practica No. 2
IDENTIFICACION DE COMPUESTOS ORGANICOS
OBJETIVOS
Al finalizar la prctica el alumno ser capaz de: a) Explicar la importancia de la Qumica Orgnica en el rea de las ciencias biolgicas y de la salud. b) Reconocer las caractersticas ms importantes de los compuestos orgnicos. c) Aplicar una serie de pruebas sencillas que le permitan identificar y/o diferenciar a un compuesto orgnico de uno inorgnico.
INTRODUCCIN
"La Qumica Orgnica es la parte de la qumica que estudia los compuestos de carbono Sustancias como CO, CO2, H2CO3, carbonatos, HCN y cianuros aunque contienen carbono presentan propiedades ms prximas a los compuestos inorgnicos
Universidad Nacional Autnoma de Honduras 9 Manual de Laboratorio
Para conocer este apartado usted deber realizar una consulta bibliogrfica: explicar la teora de la fuerza vital y har una resea de los hechos ms importantes en la historia de la qumica orgnica. Su trabajo no exceder de 10 pginas incluyendo portada, objetivos, contenido, conclusiones y bibliografa. Lo enviaran como documento adjunto al correo de su instructor antes del 06 de octubre del 2009
DONDE SE ENCUENTRAN LOS COMPUESTOS ORGANICOS
Los seres vivos estamos formados por molculas orgnicas, protenas, cidos nucledos, azcares y grasas. Todos ellos son compuestos cuya base principal es el carbono. Los productos orgnicos estn presentes en todos los aspectos de nuestra vida: la ropa que vestimos, los jabones, champs, desodorantes, medicinas, perfumes, utensilios de cocina, la comida, etc. Los productos orgnicos han mejorado nuestra calidad y esperanza de vida. Podemos citar una familia de compuestos que a casi todos nos ha salvado la vida, los antibiticos
CARBONO
El carbono es un elemento qumico de nmero atmico 6 y smbolo C. Es slido a temperatura ambiente. Dependiendo de las condiciones de formacin, puede encontrarse en la naturaleza en distintas formas alotrpicas, carbono amorfo y cristalino en forma de grafito o diamante. Es el pilar bsico de la qumica orgnica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este nmero en unos 500.000 compuestos por ao, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre. El carbono es un elemento notable por varias razones. Sus formas alotrpicas incluyen, sorprendentemente, una de las sustancias ms blandas (el grafito) y la ms dura (el diamante) y, desde el punto de vista econmico, uno de los materiales ms baratos (carbn) y uno de los ms caros (diamante). Ms an, presenta una gran afinidad para enlazarse qumicamente con otros tomos pequeos, incluyendo otros tomos de carbono con los que puede formar largas cadenas, y su pequeo radio atmico le permite formar enlaces mltiples
Universidad Nacional Autnoma de Honduras 10 Manual de Laboratorio
El Carbono
Smbolo: C Nmero atmico: 6 Grupo IV A, 2do periodo Configuracin electrnica: 1s22s22p2 Formas alotrpicas: grafito y diamante. Capacidad de formar enlaces covalentes con otros tomos de carbono.
Caractersticas de los Compuestos Orgnicos
Composicin elemental: C, H, O, N, S, P, Cl, Br, etc. Son muy sensibles al calentamiento y a los agentes qumicos. Son combustibles y poco densos No electro conductores Poco Hidrosolubles Bajos puntos de ebullicin Pueden ser de origen natural u origen sinttico Presentan enlace covalente Presentan isomera Existen ms de 4 millones (son muy abundantes) Presentan concatenacin
PARTE PRCTICA
-Solubilidad
Se compara la capacidad de formar una mezcla homognea con un solvente polar (agua) vs un solvente apolar (hexano)
Universidad Nacional Autnoma de Honduras 11 Manual de Laboratorio
-Conductividad Elctrica
La conductividad elctrica es la capacidad de un cuerpo de permitir el paso de la corriente elctrica a travs de s
-Combustin
Completa Incompleta
-Desprendimiento de Amoniaco
Al calentar la urea se desprende amoniaco y cido isocinico. Con este ensayo se comprueba que los compuestos orgnicos son sensibles al calor
Universidad Nacional Autnoma de Honduras 12 Manual de Laboratorio
Practica No. 3
ALCANOS
OBJETIVOS
Al finalizar el alumno ser capaz de: a) Conocer las caractersticas de los alcanos y sus propiedades y usos. b) Realizar algunas pruebas para determinar solubilidad, inflamabilidad y obtencin del metano. c) La importancia de conocer sus aplicaciones en la industria y en la medicina.
INTRODUCCIN
Los alcanos son hidrocarburos, es decir que tienen slo tomos de carbono e hidrgeno. La frmula general para alcanos alifticos (de cadena lineal) es CnH2n+2, y para ciclo alcanos es CnH2n. Tambin reciben el nombre de hidrocarburos saturados A pesar de ello son muy importantes porque: -Su estudio nos permitir entender el comportamiento del esqueleto de los compuestos orgnicos (conformaciones, formacin de radicales) -Constituyen una de las fuentes de energa ms importantes para la sociedad actual (petrleo y sus derivados).
Universidad Nacional Autnoma de Honduras 13 Manual de Laboratorio
PROPIEDADES FSICAS
Punto de ebullicin. Los puntos de ebullicin de los alcanos no ramificados aumentan al aumentar el nmero de tomos de Carbono. Para los ismeros, el que tenga la cadena ms ramificada, tendr un punto de ebullicin menor. Solubilidad. Los alcanos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrgeno. Los alcanos lquidos son miscibles entre s y generalmente se disuelven en disolventes de baja polaridad. Los buenos disolventes para los alcanos son el benceno, tetra cloruro de carbono, cloroformo y otros alcanos.
PROPIEDADES QUMICAS
Los alcanos arden en el aire con llama no muy luminosa y produciendo agua y anhdrido carbnico. La energa trmica desprendida en la combustin de un alcano puede calcularse por: Q = n * 158.7 + 54.8 caloras Donde n = nmero de tomos de carbono del alcano. El principal mtodo para la obtencin de alcanos es la hidrogenacin de alquenos
Reacciones. Las reacciones ms importantes de los alcanos son la combustin. El metano es el primer alcano El metano es explosivo cuando est mezclado con aire y es un agente muy fuerte en el efecto invernadero. Otros alcanos menores tambin forman mezclas explosivas con el aire. Los alcanos lquidos ligeros son altamente inflamables, aunque este riesgo decrece con el aumento de la longitud de la cadena de carbono. El pentano, hexano, heptano y octano estn clasificados como peligrosos para el medio ambiente y nocivos.
Universidad Nacional Autnoma de Honduras 14 Manual de Laboratorio
ABUNDANCIA DE LOS ALCANOS EN EL UNIVERSO
El metano y el etano constituyen una parte importante en la composicin de la atmsfera de Jpiter. Extraccin de petrleo, que contiene muchos hidrocarburos diferentes, incluyendo alcanos. Los organismos Archaea metano gnica en el estmago de esta vaca son responsables de algo del metano en la atmsfera de la Tierra. El agua forma gotas sobre la pelcula delgada de cera de alcanos en la cscara de la manzana
APLICACIONES
Las aplicaciones de un cierto alcano pueden ser determinadas bastante bien de acuerdo al nmero de tomos de carbono. Los cuatro primeros alcanos son usados principalmente para propsitos de calefaccin y cocina, y en algunos pases para generacin de electricidad. El metano y el etano son los principales componentes del gas natural; pueden ser almacenados como gases bajo presin. Sin embargo, es ms fcil transportarlos como lquidos: esto requiere tanto la compresin como el enfriamiento del gas. Son llamados gas de pantano Por ejemplo, el propano se usa en el quemador de gas propano, el butano en los encendedores descartables de cigarrillos. Estos dos alcanos son usados tambin como propelentes en pulverizadores. Los alcanos a partir del hexadecano en adelante constituyen los componentes ms importantes del aceite combustible y aceite lubricante. Reacciones Las reacciones ms importantes de los alcanos son: Halogenacion Combustin
PRACTICA
Solubilidad
Comprobar propiedades fsicas, como solubilidad con agua y en gasolina. 1) Colocar en cinco tubos de ensayo: gasolina, querosn, aceite lubricante (derivado de petrleo) n-hexano y n-heptano, agregue agua a cada uno de ellos y observe 2) Repetir la experiencia anterior sustituyendo el agua por otro solvente orgnico
Universidad Nacional Autnoma de Honduras 15 Manual de Laboratorio
Inflamabilidad
Comprobar la combustin completa de hidrocarburos 1) Colocar en tres vidrios de reloj gasolina, querosn y aceite, acercar a cada uno un fosforo encendido con precaucin y anotar el resultado.
Obtencin del Metano.
1. Pesar 10.0 gr de cal 2. Pesar 1.0gr de NaOH 3. Mezclar cal y NaOH pesados anteriormente. 4. Pesar 4.0gr de acetato de calcio 5. Mezclar los 4.0gr de acetato de calcio y 4.0gr de la mezcla de cal y NaOH 6. Introducir los 8gr en un tubo de desprendimiento. 7. Armar el montaje 8. Hacer prueba de inflamabilidad con un fosforo, la aparicin de una llama azul comprueba la presencia de metano.
La cal sodada es una mezcla de sodio y calcio, este ltimo no interviene en la reaccin y tiene por objeto impedir la accin fuerte de los lcalis sobre el vidrio del material donde se prepara el metano.
Universidad Nacional Autnoma de Honduras 16 Manual de Laboratorio
Investigacin correspondiente a la prctica I (identificacin de compuestos orgnicos y alcanos)
1 ) Enumere las diferencias entre los compuestos orgnicos e inorgnicos. 2) Que es un solvente polar y un solvente no polar 3) Factores de que depende la solubilidad de un compuesto 4) Toxicidad del monxido de carbono 5) Usos del holln 6) Clasifique los hidrocarburos como ser (gasolina, querosn, aceite lubricante, etc..) de acuerdo a la cantidad de tomos de carbono en su estructura 7) Usos del metano
Universidad Nacional Autnoma de Honduras 17 Manual de Laboratorio
Practica No. 4
AISLAMIENTO DE LIMONENO DE NARANJAS
OBJETIVO
El alumno realizar la extraccin de limoneno a partir de cascaras de naranja mediante un disolvente, lo purificar por destilacin y comprobara que en su estructura existen dobles enlaces carbono-carbono.
INTRODUCCIN
El limoneno (Fig. 3.1a) pertenece a una clase de compuestos qumicos conocidos como terpenos. Los terpenos tienen como unidad bsica la del isopreno o 2-metil-1,3butadieno (Fig.3.1b). El limoneno se encuentra en muchos aceites esenciales, por ejemplo en: limones, naranjas, limas, bergamota y alcaravea. Los terpenos son una familia que se presenta en forma muy variada en muchas plantas. Por ejemplo el geraniol, la mentona, el menteno, el pineno, etc., son aceites esenciales que se encuentran en los geranios, la menta y el rbol de pino respectivamente. El limoneno posee un carbono quiral, por lo que las formas (+) o (-) se presentan de manera natural. Sin embargo, los rboles de naranja producen slo uno de dichos enantimeros. El alcanfor es un terpeno que puede separarse de la esencia de manzanilla (Matricaria camomilla), y puede reducirse para obtener el isoborneol y el borneol que se utiliza en la esencia de lavanda. Por otro lado,
Universidad Nacional Autnoma de Honduras 18 Manual de Laboratorio
el terpeno llamado canfeno puede extraerse del romero y su forma levgira se presenta en el citronelal o en la valeriana.
MATERIAL DE VIDRIO
1 matraz redondo de tres bocas y de 500 ml 1 condensador 1 junta en Y para destilacin 1 tapn de vidrio 1 adaptador curvo para destilacin 1 matraz Erlenmeyer de 50 ml 1 embudo de adicin 1 embudo de separacin
EQUIPO DE LABORATORIO
3 soportes universales 3 pinzas con nuez. 1 termostato 1 manta de calentamiento 1 parrilla 1 cuchillo de cocina 1 refractmetro de Abbe (ver Figs. C 9 y C 10 del anexo C) Nota: Si desconoce alguna pieza de vidrio o equipo de laboratorio, puede revisar el anexo 13 de material de vidrio y equipo de laboratorio.
SUSTANCIAS Y REACTIVOS
La cascara de tres naranjas Agua destilada Pentano (o ter) Sulfato de sodio anhidro, Na2SO4 Permanganato de potasio, KMnO4
Universidad Nacional Autnoma de Honduras 19 Manual de Laboratorio
PROCEDIMIENTO
Con un cuchillo de cocina se quita la cascara a tres naranjas, con todo y la pulpa blanca que lleva adherida, cuidando de no presionar o tocar demasiado la cascara para evitar la prdida del aceite esencial. Con ella se prepara un picadillo o. s se puede, un pur en un matraz redondo de tres bocas y de 500 ml. En la boca central se ensambla un aparato de destilacin (ver la Fig. C 3 del anexo C); en la boca lateral se coloca un embudo para adicionar agua. Se utiliza un matraz. Erlenmeyer para colectar el destilado. Se adiciona agua al pur y se calienta procurando que la ebullicin no sea muy violenta y que el nivel de lquido en el interior del matraz se mantenga constante durante el proceso de destilacin. Debe destilarse tan rpido como sea posible, de manera que se colecten 150200 ml de lquido turbio o aceitoso. El pur del matraz, se desecha y el destilado se enfra. El destilado se transfiere a un embudo de separacin y se adicionan 5-10 ml de pentano (o bien ter), se agita vigorosamente y se deja reposar para que las capas se separen. La disolucin de pentano se coloca en un pequeo matraz Erlenmeyer y se seca con sulfato de sodio anhidro. La disolucin se filtra o decanta en un recipiente previamente pesado y el pentano se evapora con un bao de vapor. Se pesa nuevamente el matraz con el limoneno, se mide el volumen y se determina su ndice de refraccin.
ANLISIS
Para comprobar la presencia de los dobles enlaces del limoneno, puede realizarse una pequea prueba con disolucin de bromo. Para ello se vierten 0,5 ml de tetrahidrofurano en un tubo de ensayo, se adicionan dos o tres gotas de la sustancia por analizar y se mezcla hasta disolver. Se agrega gota a gota una solucin al 2% de bromo lquido en tetracloruro de carbono. Una prueba de la existencia de dobles o triples enlaces es positiva cuando la solucin se vuelve incolora. El color rojo-caf del bromo desaparece cuando se adiciona a un compuesto con doble enlace C=C. ya que se forma un compuesto hidrohalogenado que generalmente es transparente. Aclaramos que tal procedimiento no se puede utilizar cuando existen sistemas conjugados. Otra alternativa es realizar una prueba con disolucin acuosa de KMnO4. La disolucin violeta de permanganato de potasio se vuelve de color caf claro o incolora debido a que se oxidan y rompen los dobles enlaces C=C. Es posible obtener el espectro IR del limoneno y compararlo con el espectro IR-18 del anexo A.
Universidad Nacional Autnoma de Honduras 20 Manual de Laboratorio
CUESTIONARIO
1. Cuntas unidades de isopreno intervienen para formar el limoneno? Identifquelas. 2. Existen 14 posibles ismeros para la misma frmula, (' ii.., que difieren en la posicin de los dobles enlaces; dibuje sus estructuras. 3. El limoneno es una molcula polar o no polar? 4. Identifique el centro quiral del limoneno. 5. Durante la separacin del limoneno a partir de su disolucin acuosa, Qu capa lo contiene, la superior o la inferior? Por qu? 6. El punto de ebullicin del limoneno es de 177C; entonces, por qu es posible separarlo de las cascaras del ctrico por destilacin con agua? 7. Investigue la estructura del canfeno y sugiera un posible mtodo para extraer el canfeno del romero. 8. La vitamina A es tambin un terpeno que puede separarse con hexano de las zanahorias y de las espinacas. Cul es su estructura? Cuntas unidades de isopreno la forman?
BIBLIOGRAFA
Clarke F. Most. Jr. 1988. Experimental Organic Chemistry. USA, John Wiley & Sons. D. L. Pavia, G. M. Lampman y G. S. Kriz, Jr. 1982, Organic Laboratory Techniques. 2a ed. New York. Saunders, p. 163. H. A. Strobel, 1982. Instrumentacin qumica. 1a ed. Mxico. Limusa.
Universidad Nacional Autnoma de Honduras 21 Manual de Laboratorio
Practica No. 5
ALQUINOS
INTRODUCCIN
Por otra parte Los alquinos son hidrocarburos alifticos con al menos un triple enlace entre dos tomos de carbono. Se trata de compuestos metaestables debido a la alta energa del triple enlace carbono-carbono. Su frmula general es CnH2n-2. Son insolubles en agua, pero bastante solubles en disolventes orgnicos usuales y de baja polaridad: ter, benceno, tetracloruro de carbono. Son menos densos que el agua y sus puntos de ebullicin muestran el aumento usual con el incremento del nmero de carbonos y el efecto habitual de ramificacin de las cadenas. Los puntos de ebullicin son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado
Universidad Nacional Autnoma de Honduras 22 Manual de Laboratorio
Los tres primeros trminos son gases; los dems son lquidos o slidos. A medida que aumenta el peso molecular aumentan la densidad, el punto de fusin y el punto de ebullicin. Los acetilenos son compuestos de baja polaridad, por lo cual sus propiedades fsicas son muy semejantes a la de los alquenos y alcanos. La mayor parte de los alquinos se fabrica en forma de acetileno. A su vez, una buena parte del acetileno se utiliza como combustible en la soldadura a gas debido a las elevadas temperaturas que alcanzada, tambin en iluminacin ya que arden en presencia de oxgeno. En la industria qumica los alquinos son importantes productos de partida por ejemplo en la sntesis del PVC (adicin de HCl) de caucho artificial etc. El grupo alquino est presente en algunos frmacos citostticos. Los polmeros generados a partir de los alquinos, los polialquinos, son semiconductores orgnicos y pueden ser dotados parecido al silicio aunque se trata de materiales flexibles. Sntesis de Alquinos: Deshidrohalogenacion de un Dihaluro Geminal o Vecinal Reaccin de Acetiluros Metlicos con Halogenuros de alquilo.
SINTESIS DEL ACETILENO
Nombre de la Sntesis: ____________________________________________ 1. Colocar en un baln de 3 cuellos trozos de carburo clcico y armar el aparato como indica el esquema. 2. Hacer caer agua contenida en un embudo de separacin gota a gota. 3. Dejar desplazar el aire y llenar dos tubos de ensayo. 4. Tapar los tubos de ensayo y realizar pruebas. Reaccin de Sntesis: _____________________________________________________
Usos del Acetileno (Investigar): _________________________________ _________________________________ _________________________________
Universidad Nacional Autnoma de Honduras 23 Manual de Laboratorio
Pruebas a Realizar: a) Combustin: En esta prueba se comprobara la propiedad de los alquinos de sensibilidad al calor, as como tambin la comprobacin de la combustin completa. Procedimiento: - Tomar con una pinza de madera uno de los tubos de ensayo con etileno, destapar y acercarlo rpidamente a la llama del mechero.
Reaccin____________________________________________________
b) Reaccin de Insaturacion de Baeyer: En esta prueba comprobara la capacidad de los alquinos de oxidarse formando diferentes productos las cuales depender del medio en que se desarrolle la reaccin, la prueba se considera positiva cuando hay un cambio de coloracin morado-caf. Procedimiento: - Tome el tubo de ensayo con etileno agrguele 1 o 2 ml de KMnO4 y adicionar solucin de NaOH o NA2CO3.
Universidad Nacional Autnoma de Honduras 24 Manual de Laboratorio
Practica No. 6
COMPUESTOS AROMATICOS
INTRODUCCIN
En 1825, Faraday aisl un compuesto puro que presentaba un punto de ebullicin de 80C, a partir de una mezcla aceitosa que condensaba del gas del alumbrado, que era el combustible que se empleaba en las lmparas de gas. Posteriormente Mitscherlich sintetiz el mismo compuesto, calculo la densidad de vapor, lo que le permiti obtener el peso molecular que era aproximadamente 78, el cual corresponde a una frmula molecular de C6H6. Como dicho compuesto se haba obtenido a partir de la goma benju, se le denomino bencina y a partir de ah deriv el nombre a benceno como actualmente se le conoce. Ya a finales del siglo XIX se fueron descubriendo muchos otros compuestos que parecan estar relacionados con el benceno pues tenan bajas relaciones de hidrgeno a carbono y despedan aromas agradables, adems presentaban la peculiaridad de que se podan convertir en benceno o compuestos afines. A este grupo de compuestos se le llamo aromticos por presentar aromas agradables. Posteriormente el estudio de la estabilidad que presentaban estos compuestos, llevo consigo que el trmino aromtico se utilizara para designar a compuestos que presentaban una estabilidad muy similar, independientemente de su olor.
Universidad Nacional Autnoma de Honduras 25 Manual de Laboratorio
August kekule propuso en 1866 la estructura del benceno, la cual se deriv as:
En general, podemos decir que los compuestos aromticos estn constituidos por el benceno y todos aquellos compuestos que presentan un comportamiento qumico similar y que dan lugar a la serie aromtica, la cual se construye a partir del benceno. Los compuestos aromticos tienen las siguientes caractersticas: 1. 2. 3. 4. 5. 6. 7. Son cclicos, anillo aromtico. Hibridacin sp2 Planos Conjugados. Presentan estabilidad inusual. Reaccionan con electrfilos para dar productos de sustitucin. Cumplen la regla de Huckel 4n + 2
Las reacciones de los compuestos orgnicos son reacciones donde el anillo sirve de fuente electrnica a reactivos que buscan electrones (electrfilos) y debido a la estabilidad por resonancia, estas reacciones conducen a la sustitucin, algunas de las reacciones son: a) b) c) d) e) Sulfonacin Nitracin Halogenacion Alquilacin Acilacion
Los hidrocarburos aromticos ms importantes se encuentran en todas las hormonas animales o vegetales y vitaminas; prcticamente todos los condimentos, perfumes y tintes orgnicos, tanto sintticos como naturales; los alcaloides que no son alicclicos (ciertas bases alifticas como la putrescina a veces se clasifican incorrectamente como alcaloides), y sustancias como el trinitrotolueno (TNT) y los gases lacrimgenos. Por otra parte los hidrocarburos aromticos suelen ser nocivos para la salud, como los llamados BTEX:
Universidad Nacional Autnoma de Honduras 26 Manual de Laboratorio
benceno, tolueno, etilbenceno y xileno por estar implicados en numerosos tipos de cncer o el alfa-benzopireno que se encuentra en el humo del tabaco, extremadamente carcinognico igualmente, ya que puede producir cncer de pulmn. Muchos compuestos aislados de fuentes naturales son aromticos. Adems del benceno, el benzaldehdo y el tolueno, compuesto como la hormona esteroidal (estroma) y la morfina, analgsico bien conocido, tiene anillos aromticos. Muchos frmacos sintticos tambin son aromticos en parte; tranquilizante como El Diazepan.La exposicin prolongada del benceno puede producir Leucemia.
PARTE EXPERIMENTAL:
1-. Solubilidad: Comprueba la capacidad de los compuestos aromticos en disolverse en un compuesto polar o no polar. Compuesto H2O Etanol
2-. Oxidacin: Comprueba la capacidad de los compuestos de oxidarse ante agentes oxidantes fuertes como el KMnO4 y el K2Cr2O7. La prueba se considera positiva cuando da un cambio de coloracin de morado-caf en el caso que se use KMnO4.
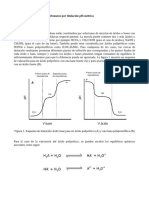
3-. Reconocimiento de Fenoles: Prueba de Uffelman : Reconoce la cantidad de grupos hidroxilos (OH) unidos a un anillo aromtico, la cual si al anillo est unido 1 grupo OH la coloracin ser amarilla , en cambio si estn unidos 2 OH al anillo su coloracin ser verde y si al tiene 3 OH unidos al anillo ser de color azul.
4-. Esterificacin de Fenoles: Procedimiento: A 0.5 ml de fenol se agrega gota a gota 1 ml de cloruro de acetilo. Observe si la reaccin es exotrmica, vace el producto obtenido en 20 ml de agua fra, observe la reaccin y aprecie el olor.
Universidad Nacional Autnoma de Honduras 27 Manual de Laboratorio
4-. Sntesis del cido Pcrico Nombre de la Sntesis: _______________________________________________________ Reacciones Involucradas: ____________________________________________________ Procedimiento: Pesar 2.0 gr de fenol y aadir 5.0 ml de cido sulfrico concentrado. SOLUCION A Medir 5 ml de cido sulfrico y mezclar con 5 ml de cido ntrico (hacer la mezcla en una campana de gases y en bao de hielo).SOLUCION B. Mezclar la solucin A y B (hacer la mezcla en una campana de gases y en bao de hielo). Colocar en beaker que contiene la mezcla en Bao Mara Observar la precipitacin de los cristales de Acido Pcrico.
Reaccin de Sntesis:
_________________________________________________________________________
Montaje:
Investigacin: Usos del cido Pcrico.
Universidad Nacional Autnoma de Honduras 28 Manual de Laboratorio
Practica No. 7
ALCOHOLES Y POLIOLES
OBJETIVO
a) Describir las propiedades fsicas y qumicas de los alcoholes y polioles. b) Que el alumno aprenda mediante pruebas qumicas la clasificacin de los alcoholes.
INTRODUCCIN
Son los compuestos que tienen grupos hidroxilo (OH), unido a una cadena carbonada con hibridacin sp3. La solubilidad de un alcohol en agua, o en un compuesto orgnico est relacionado con el nmero de grupos hidroxilos que contenga la molcula a mayor nmero de OH, con respecto al nmero de carbonos mayor ser la solubilidad en agua y menos en compuestos orgnicos. Por lo tanto el aumento del nmero de tomos de carbono con disminucin proporcional del nmero de grupos OH presentes da por resultado una menor solubilidad en agua y un aumento de la solubilidad en solventes orgnicos. Los alcoholes muestran un incremento bastante constante en el punto de ebullicin a medida que aumenta el nmero de tomos de carbono. La ramificacin de cadenas de carbono causa una disminucin en el punto de ebullicin.
Universidad Nacional Autnoma de Honduras 29 Manual de Laboratorio
CLASIFICACION
Segn el tipo de carbono al cual est unido el grupo hidroxilo en la cadena de los alcoholes se clasifican en: 1. Primarios 2. Secundarios 3. Terciarios
ALCOHOLES DE USO COMUN
Metanol Se denomina alcohol de madera porque se obtiene por destilacin seca. Se utiliza como disolvente para pinturas y como combustible. Es muy toxico, y produce ceguera cuando se ingiere o se inhala en pequeas cantidades. Etanol Se obtiene por fermentacin de carbohidratos (azucares y almidn) es muy venenoso y produce la muerte a concentraciones superiores al 0.4% en sangre. Se utiliza como antdoto contra el envenenamiento por metanol o glicol. Isopropanol Se mezcla con agua y todos los disolventes orgnicos, se emplea como anticongelantes, disolventes, limpiador, deshidratante, agente de extraccin y antisptico.
Universidad Nacional Autnoma de Honduras 30 Manual de Laboratorio
POLIOLES
Son compuestos orgnicos que poseen ms de un grupo hidroxilo y presentan propiedades similares a los alcoholes, los polioles los podemos clasificar en:
Dioles Trioles Tetradioles Pentadioles
2 grupos OH 3 grupos OH 4 grupos OH 5 grupos OH
Dioles: El etilenglicol se utiliza como disolvente, anticongelante, fluido hidrulico. El propilenglicol es utilizado en medicamentos y alimentos. Trioles: Su principal representante es la glicerina o 1,2,3 propanotriol, el propanotriol es uno de los principales productos de la degradacin digestiva de los lpidos en el curso del ciclo de Krebs. Se produce tambin como un producto intermedio de la fermentacin alcohlica Fue descubierta en 1779 por Scheele. Su nombre proviene de su sabor dulce. Es una sustancia muy viscosa, soluble en el agua y no toxica. Al nitrar la glicerina se forma un ester que es muy explosivo, conocido como nitroglicerina.
Mtodos de Preparacin de Alcoholes
HIDROLISIS BASICA DE HALUROS DE ALQUILO. HIDRATACION DE ALQUENOS
Universidad Nacional Autnoma de Honduras 31 Manual de Laboratorio REDUCCION DE COMPUESTO CARBONILO.
PRUEBAS DE ALCOHOLES
SOLUBILIDAD
1. El agua y el alcohol tienen propiedades semejantes (son polares) debido a que ambos contienen el grupo OH. 2. Al aumentar el nmero de tomos de carbono la solubilidad del alcohol disminuye
3. Colocar en un tubo de ensayo 5.0ml de alcohol X ensaye solubilidad en agua, luego cambie agua por benceno Observe. 4. Ensaye la solubilidad del glicerol en agua, benceno y ter.
DETERMINACION DE AGUA EN UN ALCOHOL. Caliente en tubo de ensayo aproximadamente 1.0g de CUSO4.5H2O hasta que su color pase de azul a blanco, una vez frio aada 5ml de alcohol que se le indique y djelo reposar, de existir agua en un alcohol el sulfato de cobre deshidratado, se torno azul de nuevo.
Universidad Nacional Autnoma de Honduras 32 Manual de Laboratorio
PRUEBA DE ESTERIFICACION a) Se mezcla 1 ml de cido actico, 1 ml de alcohol isoamlico y 2 gotas de cido sulfrico. b) Colocar a bao Mara durante 3 - 5 min. c) Verter esta mezcla en agua fra y determinar olor y consistencia.
En esta reaccin se obtiene el acetato de isoamilo. El cual tiene un olor caracterstico a banano y Consistencia oleosa. PRUEBA DE OXIDACION Adicionar al alcohol problema 5 ml de K2Cr2O7 al 10%. Agregar 5 gotas de cido sulfrico concentrado. Observar cambio de coloracin de naranja a verde acua
.
PRUEBA DE LUCAS Se basa en la diferencia de reactividad de los tres tipos de alcoholes. Reactivo de Lucas: ZnCl2/HCl til para clasificar a los alcoholes. La formacin de un halogenuro de alquilo (RX) a partir de un alcohol se manifiesta por la turbiedad que aparece cuando se separa el RX de la solucin, en consecuencia el tiempo que transcurra hasta la aparicin de la turbiedad es una medida de la reactividad del alcohol. La velocidad de reaccin es de terciario > secundario > primario
Universidad Nacional Autnoma de Honduras 33 Manual de Laboratorio
PRUEBA DE YODOFORMO. Esta prueba es especfica para identificar metil alcoholes y metil cetonas, estos compuestos orgnicos forman la sal soluble de un cido carboxlico (con un tomo de carbono menos), y se observan un precipitado amarillo de yodoformo CHI 3 (con punto de fusin 119).
Agregar 1.0ml de cada uno de los alcoholes 10 gotas de una solucin de yodo en yoduro de potasio (lugol), seguidamente agregue gota a gota una solucin de hidrxido de sodio hasta que la solucin se decolore, calentar suavemente a bao mara y djelo reposar de 10 a 15 minutos. RECONOCIMIENTO GLICERINA Fundir 1g de bisulfito de potasio en un tubo de desprendimiento, sobre la sal fundida dejar caer unas gotas de glicerina. La formacin de glicerina se reconoce por el fuerte y penetrante olor. Dar la reaccin de formacin Bisulfito de potasio + Glicerina
Investigacin 1. Usos de la glicerina 2. Podra emplear la oxidacin para diferenciar los tres tipos de alcoholes? Explique 3. Que familias se pueden sintetizar a partir de alcoholes
Universidad Nacional Autnoma de Honduras 34 Manual de Laboratorio
Practica No. 8
ALDEHIDOS Y CETONAS
OBJETIVO
Diferenciar los aldehdos de las cetonas por medio de pruebas cualitativas
INTRODUCCIN
Los aldehdos y cetonas son compuestos que contienen el grupo carbonilo (COO) , si uno de los tomos unido al grupo carbonilo es un tomo de hidrogeno , el compuesto es un aldehdo, el otro tomo unido al grupo carbonilo puede ser un Hidrogeno, Alquilo o arilo. En el caso de las cetonas, ambos grupos unidos al grupo carbonilo son alquilo o arilo. Tambin existen cetonas cclicas.
O R-C-H ALDEHIDO
O R-C-R CETONA
Los aldehdos y cetonas se encuentran entre los compuestos ms importantes tanto en la naturaleza como en la industria qumica: En la naturaleza, muchas de las sustancias necesarias para los seres vivos son aldehdos o cetonas. En la industria qumica se sintetizan grandes cantidades de tales compuestos, que se usan como solventes o como materias primas para una multitud de productos.
Universidad Nacional Autnoma de Honduras 35 Manual de Laboratorio
Son los compuestos que tienen grupos hidroxilo (OH), unido a una cadena carbonada con hibridacin sp3. La solubilidad de un alcohol en agua, o en un compuesto orgnico est relacionado con el nmero de grupos hidroxilos que contenga la molcula a mayor nmero de OH, con respecto al nmero de carbonos mayor ser la solubilidad en agua y menos en compuestos orgnicos. Por lo tanto el aumento del nmero de tomos de carbono con disminucin proporcional del nmero de grupos OH presentes da por resultado una menor solubilidad en agua y un aumento de la solubilidad en solventes orgnicos. Los alcoholes muestran un incremento bastante constante en el punto de ebullicin a medida que aumenta el nmero de tomos de carbono. La ramificacin de cadenas de carbono causa una disminucin en el punto de ebullicin.
Ejemplos: El Formaldehido: Es utilizado para fabricar materiales aislantes empleados en la industria de la construccin, tambin en disolucin con agua (formalina) es un conservador biolgico. El Benzaldehido es el aldehdo aromtico ms sencillo, se obtiene del aceite de almendras amargas. La Acetona es la cetona ms simple, es un disolvente industrial importante y el ingrediente principal de los removedores de esmaltes para uas. La Acetofenona perfumera. es la acetona aromtica ms sencilla, es utilizada en
Propiedades Fsicas
La doble unin del grupo carbonilo son en parte covalentes y en parte inicas dado que el grupo carbonilo est polarizado debido al fenmeno de resonancia. El formaldehdo a una temperatura de 20C es un gas, los dems aldehdos alifticos y aromticos son lquidos incoloros.
Universidad Nacional Autnoma de Honduras 36 Manual de Laboratorio
La mayor parte de los aldehdos de peso molecular bajo tienen olor intenso, y se intensifica cuando aumenta el peso molecular.
Los aldehdos y cetonas de bajo peso molecular son solubles en agua, cuando aumenta la longitud de la cadena disminuye dicha solubilidad Los compuestos carbonilicos presentan puntos de ebullicin ms bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullicin de aldehdos y cetonas de igual peso molecular.
PROPIEDADES QUMICAS
Se comportan como reductores, por oxidacin el aldehdo da cidos carboxlicos con igual nmero de tomos de carbono, y las cetonas no se oxidan en condiciones normales La reaccin tpica de los aldehdos y las cetonas es la adicin nucleoflica.
USOS
Los usos principales de los aldehdos y cetonas son: La fabricacin de: 1. 2. 3. 4. 5. 6. Resinas Plsticos Solventes Pinturas Perfumes Esencias
ALDEHDOS Y CETONAS IMPORTANTES
El formaldehdo Es un gas incoloro y de olor extremadamente irritante. Se disuelve en agua en soluciones del 37 al 40 % (Formol). Es germicida, astringente, antisptico y fungicida.
Universidad Nacional Autnoma de Honduras 37 Manual de Laboratorio
La conservacin de cadveres con formaldehdo depende ms de efecto antimicrobiano que el endurecimiento de los tejidos (se conjuga con las protenas)
El acetaldehdo Es un lquido incoloro, extremadamente voltil e importante en sntesis orgnica. El cloral Es el tricloroacetaldehdo, aceite inestable y desagradable por lo cual se introdujo en medicina en forma de hidrato de cloral, CCl3 CH(OH)2. Se utiliza en la sntesis del DDT y es el ms antiguo de los hipnticos. Es muy irritante a la piel y a la mucosa El paraldehido Es un compuesto cclico que se forma por la adicin nucleoflica de tres molculas de acetaldehdo. Es un lquido incoloro, de aroma fuerte y sabor urente desagradable. Es un hipntico de accin rpida. Es eficaz en convulsiones experimentales y se ha empleado en el tratamiento urgente del ttano, eclampsia, epilepsia y envenenamiento por medicamentos convulsionante
SNTESIS DE COMPUESTOS CARBONILOS
Para preparar aldehdos y cetonas se pueden emplear los siguientes mtodos: 1. Oxidacin de alcoholes primarios y secundarios:
Oxidacin de alcoholes con reactivos de cromo (VI). Los alcoholes primarios dan aldehdos y los secundarios cetonas.
Universidad Nacional Autnoma de Honduras 38 Manual de Laboratorio
2. Ozonlisis Los alquenos rompen con ozono generando aldehdos y cetonas. La reaccin requiere un reductor de segunda etapa. 3. Hidratacin de alquinos Hidratacin de alquinos, produce enoles que tautomerizan a compuestos carbonilos. sta hidratacin puede ser Markovnikov utilizando agua, sulfrico y sulfato de mercurio. La hidroboracin-oxidacin produce la adicin anti-Markovnikov.
PARTE EXPERIMENTAL Ensayo Fenilhidrazina
Reaccin de carbonilos con Fenilhidrazina
Los derivados de la hidrazina, fenilhidrazina y 2,4-dinitrofenilhidrazina, condensan con aldehdos y cetonas formando hidrazonas que dan precipitados de color amarillo. Esta reaccin se puede emplear como ensayo analtico para identificar aldehdos y cetonas, slo estos compuestos dan dicho precipitado.
Pruebas de Oxidacin
Los aldehdos oxidan fcilmente y se convierten en el cido carboxlico respectivo, en contraste con las cetonas que son difciles de oxidar, en presencia de los agentes oxidantes habituales de gran poder como el permanganato de potasio, dicromato de potasio y otros.
Ensayos Fehling y Tollens
Son ensayos analticos especficos de aldehdos, basados en su fcil oxidacin a cidos carboxlicos.
1. Ensayo de Fehling
El ensayo de Fehling se emplea como oxidante el in cprico en medio bsico, la precipitacin de xido cuproso (rojo) indica la presencia de un aldehdo.
Universidad Nacional Autnoma de Honduras 39 Manual de Laboratorio
2. Ensayo de Tollens
El ensayo de Tollens utiliza como reactivo una disolucin amoniacal de plata, con presencia de un aldehdo se produce un precipitado de plata elemental en forma de espejo de plata.
Oxidacin con KMnO4
El ensayo utiliza como reactivo una solucin de KmnO4 al 1% en medio bsico. O H3C-C-H KMnO4 O H-C-OH + MnO2 + KOH
Prueba de Yodoformo
Esta prueba es til para la determinacin de metil cetonas. Coloque en tubos de ensayo aproximadamente 2ml de agua y 5 gotas del aldehdo o cetona utilizados, se alcaliniza la solucin con 12 gotas de NaOH al 10%, luego se aade a la solucin el reactivo de lugol, hasta que se coloree de un color amarillo, si la reaccin es positiva despus de un minuto desaparece el color amarillo del yodo y se forma el precipitado de color amarillo del yodoformo.
Reactivo de Schiff
El reactivo de Schiff es clorhidrato de p-rosaanilina que se decolora con cido sulfuroso y reacciona con los aldehdos produciendo una coloracin prpura. Permite diferenciar los aldehdos de las cetonas. (No es una prueba de oxidacin)
Universidad Nacional Autnoma de Honduras 40 Manual de Laboratorio
Practica No. 9
ACIDOS CARBOXILICOS
OBJETIVO
Comprobar algunas propiedades fsicas y qumicas de los Acidos carboxlicos. Demostrar la importancia de estas sustancias en la farmacologa y medicina actual.
INTRODUCCIN
Los cidos carboxlicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH o CO2H.
Universidad Nacional Autnoma de Honduras 41 Manual de Laboratorio
Nomenclatura
Los nombres de los cidos carboxlicos se designan segn la fuente natural de la que inicialmente se aislaron. Se clasificaron as: Nombres y fuentes naturales de los cidos carboxlicos Estructura Nombre IUPAC cido metanoico Nombre comn Fuente natural
HCOOH
cido frmico
Destilacin destructiva de hormigas (formica en latn) Fermentacin del vino
CH3COOH
cido etanoico cido actico cido propanoico cido butanoico cido pentanoico cido hexanoico cido propinico
CH3CH2COOH
Fermentacin de lcteos (pion en griego)
CH3CH2CH2COOH
cido butrico
Mantequilla (butyrum, en latn)
CH3(CH2)3COOH
cido valrico
Raz de la valeriana officinalis
CH3(CH2)4COOH
cido caproico Dolor de cabeza
Caractersticas y propiedades
Los derivados de los Acidos carboxlicos tienen como frmula general R-COOH.
Tiene propiedades acidas; los dos tomos de oxigeno son electronegativos y tienden a atraer a los electrones del tomo de hidrogeno del grupo hidroxilo con lo que se debilita el enlace y es ms fcil que se ceda el correspondiente protn, H+, quedando el neutrn del cido, R-COO-.
Universidad Nacional Autnoma de Honduras 42 Manual de Laboratorio
Adems, en este anin, la carga negativa se distribuye (se deslocaliza) simtricamente entre los dos tomos de oxgeno, de forma que los enlaces carbono-oxigeno adquieren un carcter de enlace parcialmente doble. Generalmente los cidos carboxlicos son cidos dbiles, con solo un 1% de sus molculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolucin acuosa. Pero si son ms cidos que otros, en los que no se produce esa deslocalizacin electrnica, como por ejemplo los alcoholes. El ion resultante, R-COOH-, se nombra con el sufijo "-ato". Por ejemplo, el anin procedente del cido actico se llama ion acetato. Al grupo COO- se le denomina carboxilato.
Propiedades fsicas
Los cidos de masa molar baja (hasta diez tomos de carbono) son lquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al cido actico; el de la mantequilla rancia al acido butrico. El cido caproico se encuentra en el pelo y secreciones del ganado caprino. Los cidos C5 a C10 poseen olores a cabra. El resto solidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusin y ebullicin crecen al aumentar la masa molar. Los cidos inferiores son solubles en agua; su solubilidad decrece a partir del cido butrico con el aumento del carcter hidrocarbonado de la molcula. Todos los cidos son solubles en solventes orgnicos
Derivados de Acidos Carboxlicos
Los principales derivados de cidos carboxlicos son: 1. 2. 3. 4. 5. Esteres Amidas Anhdridos Nitrilos Sales acidas
Universidad Nacional Autnoma de Honduras 43 Manual de Laboratorio
PRACTICA
1. SOLUBILIDAD En un tubo de ensayo coloque 1 ml o 1 g del cido carboxlico y agregue agua hasta la mitad del tubo de ensayo agite y observe si las sustancias se disuelven. Repita la experiencia sustituyendo el agua por un solvente orgnico como el etanol. 2. OXIDACION Coloque en un tubo de ensayo 1 ml o 1g del cido carboxlico y agregue 5 ml de la solucin alcalina de permanganato de potasio, observe si ocurre algn cambio. 3. SINTESIS DE ACIDO BENZOICO La sntesis ms sencilla es tratar al benceno con una alquilacin Friedel-Crafts con un halogenuro de metilo en AlCl3 para dar tolueno y posteriormente llevarlo a cabo con una oxidacin con permanganato de potasio en medio acido (KmnO4/ H+). El producto ser acido benzoico. 4. SINTESIS DEL ACIDO ACETIL SALICILICO La reaccin qumica de la sntesis de la aspirina se considera una esterificacin. El cido saliclico es tratado con anhdrido actico, un compuesto derivado de un cido, lo que hace que el grupo alcohol del salicilato se convierta en un grupo acetilo (salicilato-OH salicilato-OCOCH3). Este proceso produce aspirina y cido actico, el cual se considera un subproducto de la reaccin. La produccin de cido actico es la razn por la que la aspirina con frecuencia huele como a vinagre. Como catalizador casi siempre se usan pequeas cantidades de cido sulfrico y ocasionalmente cido fosfrico. El mtodo es una de las reacciones ms usadas en los laboratorios de qumica en universidades de pregrado.
REACCION QUIMICA
Universidad Nacional Autnoma de Honduras 44 Manual de Laboratorio
5. SINTESIS DEL ACETAMINOFEN Las reaccin del p-aminofenol con anhdrido actico, produce la acetilacin del primero, obtenindose como productos el paracetamol y cido actico. Aunque conviene proteger el grupo hidroxilo fenlico debido a su mayor poder nucleofilo, respecto al nitrgeno anilinico. 6. SINTESIS DE LA BENZOCAINA Se obtiene por esterificacin a partir del cido p-aminobenzoico (PABA); de forma esquemtica: acido p-aminobenzoico + etanol + acido (catalizador) benzocana Tambin se puede sintetizar por reduccin del correspondiente nitrobenzoato. Uno de sus usos comunes es el anestesiar localmente las heridas bucales, como fuegos, aftas, etc... La benzocana o p-aminobenzoato de etilo es el ester etlico del cido p-aminobenzoico (PABA). Es un anestsico local, empleado como calmante del dolor.
INVESTIGACIONES
1. REACCION QUIMICA DE LA SINTESIS DE: ACETAMINOFEN BENZOCAINA ACIDO BENZOICO 2. NOMBRE QUIMICO DEL ACETAMINOFEN 3. NOMBRES COMERCIALES DEL ACIDO ACETIL SALICILICO Y DEL ACETAMINOFEN.
También podría gustarte
- 12 . - Empacadores y Accesorios Del Aparejo de ProducciónDocumento47 páginas12 . - Empacadores y Accesorios Del Aparejo de Producciónjose abundio100% (3)
- Manual Seleccion Bombas Desplazamiento Positivo UIS 2011Documento495 páginasManual Seleccion Bombas Desplazamiento Positivo UIS 2011Andrés Lizcano100% (15)
- Calculo de AcometidaDocumento13 páginasCalculo de AcometidaadictosradioAún no hay calificaciones
- P.12 Preparación de Una Muestra de Jamón Serrano PDFDocumento1 páginaP.12 Preparación de Una Muestra de Jamón Serrano PDFAdRiiiAún no hay calificaciones
- Diapositivas SinterizacionDocumento22 páginasDiapositivas SinterizacionrafaelAún no hay calificaciones
- Cuna de Calor Radiante Airshield Iics90 PDFDocumento70 páginasCuna de Calor Radiante Airshield Iics90 PDFKevin SerranoAún no hay calificaciones
- Oil and Gas Innovation ForumDocumento59 páginasOil and Gas Innovation ForumNinfa SuarezAún no hay calificaciones
- ITBA - Terminacion - Pistoneo 1Documento17 páginasITBA - Terminacion - Pistoneo 1Federico Arquero100% (1)
- Guía QyF Laboratorio QOI I - 2017Documento20 páginasGuía QyF Laboratorio QOI I - 2017Maria Jose ValdebenitoAún no hay calificaciones
- 1ALibro1Cap2Fis PDFDocumento47 páginas1ALibro1Cap2Fis PDFJosefLopezAguilarAún no hay calificaciones
- Informe de Laboratorio 3Documento8 páginasInforme de Laboratorio 3Kinesis lduAún no hay calificaciones
- Practica 6Documento8 páginasPractica 6Jennifer LinoAún no hay calificaciones
- COMPLEJOMETRÍADocumento4 páginasCOMPLEJOMETRÍAYaney Yulei BrownAún no hay calificaciones
- Tema 5 Control de Calidad y Pureza de DrogasDocumento38 páginasTema 5 Control de Calidad y Pureza de DrogasEsteban A. SilvaAún no hay calificaciones
- 13 Eficiencia de Los Antiacidos 2018Documento3 páginas13 Eficiencia de Los Antiacidos 2018Carlos Portilla ArciniegasAún no hay calificaciones
- MG TEMA 4movilidad+bacterianaDocumento24 páginasMG TEMA 4movilidad+bacterianaBryan JumboAún no hay calificaciones
- Ficha de Seguridad GlicerinaDocumento2 páginasFicha de Seguridad Glicerinajohan bustacaraAún no hay calificaciones
- Voltamperometria HidrodinámicaDocumento2 páginasVoltamperometria HidrodinámicaFlorwenciaGonzalezAún no hay calificaciones
- Informe Análisis GravimetríaDocumento3 páginasInforme Análisis GravimetríaSamuel Gámez100% (1)
- FenolftaleinaDocumento6 páginasFenolftaleinaSarmiento FerAún no hay calificaciones
- Informe 3 4 Identificacion de DNADocumento1 páginaInforme 3 4 Identificacion de DNARaúl Zuñiga RiveraAún no hay calificaciones
- Cuestionario LMSODocumento3 páginasCuestionario LMSOAle DragonAún no hay calificaciones
- Preguntas ExtrasDocumento1 páginaPreguntas ExtrasJosé Raul Romero FigueroaAún no hay calificaciones
- Titulación Por PrecipitaciónDocumento8 páginasTitulación Por Precipitaciónoscar8rincon-7Aún no hay calificaciones
- Universidad de Antioquia Facultad de IngDocumento10 páginasUniversidad de Antioquia Facultad de IngNICOLAS GUERRERO ARANGOAún no hay calificaciones
- Deber 4 Jaime Pérez Cuestiones Cap1 SilvaDocumento4 páginasDeber 4 Jaime Pérez Cuestiones Cap1 Silvajaime perezAún no hay calificaciones
- Laboratorio 5 Aldehidos y CetonasDocumento11 páginasLaboratorio 5 Aldehidos y CetonasFernanda MartinezAún no hay calificaciones
- Rojo FenolDocumento6 páginasRojo FenolLeidy Milena Hernandez BarraganAún no hay calificaciones
- Informe # 3 - Practica de QuinonasDocumento10 páginasInforme # 3 - Practica de QuinonasANDRES CAMILO VILLAMIL HERNANDEZAún no hay calificaciones
- Cromatografia Capa FinaDocumento8 páginasCromatografia Capa FinaÁlan Hernández0% (1)
- La Enzima Fosfofructuquinasa en Higado de AlpacaDocumento5 páginasLa Enzima Fosfofructuquinasa en Higado de AlpacaEdita TorresAún no hay calificaciones
- Flav Ono IdesDocumento26 páginasFlav Ono IdesAnonymous vEEQ7019euAún no hay calificaciones
- Procedimiento de Preparacion y Valoracion de EDTADocumento3 páginasProcedimiento de Preparacion y Valoracion de EDTAstefanymor10Aún no hay calificaciones
- P3 - FQFDocumento3 páginasP3 - FQFDalia Candela SalazarAún no hay calificaciones
- Qan - U1 - A5 - MialDocumento24 páginasQan - U1 - A5 - MialRogelioValdezClarkAún no hay calificaciones
- Práctica 1. Diagnóstico ParasitarioDocumento9 páginasPráctica 1. Diagnóstico ParasitarioKATHYA ALEJANDRA ORTIZ DE LA ROSAAún no hay calificaciones
- Práctica 5 Análisis Carbonatos BicarbonatosDocumento4 páginasPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaAún no hay calificaciones
- Orga III-5Documento4 páginasOrga III-5mariferAún no hay calificaciones
- SecmeDocumento30 páginasSecmeCynthia DiOrAún no hay calificaciones
- Hds Eter Etílico Nom 018 2015 Mary Meag Guia de AccionesDocumento1 páginaHds Eter Etílico Nom 018 2015 Mary Meag Guia de Accionesamoalcristal969Aún no hay calificaciones
- Practica 2. Acido Acetil SalicilicoDocumento9 páginasPractica 2. Acido Acetil SalicilicogstorrespAún no hay calificaciones
- Extracción de La Cafeína Presente en Un CaféDocumento5 páginasExtracción de La Cafeína Presente en Un CaféYraya CalzadoAún no hay calificaciones
- AzetidinaDocumento664 páginasAzetidinarudy juaquin villa quispeAún no hay calificaciones
- Uso Del Refractometro de ABBE y DeterminDocumento10 páginasUso Del Refractometro de ABBE y DeterminEdgarRevillaChirinosAún no hay calificaciones
- Síntesis y Caracterizacción Del Ácido AcetilsalicílicoDocumento12 páginasSíntesis y Caracterizacción Del Ácido AcetilsalicílicoMartaYanesSánchezAún no hay calificaciones
- Informe1 Nitracion LilianaPinto 1410851 CorregidoDocumento11 páginasInforme1 Nitracion LilianaPinto 1410851 CorregidoLeonardo Alexander Perdigon RojasAún no hay calificaciones
- Re 10 Lab 020 Quimica Organica I v3Documento26 páginasRe 10 Lab 020 Quimica Organica I v3OscarAún no hay calificaciones
- Practica No - 7 Sintesis de BencildenacetofenonaDocumento2 páginasPractica No - 7 Sintesis de BencildenacetofenonaAmy GuillenAún no hay calificaciones
- Correccion de La MasaDocumento21 páginasCorreccion de La MasaDavid CañonAún no hay calificaciones
- Acido KaurenoicoDocumento3 páginasAcido KaurenoicoJhonatan RojasAún no hay calificaciones
- Reporte Voltametria y PolarografiaDocumento46 páginasReporte Voltametria y Polarografiadiogenes2011Aún no hay calificaciones
- Laboratorio 1 ParasitoDocumento16 páginasLaboratorio 1 ParasitoCarla Yelixa Garnica MenecesAún no hay calificaciones
- Practica 10Documento4 páginasPractica 10Oscar AlmazánAún no hay calificaciones
- 123-Msds Acido OxalicoDocumento5 páginas123-Msds Acido Oxalicoarsa1aAún no hay calificaciones
- Tarea Tres FuncionalesDocumento65 páginasTarea Tres FuncionalesJCKARLAún no hay calificaciones
- Oxima CiclohexanonaDocumento6 páginasOxima CiclohexanonaMonse VillegasAún no hay calificaciones
- CURVA TITULACION NH3 HCLDocumento2 páginasCURVA TITULACION NH3 HCLArmando MoraAún no hay calificaciones
- Umss Derecho InformeDocumento19 páginasUmss Derecho InformeJEANNE CALLE CALLEJASAún no hay calificaciones
- Síntesis Del CiclohexenoDocumento5 páginasSíntesis Del CiclohexenoSalvador Nicosia GironAún no hay calificaciones
- Informe Extraccion Soxhlet y Marcha FitoquimicaDocumento10 páginasInforme Extraccion Soxhlet y Marcha FitoquimicaJOAN PABLO GARNICA ZAPATAAún no hay calificaciones
- EquilibrioDocumento6 páginasEquilibrioSilvia SkyloveAún no hay calificaciones
- Estandarizacion de Soluciones PatrónDocumento10 páginasEstandarizacion de Soluciones Patrónmateo201211Aún no hay calificaciones
- Laboratorio 1. Fraccionamiento de Tejidos (Versión Final) - Agroindustrial PDFDocumento4 páginasLaboratorio 1. Fraccionamiento de Tejidos (Versión Final) - Agroindustrial PDFAndres Hurtado Saenz0% (4)
- Corregido-Determinación Del Contenido de Cloruro de Sodio en Sal para Consumo Humano Por Valoración VolumétricaDocumento11 páginasCorregido-Determinación Del Contenido de Cloruro de Sodio en Sal para Consumo Humano Por Valoración Volumétricacristian david londoño riverAún no hay calificaciones
- Normas de Seg. ORG2Documento7 páginasNormas de Seg. ORG2Gonzales AlissonAún no hay calificaciones
- Normas de SeguridadDocumento6 páginasNormas de SeguridadRamon García EscuderoAún no hay calificaciones
- Practica de NormasDocumento8 páginasPractica de NormasGonzales AlissonAún no hay calificaciones
- Pract 1 PDFDocumento5 páginasPract 1 PDFJefree Snayder Perez PorrasAún no hay calificaciones
- Clausulado Multiasistencia DaviviendaDocumento19 páginasClausulado Multiasistencia DaviviendaJenny Marcela Solano GuerreroAún no hay calificaciones
- Informe Fisicoquimica de Alimentos. MicroondasDocumento16 páginasInforme Fisicoquimica de Alimentos. MicroondasMario Perez Rivera50% (2)
- Impuesto Selectivo Al ConsumoDocumento11 páginasImpuesto Selectivo Al ConsumoCeleste MontenegroAún no hay calificaciones
- Mapa Mental Padres de La TermodiDocumento1 páginaMapa Mental Padres de La TermodiomarAún no hay calificaciones
- Informe 4. Ariete HidráulicoDocumento4 páginasInforme 4. Ariete HidráulicoGeraldine NiñoAún no hay calificaciones
- Sistemas Flex Unido - MergedDocumento316 páginasSistemas Flex Unido - MergedauxiliarsgiilkingenieriasasAún no hay calificaciones
- 6.5 Flujo Laminar y TurbulentoDocumento3 páginas6.5 Flujo Laminar y TurbulentoNriqueZhuniorAún no hay calificaciones
- Matriz de Obligaciones Ambientales HidroeléctricasDocumento14 páginasMatriz de Obligaciones Ambientales HidroeléctricasWillam Villarreal RosalesAún no hay calificaciones
- Parcial (Jose Bohorquez)Documento14 páginasParcial (Jose Bohorquez)david80147179100% (1)
- Practica de Multimetro ESPEDocumento8 páginasPractica de Multimetro ESPERonny TonyAún no hay calificaciones
- M4 Sistema de Suspensión y Neumático P1Documento14 páginasM4 Sistema de Suspensión y Neumático P1Franklin BravoAún no hay calificaciones
- Taller 3 Semana 7 Grupo 7 Informe BiomasaDocumento4 páginasTaller 3 Semana 7 Grupo 7 Informe BiomasaMario ManobandaAún no hay calificaciones
- Reparacion - 309566n PDFDocumento48 páginasReparacion - 309566n PDFPepe PedroAún no hay calificaciones
- Ciclo de Born-Haber.Documento10 páginasCiclo de Born-Haber.jcvm_1975Aún no hay calificaciones
- Maquinas Eléctricas II - Clase 05Documento25 páginasMaquinas Eléctricas II - Clase 05ANNieAún no hay calificaciones
- Silabo Impacto Ambiental 2017 2Documento2 páginasSilabo Impacto Ambiental 2017 2Javier Cossa CabanillasAún no hay calificaciones
- Master en Ingenieria IndustrialDocumento146 páginasMaster en Ingenieria IndustrialchapinoAún no hay calificaciones
- Plano Electrico de Mi Vivienda2 PDFDocumento1 páginaPlano Electrico de Mi Vivienda2 PDFIvan M. GüichardoAún no hay calificaciones
- 1161-Texto Del Artículo-3966-1-10-20170315Documento14 páginas1161-Texto Del Artículo-3966-1-10-20170315Man MoralesAún no hay calificaciones
- Informe de FundicionDocumento32 páginasInforme de FundicionMurcia MarcelaAún no hay calificaciones
- XVIII - B - Criterios de Disen o Arquitecto Nico para Primaria PDFDocumento87 páginasXVIII - B - Criterios de Disen o Arquitecto Nico para Primaria PDFJosé De Jesús MoralesAún no hay calificaciones
- Trabajo 1Documento9 páginasTrabajo 1Anonymous alzR2b1pqAún no hay calificaciones