Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Episodiosperidicosdeespumacinconimplicacindefilamentosgramnegativos Elmorfotipo0581 100902170343 Phpapp01
Episodiosperidicosdeespumacinconimplicacindefilamentosgramnegativos Elmorfotipo0581 100902170343 Phpapp01
Cargado por
Oladier Hoyos BastidasTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Episodiosperidicosdeespumacinconimplicacindefilamentosgramnegativos Elmorfotipo0581 100902170343 Phpapp01
Episodiosperidicosdeespumacinconimplicacindefilamentosgramnegativos Elmorfotipo0581 100902170343 Phpapp01
Cargado por
Oladier Hoyos BastidasCopyright:
Formatos disponibles
ARTICULOS
TECNICOS
Resumen
Las bacterias filamentosas Actinomicetos Gram positivos (GALO) y Microthrix parvicella son responsables de la espumacin en los fangos activos de las EDAR. La clasificacin de estos microorganismos se realiza segn Eikelboom (2000) y Jenkins et al. (2003) por morfotipos, los cuales muestran, a veces, una alta diversidad de especies usando sondas especficas. Un proceso peridico de espumacin en la EDAR del municipio de TorresTorres (Valencia) con dominancia del morfotipo 0581, ha permitido comprobar la identidad, tanto ptica como filogentica, de dicho morfotipo. Al contrario de lo que pueda parecer debido a su similitud morfolgica con Microthrix parvicella, el morfotipo 0581 se encuentra filogenticamente relacionado con el phyllum Chloroflexi y no con el phyllum Actinobacteria, al que pertenece Microthrix parvicella.
Episodios peridicos de espumacin con implicacin de filamentos Gram negativos. El morfotipo 0581: un desconocido
Por: Andrs Zornoza(*); Eva Rodrguez(**); Laura Isac(**); Jos Luis Alonso(***); Natividad Fernndez(**); Francisco Zorrilla(****); Vicente Fajardo(****) EDAR Quart-Benager (Valencia) Entidad Pblica de Saneamiento de la Generalidad Valenciana (Epsar) E-mail: azetazeta@hotmail.com Web: es.geocities.com/mndmicroscopico (**) Asociacin Cientfica Grupo Bioindicacin Sevilla (GBS) E-mail: g.b.s@lycos.es Web: www.grupobioindicacionsevilla.com (***) Universidad Politcnica de Valencia Ciudad Politcnica de la Innovacin Instituto del Agua y Medio Ambiente (I.I.M.A.A.) Grupo de Qumica y Microbiologa E-mail: jalonso@ihdr.upv.es (****) General Valenciana del Agua, S.A. (Egevasa) Edificio Torres del Turia C/ Santa Amalia, 2 , 2 Entresuelo, Pta. K - 46009 Valencia E-mail: egevasa@egevasa.es - Web: www.egevasa.es
(*)
Palabras clave:
Abstract
Periodical episodes of foaming involving gram-negative filaments. Morphotype 0581: an unknown. The gram-positive filamentous bacteria Actinomycetes (GALO) and Microthrix parvicella are responsible for foaming in active sludge in waste water treatment plants. According to Eikelboom (2000) and Jenkins et al. (2003), these micro-organisms are classified by morphotypes, which sometimes show a large diversity of species when specific probes are used. A study of the periodical foaming process in the waste water treatment plant in the municipality of Torres-Torres, in the province of Valencia, Spain, with a predominance of morphotype 0581, has made it possible to ascertain both the optical and phylogenetic identity of this morphotype. Contrary to what might have been expected in view of its morphological similarity to Microthrix parvicella, morphotype 0581 is phylogenetically related to the phyllum Chloroflexi and not to the phyllum Actinobacteria, to which Microthrix parvicella belongs.
2
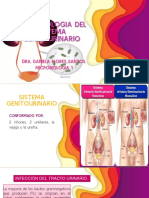
TECNOLOGIA DEL AGUA
1. Introduccin os microorganismos filamentosos son miembros junto con protozoos y metazoos de la microfauna de las plantas de tratamiento de aguas residuales por fangos activos, desempeando un papel esencial en la formacin del flculo (Madoni et al., 2000). Comnmente, la proliferacin excesiva de bacterias filamentosas genera problemas de explotacin y causa serios problemas de separacin en el clarificador. Estos problemas pueden ser clasificados en dos grandes grupos, que pueden aparecer de forma separada o conjunta: esponjamiento o bulking y espumacin o foaming. En este ltimo caso, los agregados de bacterias filamentosas se unen con burbujas de gas y partculas del flculo, formando espumas en la
superficie del tanque (Madoni et al., 2000). Este efecto genera la separacin de la masa de fango hacia la superficie, dando lugar a un ecosistema que tiende a evolucionar de forma diferente al resto, con caractersticas fisicoqumicas distintas. Estas espumas son generadas por determinadas bacterias filamentosas, usualmente Gram positivas con alto contenido en Guanina/Citosina (Seviour, 1999) que, por las caractersticas de su pared celular, pueden absorber compuestos de baja solubilidad (Martins et al., 2004) y fuertemente hidrofbicos. Dentro de las bacterias filamentosas con mayor capacidad para formar espumas estn: Microthrix parvicella, GALO, PTLO, T 0092, T 0675, T 0041 y bacterias cocales (Jenkins et al., 2003).
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
2. Identificacin de bacterias filamentosas Evidentemente, la identificacin correcta del filamento generador de la alteracin es primordial en el proceso de explotacin de la EDAR. El sistema de identificacin/denominacin para las bacterias filamentosas ms frecuentes en fangos activos fue publicado por Eikelboom en 1975. Posteriormente Eikelboom y van Buijsen (1983) y Jenkins et al. (1996), desarrollaron unas claves de identificacin dicotmicas en funcin de una serie de caractersticas morfolgicas y una reactiva a las tinciones clsicas, quedando la nomenclatura, pues, en forma de un cdigo de cuatro cifras precedido por la denominacin tipo y en algunos casos el gnero. La versin mas actualizada de esta clave de identificacin, Jenkins et al. (2003), es una modificacin de la aportada por Eikelboom y van Buijsen (1983), en la que se recogen las 23 bacterias filamentosas que con mayor frecuencia se encuentran en los fangos activos. De hecho, la mayora de los estudios se realiza con las tcnicas convencionales de caracterizacin por fenotipos (Seviour, 1999). No obstante, el uso de estas claves de identificacin no est exento de riesgo, ya que la morfologa as como las respuestas a las diferentes tinciones de estas bacterias pueden cambiar en virtud de variaciones en factores ambientales. En sistemas industriales de fangos activos, incluso, pueden encontrarse morfotipos de bacterias filamentosas distintos a los habituales (Seviour, 1999). La identificacin y el papel bioindicador de los microorganismos filamentosos han sido temas de estudio durante dcadas. Sin embargo, debido a la complejidad de las comunidades microbianas, las tcnicas de identificacin y, en consecuencia, la bioindicacin, se encuentran limitadas por los mtodos clsicos. El empleo en los ltimos aos de tcnicas moleculares que estudian la composicin de lpidos
de la pared, secuencias e hibridacin de cidos nucleicos (Seviour y Blackall, 1999, Lacko et al., 1999), aplicados al estudio de las bacterias filamentosas, estn determinando la verdadera relacin evolutiva entre estas bacterias. Dichos estudios permiten situarlas en el rbol filogentico y conocer su fisiologa gracias al aislamiento de cultivos puros. Sin embargo, en la actualidad, slo una minora de filamentos se ha identificado usando estudios filogenticos. La hibridacin in situ con sondas de ARN ribosmico marcadas con fluorocromos (FISH) permite identificar, mediante microscopa de fluorescencia, los microorganismos en muestras en su medio natural (Bjornssom et al., 2002). Esta tcnica se basa en la hibridacin directa de la bacteria a identificar con una sonda complementaria de una regin del 16S o 23S ARN ribosmico, que previamente se ha diseado para que sea especfica de la bacteria que se va identificar. En la relacin de organismos filamentosos recogida en el manual de Jenkins et al. (2003) se resumen diferentes estudios, detallando el orden de aparicin y abundancia de los filamentos en distintas plantas de tratamiento del mundo. Tal y como se observa en la Tabla 1, a excepcin de los hongos, cuya presencia no es muy comn en fangos activos, los filamentos que ocupan los 10 primeros puestos son: GALO, Tipo 1701, Tipo 021N, Tipo 0041, Thiothrix sp., Sphaerotilus natans, Microthrix parvicella, Tipo 0092, Haliscomenobacter hydrossis y Tipo 0675. En la EDAR del municipio de Torres-Torres (Valencia) se producen de forma peridica episodios de foaming. En el periodo de estudio (marzo, abril y mayo 2005) se present como filamento dominante el morfotipo 0581, el morfotipo 0092 como secundario y Microthrix parvicella de forma ocasional, tanto en las espumas generadas como en el licor mezcla. Esta situacin nos ha permitido comprobar cmo este tipo filamentoso, el Tipo 0581, uno
de los filamentos con menor grado de incidencia en los episodios de bulking y foaming del estudio presentado por Jenkins et al., 2003 (Tabla 1) y en la bibliografa, en general, puede generar procesos de espumacin tpicos de bacterias Gram positivas y ser, adems, dominante. Por su parte, Microthrix parvicella es uno de los organismos con mayor grado de ocurrencia en fangos activos (Jenkins et al., 2003) y est implicado en severos problemas de separacin slido/lquido y foaming (Rossetti et al., 2005), con la particularidad de presentar una gran similitud morfolgica con el Tipo 0581. A nivel ptico, la diferencia entre ambos filamentos se reduce a la respuesta ofrecida a la tincin Gram, positiva para Microthrix parvicella y negativa para el morfotipo 0581. Todas estas observaciones, unidas al hecho de que algunos filamentos pueden cambiar morfolgicamente segn las condiciones ambientales (Martins et al., 2004), nos hicieron plantear la posibilidad de que el filamento identificado como Tipo 0581 se tratase, en realidad, de Microthrix parvicella. En concreto, muchos actinomicetos, entre ellos Microthrix parvicella, se fragmentan en su ciclo vital, lo que hace que parezcan otros organismos bajo condiciones ambientales distintas (Seviour y Blackal, 1999). La revisin taxonmica de ambas bacterias nos permite comprobar que el Tipo 0581 est actualmente en estudio, con ubicacin desconocida (Seviour, 1999). Es decir, con la denominacin Tipo 0581 nos encontramos ante un puzzle todava por resolver (Rossetti et al. 2005). En cuanto a Microthrix parvicella, gracias a los estudios con tcnicas de secuenciacin, se han aislado e identificado varias cepas como posibles candidatas y se han desarrollado las siguientes sondas FISH para su deteccin e identificacin directa en muestras de espumas: MPA60, MPA223, MPA645, MPA650, CompMPA650.1, CompMPA650.2 (Erhart et al., 1997).
TECNOLOGIA DEL AGUA
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Tabla 1
Organismo Filamentoso USAa Pases Bajosb,e Alemaniac,e Sudfricad Australiaf Dinamarcag Italiah Repblica Checai
Nocardioformes y actinomycetes Tipo 1701 Tipo 021N Tipo 0041 Thiothrix spp. Sphaerotilus natans Microthrix parvicella Tipo 0092 Haliscomenobacter hydrossis Tipo 0675 Tipo 0803 Nostocoida limicola I, II y III Tipo 1851 Tipo 0961 Tipo 0581 Beggiatoa spp. Hongos Tipo 0914
a b c d e f g h i
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
? 5 2 6 19 7 1 4 3 9 11 12 10 8 18 15 -
? 8 1 3 4 2 6 10 7 9 -
6 8 6 9 2 1 9 4 7 8 3 9 5
3 12 1 2 13 14 1 4 5 2 9 5 8 10 15 7
3 2 1 3 6 5
2 9 6 3 7 1 4 3 5 8 10
6 13 7 5 8 1 3 11 11 4 2 9 10
Richard et al. (1982) y Strom y Jenkins (1984): 525 muestras de 270 plantas. Eikelboom (1977): 1100 muestras de 200 plantas. Wagner (1982): 3500 muestras de 315 plantas. Blackbeard et al. (1986a y 1986b): 111 plantas que incluyen 26 plantas de eliminacin biolgica de nutrientes (BNR); licor mezcla con bulking y sin bulking. No se incluyen las nocardioformes. Seviour et al. (1994): 38 plantas de eliminacin biolgica de fsforo (EBPR). Kristenesen et al. (1994): 40 plantas. Rossetti et al. (1994): 40 plantas. Wanner et al. (1998): 86 muestras de 86 plantas.
Tabla 1. Abundancia de organismos filamentosos. Fuente: Jenkins et al., 2003.
Por lo tanto, partimos de la base que el nombre vernculo de Microthrix parvicella, probablemente, se pueda dividir taxonmicamente mediante el empleo de sondas especficas, las cuales permitirn discernir claramente si nos encontramos con especies distintas o variedades de la misma. De hecho, Seviour (1999) define este grupo como filogenticamente diverso. En resumen, el objetivo de este estudio es dilucidar la autntica identidad del filamento identificado
TECNOLOGIA DEL AGUA
275 / AGOSTO / 2006
como Tipo 0581, para lo que se ha realizado un anlisis de la decantabilidad del fango, un estudio con microscopa ptica y la caracterizacin filogentica con FISH de dicha bacteria dominante. 3. Material y mtodos El muestreo se ha realizado en la EDAR situada en el municipio de Torres-Torres, titularidad de la Entidad Pblica de Saneamiento de Aguas Residuales de la Generalidad Valenciana (Epsar) y explotada
por la Empresa General Valenciana del Agua (Egevasa) desde el ao 1992. Esta planta est diseada para tratar 625 m 3/da de caudal medio con una carga de 300 mg/l de slidos en suspensin totales y una DBO 5 de 300 mg O 2/l. La lnea de agua consta de un pretratamiento que comprende un desbaste y un tamizado, un reactor biolgico circular de mezcla completa (650 m 3) con dos aireadores sumergidos y un decantador secundario. La lnea de
ARTICULOS
TECNICOS
fangos consta de un secado de fangos realizado en eras de secado. Con el fin de determinar el intervalo de carga msica a la cual opera la planta depuradora, se estableci un periodo de muestreo comprendido entre los das 19-24 de abril 2005, encontrndose la temperatura ambiental en torno a 25 C. Para ello se habilit un equipo tomamuestras automtico despus del pretratamiento y justo antes de la entrada del influente al reactor biolgico. La toma de agua se program para la recogida de muestras cada 30 minutos con las que se confeccion una muestra compuesta a partes iguales. Los anlisis fsico-qumicos se realizaron segn los Mtodos Normalizados (APHA, AWWA, WPCF). Las muestras de licor mezcla se tomaron justo a la salida del reactor biolgico y las de emulsin (nata) se
recogieron en la superficie del decantador secundario. Simultneamente se realizaron mediciones horarias del oxgeno disuelto en distintas partes del reactor. El tratamiento preliminar de las muestras del reactor para la observacin microscpica y su conservacin se realizaron segn el protocolo establecido en Rodrguez et al. (2004). El estudio de las muestras del reactor y de las espumas se ha realizado siguiendo el protocolo de GBS (Rodrguez et al., 2004). La identificacin de bacterias filamentosas se hizo segn a los manuales de Jenkins et al. (1996, 2003) y Seviour y Blackall (1999). La observacin ptica se ha realizado con un microscopio Zeiss modelo Axiostar con objetivos de 100x, 200x, 400x y 1.000x, dotado de equipo para microfotografa.
Tabla 2
Debido a la abundancia de filamentos presentes en el reactor hubo que practicar una V30 diluida en la proporcin 1:3 (Stbbe et al., 1964; Jenkins et al., 2003). Es por ello que el ndice volumtrico de fangos se expresa en su forma diluida (IVFD). Con la tcnica FISH se han utilizado sondas especficas marcadas con fluorocromos, para la deteccin de bacterias filamentosas en las muestras del reactor y de las espumas (Tabla 2). Esta tcnica es ms fiable para la identificacin de bacterias filamentosas que las tcnicas convencionales, al basarse en secuencias de nucletidos especficas de las bacterias o grupos de bacterias que se quieren identificar. Las hibridaciones se han realizado a 46 C durante 1,5-3 h segn el protocolo de Manz et al. (1992).
Sonda
Secuencia (5-3)
Especificidad
% F1
Referencia
EUB 338 I EUB 338 II EUB 338 III ALF1b BET42a GAM42a HGC69a LGC354A LGC354B LGC354C CF319 GNSB941 CFX1223 TM7905 MPA645 MPA223 MPA60
1 Concentracin ptima de formamida. 2 Microthrix parvicella.
GCTGCCTCCCGTAGGAGT GCAGCCACCCGTAGGTGT GCTGCCACCCGTAGGTGT CGTTCG(C/T)TCTGAGCCAG GCCTTCCCACTTCGTTT GCCTTCCCACATCGTTT TATAGTTACCACCGCCGT TGGAAGATTCCCTACTGC CGGAAGATTCCCTACTGC CCGAAGATTCCCTACTGC TGGTCCGTGTCTCAGTAC AAACCACACGCTCCGCT CCATTGTAGCGTGTGTGTMG CCGTCAATTCCTTTATGTTTTA CCGGACTCTAGTCAGAGC GCCGCGAGACCCTCCTAG GGATGGCCGCGTTCGACT
Bacteria Planctomycetes Verrucomicrobia
20 20 20 20 35 35 25 35 35 35 35 35 35 20 20 20 20
Amann (1990) Daims et al. (1999) Daims et al. (1999) Manz et al. (1992) Manz et al. (1992) Manz et al. (1992) Roller et al. (1994) Meier et al. (1999) Meier et al. (1999) Meier et al. (1999) Manz et al. (1992) Bjrnsson et al. (2002) Hugenholz et al. (2000) Erhart et al. (1997) Erhart et al. (1997) Erhart et al. (1997) Gich et al. (2001)
Proteobacteria Proteobacteria Proteobacteria
Actinobacteria Firmicutes Firmicutes Firmicutes Bacteroidetes Chloroflexi Chloroflexi TM7 Microthrix parvicella2 Microthrix parvicella Microthrix parvicella
Tabla 2. Sondas utilizadas para identificar el Tipo 0581.
TECNOLOGIA DEL AGUA
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Figura 1. Ensayos correspondientes a la muestra de estudio. A: Ensayo de la V30 sin diluir y diluido (a la derecha). B: Levantamiento de la manta de fango, generando la tpica Probeta partida. C: Capa emulsionada en superficie.
3.1. Antecedentes bibliogrficos: descripcin del morfotipo 0581 a nivel ptico Jenkins et al. (2003): Filamento curvado y enrollado situado dentro del flculo o libre en el espacio interflocular. La longitud del tricoma se encuentra tpicamente entre 100 y 200 m de longitud y 0,5-0,8 m de ancho. No se aprecian las clulas a lo largo del filamento. No presenta ni septos visibles, ni vaina, ni crecimiento adherido. No presenta ni ramificaciones ni movilidad. Reactiva a tinciones: Gram negativo y Neisser negativo. Clave de identificacin: Localizacin dentro del flculo y reaccin Gram negativa. El filamento puede ser confundido con Microthrix parvicella, pero la reaccin fuertemente positiva de este otro filamento lo diferencia de la reaccin Gram negativa, propia del morfotipo 0581. Eikelboom (2000): No modifica sustancialmente las claves identificativas de este filamento respecto a su primera edicin (1983), salvo el dimetro celular que lo sita entre los rangos de 0,3-0,4 m y la longitud del filamento, que presenta valores inferiores a 200 m. Esta circunstancia sugiere la posibilidad de que Microthrix parvicella y T 0581
TECNOLOGIA DEL AGUA
pudieran tratarse de distintas formas de crecimiento de la misma especie. Microthrix parvicella, descrita por primera vez por Pasveer en 1969, se incluye en el phyllum Actinobacteria (Rossetti et al., 2005), con caractersticas especiales, siendo uno de los filamentos ms polmicos de la lista de Eikelboom. La distinta morfologa presentada por esta bacteria, segn los sustratos utilizados, hace pensar que existen variantes, definidas por Eikelboom como distintos ecotipos que en realidad se corresponden con la misma especie. En muchos casos, este polimorfismo guarda relacin con la adaptabilidad de la especie (Margalef, 1998). Por otra parte, algunos autores encuentran codominancia entre Microthrix parvicella y el Tipo 0092 (Madoni et al., 2000), as como distintos ecotipos de Microthrix parvicella en funcin de la temperatura. Esta ltima presenta un ptimo de crecimiento a 25 C (Seviour y Blackal, 1999), con crecimiento en forma alargada (200-500 m) que, durante el verano, se fragmenta y queda en forma de filamentos cortos (20-200 m) (Hawany y Tanakoo, 1998; Rossetti et al., 2005). La frecuencia de las distintas formas filamentosas es funcin de las condi-
ciones ambientales, algunas de las cuales cambian en el curso del ao (Margalef, 1998). Esta ltima circunstancia nos hizo pensar que Microthrix parvicella y T 0581 podran pertenecer al mismo grupo filogentico y que ambas podran encontrarse ntimamente ligadas al Tipo 0092 en funcin de sus caractersticas ecolgicas. 4. Resultados y discusin Para poder determinar las caractersticas de las bacterias es necesario establecer la decantabilidad del fango, conocer los parmetros operacionales de la EDAR, proceder al anlisis ptico del fango y realizar su estudio filogentico. 4.1. Anlisis de decantabilidad Debido a la longitud y forma de crecimiento similares en Microthrix parvicella y el Tipo 0581, es lgico pensar que el anlisis macroscpico realizado sobre el conocido ensayo de la V30 sea tambin muy parecido en cuanto a la velocidad de decantacin, aspecto algodonoso del licor, emulsin en superficie y elevacin de la masa de fango. Ambas formas de crecimiento filamentoso producen valores de IVF elevados y emulsiones (natas), por lo que podra con-
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Figura 2. Aspecto del tratamiento secundario en la planta estudiada. A: Primeros estadios de formacin de natas en el clarificador. B: Acumulacin de natas en el reactor biolgico.
siderarse un doble efecto bulkingfoaming. En la Figura 1A se muestra en la probeta de la izquierda el ensayo de la V30 sin diluir y en la de la derecha diluido (correspondiendo un IVFD 1:3) (Stobbe et al., 1964). La forma curva del filamento, con gran tendencia a enrollarse, produce el entrelazado de los flculos y por tanto una velocidad de decantacin lenta. Grandes porciones
de licor mezcla se elevan debido a la acumulacin de microburbujas en dicha estructura, aspecto que puede apreciarse visualmente en la superficie del clarificador secundario y que en el lenguaje de la explotacin de estaciones depuradoras se denomina como trozos de fango elevado, sin tratarse de la emulsin propiamente dicha. Este hecho se puede apreciar en la Figura 1, sobre
todo cuando se practica una dilucin para realizar el ensayo de la V30 o cuando el nivel de slidos en suspensin del licor mezcla (SSLM) es bajo. Este aspecto es conocido como probeta partida. No obstante, los efectos del foaming se dejan ver en la parte superior de la probeta en forma de una capa emulsionada con aspecto creo que, a simple vista, aparece como una multitud de burbujas de aire junto con fango. En la Figura 2A se muestra la situacin del clarificador en los momentos en los que se estn formando las primeras natas, las cuales inicialmente tienen forma de escamas, con multitud de burbujas, que salen de la zona central del decantador para ocupar toda la superficie. En este tipo de episodios, segn el grado de avance del foaming, puede llegarse a colapsar toda la superficie del reactor biolgico (Figura 2B) con el aspecto tpico de chocolate espeso.
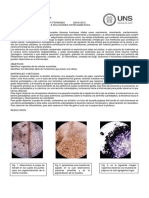
Figura 3. Reacciones a las tinciones de los filamentos encontrados en las muestras estudiadas (1.000x). A. T 0581: 1. Muestra en vivo. 2. Neisser negativa. 3. Respuesta Gram negativa de T0581, junto con reactiva Gram positiva de Microthrix parvicella; B. Microthrix parvicella: 1. Muestra en vivo. 2. Reaccin grnulo Neisser positiva. 3. Tincin Gram positiva; C. Tipo 0092: 1. Muestra en vivo. 2. Clsica tincin Neisser positiva, color prpura. 3. Tincin Gram con reactiva negativa.
TECNOLOGIA DEL AGUA
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Figura 4. Disgregacin flocular por dos bacterias de caractersticas morfolgicas similares (100x). A: Tipo 0581 (muestra estudiada); B: Microthrix .parvicella.
Figura 6. Dimetros celulares de Microthrix parvicella (introducida artificialmente) y el Tipo 0581 (1.000x) en muestra in vivo.
Figura 5. Forma en bucles tpica de Microthrix parvicella, presente en ambas bacterias (400x). A: Tipo 0581 ( muestra de estudio); B: Microthrix parvicella.
4.2. Anlisis ptico En el anlisis microbiolgico realizado a las muestras aparecen, entre otros, tres tipos bacterianos: Tipo 0581 (dominante), Tipo 0092 (secundario) y Microthrix parvicella (ocasional) (Figura 3). El anlisis detallado de las muestras indica que, tal como se puede apreciar en la Figura 4, la presencia del Tipo 0581 a niveles altos de poblacin puede producir una estructura flocular abierta, de forma similar a Microthrix parvicella. La semejanza ptica de ambos filamentos en el estudio de una muestra in vivo es notable, siendo imposible discernir entre ellos sin realizar tinciones. El anlisis mtrico no es, pues, una caracterstica distintiva, sino simplemente orientativa. La forma curva y enrollada tpica y que estamos acostumbrados a observar en Microthrix parvicella, aparece en ambos morfotipos (Figura 5). Con el fin de contrastar la morfologa de estas dos bacterias en la
TECNOLOGIA DEL AGUA
misma muestra y resaltar las diferencias, se introdujo de manera artificial Microthrix parvicella (Figura 6). El ancho celular de ambos morfotipos es distinto (Figura 6). Generalmente, el Tipo 0581 es algo ms fino que Microthrix parvicella, aunque nos podemos encontrar con dimetros similares, siendo Microthrix parvicella ms fina que la mostrada en dicha figura. Por esta razn, el dimetro celular no sera una caracterstica distintiva entre ambas.
En la Figura 7 se pueden observar espacios vacos en el tricoma, tpicos de Microthrix parvicella que, sin embargo, han podido observarse tambin en el Tipo 0581. Estos huecos parecen estar asociados a condiciones de estrs ambiental, ya que en cultivos puros no aparecen. A baja concentracin de oxgeno (0,4 mg/L) presentan morfologa irregular y alargada sin clulas deformadas o vacas (Rossetti et al., 2005). La Figura 8 nos permite comparar la reactiva a Gram (mtodo Hcker modificado). Ambos morfotipos tienen reacciones claramente distintas, lo que hara suponer que esta tincin es clave para su distincin. Sin embargo, de manera ocasional, se observan algunos filamentos con una reaccin claramente positiva a dicha tincin que los convierten en candidatos a Microthrix parvicella en la muestra estudiada, en la que el filamento dominante es el morfotipo 0581. En relacin con esto ltimo, existe
275 / AGOSTO / 2006
Figura 7. Presencia de huecos en los filamentos estudiados. A: Tipo 0581 (muestra de estudio); B: Microthrix parvicella (.1000x).
ARTICULOS
TECNICOS
Para identificar el Tipo 0581 se realizan anlisis de decantabilidad del fango
Figura 8. Comparativa de la reaccin Gram en los filamentos estudiados. A: Tipo 0581 (muestra de estudio); B: Microthrix parvicella y Tipo 0581 (1.000x).
Figura 9. Reaccin a la tincin de Neisser de los dos filamentos (1.000x). A: Microthrix parvicella con grnulos fuertemente positivos y Tipo 0581 con grnulos Neisser dbilmente positivos. B: Tipo 0581 con reaccin grnulo-negativo. C: Muestra control de Microthrix parvicella procedente de otra muestra distinta a la de estudio en la que se observa la tpica reaccin grnulo-positiva.
la hiptesis de que se pueden generar cambios en la superficie celular de algunas bacterias filamentosas frente a vertidos qumicos (Rossetti et al, 2005), lo que se traducira en reacciones a tinciones anmalas y aadira ms dificultad a la identificacin de morfotipos visualmente idnticos. En estas muestras, la determinacin filogentica aporta la clave necesaria para comprobar si se tratan de distintos morfotipos, ecotipos o especies distin-
tas con capacidad de convivir en el mismo nicho ecolgico. En cuanto a la tincin Neisser, en funcin de la actividad de los grnulos Neisser, hemos dividido los filamentos de morfologas similares en tres grupos: Filamentos del Tipo 0581, abundantes, que no presentan reaccin grnulo-Neisser positiva. Filamentos que presentan reaccin grnulo-Neisser positiva, aunque no muy marcados, distri-
Figura 10. Tincin de vainas y tincin PHB. A: Reaccin negativa a la tincin de vainas del Tipo 0581. B: Reaccin negativa a la tincin de PHB del Tipo 0581 (1.000x). Ambas procedentes de la muestra de estudio.
buidos desigualmente y de forma espaciada por todo el filamento, asignados a variantes del Tipo 0581. Filamentos con grnulos fuertemente Neisser positivos, que se han identificado como Microthrix parvicella. En la Figura 9C se puede observar un filamento con una reaccin Neisser clsica de Microthrix parvicella, mientras que la Figura 9A permite observar una reaccin variable del morfotipo 0581 a dicha tincin que contrasta con la de Microthrix parvicella. La bibliografa, sin embargo, indica que el Tipo 0581 es grnulo-Neisser negativo (Figura 9B). El resto de tinciones, tincin de vainas y PHB, muestran resultados negativos en todas las ocasiones realizadas (Figura 10), si bien Rossetti et al. (2005) indican que estas reacciones pueden presentar variabilidad segn la riqueza del medio en nutrientes y lpidos.
TECNOLOGIA DEL AGUA
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Figura 11. Aspecto tpico de situaciones de foaming. A: Sustancias de carcter hidrfobo; sistema estable aire-agua-clulas. B: Presencia material hidrfobo cercano al ncleo del flculo. C: Material hidrofbico en las zonas de mayor densidad bacteriana. D: Poblacin filamentosa en el espacio interflocular del frotis de la muestra de nata (100x).
Es tpico observar como despus de un aumento brusco de la poblacin de Actinomicetos, los cuales contienen cidos miclicos (Mycolata), junto con una subida brusca de los niveles de oxgeno en el reactor, puede generarse en escaso tiempo una gruesa capa de emulsin producto del incremento de microburbujas (Figura 11). En la Figura 11D se puede observar claramente como en el espacio interflocular, en el frotis procedente
de la muestra de nata, aparece una gran poblacin de bacterias filamentosas (Tipo 0581) siempre mayor que en el licor mezcla. Esta situacin ocurre de forma similar en Microthrix parvicella, estando descrita como LAO (acumuladora de lpidos) (Rossetti et al., 2005). La formacin de foaming producida por microorganismos filamentosos es un complejo proceso que engloba reacciones fsico-qumicas y biolgicas. El proceso termina con
Tabla 3
la estabilizacin del sistema en tres fases: aire-agua-clulas microbianas. La estabilizacin de la nata biolgica es el resultado de la produccin de materiales lipdicos, lipopptidos, protenas y carbohidratos, los cuales tienen propiedades de agentes tensioactivos. Por aadidura, las paredes celulares de los microorganismos formadores de foaming son fuertemente hidrofbicas. El mecanismo de estabilizacin de la nata podra explicarse aplicando un modelo sencillo de monocapa. La mayora de sustancias de fuerte carcter hidrfobo antes mencionadas presentan, al menos, una parte compuesta por cidos grasos (saturados o insaturados) que estn formados por un grupo polar (carboxilo) y una parte apolar (cadena hidrocarbonada) con un nmero elevado de tomos de carbono. De manera visual se observa que su presencia comienza aprecindose en las zonas centrales de los flculos que se presentan bien compactos (Figura 11B), y con una microestructura rica en formas filamentosas susceptibles de albergar o sintetizar estos compuestos (Figura 11C). Una vez que los niveles aumentan, se llega a un contacto directo molculas-licor mezcla, producindose un efecto similar al adicionar un agente tensioactivo a una disolucin acuosa. Es decir, las molculas tienden a concentrarse en la superficie (interfase lquido-gas) formando
DIA
CAUDAL ENTRADA m3
DBO5 ENTRADA mg O2/l
SSLM REACTOR mg/l
SSVLM REACTOR mg/l
V30 (1:3) ml/l
IVFD (1:3) ml/g
CARGA MSICA kg DBO/kg SSVLM.d
275 / AGOSTO / 2006
19-04-05 20-04-05 21-04-05 22-04-05 23-04-05 24-04-05
400 480 440 405 450 450
300 240 200 380 420 500
2890 2840 2770 2830 2900 2920
2250 2190 2130 2210 2290 2300
200 220 180 170 160 150
551 620 520 480 441 411
0,082 0,081 0,064 0,12 0,13 0,15
10
Tabla 3. Valores de carga msica obtenidos en el periodo de muestreo.
TECNOLOGIA DEL AGUA
ARTICULOS
TECNICOS
muchos de ellos en la situacin antes descrita y a los que se les va a facilitar una interfase lquido/gas donde las molculas se podrn disponer en monocapa. La situacin final es que los flculos con este tipo de material atrapan microburbujas (Figura 11A), por lo que tienden a flotar y acumularse en la superficie. Cuando las cantidades son importantes acaba formndose una nata espesa en la superficie del reactor y/o del clarificador secundario. 4.3. Parmetros operacionales Las cargas msicas (CM) obtenidas se mantienen bajas durante el periodo de estudio (0,06-0,08 kg. DBO/kg. MLVSS d.) y se ven incrementadas a lo largo del fin de semana debido, fundamentalmente, al aumento de la carga orgnica en el influente por el desplazamiento poblacional que sufre el municipio. A continuacin se presentan los rangos de carga msica en los que suele ser frecuente encontrar los morfotipos principales de la muestra de estudio (Jenkins et al., 2003): Tipo 0581: 0,1-0,05 kg. DBO/kg SSVLM d. Tipo 0092: 0,15-0,05 kg DBO/kg SSVLM d. Microthrix parvicella: 0,2-0,05 kg DBO/kg SSVLM d. En la Tabla 3 podemos comprobar en que rango de carga msica ha operado la EDAR durante el periodo de estudio y como coincide con los rangos tpicos que aparecen en la bibliografa. No se detect ninguna variacin importante de los distintos microorganismos presentes en funcin de la CM. Un parmetro que afecta de forma importante a los distintos organismos filamentosos es el nivel de oxgeno disuelto. El sistema de oxigenacin ocasiona zonas y momentos con escasos niveles de oxgeno, como es el caso de las zonas desde donde los aireadores impulsan el aire (posicin 1) frente a otras zonas con niveles
TECNOLOGIA DEL AGUA
Esquema reactor biolgico
10
7.
00 .3 0 12 .0 0 13 .3 0 15 .0 0 16 .3 0 18 .0 0 19 .3 0 21 .0 0 22 .3 0
00 30
00
30
00 6.
0.
1.
3.
4.
30
9.
Figura 12. Distribucin de oxgeno en el reactor estudiado.
una monocapa con los grupos polares interaccionando con las molculas de agua y los apolares dirigidos hacia la fase gas (disposicin energtica favorable). En el reactor bio-
lgico tenemos que aadir adems un factor muy importante, el sistema de aireacin, con millones de microburbujas de aire colisionando continuamente con los flculos,
11
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
Figura 13. Hibridacin con distintas sondas. A: Clulas de color rojo hibridadas con la sonda EUB338I marcada con TAMRA. B: Mismo campo que en A pero la hibridacin se ha realizado con las sondas GNSB941 y CFX1223 (marcadas con FAM), utilizadas para identificar bacterias del phyllum Chloroflexi, la flecha de color blanco seala un filamento que ha hibridado con las dos sondas del phyllum Chloroflexi y no ha hibridado con la sonda EUB338I. C y D: representan diferentes campos en los que se pueden observar clulas de color verde del morfotipo 0581 (flechas de color rojo).
275 / AGOSTO / 2006
mas elevados (posicin 2), tal y como puede apreciarse en la Figura 12. La posicin 3 corresponde al punto de muestreo del licor mezcla. Esta situacin de intermitencia en el oxgeno podra ser similar a la que se produce en el rgimen de puestas en marcha y paradas en los sistemas de aireacin por turbinas y en los que es muy comn el crecimiento de las formas de Microthrix parvicella, ms competitiva en estas situaciones de alternancia, y en las cuales tambin podra serlo la forma Tipo 0581. 4.3. Estudio filogentico El morfotipo 0581 se ha encontrado como dominante en el 10% de depuradoras con problemas de espumas en Alemania (Lemmer et al., 2004). En las muestras analizadas
TECNOLOGIA DEL AGUA
12
de la depuradora de Torres-Torres con la tcnica FISH se han utilizado sondas de diferentes phyllum para poder ubicar filogenticamente el morfotipo 0581, dominante en estas muestras. El morfotipo 0581 no ha hibridado con las siguientes sondas que se utilizan para caracterizar bacterias a nivel de phyllum: Proteobacteria, Actinobacteria, Firmicutes, Planctomycetes, Verrumicrobia, Bacteroidetes y TM7. Bjrnsson et al. (2002) encuentran tambin algunos filamentos que hibridan con la sondas del phyllum Chloroflexi y que no dan seal con las sondas EUB338 mix (I, II y III). En las muestras de Torres-Torres se han detectado morfotipos filamentosos que no hibridan con las sondas EUB338 I, II y III (Figura 13A) y que, sin embargo, hibridan con las
sondas GNSB941 y CFX1223 (Figura 13B). Se ha obtenido una seal positiva en las clulas que constituyen este morfotipo con las sondas del phyllum Chloroflexi (Figuras 13B, C y D). Bacterias filamentosas del phyllum Chloroflexi se han descrito como abundantes en procesos de tratamiento de aguas residuales con eliminacin de nutrientes (Bjrnsson et al., 2002). Con la tcnica FISH en las muestras de Torres-Torres se ha detectado seal de hibridacin en algunas clulas/filamentos del morfotipo Microthrix parvicella. Las clulas hibridadas daban una seal dbil (Figuras 14A y 14B). Este resultado correspondera a un bajo contenido en ribosomas en las clulas que constituyen el filamento de Microthrix parvicella.
ARTICULOS
TECNICOS
Figura 14. Microthrix parvicella hibridado con sondas MPA645, MPA223 y MPA60, utilizadas para identificar este morfotipo. Las figuras A y B representan diferentes campos en los que se pueden observar clulas de Microthrix parvicella de color rojo (flechas de color blanco) (fluorocromo TAMRA utilizado para marcar las tres sondas).
5. Conclusiones Es evidente la necesidad de utilizar tcnicas moleculares para avanzar en la identificacin de los distintos morfotipos descritos por Eikelboom. El FISH se plantea como una opcin muy interesante al no necesitar cultivos puros, aunque s dominancia del organismo en el fango activo. Tiene, adems, la ventaja de utilizar la propia muestra y ser repetitivo. Sin embargo, para poder aplicar esta tcnica es necesario que la clula est activa, porque en situaciones de estrs el contenido en ribosomas de la clula podra situarse por debajo del lmite de deteccin de la seal de hibridacin. Los futuros estudios deben ir encaminados, por una parte, a desentraar la filogenia de las distintas bacterias implicadas en las alteraciones de fangos activos, ya que este dato es fundamental para conocer el porqu del fenmeno. Por otra parte, se necesita obtener sistemas de aplicacin FISH en planta, de forma que los operadores puedan realizar identificaciones certeras y por lo tanto obtener informacin de la ecologa de una determinada bacteria, as como tomar las decisiones oportunas. A pesar de las caractersticas morfolgicas de este organismo, similares a Microthrix parvicella, la tcnica de FISH ha podido poner de manifiesto que el morfotipo 0581 estara incluido dentro del phyllum Chloroflexi, no guardando relacin
con los Actinomicetos, clsicos formadores de natas, que se incluyen en el phyllum Actinobacteria. Corroboramos que tanto la tincin de Neisser como PHB no son diferenciadoras de ambas bacterias, aunque s que se ha podido comprobar que el Tipo 0581 puede presentar respuesta negativa y respuesta dbilmente positiva a grnulos Neisser, distinta a la de Microthrix parvicella que es mucho ms intensa. Algunas formas filamentosas de este morfotipo pueden presentar reacciones anmalas a ambas tinciones debido a deficiencias nutricionales o vertidos, que no permitiran tomar una decisin clara en su identificacin. Por el contrario, la tincin Gram s permite diferenciar al Tipo 0581. Sera conveniente realizar un estudio a nivel nacional y un seguimiento de esta bacteria para comprobar si su grado de influencia es realmente tan bajo o si por el contrario ha pasado desapercibida al ser confundida con Microthrix parvicella. A pesar de las escasas citas bibliogrficas, este filamento hemos podido comprobar que es capaz de generar situaciones con doble efecto bulking-foaming, por lo que debe presentar capacidades competitivas respecto al resto de bacterias que comparten el mismo ecosistema. En este episodio, coincidiendo con la bibliografa, el trinomio Tipo 0581, M.p y Tipo 0092 ha estado
asociado a bajas cargas msicas y a alternancia de oxgeno, lo que parece indicar que comparten estas mismas necesidades y pueden competir en el mismo nicho. Fluctuaciones en las condiciones ambientales, no detectables por el operador, permitira el desarrollo aventajado de una de estas bacterias, sin que las otras llegaran a desaparecer. 6. Agradecimientos Queremos dejar constancia de nuestro agradecimiento a cada una de las empresas y centros a los que pertenecemos, especialmente a Egevasa, Epsar y Emasesa, por su apoyo y respaldo a nuestro trabajo. Tambin agradecemos su colaboracin a Rebeca Castresana de Miguel, durante la toma de muestras y en la obtencin de parmetros fisicoqumicos. 7. Bibliografa 1. Amann, R.I.; Binder, B.J.; Olson, R.J.; Chisholm, S.W.; Devereux, R.; Stahl, D.A. (1990). Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analysing mixed microbial populations. Appl. Environ. Microbiol. 56,1919-1925. 2. APHA, AWWA, WPCF (1989). Standard Methods for the Examination of Water and Wastewater. 17 Edition.
TECNOLOGIA DEL AGUA
13
275 / AGOSTO / 2006
ARTICULOS
TECNICOS
14
3. Bjornsson, L.; Hugenhtotz, P.; Tysan, G.W.; Blackall, L.L. (2000). Filamentous chloroflexi (green non-sulfur bacteria) are abundant in wastewater treatment processes with biological nutrient removal. Microbiol. 148, 2309-2318. 4. Daims, H.; Brhl, A.; Amann, R.; Schleifer, K.H.; Wagner, M. (1999) The domain-specific probe EUB 338 is insufficient for the detection of all Bacteria: Development and evaluation of a more comprehensive probe set. Syst. Appl. Microbiol. 22, 434-444. 5. Eikelboom, D.H. (1975). Filamentous organisms observed in activated sludge. Wat. Res. 9, 365-388. 6. Eikelboom, D.H. (2000). Process control of activated sludge plants by microscopic investigation. London, U.K.; IWA Publishing. 7. Eikelboom, D.H.; Van Buijsen, H.J.J. (1983). Microscopic sludge investigation manual, 2nd Edn. TNO Research Institute of Environnmental Hygiene, Delft. 8. Erhart, R.; Bradford, D.; Seviour, R.; Amann, R.; Blackall, L.L. (1997). Development and use of fluorescent in situ hybridization probes for the detection and identification of Microthrix parvicella in activated sludge. Syst. Appl. Microbiol. 20, 310-318. 9. Gich, F.; Garca-Gil, J.; Overmann, J. (2001). Previously unknown and phylogenetically diverse members of the green nonsulfur bacteria are indigenous to freshwater lakes. Arch. Microbiol. 177, 1-10. 10. Hugenholtz, P.; Tyson, G.W.; Webb, R.I.; Wagner, A.M.; Blackall L.L. (2001). Investigation of candidate division TM7, a recently recognized major lineage of the domain Bacteria with no known pure-culture representatives. Appl. Environ. Microbiol. 67, 411-419.
TECNOLOGIA DEL AGUA
11. Hwang, Y.; Tanaka, T. (1998). Control of Microthrix parvicella foaming in activated sludge. Wat. Res. 32, 5, 1678-1686. 12. Jenkins, D.; Richard, M.G.; Daigger, G.T. (1996). Manual on the causes and control of activated sludge bulking and foaming. 2nd Edition. Lewis publishers (Michigan). 13. Jenkins, D.; Richard, M.G.; Daigger, G.T. (2003). Manual on the causes and control of activated sludge bulking and foaming. 3rd Edition. Lewis publishers (Michigan). 14. Lacko, N.; Bux, F.; Kasan, H.C.; Water, S.A. (1999) Survey of filamentous bacteria in activates sludge plants in Kwazulv-Nabel. http: // www. wrc.org.za. 15. Madoni, P.; Davoli, D.; Gibin, G. (2000). Survey of filamentous microroganims from bulking and foaming activatedsludge plants in Italy. Wat. Res. 34, 6, 1767-1772. 16. Madoni, P.; Davoli, D. (1997). Testing the control of filamentous microorganisms responsible for foaming in a full-scale activated sludge plant running with initial aerobic or anoxic contact zone. Bios. Technol. 60, 43-49. 17. Manz, W.; Amann, R.; Ludwig, W.; Wagner, M.; Schleifer, K.H. (1992) Phylogenetic oligodeoxynucleotide probes for the major subclasses of proteobacteria: problems and solutions. Syst. Appl. Microbiol. 15, 593600. 18. Margalef, R. (1989). Ecologa. Ed. Omega, Barcelona. 19. Martins, A.M.P.; Pagilla, K.; Heijren, J.J.; Valoosgrecht, M.C.M. (2004). Filamentous bulking sludge. A critical review. Wat. Res. 38, 793-817. 20. Meier, H.; Amann, R.; Ludwig, W.; Schleifer, K.H. (1999). Specific oligonucleotide probes for in situ detection of a major group of Gram-positive bacte-
21.
22.
23.
24.
25.
26.
27.
28.
ria with low G+C content. Syst. Appl. Microbiol. 22, 186-196. Richard, M.G. (1989). Activated sludge Microbiology. The Water Pollution Control federation. Alexandra, V.H. Richard, M.; Sear, B.; Fort Collium, C.O. (2003). Activated Sludge microbiology problems and their control presented at the 20th Annual USEPA National Operator Trainus. Conference. Buffalo, Ny. Rodrguez, E.; Isac, L.; Fernndez, N.; Salas, M.D. (2004). Manual de Trabajo para Anlisis Biolgicos en Fangos Activados. Jornada de Transferencia de Tecnologa sobre Ejercicios interlaboratorios en fangos activos como sistema de control de calidad en la EDAR (Sevilla, octubre de 2004) I.S.B.N. 6080189-6. Roller, C.M.; Wagner, M.; Amann, R.; Ludwig, W.; Schleifer K.H. (1994) In situ probing of Gram-positive bacteria with high DNA G+C content using 23S rRNA-targeted oligonucleotides. Microbiol. 140, 2849-2858. Rossetti, R.; Torrei, M.C.; Nielsen, P.H.; Tandoi, V. (2005). Microthrix parvicella a filamentous bacterium causing bulking and foaming in activated sludge systems: a review of current knowlwdge. FEMS Microbiol. Rev. 29, 49-64. Seviour, E.M.; Williams, C.J.; Seviour, R.J.; Soddell, J.A.; Lindrea K.C. (1990). A survey of filamentous bacterial populations from foaming activated sludge plants in eastern states of Australia. Wat. Res. 24, 493498. Seviour, R.J.; Blackall, L.L. (1999). The Microbiology of Activated Sludge. Kluwer Academic Publishers, U.S.A. Seviour, R.J. (1999). The microbiology of activated sludge. Kluwer Academic Publishers. Netherlandas.
275 / AGOSTO / 2006
También podría gustarte
- Biología General Los Sistemas Vivientes - (PG 8 - 197)Documento190 páginasBiología General Los Sistemas Vivientes - (PG 8 - 197)Vivis Gonzalez86% (7)
- Biologia LIBRO (Gloria Casam)Documento152 páginasBiologia LIBRO (Gloria Casam)Dave89% (18)
- Los bacteriófagos: Los virus que combaten infeccionesDe EverandLos bacteriófagos: Los virus que combaten infeccionesAún no hay calificaciones
- Bacteriologia Del Sistema GenitourinarioDocumento59 páginasBacteriologia Del Sistema GenitourinarioRoberto J GonzalesAún no hay calificaciones
- Articulo Tecnico Microscopia Convencional Fish Morfotipos Filamentosos Fangos Activos Tecnoaqua EsDocumento10 páginasArticulo Tecnico Microscopia Convencional Fish Morfotipos Filamentosos Fangos Activos Tecnoaqua Esfatylu2014Aún no hay calificaciones
- 10881-Texto Del Articulo-32802-2-10-20210420Documento3 páginas10881-Texto Del Articulo-32802-2-10-20210420Tf ElbacanAún no hay calificaciones
- PROGRAMA XXVIII-Congreso SEMv8Documento5 páginasPROGRAMA XXVIII-Congreso SEMv8sandraAún no hay calificaciones
- Tarea 3. Yolman Yesid Ruano MuñozDocumento5 páginasTarea 3. Yolman Yesid Ruano MuñozSaray PonceAún no hay calificaciones
- HongosdepudricionblancaDocumento4 páginasHongosdepudricionblancaHernan RealAún no hay calificaciones
- Detección de hongos y oomycetos en cultivos de peces dulceacuícolas empleando el kit BIAADETECT, producto desarrollado a partir del homóptero Dactylopius coccus. Rocío Parra Laca, Fernando García-Gil de Muñoz, Laura E. Borrego Enríquez, Humberto Lanz-Mendoza, Ignacio del Río Dueñas y Fidel de la Cruz Hernández-Hernández.Documento7 páginasDetección de hongos y oomycetos en cultivos de peces dulceacuícolas empleando el kit BIAADETECT, producto desarrollado a partir del homóptero Dactylopius coccus. Rocío Parra Laca, Fernando García-Gil de Muñoz, Laura E. Borrego Enríquez, Humberto Lanz-Mendoza, Ignacio del Río Dueñas y Fidel de la Cruz Hernández-Hernández.Investigación Universitaria Multidisciplinaria100% (1)
- Cartilla Ilustrada 9789587943382Documento36 páginasCartilla Ilustrada 9789587943382RICARDO ANDRES JARA RUEDAAún no hay calificaciones
- Cydia Pomonella Este SíDocumento1 páginaCydia Pomonella Este Sílp.anahi2405Aún no hay calificaciones
- Industrial BiofilmsDocumento13 páginasIndustrial BiofilmsMAR�A JOS� NI�O MELOAún no hay calificaciones
- Tarea n3 Genetica y Ecologia Microbiana Relacion Huesped Microorganismo VacunasDocumento12 páginasTarea n3 Genetica y Ecologia Microbiana Relacion Huesped Microorganismo VacunasMarlin TavarezAún no hay calificaciones
- U7.8.repaso FinalDocumento6 páginasU7.8.repaso Finalmaria jose sanchez matiasAún no hay calificaciones
- Streptococcus IniaeDocumento8 páginasStreptococcus IniaeDayanna Sant Álv100% (1)
- Teora 9 Metalonezimas de La FotosintesisDocumento36 páginasTeora 9 Metalonezimas de La FotosintesisPatricia PovedaAún no hay calificaciones
- Biologia Animal y VegetalDocumento3 páginasBiologia Animal y VegetalMicaela UrquizaAún no hay calificaciones
- Tema 1Documento32 páginasTema 1Stephanny AguileraAún no hay calificaciones
- PseudopodosDocumento6 páginasPseudopodosEdgar Ivan Romero OlveraAún no hay calificaciones
- Terrabacteria - Wikipedia, La Enciclopedia LibreDocumento5 páginasTerrabacteria - Wikipedia, La Enciclopedia LibreLizbethAún no hay calificaciones
- Microscopía y Principales Características Morfológicas de Algunos Ectoparásitos de Interés VeterinarioDocumento23 páginasMicroscopía y Principales Características Morfológicas de Algunos Ectoparásitos de Interés VeterinarioDaniel ArteagaAún no hay calificaciones
- 305 INFORME Desinfectantes PDFDocumento10 páginas305 INFORME Desinfectantes PDFWilliam PachonAún no hay calificaciones
- 5417-Texto Del Artículo-12030-1-10-20131002Documento11 páginas5417-Texto Del Artículo-12030-1-10-20131002Fiorella YavarAún no hay calificaciones
- 2008 - Identificación de Bacterias Filamentosas en EDAR InsdustrialesDocumento9 páginas2008 - Identificación de Bacterias Filamentosas en EDAR InsdustrialesAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- Relaciones Simbioticas Protegen A Las HormigasDocumento4 páginasRelaciones Simbioticas Protegen A Las HormigasHarey VargasAún no hay calificaciones
- 7 Interacciones Entre EspeciesDocumento80 páginas7 Interacciones Entre EspeciesSaraAponteAún no hay calificaciones
- Guevara - Said - 3B - Grupo2 - Tarea 4.1 .Placa Bacteriana y Control de MicroorganismosDocumento21 páginasGuevara - Said - 3B - Grupo2 - Tarea 4.1 .Placa Bacteriana y Control de MicroorganismosSaid Guevara AriasAún no hay calificaciones
- Marta Negroni Microbiologia Estomatologi RemovedDocumento15 páginasMarta Negroni Microbiologia Estomatologi RemovedDaniela NaranjoAún no hay calificaciones
- PirasDocumento28 páginasPirasAlejandro Giraldo ObregónAún no hay calificaciones
- LIQUENES Morfología, Clasificación y Usos 2015Documento56 páginasLIQUENES Morfología, Clasificación y Usos 2015Teodoro Chivatá Bedoya80% (5)
- Apunte Protistas PDFDocumento18 páginasApunte Protistas PDFLorena RissoAún no hay calificaciones
- Sim PosioDocumento24 páginasSim PosioLetyfungosAún no hay calificaciones
- NEMATODOSDocumento7 páginasNEMATODOSYaritza SosaAún no hay calificaciones
- Biología Semana 13 - 2021 IIIDocumento6 páginasBiología Semana 13 - 2021 IIIDavid LlontopAún no hay calificaciones
- BiofilmsDocumento4 páginasBiofilmsOscar ArribasAún no hay calificaciones
- 332758-Text de L'article-477588-1-10-20180207Documento6 páginas332758-Text de L'article-477588-1-10-20180207alaurindinhaAún no hay calificaciones
- Actividades Previas 2Documento6 páginasActividades Previas 2Alexis MoisenAún no hay calificaciones
- Laboratorio 3 Observacion Microscopica DDocumento7 páginasLaboratorio 3 Observacion Microscopica DbrayanAún no hay calificaciones
- Hongos - LiquenizadosDocumento24 páginasHongos - LiquenizadosJorge David Padilla FlorezAún no hay calificaciones
- Tarea 2 Análisis de Los Grupos Funcionales MicrobianosDocumento18 páginasTarea 2 Análisis de Los Grupos Funcionales Microbianosduenaselibey1Aún no hay calificaciones
- Laminas Botanica General 1 PDFDocumento61 páginasLaminas Botanica General 1 PDFtatosum77Aún no hay calificaciones
- Botanicasist PrincipiosDocumento61 páginasBotanicasist Principiosmanuelborgefenix1362Aún no hay calificaciones
- VirologíaDocumento131 páginasVirologíafranca morelloAún no hay calificaciones
- Conteo de PlanctonDocumento16 páginasConteo de Planctonjulio.nunez2901Aún no hay calificaciones
- Morfolog A de Hongos Parte 2Documento10 páginasMorfolog A de Hongos Parte 2Ignacio RinaldiAún no hay calificaciones
- B RSM Dom Sem1Documento2 páginasB RSM Dom Sem1Tq NoemíAún no hay calificaciones
- Mucus en CoralesDocumento8 páginasMucus en CoralesIvanAntonioVilchezAún no hay calificaciones
- Presentacion MonogeneosDocumento15 páginasPresentacion MonogeneosAndrew EvAún no hay calificaciones
- Biofilm, Importancia en La Práctica Veterinaria PDFDocumento6 páginasBiofilm, Importancia en La Práctica Veterinaria PDFRafa MarinAún no hay calificaciones
- 5-Practica de ProtistasDocumento6 páginas5-Practica de Protistasperrero20Aún no hay calificaciones
- Tarea 3-MicroDocumento4 páginasTarea 3-Micronathalia shekAún no hay calificaciones
- Mecanismos ResumenDocumento3 páginasMecanismos ResumenMaria Fernanda Pizarro VasquezAún no hay calificaciones
- Piezofilos ACT3Documento4 páginasPiezofilos ACT3Sol MartinezAún no hay calificaciones
- Nota CientíficaDocumento8 páginasNota CientíficaMarcoAún no hay calificaciones
- Identificación, Biología, y Comportamiento de Las Polillas de La Papa en El EcuadorDocumento12 páginasIdentificación, Biología, y Comportamiento de Las Polillas de La Papa en El EcuadorJorge Luis Alonso G.0% (1)
- Conteo de Plancton PDFDocumento16 páginasConteo de Plancton PDFjulio.nunez2901Aún no hay calificaciones
- Public Ac I One Special 2 FinalDocumento54 páginasPublic Ac I One Special 2 FinalWendy BanderaAún no hay calificaciones
- G. BiotecnologíaDocumento12 páginasG. BiotecnologíaDiana FloresAún no hay calificaciones
- Control Biológico de Fungus GnatsDocumento4 páginasControl Biológico de Fungus GnatsLuis Guillermo Feria BarreraAún no hay calificaciones
- Atlas de ciliados y otros microorganismos frecuentes en plantas de sistemas aerobio de aguas residualesDe EverandAtlas de ciliados y otros microorganismos frecuentes en plantas de sistemas aerobio de aguas residualesAún no hay calificaciones
- 2013 - Los Morfotipos Filamentosos 0803, 0914 y 0092 en Fangos Activos PDFDocumento10 páginas2013 - Los Morfotipos Filamentosos 0803, 0914 y 0092 en Fangos Activos PDFAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- Análisis de Las Correlaciones Entre Los Parámetros Operacionales, Físico-Químicos y Biológicos Asociados Al Proceso de Fangos ActivosDocumento125 páginasAnálisis de Las Correlaciones Entre Los Parámetros Operacionales, Físico-Químicos y Biológicos Asociados Al Proceso de Fangos ActivosAula Bioindicación Gonzalo Cuesta100% (1)
- 2008 - Identificación y Caracterización de Filamentosas en Biorreactores de EDAR Del Sector PetroquímicoDocumento21 páginas2008 - Identificación y Caracterización de Filamentosas en Biorreactores de EDAR Del Sector PetroquímicoAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- 2010 - Cuantificación de Bacterias Nitrificantes Con La Técnica FISH y Análisis de Imagen en Fangos ActivosDocumento1 página2010 - Cuantificación de Bacterias Nitrificantes Con La Técnica FISH y Análisis de Imagen en Fangos ActivosAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- 2005 - Tratamiento y Conservación de Muestras para Análisis Microbiológicos de Fangos Activos (Tec)Documento11 páginas2005 - Tratamiento y Conservación de Muestras para Análisis Microbiológicos de Fangos Activos (Tec)Aula Bioindicación Gonzalo CuestaAún no hay calificaciones
- 2004 - Una Curiosidad Par La Ciencia. Reproducción Vivípara en Un Rotífero Del Fango ActivoDocumento5 páginas2004 - Una Curiosidad Par La Ciencia. Reproducción Vivípara en Un Rotífero Del Fango ActivoAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- 2008 - Identificación de Bacterias Filamentosas en EDAR InsdustrialesDocumento9 páginas2008 - Identificación de Bacterias Filamentosas en EDAR InsdustrialesAula Bioindicación Gonzalo CuestaAún no hay calificaciones
- Triptico JuanaDocumento2 páginasTriptico JuanaDavidsWilliamsAún no hay calificaciones
- Organelos BiologiaDocumento2 páginasOrganelos BiologiaDavid AguilarAún no hay calificaciones
- Ejercicios Bioinformatica para Alumnos Del Grado en QuimicaDocumento30 páginasEjercicios Bioinformatica para Alumnos Del Grado en Quimicalidia_profeparticulaAún no hay calificaciones
- Ectima ContagiosoDocumento8 páginasEctima ContagiosoCAPRINOS BAJA CALIFORNIA SUR, MEXICO100% (2)
- BiologiaDocumento2 páginasBiologiaJohailin CruzAún no hay calificaciones
- Trabajo Asincrónico El Nucleo 2Documento6 páginasTrabajo Asincrónico El Nucleo 2LUISA MARQUEZ MORALESAún no hay calificaciones
- Genotipo FenotipoDocumento5 páginasGenotipo Fenotipoantonio martinezAún no hay calificaciones
- ManualInmunologia2007 08Documento84 páginasManualInmunologia2007 08Noor Alia Cerino HernándezAún no hay calificaciones
- PloconsDocumento1 páginaPloconsmiguel rodriguezAún no hay calificaciones
- Ácidos NucleicosDocumento23 páginasÁcidos NucleicosAngie Natalia Lopez RuizAún no hay calificaciones
- Biografia de Gregor MendelDocumento2 páginasBiografia de Gregor MendelMónica VeraAún no hay calificaciones
- Protocolo de Extracción Casera de AdnDocumento5 páginasProtocolo de Extracción Casera de AdnAnna Mauri AvalosAún no hay calificaciones
- PRUEBA Microorganismo 7°Documento2 páginasPRUEBA Microorganismo 7°Virginia SereyAún no hay calificaciones
- Aislamiento de RhizobiumDocumento4 páginasAislamiento de RhizobiumIris Margoth MAún no hay calificaciones
- Microorganismos de Uso IndustrialDocumento4 páginasMicroorganismos de Uso IndustrialDavid OspinaAún no hay calificaciones
- Taller - 3 Biomoleculas y MetabolismoDocumento3 páginasTaller - 3 Biomoleculas y MetabolismoJuan Diego León CardonaAún no hay calificaciones
- Paradigmas en EspañolDocumento16 páginasParadigmas en EspañolLuifer AgudeloAún no hay calificaciones
- Anemia Infecciosa Equina 2Documento13 páginasAnemia Infecciosa Equina 2Geraldine DavilaAún no hay calificaciones
- Psicofármacos, GeneralidadesDocumento28 páginasPsicofármacos, GeneralidadesAndrea Catalina Martins100% (1)
- Cuál Es La Relación Que Tiene La Autoperpetuación y La NutriciónDocumento2 páginasCuál Es La Relación Que Tiene La Autoperpetuación y La NutriciónJoohana Antonio NuñezAún no hay calificaciones
- FICHA Primer Ciclo - de Qué Están Hechos Los Seres VivosDocumento13 páginasFICHA Primer Ciclo - de Qué Están Hechos Los Seres VivosAndrea Romero M.Aún no hay calificaciones
- Terminologia MedicaDocumento29 páginasTerminologia MedicaMario Alejandro CamposAún no hay calificaciones
- Cancer CervixDocumento88 páginasCancer CervixDanna ChrissAún no hay calificaciones
- DIAGNOSTICA DÉCIMO RespuestaDocumento5 páginasDIAGNOSTICA DÉCIMO RespuestaDIANA CAROLINA POSADA LINARESAún no hay calificaciones
- Teoria EndosimbioticaDocumento3 páginasTeoria EndosimbioticaFernanda BvAún no hay calificaciones
- Celulas ProcariotasDocumento2 páginasCelulas ProcariotasRonyAnleuAún no hay calificaciones
- Clase Ligamiento 2009Documento45 páginasClase Ligamiento 2009lorenaAún no hay calificaciones
- 26436.inmunocromatografia VIH y Covid 19Documento14 páginas26436.inmunocromatografia VIH y Covid 19Camila Córdova LópezAún no hay calificaciones