Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tev PDF
Cargado por
CarlosSusulPeñaMaGaña0 calificaciones0% encontró este documento útil (0 votos)
43 vistas10 páginasTítulo original
2._TEV.pdf
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
43 vistas10 páginasTev PDF
Cargado por
CarlosSusulPeñaMaGañaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
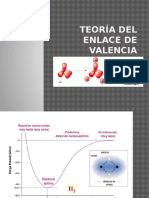
Teora del Enlace de Valencia (TEV)
Fue desarrollada por Linus Pauling, (California Insitute of
Technology). Explica en forma razonable la estructura de
los complejos
La resolucin exacta de la ecuacin de
Schrdinger era imposible para molculas
polielectrnicas, por lo se precisaba realizar
algunas aproximaciones:
La teora del enlace de valencia que
construye la funcin de onda de la
molcula vista como un conjunto de
pares electrnicos localizados en un
tomo o entre dos tomos. Se trata de
la versin mecano-cuntica de las ideas
de Lewis y comparte con ellas
conceptos como la resonancia.
Teora del Enlace de Valencia
Cuando participan orbitales
direccionales, el solapamiento
depende de la direccin de
interaccin.
La energa de un orbital hbrido es la media aritmtica de la de los orbitales mezclados.
La funcin de onda del estado fundamental es la que minimiza la energa del sistema.
Teora del Enlace de Valencia
Para tomos del tercer perodo en adelante, la diferencia de energa
entre las orbitales s, p y d es lo suficientemente pequea, de modo
que estos tres tipos de funciones toman parte en la formacin de los
enlaces.
An en compuestos que no son
de coordinacin, tales como PF5,
PF3Cl2, PCl5, SF6, se pueden utilizar
uno o dos orbitales d en la
formacin de los enlaces.
Teora del Enlace de Valencia
En el caso de los metales de transicin en los
compuestos de coordinacin, deben hibridarse tantos
orbitales atmicos como se necesiten para acomodar los
pares libres de los ligantes para formar los enlaces .
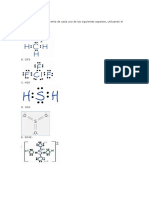
En esta teora se supone que los enlaces entre los
ligandos y el metal son de tipo covalente
H
N
H
Teora del Enlace de Valencia: Complejos
Octadricos
Ejemplo en el ion [Fe (H2O)6]3+
NENE = ?
Su momento magntico indica que tiene 5
electrones desapareado.
Cada ligando de H2O dona dos electrones y ocupa los seis orbitales hbridos formando
seis enlaces covalentes coordinados.
Aqu se emplean los orbitales 4d (ms externos) por lo que el complejo resultante se
llama complejo de orbital externo.
Teora del Enlace de Valencia: Complejos
Octadricos
Ejemplo en el ion [Fe (CN)6]3-:
NENE = ?
Su momento magntico indica que tiene un
desapareado.
electrn
Por tanto los orbitales 3dx2-y2 y 3dz2 (orbitales internos)
participan en la hibridacin, con los 4s y 4p, dando un complejo
de orbital interno.
Teora del Enlace de Valencia: Complejos
Octadricos
[Fe(CN)6]4-
Diamagntico
[Ni(CN)4]2-
Diamagntico
[Fe(CO)5]
Diamagntico
Cul es la hibridacin del metal en cada compuesto?
Teora del Enlace de Valencia
[Fe(CN)6]4d2sp3
[Ni(CN)4]2dsp2
[Fe(CO)5]
dsp3
Teora del Enlace de Valencia
Teora del Enlace de Valencia: Puntos dbiles
También podría gustarte
- Enlace de ValenciaDocumento14 páginasEnlace de ValenciaMiguel SánchezAún no hay calificaciones
- Teoria de Orbitales AtomicosDocumento7 páginasTeoria de Orbitales AtomicosDark HikaruAún no hay calificaciones
- Punto 1 de ContenidoDocumento6 páginasPunto 1 de ContenidoArmando ArmendarizAún no hay calificaciones
- Quimica Teoria de Enlace.-1Documento31 páginasQuimica Teoria de Enlace.-1Samuel EscobarAún no hay calificaciones
- Notas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaDocumento7 páginasNotas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaEgcrisostomoAún no hay calificaciones
- Teoría Del Enlace de Valencia XDDocumento12 páginasTeoría Del Enlace de Valencia XDEmanuelAún no hay calificaciones
- Teoría del enlace de valencia y hibridación de orbitalesDocumento143 páginasTeoría del enlace de valencia y hibridación de orbitalesDiego Morales MataAún no hay calificaciones
- Apuntes Unidad 4. Enlace Covalente y Geometría MolecularDocumento19 páginasApuntes Unidad 4. Enlace Covalente y Geometría Molecularmjlizanco8Aún no hay calificaciones
- Orbitales Atómicos y Configuración Electrónica PDFDocumento10 páginasOrbitales Atómicos y Configuración Electrónica PDFedisonAún no hay calificaciones
- Estructura de LewisDocumento14 páginasEstructura de LewisEdwin Roberto Molina RamirezAún no hay calificaciones
- UiouikjkjklDocumento10 páginasUiouikjkjklRaymi CampoAún no hay calificaciones
- Ii Sesión El Atomo de CarbonoDocumento47 páginasIi Sesión El Atomo de Carbonobilder rojas rivadeneiroAún no hay calificaciones
- Enlaces QuímicosDocumento27 páginasEnlaces QuímicosFernando ZuñigaAún no hay calificaciones
- Geometría Molecular RPENVDocumento24 páginasGeometría Molecular RPENVRomaRemoAún no hay calificaciones
- Enlace covalente: compartición de electronesDocumento31 páginasEnlace covalente: compartición de electronesceo_quercusAún no hay calificaciones
- Geometría Molecular 1Documento56 páginasGeometría Molecular 1Kevin Guao BolañoAún no hay calificaciones
- Teoria de Enlace Valencia TevDocumento12 páginasTeoria de Enlace Valencia TevpelusaAún no hay calificaciones
- Teorías para Explicar El Enlace CovalenteDocumento22 páginasTeorías para Explicar El Enlace CovalenteJuan RamírezAún no hay calificaciones
- Conocimientos Previos para Química OrgánicaDocumento6 páginasConocimientos Previos para Química OrgánicaAvril Bolondi MedinaAún no hay calificaciones
- Monografia Compuestos de CoordinacionDocumento11 páginasMonografia Compuestos de CoordinacionCT Laiño Valeria AlejandraAún no hay calificaciones
- Teoría Del Enlace de ValenciaDocumento6 páginasTeoría Del Enlace de ValenciaErik Ortiz BlancoAún no hay calificaciones
- Investigacion TrpecvDocumento4 páginasInvestigacion TrpecvMario Castilla RgAún no hay calificaciones
- Regla Del Octeto y Electrones de ValenciaDocumento4 páginasRegla Del Octeto y Electrones de Valencianalgui911Aún no hay calificaciones
- Tema2 Enlace QuimicoDocumento9 páginasTema2 Enlace Quimicoanucissu15Aún no hay calificaciones
- TREPEVDocumento4 páginasTREPEVfaltriqueraAún no hay calificaciones
- Tabla Periódica 2012Documento39 páginasTabla Periódica 2012Pochoo AlexAún no hay calificaciones
- Cuestionarios de QuimicaDocumento13 páginasCuestionarios de QuimicaAnita EspinosaAún no hay calificaciones
- Hibridación Orbital y Teoría de Orbitales MolecularesDocumento4 páginasHibridación Orbital y Teoría de Orbitales MolecularesazulcathalinagAún no hay calificaciones
- Enlace CovalenteDocumento18 páginasEnlace CovalenteManuelReznorAún no hay calificaciones
- 4 Practica 4 y 5 Practica 3 - Enlaces IntermolecularesDocumento5 páginas4 Practica 4 y 5 Practica 3 - Enlaces Intermoleculareslaura cabrera alarconAún no hay calificaciones
- CLASE 03 - CM10Documento35 páginasCLASE 03 - CM10AlejandroAún no hay calificaciones
- Teoría Del Enlace de ValenciaDocumento3 páginasTeoría Del Enlace de Valencia02-AS-LI-ROSSANJHELA JHOSELINE MANDUJANO OREAún no hay calificaciones
- Investigación 2 de QuímicaDocumento13 páginasInvestigación 2 de QuímicaJuanCaAPAún no hay calificaciones
- Enlace QuimicoDocumento136 páginasEnlace QuimicoHenry VelesacaAún no hay calificaciones
- Que Son Los OrbitalesDocumento7 páginasQue Son Los OrbitalesOskar JD KasallasAún no hay calificaciones
- La Materia y Sus TransformacionesDocumento6 páginasLa Materia y Sus TransformacionesEsteban ÑacataAún no hay calificaciones
- Hibridación de Orbitales AtómicosDocumento30 páginasHibridación de Orbitales AtómicosMonica BortAún no hay calificaciones
- Consulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.Documento10 páginasConsulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.BryanAngamarcaAún no hay calificaciones
- Ejercicios Resueltos de EnlaceDocumento4 páginasEjercicios Resueltos de EnlaceKarol GonzálezAún no hay calificaciones
- Enlace e HibridaciónDocumento19 páginasEnlace e HibridaciónAlonso Pino100% (4)
- Puntos 4-6Documento4 páginasPuntos 4-6alejo uribeAún no hay calificaciones
- Enlace de Valencia e Hibridación Quimica 1Documento52 páginasEnlace de Valencia e Hibridación Quimica 1Esteban CastilloAún no hay calificaciones
- Enlaces QuimicosDocumento12 páginasEnlaces QuimicosMARIA ISABEL MESA PEREZAún no hay calificaciones
- Unidad II Teoría Orbital MlecularDocumento82 páginasUnidad II Teoría Orbital Mlecularvillegas.angelaAún no hay calificaciones
- Enlaces y Geometria MolecularDocumento23 páginasEnlaces y Geometria MolecularRaul Alberto Fassora VoigtAún no hay calificaciones
- Guia Enlace Quimico 10Documento6 páginasGuia Enlace Quimico 10lucia100% (1)
- Polaridad de EnlacesDocumento9 páginasPolaridad de EnlacesAriel Alvin Arias CondeAún no hay calificaciones
- Informe Capítulos 1 y 2 Del Libro de John McmurryDocumento4 páginasInforme Capítulos 1 y 2 Del Libro de John McmurryPaula Marialys Ramirez ManzuetaAún no hay calificaciones
- Práctica No 1 Enlaces HíbridosDocumento9 páginasPráctica No 1 Enlaces HíbridosZury Carrion100% (1)
- Enlace Químico: Regla Del OctetoDocumento5 páginasEnlace Químico: Regla Del Octetonaiara sanchezAún no hay calificaciones
- Capítulo 9. - Geometría Molecular y Teorías de Enlace OKDocumento18 páginasCapítulo 9. - Geometría Molecular y Teorías de Enlace OKJorgeAguilarAún no hay calificaciones
- $RW07N9HDocumento15 páginas$RW07N9Hedson chavezAún no hay calificaciones
- Estructuras de LewisDocumento125 páginasEstructuras de LewisJonathan RocaAún no hay calificaciones
- Geometría y enlaces de moléculasDocumento5 páginasGeometría y enlaces de moléculasmg88mgAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosDe EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosAún no hay calificaciones
- Modelo Del Carbon14 Modificacion Veronica 1Documento9 páginasModelo Del Carbon14 Modificacion Veronica 1CarlosSusulPeñaMaGañaAún no hay calificaciones
- Reporte Fisica Aplicada Ala QuimicaDocumento6 páginasReporte Fisica Aplicada Ala QuimicaCarlosSusulPeñaMaGañaAún no hay calificaciones
- Tev PDFDocumento10 páginasTev PDFCarlosSusulPeñaMaGañaAún no hay calificaciones
- Complejo QuimicoDocumento2 páginasComplejo QuimicoCarlosSusulPeñaMaGañaAún no hay calificaciones
- Tev PDFDocumento10 páginasTev PDFCarlosSusulPeñaMaGañaAún no hay calificaciones
- Determinacion Del Coeficiente de Solubilidad de Una Sal AnhidraDocumento5 páginasDeterminacion Del Coeficiente de Solubilidad de Una Sal AnhidraCarlosSusulPeñaMaGañaAún no hay calificaciones