Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Estequiometria Microbiana 1
Estequiometria Microbiana 1
Cargado por
Pablo LauraDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Estequiometria Microbiana 1
Estequiometria Microbiana 1
Cargado por
Pablo LauraCopyright:
Formatos disponibles
Villanueva A. Carlos E.
Biotecnologa Microbiana
ESTEQUIOMETRIA MICROBIANA
1. CONCEPTOS Y APLICACIN EN BIOPROCESOS
Estudia las relaciones aritmticas entre las masas o volmenes de los reactantes y los
productos en una reaccin qumica llevada a cabo por los microorganismos.
Los clculos estequiomtricos permiten determinar las relaciones msicas y molares entre
los reactantes y los productos finales en los procesos fermentativos.
Cual es la concentracin final de microorganismos o productos obtenidos respecto de la
concentracin de los componentes (sustratos) del medio de cultivo ?
Esta informacin se deduce de las ecuaciones de reaccin escrita y balanceadas
correctamente y de los pesos atmicos pertinentes.
Por ejemplo:
Reactantes
1.
2 H2
4g
O2
32 g
Productos
2 H2 O
36 g
36 g
2.
C6H1206 + 6 O2
180 g
192 g
372 g
6 CO2 + 6 H2O + 38 ATP
264 g
108 g
372 g
Durante las reacciones qumicas o bioqumicas los tomos y molculas se reordenan para
formar nuevos grupos pero se conservan las cantidades siguientes:
1. La masa total de reactantes = masa total de productos; y
2. El numero de tomos de cada elemento (C,H,O) en los reactantes = numero de
tomos de cada elemento (C,H,O) en los productos.
Sin embargo, no existe una ley correspondiente para la conservacin de moles, es decir,
moles de reactantes # moles de productos
La estequiometra es de aplicacin en bioprocesos porque permite:
1. El balance de masa y energa
2. Determinar el rendimiento terico y compararlo con el rendimiento actual del
producto.
3. Chequear la consistencia de datos de la fermentacin experimental
4. Formulacin del medio de nutrientes
El crecimiento microbiano (rx = dx /dt = X) y la formacin de productos (rp = dp/dt = qp .
X) son procesos complejos que reflejan la cintica y estequiometra global de cientos de
reacciones intracelulares.
Villanueva A. Carlos E.
Biotecnologa Microbiana
Discutiremos:
Como son formuladas las ecuaciones de reaccin para el crecimiento microbiano y
la sntesis de productos (metabolitos) ?
2. ESTEQUIOMETRIA DEL CRECIMIENTO MICROBIANO
Cuando ocurre crecimiento celular (rx = dx /dt = X), las clulas (biomasa, X) constituye
un producto de la reaccin y debe ser representada en la ecuacin de reaccin
estequiomtrica.
A. PLANTEAMIENTO DE LA ECUACION DE CRECIMIENTO CELULAR
a. El crecimiento celular obedece a la ley de la conservacin de la masa y podemos
escribir la siguiente ecuacin para expresar el crecimiento celular aerobio.
CwHxOyNz + a O2 + b HgOhNi
Formula quimica
sustrato
Formula quimica
fuente N2
c CHON
+ d CO2
+ e H2 O
Formula quimica
biomasa seca
Glucosa: C6H1206
W=6
X =2
Y =6
Z = carece
Donde:
a, b, c, d, e
son los coeficientes estequiomtricos
b. La ecuacin es escrita sobre la base de 1 mol de sustrato. Por lo tanto: a moles de O2
son consumidos y d moles de CO2 son formados por mol de sustrato reactante.
c. La figura representa esta conversin a nivel celular.
Bioconversin
del sustrato, oxigeno y fuente de nitrgeno para crecimiento celular
CwHxOyNz -----------
---------
c CHON
a O2
----------
--------
d CO2
b HgOhNi
----------
---------
e H2 O
CELULA
d. No se incluye multitud de compuestos tales como ATP y NADH, no sujetos a intercambio
neto con el ambiente. Las vitaminas y minerales podran estar incluidos, pero se obvian
por su consumo pequeo. Otras sustancias y productos podran ser seleccionados si
son apropiados.
Villanueva A. Carlos E.
Biotecnologa Microbiana
e. La biomasa es representada por la formula CHON que es una reflexin de la
composicin de la biomasa microbiana.
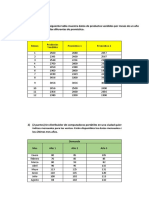
Los microorganismos (por ej. E. coli) contienen un amplio rango de elementos (Tabla
1). Sin embargo 90 95 % de la biomasa puede estar constituida por 4 elementos
mayores: C, H, O, N.
Tabla 1.
En la Tabla 2 son listadas la composicin elemental de varias especies en trminos de
aquellos 4 elementos.
Tabla 2
Composicin elemental y grado de reduccin para organismos seleccionados
Organismo
Formula elemental
Grado de reduccin
(Relativo al NH3)
Escherichia coli
Saccharomyces cerevisiae
Saccharomyces cerevisiae
Candida utilis
Candida utilis
Candida utilis
Candida utilis
C H 1.77 O 0.49 N 0.24
C H 1.83 O 0.56 N 0.17
C H 1.81 O 0.51 N 0.17
C H 1.83 O 0.54 N 0.10
C H 1.87 O 0.56
C H 1.83 O 0.46
C H 1.87 O 0.56
4.07
4.20
4.28
4.45
Promedio
C H 1.79 O 0.50 N 0.20
4.9
C H 1.8 O 0.5 N 0.2 puede ser usado como una formula general cuando el anlisis de
composicin no es disponible.
El peso molecular promedio de biomasa basado sobre cantidades de C, H, O, N,
es por lo tanto 24.6 aunque el 5-10 % de residuo mineral es a menudo adicionado
para contar aquellos elementos no incluidos en la formula.
Villanueva A. Carlos E.
Biotecnologa Microbiana
B. FORMULA MINIMA DE UN MICROORGANISMO PROMEDIO
1. Composicin elemental de un microorganismo
Es el porcentaje de cada elemento contenido en 100 partes de masa celular (tabla 1)
Se puede definir un microorganismo promedio como aquel cuya composicin (%
P/P) de elementos mayoritarios (C,H,O,N) es:
C = 46.5 %
; H = 6.49 ;
O = 31.0 % ;
N = 10.85
Siendo el contenido de sales 5 %
La composicin elemental de la biomasa se mantiene constante durante el cultivo,
No se modifica mayormente durante un cultivo. Son semejantes para distintos tipos
de microorganismos (bacterias y hongos).
Sin embargo, la composicin macromolecular (protenas, cidos nucleicos, etc.)
puede variar sensiblemente.
2. Determinacin de formula mnima de un microorganismo promedio
Teniendo en cuenta la composicin elemental media anterior es posible escribir
una formula mnima de un microorganismo promedio, como:
C H 1.67 O 0.5 N 0.2
Esta formula representa solo el 95 % p/p de la biomasa. Se calcula as:
Clculo de cocientes atmicos:
Dividir composicin centesimal de cada elemento por su peso atmico
C = 46.5 / 12 = 3.88
H = 6.49 / 1 = 6.49
O = 31.0 / 16 = 1.94
N = 10.85 / 14 = 0.78
Obtener relacin atmica:
Dividir los cocientes atmicos por el menor de ellos
C = 3.88 / 0.78 = 4.97
O = 1.94 / 0.78 = 2.49
H=
N=
6.49 / 0.78 = 8.32
0.78 / 0.78 = 1
Relacionando al carbono
Dividir relaciones atmicas entre 4.97
C = 1
Resulta la:
H = 1.67
0 = 0.5
N = 0.2
Frmula mnima : C H 1.67 O 0.5 N 0.2
Definir 1- C mol de biomasa
Con fines netamente prcticos:
cantidad de biomasa que contiene un atomo gramo de carbono
Qu peso de clulas ( o biomasa) corresponde a un mol ? es decir,
Cuantos gramos de clulas ( o biomasa) corresponde a un mol ?
12 (1) + 1 (1.67) + 16 (0.5) + 14 (0.2) 24.47
1C-mol de biomasa = ------------------------------------------------- = ------- = 25.8 g
0.95
Villanueva A. Carlos E.
Biotecnologa Microbiana
Por tanto una concentracin de biomasa ( X en gL-1) es equivalente a:
X/25.8 C-mol de biomasa;
o bien: XGx /12 C-mol de biomasa L-1
Donde: Gx es la fraccin de carbono de biomasa (0.465 para el microorganismo
promedio)
Esta ltima forma de calcular los C-moles de biomasa es ventajosa ya que solo
requiere conocer Gx, un dato que se puede obtener fcilmente de la bibliografa.
En caso de no existir datos disponibles, se puede suponer Gx = 0.465 sin temor a
cometer errores graves.
Definir 1-C mol de fuente de carbono y energa, y tambin 1 C mol de producto.
Por ejemplo para :
Glucosa (C6H1206)
Etanol (C2H60)
1-C mol de glucosa ser CH20
= 30 g
1-C mol de etanol ser CH30 0.5 = 23 g
En general para un compuesto de la forma Cn HLOq Nm 1-C mol estar representado
por C HL/n Oq/n N m/n
C. DETERMINACION DE COEFICIENTES ESTEQUIOMETRICOS
La ecuacin de reaccin planteada no es completa si no se conocen los coeficientes
estequiomtricos a, b, c, d, e
CwHxOyNz + a O2 + b HgOhNi
c CHON + d CO2
+ e H2 O
PROCEDIMIENTO:
1. Obtencin de la formula para biomasa: una vez obtenida, los coeficientes son
evaluados usando procedimientos normales para balances de ecuaciones.
2. Balance elemental y solucin de ecuaciones simultaneas
CwHxOyNz + a O2 + b HgOhNi
Balance de C:
w
Balance de H:
x + bg
Balance de O: y + 2a + bh
Balance de N:
z + bi
c CHON + d CO2
=
=
=
=
+ e H2 O
c+ d
c + 2e
c + 2d + e
c
Se tiene 5 coeficientes desconocidos y solo 4 ecuaciones de balance
3. Informacin adicional: esta es requerida antes que las ecuaciones puedan ser
resueltas. Usualmente es obtenida de experimentos. Un parmetro medible til es el:
Moles CO2 producido
Coeficiente estequiomtrico, RQ = ---------------------------------- = --moles O2 consumido
a
4. Determinacin de los coeficientes estequiomtricos
5. Completar ecuacin de reaccin.
6. Determinar cantidades de S, N, O
Villanueva A. Carlos E.
Biotecnologa Microbiana
3. ESTEQUIOMETRIA DE LA FORMACION DE PRODUCTOS
BALANCE QUIMICO:
Los procesos microbianos en los cuales la biomasa microbiana (CHON) es el nico
producto formado (ej. produccin de levadura de panificacin), son en la practica
relativamente raros.
Cuando el crecimiento microbiano es acompaado de la produccin de uno o varios
metabolitos (CjHkOlNm) la reaccin global obedece al principio de la conservacin de la
materia y la ecuacin estequiomtrica del crecimiento puede extenderse para incluir la
sntesis del metabolito de la sgte manera:
CwHxOyNz + a O2 + b HgOhNi
Donde: CjHkOlNm
f
c CHON
+ d CO2 + e H2 O + f CjHkOlNm
: frmula
bruta del conjunto de productos del metabolismo
diferentes a la biomasa, CO2 y H2 O
: coeficiente estequiomtrico para el producto.
APLICACIONES DE LOS CLCULOS ESTEQUIOMTRICOS
1. Estequiometra de la produccin de etanol
1.1.
Clculo del coeficiente rendimiento terico del etanol
Ejercicio:
Determnese el coeficiente de rendimiento de etanol conociendo que la reaccin global
del proceso fermentativo obedece a la siguiente ecuacin qumica:
C6 H12 O6
2C2 H5OH
2CO2
Solucin:
La ecuacin corresponde a la reaccin principal de la fermentacin de etanol: conversin
de glucosa en etanol y dixido de carbono
Esta ecuacin expresa que una molcula de glucosa se descompone para dar 2
molculas de etanol y dos molculas de dixido de carbono
Aplicando los pesos moleculares, la ecuacin muestra que la reaccin de 180 gramos de
glucosa produce 92 gramos de etanol y 88 gramos de dixido de carbono.
Y p/s
2 [ 12(2) + (6) + (16) ]
92
= ---------------------------------- = ------ = 0.51 gg-1
[ 12(6) + (12) + 16 (6) ]
180
Quiere decir: se formaron 0.51 g de etanol por gramo de glucosa consumida
Villanueva A. Carlos E.
Biotecnologa Microbiana
2. Estequiometra de la produccin de aminocidos
2.1.
Clculo del coeficiente rendimiento terico del acido glutmico
Ejercicio:
Cual es el rendimiento terico del acido glutmico a partir de la glucosa y del total de
reactantes consumidos?
La ecuacin estequiomtrica es:
C6 H12 O6
+ NH3
180 g
17 g
+ 3/2 O2
48 g
C5 H9NO4
+ CO2 + 3H2O
147 g
Solucin:
Aplicando los pesos moleculares, la ecuacin muestra que la reaccin de 180 gramos de
glucosa produce 147 gramos de acido glutmico .
Y p/s
147 g C5 H9NO4
147
= ------------------------------- = ------ = 0.81 gg-1
180 g C2 H12 O6
180
147 g C5 H9NO4
147g producto
Y p/s = ------------------------------------------------- = ----------------------- = 0.6 gg-1
180 g C2 H12 O6 + 17 g NH3 + 48 O2
245 g reactantes
Consumidos
El rendimiento es un trmino muy importante en el anlisis bioqumico dada la complejidad
del metabolismo y la existencia de frecuentes reacciones laterales.
2.2.
Clculo de relaciones msicas en la produccin de acido glutmico
Ejercicio:
La reaccin global para la conversin microbiana de glucosa a acido glutmico es:
C6 H12 O6
+ NH3
+ 3/2 O2
C5 H9NO4
+ CO2 + 3H2O
Qu masa se O2 se necesita para producir 15 g de acido glutmico?
Solucin:
Pesos moleculares: Oxigeno = 32
Acido glutmico: 147
En la ecuacin, los gramos de acido glutmico se convierten en moles utilizando los
corchetes unidad de pesos moleculares.
Se aplica la ecuacin estequiomtrica para convertir los moles de acido glutmico en moles
de oxigeno.
Finalmente los moles de oxigeno se convierten en gramos
1 mol glutmico
3/2 mol O2
32 g O2
15 g. glutmico [ --------------------- ] [ -------------------- ] [ ----------- ] = 4.9 g O2
147 glutmico
1 mol glutmico
1 mol 02
Entonces se necesitan 4.9 g de oxigeno. Si existe tambin crecimiento microbiano se
necesitar una cantidad de oxigeno mayor.
ESTEQUIOMETRIA EN LAS REACCIONES INDUSTRIALES
La ecuacin de la fermentacin alcohlica: C2 H12 O6 2C2 H5OH + 2CO2 . Sugiere
que todos los reactantes (GLUCOSA) se convierten en los productos especificados
(ETANOL y CO2) y que la reaccin progresa hasta el final .
Sin embargo, en los procesos industriales esto no es el caso. En las reacciones
industriales la estequiometra puede no conocerse con exactitud y con el fin de manipular
la reaccin convenientemente, los reactantes no se alimentan en las proporciones exactas
indicadas por la ecuacin de la reaccin. Normalmente se aaden cantidades de algunos
reactantes en exceso, los cuales se encuentran mezclados con el producto una vez que la
reaccin ha finalizado. Adems los reactantes se consumen en reacciones laterales para
formar productos no descritos en la reaccin principal; estos subproductos forman parte
tambin de la mezcla final de la reaccin.
En estas circunstancias se necesita informacin adicional antes de calcular las cantidades
de producto formado o de reactante consumido.
Algunos trminos utilizados para describir las reacciones parciales o laterales son:
REACTANTE LIMITANTE
Reactante que se encuentra presente en la menor cantidad estequiomtrica.
Mientras que los otros reactantes pueden estar presentes en menores cantidades absolutas
al mismo tiempo que se consume la ltima molcula de reactante limitante, en la mezcla
final de la reaccin aparecern cantidades residuales de todos los reactantes excepto del
reactante limitante.
Ejercicio:
Para la reaccin de produccin del acido glutmico:
C6 H12 O6
180 g
+ NH3
17 g
+ 3/2 O2
48 g
C5 H9NO4
147 g
+ CO2 + 3H2O
Cual es el reactante limitante si se proporcionan 100 g de glucosa, 17 g de NH3 y 48g de
O2 ?
Solucin:
La glucosa ser el reactante limitante, incluso aunque se disponga de la mayor cantidad de
masa comparada con las dems sustancias.
REACTANTE EN EXCESO
Reactante presente en una cantidad en exceso sobre la necesaria para combinar con aquel
reactante limitante.
Es aquel que permanece en la mezcla de reaccin una vez que el reactante limitante se ha
consumido totalmente.
El porcentaje en exceso se calcula utilizando la relacin entre la cantidad de material en
exceso y la cantidad necesaria para el consumo completo de reactante limitante.
Moles (masa) presente moles (masa) necesarios para
reaccionar completamente con el reactante limitante
% en exceso = ------------------------------------------------------------------------------ x 100
moles (masa) necesarios para reaccionar completamente
con el reactante limitante
CANTIDAD REQUERIDA DE REACTANTE
Es la cantidad estequiomtrica necesaria para alcanzar la conversin completa del reactante
limitante.
Ejercicio:
En el caso de la produccin del acido glutmico:
C6 H12 O6
180 g
+ NH3 + 3/2 O2
17 g
48 g
C5 H9NO4
147 g
+ CO2 + 3H2O
a. Cul es la cantidad requerida del reactante NH3 para alcanzar la conversin completa
de 100 g de glucosa ?
b. Si se aaden 17 g de NH3 Cul es el % en exceso de NH3?
Solucin:
a. Se requiere 17 g de NH3 para la conversin completa de 180 g de glucosa. Por lo tanto,
la cantidad requerida de NH3 para la conversin completa de 100 g de glucosa es:
17 g NH3 x 100 g glucosa
Cantidad requerida de NH3 =___---------------------------------------------------------- = 9.4 g NH3
180 g glucosa
% en exceso de NH3 =
17 g NH3 - 9.4 g NH3
--------------------------------- x 100
9.4 g NH3
0.80 x 100 = 80%
Las cantidades requeridas y en exceso se basan en la misma cantidad de reactante
limitante incluso solo se produzca una parte de la reaccin.
También podría gustarte
- Caramelizacion y ReaccionDocumento18 páginasCaramelizacion y ReaccionLasTenia Coronel CarpioAún no hay calificaciones
- Globoflexia 5Documento28 páginasGloboflexia 5alltheloversAún no hay calificaciones
- Modelo de MonodDocumento8 páginasModelo de MonodJro Prz MntsAún no hay calificaciones
- Cuadernos de Cátedra IIIDocumento40 páginasCuadernos de Cátedra IIIPaola Ferreira50% (2)
- Memoria DescriptivaDocumento19 páginasMemoria DescriptivaTrini Hernández TéllezAún no hay calificaciones
- 1 Estequiometría Del Crecimiento y Balances PDFDocumento59 páginas1 Estequiometría Del Crecimiento y Balances PDFAntonio de la CruzAún no hay calificaciones
- Cinètica MicrobianaDocumento50 páginasCinètica MicrobianaAmayrani Figueroa DiazAún no hay calificaciones
- Biorreactor AirliftDocumento60 páginasBiorreactor AirliftAlexis GonzalezAún no hay calificaciones
- Estequiometria Del Crecimiento Microbiano-Balances - Sandra Bazan PDFDocumento69 páginasEstequiometria Del Crecimiento Microbiano-Balances - Sandra Bazan PDFSandra BazanAún no hay calificaciones
- Etapas de Un Bioproceso (Ejemplo)Documento2 páginasEtapas de Un Bioproceso (Ejemplo)Martin CebrerosAún no hay calificaciones
- Evaluacion El Atomo 4°Documento2 páginasEvaluacion El Atomo 4°Sedevalparaiso Licapeve100% (2)
- Crecimiento Microbiano y Cálculo de RendimientosDocumento18 páginasCrecimiento Microbiano y Cálculo de RendimientosCorazon Contento100% (2)
- Transferencia de Calor en Bioprocesos. 2016 2Documento36 páginasTransferencia de Calor en Bioprocesos. 2016 2jair salcedo0% (1)
- Estequiometría de BacteriaDocumento2 páginasEstequiometría de BacteriaDavid100% (1)
- Problemas ResueltosDocumento12 páginasProblemas ResueltosJuan Pablo MartinAún no hay calificaciones
- Guia Ejercicios BioreactoresDocumento19 páginasGuia Ejercicios BioreactoresLuci Sims75% (28)
- Estequiometría Del Crecimiento y BalancesDocumento59 páginasEstequiometría Del Crecimiento y BalancesJoao Lecca Ruíz100% (1)
- Ejercicios ResueltosDocumento24 páginasEjercicios ResueltosFeshir Gutierrez0% (3)
- Cinetica MicrobianaDocumento59 páginasCinetica MicrobianaMiguelAngelToralRomeroAún no hay calificaciones
- Servicios Auxiliares de Un BiorreactorDocumento11 páginasServicios Auxiliares de Un BiorreactorJasminPonceAún no hay calificaciones
- Balance Materia en Sistemas de CultivoDocumento19 páginasBalance Materia en Sistemas de CultivoWilfredo TullumeAún no hay calificaciones
- Apuntes de Bioreactores Ver 1-1-2014Documento112 páginasApuntes de Bioreactores Ver 1-1-2014Camila Javiera Vergara100% (1)
- Biorreactor de Columna de BurbujeoDocumento9 páginasBiorreactor de Columna de BurbujeoZHAIRA0260% (5)
- Métodos de Determinación Del KlaDocumento13 páginasMétodos de Determinación Del KlaSarahi BascopeAún no hay calificaciones
- Análisis Matricial Jairo Uribe Escamilla PDFDocumento180 páginasAnálisis Matricial Jairo Uribe Escamilla PDFIgor Alarcón100% (1)
- VVM en FermentacionesDocumento3 páginasVVM en FermentacionesJean Carlos QvisPe100% (1)
- Taller Bioreactores SemA2014Documento2 páginasTaller Bioreactores SemA2014Daniel David Olaya67% (3)
- T2 Prob Int M PDFDocumento3 páginasT2 Prob Int M PDFMariana MillanAún no hay calificaciones
- 2.4 Diseño de Biorreactores - Variables Y Parámetros de DiseñoDocumento5 páginas2.4 Diseño de Biorreactores - Variables Y Parámetros de DiseñoGuille SuásteguiAún no hay calificaciones
- Estequiometria Microbiana 1Documento5 páginasEstequiometria Microbiana 1Richard Icaro EsparzaAún no hay calificaciones
- Modelos Cinéticos No Estructurados - No SegregadosDocumento4 páginasModelos Cinéticos No Estructurados - No SegregadosTanilvalAún no hay calificaciones
- Estequiometría Del CrecimientoDocumento26 páginasEstequiometría Del CrecimientoFrancisco Javier Dominguez De Los SantosAún no hay calificaciones
- Consumo de Sustrato. Consumo de Sustrato para Crecimiento.Documento5 páginasConsumo de Sustrato. Consumo de Sustrato para Crecimiento.Alex TeranAún no hay calificaciones
- Fisioterapia WordDocumento19 páginasFisioterapia WordLasTenia Coronel Carpio0% (1)
- Acústica Del PianoDocumento4 páginasAcústica Del PianoJosé MartinezAún no hay calificaciones
- Unidad 5. Cinética Microbiana. CineticaDocumento21 páginasUnidad 5. Cinética Microbiana. CineticaJaqueline Zambrano100% (1)
- Ejercicios Cultivo en Lote para EstudiantesDocumento1 páginaEjercicios Cultivo en Lote para EstudiantesBarbie Centeno33% (3)
- Ecuación de Monod y Crecimiento ExponencialDocumento4 páginasEcuación de Monod y Crecimiento ExponencialAna Rodriguez Rodriguez100% (1)
- Biorreactor de Tanque Agitado - Morgan G. Vásquez 2010Documento6 páginasBiorreactor de Tanque Agitado - Morgan G. Vásquez 2010Morgan G. Vásquez78% (9)
- Ejercicios Cinetica de Crecimiento CelularDocumento4 páginasEjercicios Cinetica de Crecimiento CelularClaudio Eduardo Jara CarrilloAún no hay calificaciones
- Biorreactores No ConvencionalesDocumento56 páginasBiorreactores No ConvencionalesXavier Lira Palza100% (4)
- Cinetica de Consumo de SustratoDocumento28 páginasCinetica de Consumo de Sustratoromael100% (1)
- Practica 3 Determinación Del Coeficiente de TransferDocumento14 páginasPractica 3 Determinación Del Coeficiente de TransferFernando CardonaAún no hay calificaciones
- Estequiometria OficialDocumento23 páginasEstequiometria OficialElmer Santisteban SanchezAún no hay calificaciones
- Problemas Formulacion y CineticaDocumento2 páginasProblemas Formulacion y CineticaAbryAún no hay calificaciones
- Diseno de BiorreactoresDocumento55 páginasDiseno de BiorreactoresGonzalo1959100% (9)
- Clean in Place BiorreactoresDocumento8 páginasClean in Place BiorreactoresJanai Arriaga100% (1)
- Estequiometria y Cinetica Del Crecimiento BacterianoDocumento14 páginasEstequiometria y Cinetica Del Crecimiento BacterianoMariflor MarquezAún no hay calificaciones
- Cinética de FermentaciónDocumento26 páginasCinética de FermentaciónElizabeth Granda Carazas33% (3)
- Balance de Biorreactor Por Lote AlimentadoDocumento1 páginaBalance de Biorreactor Por Lote AlimentadoLuz RoldanAún no hay calificaciones
- Practica Miles and Misra Equipo 4Documento20 páginasPractica Miles and Misra Equipo 4Isabel Benitez0% (2)
- Libro de Cinetica MicrobianaDocumento24 páginasLibro de Cinetica MicrobianaCristian Danilo Hernandez FigueroaAún no hay calificaciones
- Ejercicios KLa Coeficiente de Transferencia de MasaDocumento12 páginasEjercicios KLa Coeficiente de Transferencia de MasaGabriela Kaulitz Jahseh67% (3)
- Preguntas Cinética de Crecimiento MicrobianoDocumento3 páginasPreguntas Cinética de Crecimiento MicrobianoGabriell NevarezAún no hay calificaciones
- Ecuaciones de Diseño de BiorreactorDocumento7 páginasEcuaciones de Diseño de BiorreactorjesusAún no hay calificaciones
- Ejercicios Ingenieria BiorreactoresDocumento25 páginasEjercicios Ingenieria BiorreactoresEduardo RosadoAún no hay calificaciones
- Estequiometria de Crecimiento MicrobianoDocumento22 páginasEstequiometria de Crecimiento MicrobianoJose EstebanAún no hay calificaciones
- Biorreactor Tipo WAVE y FootobiorreactorDocumento9 páginasBiorreactor Tipo WAVE y FootobiorreactorNiní OrtizAún no hay calificaciones
- Ejercicios BIOPROCESOS ScilabDocumento7 páginasEjercicios BIOPROCESOS ScilabHeisenberg E GomezAún no hay calificaciones
- F ESTEQUIOMETRIA-MICROBIANA-1.pdf 24589438 CompressedDocumento10 páginasF ESTEQUIOMETRIA-MICROBIANA-1.pdf 24589438 CompressedJesús MonterrozaAún no hay calificaciones
- Estequiometria MicrobianaDocumento3 páginasEstequiometria MicrobianaArianaAún no hay calificaciones
- ESTEQUIOMETRIADocumento14 páginasESTEQUIOMETRIABreynerChunquiSuarezAún no hay calificaciones
- Capítulo 5Documento16 páginasCapítulo 5Pedro Peláez SánchezAún no hay calificaciones
- Balances en BioprocesosDocumento9 páginasBalances en BioprocesosMafe BotiaAún no hay calificaciones
- Crecimiento MicrobianoDocumento14 páginasCrecimiento MicrobianoJuãn Leão100% (1)
- Estequiometria MicrobianaDocumento9 páginasEstequiometria MicrobianaJR LindoAún no hay calificaciones
- Diseño de Plantas - Galletas de AlgarrobaDocumento119 páginasDiseño de Plantas - Galletas de AlgarrobaLasTenia Coronel CarpioAún no hay calificaciones
- Aceite de Ajonjoli - TADocumento12 páginasAceite de Ajonjoli - TALasTenia Coronel CarpioAún no hay calificaciones
- Ramas de La Toxicologia WordDocumento1 páginaRamas de La Toxicologia WordLasTenia Coronel CarpioAún no hay calificaciones
- Ficha Tecnica Del CafeDocumento2 páginasFicha Tecnica Del CafeLasTenia Coronel CarpioAún no hay calificaciones
- Tratamiento de Aguas Saladas PDFDocumento34 páginasTratamiento de Aguas Saladas PDFLasTenia Coronel CarpioAún no hay calificaciones
- Industrializacion de Aceites y GrasasDocumento9 páginasIndustrializacion de Aceites y GrasasLasTenia Coronel CarpioAún no hay calificaciones
- Diagrama de Flujo para Curado y Salado en HúmedoDocumento1 páginaDiagrama de Flujo para Curado y Salado en HúmedoLasTenia Coronel CarpioAún no hay calificaciones
- ToffeeDocumento9 páginasToffeeLasTenia Coronel CarpioAún no hay calificaciones
- Elaboracion de Licores A Base de LecheDocumento3 páginasElaboracion de Licores A Base de LecheLasTenia Coronel Carpio100% (1)
- III Bimestre - 2da Practica Rm. Gamma FisicaDocumento4 páginasIII Bimestre - 2da Practica Rm. Gamma FisicaJORGE LUISAún no hay calificaciones
- 01 Volumen 01 Memoria DescriptivaDocumento54 páginas01 Volumen 01 Memoria DescriptivaRonald PSAún no hay calificaciones
- Gabarito 1º Examen Final 5jul2022 RM1Documento14 páginasGabarito 1º Examen Final 5jul2022 RM1Martín UzabalAún no hay calificaciones
- Propieddades de Los GasesDocumento2 páginasPropieddades de Los GasesGisell GimenezAún no hay calificaciones
- Informe de Laboratorio Del Experimento de Prueba de TracciónDocumento83 páginasInforme de Laboratorio Del Experimento de Prueba de TracciónScribdTranslationsAún no hay calificaciones
- Tratamiento de Imagenes SatelitalesDocumento41 páginasTratamiento de Imagenes SatelitalesYary LopezAún no hay calificaciones
- Tercera Asignacion de Estadistica Aplicada A La Ingenieria 2019 IIDocumento3 páginasTercera Asignacion de Estadistica Aplicada A La Ingenieria 2019 IICristian Ener GCAún no hay calificaciones
- Imagenes Modelacion EcuacionDocumento26 páginasImagenes Modelacion EcuacionPROFABELGPAún no hay calificaciones
- 2a ALUMNOS Conceptos Basicos Probabilidad Equilibrio EntropiaDocumento7 páginas2a ALUMNOS Conceptos Basicos Probabilidad Equilibrio EntropiadfpayykwnrwbfmniwyAún no hay calificaciones
- Caracteristicas Maquinas ElectricasDocumento40 páginasCaracteristicas Maquinas ElectricasPedro100% (1)
- Mem - Cal.RBO 261014Documento4 páginasMem - Cal.RBO 261014f3r_nano9074Aún no hay calificaciones
- Curvas Estandar ABS Y TIROSINADocumento7 páginasCurvas Estandar ABS Y TIROSINALuis R. DzulAún no hay calificaciones
- Informe II-OrgánicaII Síntesis Del Ácido M-NitrobenzoicoDocumento9 páginasInforme II-OrgánicaII Síntesis Del Ácido M-NitrobenzoicoBryan JumboAún no hay calificaciones
- Zener Mono 500w PDFDocumento16 páginasZener Mono 500w PDFNASKAR SOUNDSAún no hay calificaciones
- 5 Funciones de TransferenciaDocumento13 páginas5 Funciones de TransferenciaeddytumiriAún no hay calificaciones
- Introduccion Estructuras MetálicasDocumento12 páginasIntroduccion Estructuras MetálicasIsmaelAún no hay calificaciones
- Ejercicios de RefuerzoDocumento20 páginasEjercicios de RefuerzoAndré CalderónAún no hay calificaciones
- Análisis ElementalDocumento5 páginasAnálisis ElementalElmojadoAún no hay calificaciones
- CUESTDocumento4 páginasCUESTDarwin QcAún no hay calificaciones
- Formato Informe de LaboratorioDocumento21 páginasFormato Informe de LaboratorioSalma VillarrealAún no hay calificaciones
- CablesDocumento39 páginasCablessishio11Aún no hay calificaciones
- Como Hacer La TesisDocumento9 páginasComo Hacer La TesisCRISTOBAL MUNGUIA CHIPANAAún no hay calificaciones
- BloqueA Materiales Diagramas - EquilibrioDocumento16 páginasBloqueA Materiales Diagramas - Equilibriolos_pajarillosAún no hay calificaciones
- Modelo Atomico de SummerfieldDocumento2 páginasModelo Atomico de Summerfieldalonsini1Aún no hay calificaciones
- Formato Encuesta para La Identificación de PeligrosDocumento1 páginaFormato Encuesta para La Identificación de PeligrosPaola SanchezAún no hay calificaciones