Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Electrometalurgia 2
Cargado por
Rossel wilson Mamani HuancaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Electrometalurgia 2
Cargado por
Rossel wilson Mamani HuancaCopyright:
Formatos disponibles
ELECTROMETALURGIA
AO DE LA PROMOCION DE LA INDUSTRIA
RESPONSABLE Y COMPROMISO CLIMATICO
UNIVERSIDAD NACIONAL JORGE BASADRE
GROHMANN
FACULTAD DE INGENIERIA
ALEXANDER ESCOBAR AROCUTIPA
2010-34761
dest_1014@hotmal.com
CONTENIDO DEL TEMA
DESARROLLO HISTORICO DE LA ELECTROQUIMICA
ELECTROMETALURGIA
PROCESOS ELECTROMETALRGICOS
- Electro obtencin (Electrowinning) de metales
- Electro refinacin (Electrorefining) de metales
- Galvanoplastia (Electroplating)
- Electro conformado (Electroforming)
ELECTROQUIMICA
ELECTROLISIS
- Reaccin redox (Oxidacin-reduccin)
TIPOS DE TRANSFORMACIONES
- Transformaciones espontneas
- Transformaciones no espontneos
TIPOS DE REACCIONES
- Reaccin de oxidacin
- Reaccin de Reduccin
DESARROLLO HISTORICO DE LA
ELECTROQUIMICA
Fue descubierto accidentalmente
en 1800 por William Nicholson
mientras estudiaba el
funcionamiento de las bateras.
Entre los aos 1833 y 1836 el
fsico y qumico ingls Michael
Faraday desarroll las leyes de la
electrlisis que llevan su nombre y
acu los trminos electrolticos.
Michael Faraday, Qumico ingls
considerado el fundador de la
electroqumica actual. Estudio solo
la primaria, para su suerte fue
ayudante de un encuadernador y
fue ah donde aprovecho para
auto educarse.
William Nicholson Michael Faraday
DESARROLLO HISTORICO DE LA
ELECTROQUIMICA
Fines del siglo XVIII
Se establece la diferencia entre:
Cuerpos conductores. Ej. Metales.
Cuerpos no conductores. Ej. Azufre,
sales. Soluciones:
a) Conducen corriente elctrica.
b) No conducen corriente elctrica.
Por los aos 1832 . Faraday
Introduce los trminos: electrlisis,
electrolito, electrodo, nodo, ctodo,
in, catin y anin y formula las leyes
cualitativas y cuantitativas
En 1889
Se produce la aplicacin en la
electrodeposicin del aluminio por
Herault en Francia y Hall en EE.UU.
ELECTROMETALURGIA
La electrometalurgia se define como la rama de la metalurgia que usa la energa elctrica
para la produccin y tratamiento de los metales, la energa elctrica es convertida en
calor con el fin de producir la temperatura necesaria para el proceso o servir para
descomponer un compuesto por accin de electroltica en el que el calor generado es
relativamente pequeo por electrolisis, en la que la cantidad de calor empleado es
necesariamente grande.
La electrometalurgia en solucin
acuosa : Aplicada
fundamentalmente a la
produccin de Cu, Zn, Ni, Co, Pb,
Ag, Au y otros metales menores
(Cd, Cr, Mn, Ga, Ti, Te).
La electrometalurgia en sales
fundidas : Aplicada
principalmente a la produccin de
Al, Li, Mg, Na, K y otros metales
menores (Tierras raras, Ti, V, W,
Zr, Th).
PROCESOS ELECTROMETALURGICOS
A - Electro obtencin (Electrowinning) de metales
B - Electro refinacin (Electrorefining) de metales
C - Galvanoplastia (Electroplating)
D - Electro conformado (Electroforming)
PROCESOS ELECTROMETALURGICOS
A - Electro obtencin (Electrowinning) de metales
Consiste en la extraccin de metales a partir de soluciones,
en forma de depsitos metlicos puros, densos y compactos
o depsitos metlicos en polvo (pulvi-electrometalurgia) o
bien, depsitos de compuestos metlicos (xidos, hidrxidos
o sales).
PROCESOS ELECTROMETALURGICOS
B - Electro refinacin (Electrorefining) de metales
Consiste en la obtencin de depsitos
metlicos de alta pureza a partir de un
metal impuro.
Consiste en recubrimientos metlicos
delgados con fines anticorrosivos o
estticos ( cromados)
PROCESOS ELECTROMETALURGICOS
C - Galvanoplastia (Electroplating)
Consiste en recubrimientos metlicos delgados con fines
anticorrosivos o estticos (cromados). El proceso se basa en el
traslado de iones metlicos desde un nodo a un ctodo, donde se
depositan, en un medio lquido acuoso, compuesto
fundamentalmente por sales metlicas y ligeramente acidulado.
PROCESOS ELECTROMETALURGICOS
D - Electro conformado (Electroforming)
Consiste en la elaboracin de piezas metlicas especiales por va electroltica.
El electroconformado es un proceso de deposicin electroltica utilizado para la
fabricacin de cscaras metlicas de pared delgada. Su principal atractivo es su gran
capacidad para reproducir hasta el ms mnimo detalle de la superficie del modelo
empleado en el proceso. Es conocido desde mediados del siglo XIX, y es empleada
hoy en da para la fabricacin de productos de rejilla de precisin, en micro y
nanofabricacin, y en el desarrollo de herramientas y utillajes
ELECTROQUIMICA
La electroqumica es una rama de la qumica que estudia las
reacciones qumicas producidas por accin de la corriente elctrica,
as como la produccin de corriente elctrica, mediante reacciones
qumicas.
Transformacin qumica Energa elctrica
Batera y EW
La electrolisis, o descomposicin de la materia que acompaa al paso de la
electricidad a travs de ella, y la accin de la celda galvnica, o el papel de una
reaccin qumica como un generador elctrico. En cualquier proceso electroltico
debe producirse una reaccin de oxidacin en el nodo y una reaccin de
reduccin en el ctodo. La palabra Electrlisis viene de las races electro,
electricidad y lisis, separacin
ELECTROLISIS
- +
+
+ -
-
-
+
+
-
-
+
-
+
nodo
Catin
Ctodo
anin
La energa necesaria para separar a los iones e incrementar
su concentracin en los electrodos es aportada por la fuente
de alimentacin elctrica.
En los electrodos se produce una transferencia de electrones entre estos y los iones,
producindose nuevas sustancias. Los iones negativos o aniones ceden electrones al nodo (+) y
los iones positivos o cationes toman electrones del ctodo (-).
Se funde o se disuelve el electrlito en un determinado
disolvente, con el fin de que dicha sustancia se separe
en iones (ionizacin).
Se aplica una corriente elctrica continua
mediante un par de electrodos conectados a una
fuente de alimentacin elctrica y sumergidos en
la disolucin. El electrodo conectado al polo
positivo se conoce como nodo, y el conectado al
negativo como ctodo
Cada electrodo atrae a los iones de carga opuesta. As,
los iones negativos, o aniones, son atrados al nodo,
mientras que los iones positivos, o cationes, se
desplazan hacia el ctodo.
PROCESO DE ELECTROLISIS
En todo proceso electroltico ocurren dos semirreaciones:
REDUCCIN: se caracteriza por una ganancia de electrones y se verifica en el electrodo
negativo (ctodo)
OXIDACIN: se caracteriza por una prdida de electrones y se verifica en el electrodo deficiente
de electrones o positivo (nodo)
No obstante , estas reacciones no son necesariamente la de oxidacin de los iones negativos y la
de reduccin de los iones positivos presentes en la disolucin. En una disolucin acuosa, tanto el
agua como los electrodos pueden ser oxidados o reducidos.
PROCESOS DE ELECTROLISIS
Las reacciones en las que el n de oxidacin de dos ms sustancias cambia
se llaman reacciones de oxidacin reduccin
(0) (+2) (+2) (0)
Zn ( s) + Cu
2+
( ac) Zn
2+
( ac) + Cu(s)
Las reacciones redox constan de dos partes o semireacciones que ocurren
simultneamente.
OXIDACIN: PRDIDA de electrones de
una molcula, tomo in.
Zn ( s) Zn
2+
( ac) +2e
-
REDUCCIN: GANANCIA de electrones de
una molcula, tomo in.
Cu
2+
( ac) +2e
-
Cu(s)
REACCION REDOX (OXIDACION REDUCCION)
El estado o nmero de oxidacin (EOX ) es la carga elctrica que tiene un elemento cuando forma parte
de un compuesto.
Oxidante (Agente Oxidante)
Cualquier sustancia pura (elementos, compuestos) que capta, recepta o gana electrones para reducirse.
El oxidante contiene siempre al elemento que se reduce.
Reductor (Agente Reductor)
Sustancia pura (elementos, compuestos) que cede, dona o pierde electrones para oxidarse. El reductor
contiene al elemento que se oxida.
ESTADOS DE OXIDACION
Zn = Agente Reductor. Su estado de oxidacin pasa de 0 a +2, dona
electrones a los iones cobre y hace que se reduzca.
Cu
++
= Agente Oxidante. Su estado de oxidacin pasa de +2 a 0, acepta
electrones del zinc metlico y hace que ste se oxide.
0 2 2
0
2
2
Cu Zn Cu Zn
Cu e Cu
e Zn Zn
Experimentalmente, no es posible observar una semireaccin aislada,
debido a que siempre debe haber una segunda semireaccin que sirva
como fuente o como receptor de electrones, es decir, una semireaccin
individual es un concepto terico
EJEMPLO
B - Transformaciones no espontneos.
Si un metal en la naturaleza se encuentra como xido o sulfuro es
necesario dar energa para obtener el metal, entonces esta
transformacin no es espontnea.
Energa elctrica Transformacin qumica
Proceso no espontneo
TIPOS DE TRANSFORMACION
TIPOS DE REACCIONES
A) Reaccin de oxidacin
El oxigeno es un gas fcilmente disponible del medio ambiente y toma parte
en muchas reacciones de la vida cotidiana.
La adicin de oxigeno a un tomo, in o una molcula; se conoce como una
reaccin de oxidacin. Ej. Un metal al medio ambiente ser oxidado.
Remocin de electrones desde un tomo o grupo de tomos, es
tambin una reaccin de oxidacin, es decir pierde electrones y
por lo general se carga positivamente, pero tambin se puede
neutralizarse, como en el caso del cloro.
Ejemplo.
Fe
= Fe
+2
+ 2e
-
2Cl
-
= Cl
2
+ 2e
-
TIPOS DE REACCIONES
B - Reaccin de Reduccin
Remocin de oxigeno. La reaccin de reduccin es una reaccin
opuesta a la reaccin de oxidacin, es decir el oxigeno ser removido
del xido.
TIPOS DE REACCIONES
B - Reaccin de Reduccin
Adicin de electrones, a un tomo o grupo de tomos, tambin es una
reaccin de reduccin, es decir gana electrones y por lo general se
neutraliza o se carga negativamente.
Cl
2
+ 2e
-
= 2Cl
-
Cu
++
+ 2 e
-
= Cu
TIPOS DE REACCIONES
También podría gustarte
- Seminario Resuelto Sobre Gases IdealesDocumento10 páginasSeminario Resuelto Sobre Gases IdealesMilton Escudero Miranda0% (1)
- Baños ElectroliticosDocumento32 páginasBaños ElectroliticosRicardo Cano RamírezAún no hay calificaciones
- Beneficio de Min. y Pirometalurgia - BERNARDO COTRINA, Leydith DanitzaDocumento2 páginasBeneficio de Min. y Pirometalurgia - BERNARDO COTRINA, Leydith DanitzaLeydith Danitza Bernardo CotrinaAún no hay calificaciones
- Electro MetalurgiaDocumento22 páginasElectro MetalurgiaMarcovid PG100% (2)
- Sílabo Electrometalurgia CompetenciasDocumento3 páginasSílabo Electrometalurgia CompetenciasDiego RoqueAún no hay calificaciones
- Manual - Proceso de ElectroobtenciónDocumento42 páginasManual - Proceso de Electroobtenciónmirkoav100% (7)
- Guia de Ejercicios PDFDocumento72 páginasGuia de Ejercicios PDFYanina FerreiraAún no hay calificaciones
- Conceptos Basicos de ElectroquimicaDocumento8 páginasConceptos Basicos de ElectroquimicachoriparicateAún no hay calificaciones
- LIQUIDOS MAGNETICOS UTILIZADOS PARA RECUPERACIÓN DEL ORO Ponencia PDFDocumento26 páginasLIQUIDOS MAGNETICOS UTILIZADOS PARA RECUPERACIÓN DEL ORO Ponencia PDFOswaldo ChávezAún no hay calificaciones
- Manual de Funcionamiento de La Nikon F60-N60-ES.Documento73 páginasManual de Funcionamiento de La Nikon F60-N60-ES.Pedro Linares88% (8)
- Electrometalurgia A. MoralesDocumento93 páginasElectrometalurgia A. Moralescenthus100% (3)
- Electrometalurgia Del OroDocumento4 páginasElectrometalurgia Del OroAurora CarreraAún no hay calificaciones
- ElectrometalurgiaDocumento13 páginasElectrometalurgiaCarlos VergaraAún no hay calificaciones
- Practica de Catodos FinalDocumento20 páginasPractica de Catodos FinalvalerioAún no hay calificaciones
- Syllabus ElectrometalurgiaDocumento3 páginasSyllabus ElectrometalurgiaHector Juan Donaires SalazaeAún no hay calificaciones
- Electro - MetalurgiaDocumento38 páginasElectro - MetalurgiaItalo Perez AvelloAún no hay calificaciones
- REF AgDocumento26 páginasREF AgJose Carlos YvAún no hay calificaciones
- Metalurgia Extractiva Del CobreDocumento89 páginasMetalurgia Extractiva Del Cobrepablodugal100% (2)
- Metalurgia ExtractivaDocumento3 páginasMetalurgia ExtractivaLeli MartinezAún no hay calificaciones
- SolidificacionDocumento223 páginasSolidificacionEstef LuAún no hay calificaciones
- Metalurgia 2 Capitulo VI 2019Documento30 páginasMetalurgia 2 Capitulo VI 2019Helena Vilchez ValdiviaAún no hay calificaciones
- Informe Tostación Sulfatante de CalcopiritaDocumento37 páginasInforme Tostación Sulfatante de CalcopiritaIvanRodriguez50% (2)
- Horno Eléctrico de ArcoDocumento19 páginasHorno Eléctrico de ArcoDaniel CarlosAún no hay calificaciones
- Cuestionario de Electrorefinación Del CobreDocumento3 páginasCuestionario de Electrorefinación Del CobreDaniel Humberto Hospina RiosAún no hay calificaciones
- Termodinamica y HidrometalurgiaDocumento55 páginasTermodinamica y Hidrometalurgiafrank100% (3)
- Refineria de IloDocumento19 páginasRefineria de IloBraulio ala andiaAún no hay calificaciones
- PeletizacionDocumento36 páginasPeletizacionDani ElAún no hay calificaciones
- ElectroquimicaDocumento88 páginasElectroquimicaFelipe Andres Santiago Diaz100% (1)
- Informe de Electro ObtencionDocumento4 páginasInforme de Electro ObtencionClaudia Alejandra Robles100% (1)
- Reporte Metalurgico y de Materiales - Recuperación de MetalesDocumento10 páginasReporte Metalurgico y de Materiales - Recuperación de MetalesXochitl PérezAún no hay calificaciones
- Tratamientos Térmicos de Los Aceros (Sturla) INDICEDocumento6 páginasTratamientos Térmicos de Los Aceros (Sturla) INDICEBautista BruzzoAún no hay calificaciones
- Electro Refinacion DelcobreDocumento27 páginasElectro Refinacion DelcobreCristhian Ccente IngaAún no hay calificaciones
- Auxiliar No 2Documento8 páginasAuxiliar No 2Cristian AlvayaiAún no hay calificaciones
- Laboratorio 4 - ElectrometalúrgiaDocumento11 páginasLaboratorio 4 - ElectrometalúrgiaEmerson SivinchaAún no hay calificaciones
- Apuntes de SiderurgiaDocumento22 páginasApuntes de SiderurgiajavierAún no hay calificaciones
- ElectroobtenciónDocumento6 páginasElectroobtenciónluiskrkicAún no hay calificaciones
- Refinacion Del Estano Por Eletrolisis en Medio BasicoDocumento14 páginasRefinacion Del Estano Por Eletrolisis en Medio BasicojosmanccAún no hay calificaciones
- Electro MetalurgiaDocumento38 páginasElectro MetalurgiaFrancisco Mura100% (2)
- Proceso de Cobreado o Bronceado A Alta Temperatura de Aceros Al CarbonoDocumento10 páginasProceso de Cobreado o Bronceado A Alta Temperatura de Aceros Al CarbonoCristian Vera100% (1)
- EJERCICIOS de SolidificacionDocumento7 páginasEJERCICIOS de SolidificacionRodrigo Antonio Henriquez TapiaAún no hay calificaciones
- Electrodeposicion Del Cobre PDFDocumento23 páginasElectrodeposicion Del Cobre PDFDeyanire LE100% (1)
- Proceso de Producion Del Cobre, Zinc, Alumiio, Plomo, Estaño y TitanioDocumento12 páginasProceso de Producion Del Cobre, Zinc, Alumiio, Plomo, Estaño y TitanioEverardo IdkAún no hay calificaciones
- Curso de ElectrometalurgiaDocumento57 páginasCurso de ElectrometalurgiaJazFachinAún no hay calificaciones
- Sesion N°6 - Mecanismos y Cinetica Del Proceso de Tostacion Hornos de TostacionDocumento45 páginasSesion N°6 - Mecanismos y Cinetica Del Proceso de Tostacion Hornos de TostacionElvis BoNi100% (1)
- Practica 4 QuimicaDocumento10 páginasPractica 4 QuimicaAnonymous NkOFWmUZ5jAún no hay calificaciones
- Electrometalurgia FAME UNJBGDocumento150 páginasElectrometalurgia FAME UNJBGAna Luisa Garnica SalgadoAún no hay calificaciones
- LABORATORIODocumento23 páginasLABORATORIOMorales Mendoza KenyoAún no hay calificaciones
- Analisis Quimico para ExponerDocumento27 páginasAnalisis Quimico para Exponergaby181107Aún no hay calificaciones
- Clase 11Documento8 páginasClase 11Leonardo Carlos Oyague CervantesAún no hay calificaciones
- Electrolisis y CorrosiónDocumento37 páginasElectrolisis y CorrosiónMarco Ccordova RruizAún no hay calificaciones
- ElectrólisisDocumento6 páginasElectrólisisAdrian Del FabroAún no hay calificaciones
- ElectrodeposicionDocumento10 páginasElectrodeposicionAlexandra ArroyoAún no hay calificaciones
- EXPOQUIMDocumento4 páginasEXPOQUIMClau GarcíaAún no hay calificaciones
- Presentacion #19 ElectrometalurgiaDocumento23 páginasPresentacion #19 ElectrometalurgiaDiego Mendoza CotaAún no hay calificaciones
- Agente OxidanteDocumento15 páginasAgente OxidanteHelder Daniel Cutire SotoAún no hay calificaciones
- Electrólisis - Wikipedia, La Enciclopedia LibreDocumento13 páginasElectrólisis - Wikipedia, La Enciclopedia LibreAndy Torres JimenezAún no hay calificaciones
- Capitulo XI Electroquimica 2023-ADocumento74 páginasCapitulo XI Electroquimica 2023-AKaren esthefani Martínez bustamanteAún no hay calificaciones
- Electro Qu Í MicaDocumento50 páginasElectro Qu Í MicaERNESTO JIMENEZAún no hay calificaciones
- ElectrometalurgiaDocumento11 páginasElectrometalurgiaYeni FloresAún no hay calificaciones
- Electrodeposición Del Zinc (Edwin Porroa Sivava)Documento20 páginasElectrodeposición Del Zinc (Edwin Porroa Sivava)EdwinPorroaSivana88% (8)
- Fico 2Documento16 páginasFico 2Kevin Stip Méndez OlivaresAún no hay calificaciones
- Teria de Pilas1Documento32 páginasTeria de Pilas1Margareth ZambranoAún no hay calificaciones
- Iperc Base Check Point Moquegua ObragDocumento7 páginasIperc Base Check Point Moquegua ObragRossel wilson Mamani HuancaAún no hay calificaciones
- Iperc Base Check Point Moquegua ObragDocumento7 páginasIperc Base Check Point Moquegua ObragRossel wilson Mamani HuancaAún no hay calificaciones
- Redox EspañolDocumento36 páginasRedox EspañolRossel wilson Mamani HuancaAún no hay calificaciones
- Arenas (Modo de Compatibilidad) PDFDocumento19 páginasArenas (Modo de Compatibilidad) PDFWilliamCastroJimenezAún no hay calificaciones
- 10 - Ciclos TermodinamicosDocumento9 páginas10 - Ciclos TermodinamicosMichael MaqueAún no hay calificaciones
- Metodología de Cocina SolarDocumento16 páginasMetodología de Cocina SolarAaron Teves100% (1)
- Fuerza Resultante PDFDocumento45 páginasFuerza Resultante PDFCarmen ZapataAún no hay calificaciones
- Problemas Gases - 2010Documento3 páginasProblemas Gases - 2010Jaime muñoz portugalAún no hay calificaciones
- Mapa Conceptual de Absorcion de GasesDocumento1 páginaMapa Conceptual de Absorcion de GasesCarmen Roxana Quispe CastilloAún no hay calificaciones
- Serie m01Documento2 páginasSerie m01Leslie Flores0% (1)
- InhibiciónDocumento125 páginasInhibiciónOrlando Tatis RangelAún no hay calificaciones
- Magnetizacion Trabajo FinalDocumento21 páginasMagnetizacion Trabajo FinalDerrick HortonAún no hay calificaciones
- Elementos Estructurales Firme Parte 1Documento13 páginasElementos Estructurales Firme Parte 1blakacyto18100% (1)
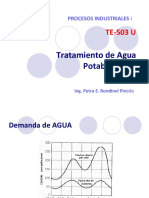
- Potabilización (I) Te503-UDocumento65 páginasPotabilización (I) Te503-ULisset FloresAún no hay calificaciones
- Agua y Sales MineralesDocumento24 páginasAgua y Sales Mineralesjack slim garcia calderonAún no hay calificaciones
- Masa Resorte Fisica 2Documento5 páginasMasa Resorte Fisica 2Laura AndreaAún no hay calificaciones
- Trabajo 14 7063133Documento16 páginasTrabajo 14 7063133Campos OscarAún no hay calificaciones
- LABMATDocumento5 páginasLABMATMilagros Rodriguez AnicchiaricoAún no hay calificaciones
- Quimica 4° Mi PensamientoDocumento66 páginasQuimica 4° Mi Pensamientobdesign24Aún no hay calificaciones
- Ejercicio 1Documento5 páginasEjercicio 1yenny cardenas beltranAún no hay calificaciones
- Informe FisicaDocumento12 páginasInforme FisicaJulieth CalderonAún no hay calificaciones
- Taller 4 - NewtonDocumento3 páginasTaller 4 - Newtondaniel vegaAún no hay calificaciones
- Activiades Previas-Practica 8Documento3 páginasActiviades Previas-Practica 8Maria de los Angeles Perez VillafuerteAún no hay calificaciones
- Informe de Arenas en VerdeDocumento21 páginasInforme de Arenas en VerdeLuz Chavez BonillaAún no hay calificaciones
- Practica 3. Compresion Perpendicular A La Fibra de MaderaDocumento6 páginasPractica 3. Compresion Perpendicular A La Fibra de MaderaMARINA SAAVEDRA CAMACHOAún no hay calificaciones
- Termografía InfrarrojaDocumento5 páginasTermografía Infrarrojared miAún no hay calificaciones
- Memoria de Calculo Estructura Viga Carrilera para Tecle ElectricoDocumento12 páginasMemoria de Calculo Estructura Viga Carrilera para Tecle ElectricoJose QuiroaAún no hay calificaciones
- DIAPOSDocumento25 páginasDIAPOSjorge luisAún no hay calificaciones
- Informe Técnico: Construcción Del Sistema de de Aire Caliente para El Prototipo de Secado de CuerosDocumento25 páginasInforme Técnico: Construcción Del Sistema de de Aire Caliente para El Prototipo de Secado de CuerosPablo Aguilar MartinezAún no hay calificaciones
- Practica 3 Prueva de TorsionDocumento7 páginasPractica 3 Prueva de TorsionBautista Gonzalez Cristopher GiovaniAún no hay calificaciones
- Obras Hidraulicas VertederosDocumento3 páginasObras Hidraulicas VertederosVhugoHuamanMolinaAún no hay calificaciones