0% encontró este documento útil (0 votos)
21 vistas54 páginasSuprarrenales 1
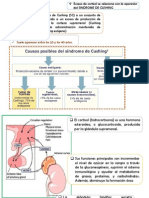
El síndrome de Cushing es un trastorno causado por la exposición prolongada a glucocorticoides, ya sea endógenos o exógenos, siendo la administración de glucocorticoides la causa más común. Se presenta con manifestaciones clínicas que varían desde síntomas sutiles hasta condiciones severas, incluyendo hipertensión, obesidad troncal y alteraciones psiquiátricas. El diagnóstico se establece mediante pruebas específicas y el manejo depende de la causa subyacente, con un enfoque en revertir los síntomas y normalizar la secreción de cortisol.
Cargado por
Kenneth MercadoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
21 vistas54 páginasSuprarrenales 1
El síndrome de Cushing es un trastorno causado por la exposición prolongada a glucocorticoides, ya sea endógenos o exógenos, siendo la administración de glucocorticoides la causa más común. Se presenta con manifestaciones clínicas que varían desde síntomas sutiles hasta condiciones severas, incluyendo hipertensión, obesidad troncal y alteraciones psiquiátricas. El diagnóstico se establece mediante pruebas específicas y el manejo depende de la causa subyacente, con un enfoque en revertir los síntomas y normalizar la secreción de cortisol.
Cargado por
Kenneth MercadoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd