Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Sesión 01 TF
Cargado por
Nícolas LeyvaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Sesión 01 TF
Cargado por
Nícolas LeyvaCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL DE TRUJILLO Ingeniería Mecánica
TRANSFORMACIONES DE FASE Y T.T.
Sesión 01
Diagramas de Fase
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Resultados de Aprendizaje
Interpretar Diagramas de Fase
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
MOTIVACIÓN
• Ingresar a www.menti.com
• Introducir el código: 525311
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Fase
Una fase de un material, en términos de su microestructura, es una región que
difiere en estructura y/o composición de otra región.
Aleación polifásica Aleación monofásica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
DEFINICIÓN DE FASE
Composición
Sistema
FIJAS
Organización
atómica
FÍSICAS QUÍMICAS
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
CARACTERÍSTICAS
La misma estructura y ordenamiento atómico en todo el
material
Tiene en general la misma composición y propiedades en
su interior.
Hay una interfase definida entre la fase y cualquiera de las
otras fases circundantes.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Agua líquida
agua Hielo
Vapor de agua
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solubilidad y soluciones sólidas
Cuando se mezclan diversos componentes o materiales, como cuando
se agregan elementos aleantes a un metal, se pueden formar soluciones
sólidas o líquidas.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solución sólida:
Fase sólida formada por la combinación de dos o más elementos que
están atómicamente dispersos, formando una única estructura (fase) y
de composición variable (por ser una solución, hay un rango de
solubilidad).
Solubilidad de soluciones sólidas:
Solubilidad total (completa)
Solubilidad parcial o limitada
Insolubilidad total
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) Solubilidad total b) Solubilidad limitada
c) Insolubilidad total
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) y b) Cu y Ni líquidos son totalmente solubles entre sí, las aleaciones sólidas de Cu y Ni tienen
solubilidad completa
c) En aleaciones Cu y Zn que contienen más de 30% de Zn se forma una segunda fase por la
solubilidad limitada del Zn en el Cu
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Límite de solubilidad
Para una temperatura
específica, existe una
concentración máxima de
átomos de soluto que se
disuelven en el disolvente para
formar una solución sólida.
Solubilidad del azúcar en un
jarabe de agua azucarada
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipos de soluciones sólidas
Solución sólida sustitucional: Solución sólida intersticial: los
los átomos de B ocupan átomos B ocupan posiciones
posiciones de la red A intersticiales de la red A
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solución sólida sustitucional:
En las soluciones sólidas sustitucionales, los átomos de soluto sustituyen en términos de
posición, a los átomos de la matriz.
Para que un sistema de aleación, como el de Cu-Ni, tenga solubilidad sólida ilimitada,
deben satisfacerse ciertas condiciones conocidas como las Reglas de Hume- Rothery:
El radio atómico de cada uno de los dos elementos no debe diferir en más del 15%,para
minimizar la deformación de la red.
Los elementos no deben formar compuestos entre sí. Es decir, no debe haber
diferencias apreciables en la electronegatividad de cada elemento.
Los elementos deben tener la misma valencia.
La estructura cristalina de cada elemento de la disolución sólida debe ser la misma
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tabla 1. Datos de interés, de metales y no metales, para la
solubilidad de sustitución.
Elem. R E.C. E- Val.
Cobre 0,128 CCC 1,8 +2
Níquel
Níquel 0,125
0,125 CCC
CCC 1,8
1,8 +2
+2
Zinc
Zinc 0,133
0,133 HC
HC 1,7
1,7 +2
+2
Aluminio 0,143 CCC 1,5 +3
Aluminio 0,143 CCC 1,5 +3
Plomo 0,175 CCC 1,6 +2, +4
Plomo 0,175 CCC 1,6 +2, +4
Cúbica
Carbono 0,077 Cúbica 2,5 +4
Carbono 0,077 diamante 2,5 +4
diamante
Cúbica
Silicio 0,117 diamante 1,8 +4
Cúbica
Silicio 0,117 1,8 +4
diamante
Cúbica
Germanio 0,139 2,0 +4
diamante
Cúbica
Germanio 0,139 2,0 +4
diamante
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo:
1. Con base en las condiciones de Hume-Rothery, ¿Cuál de los siguientes sistemas se
esperaría exhibiera una solubilidad sólida ilimitada?. Razona la respuesta.
a) Au-Ag a) Al-Au a) Mo-Ta a) Mg-Zn a) Cu-Ni
b) Al-Cu b) U-W b) Nb-W b) Mg-Cd b) Cu-Pt
Elemento Estructura Radio Elemento Estructura Radio
Cristalina atómico (nm) Cristalina atómico
Oro, Au FCC 0.144 Cobre, Cu FCC 0.128
Plata, Ag FCC 0.144 Uranio, U Ortorrómbica 0.138
Aluminio, Al FCC 0.143 Wolframio, W BCC 0.137
Niobio, Nb BCC 0.143 Molibdeno, Mo BCC 0.136
Tantalio, Ta BCC 0.143 Magnesio, Mg HCP 0.160
Zinc, Zn HCP 0.137 Cadmio, Cd HCP 0.148
Níquel, Ni FCC 0.125 Platino, Pt FCC 0.138
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solución sólida intersticial:
En las soluciones sólidas intersticiales, los átomos de soluto se sitúan en los
intersticios que hay entre los átomos del cristal.
Relación radio Intersticio/radio atómico Ri / R
Intersticio bcc fcc y hcp
Octaédrico 0.155 0.414
Tetraédrico 0.291 0.225
Radios atómicos posibles elementos intersticiales
H B C N O
0.46 0.97 0.77 0.71 0.60
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Radio del mayor intersticio
Fe FCC: 0,053 nm
Radio del mayor intersticio
Fe BCC: 0,036 nm
Radio atómico C: 0,075 nm
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Diagramas de fases
Son representaciones gráficas de las fases que están presente en un sistema de materiales
a varias temperaturas, presiones y composiciones.
De los diagramas de fases se puede obtener la siguiente información:
Mostrar que fases están presentes a diferentes composiciones y temperaturas
Determinar la temperatura a la cual una aleación enfriada bajo condiciones de equilibrio
comienza a solidificar y el rango de temperatura en el que se presenta la solidificación.
Conocer la temperatura a la cual fases diferentes comienzan a fundir.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
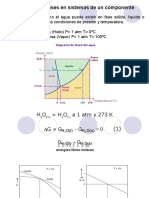
Diagramas de fases de sustancias puras
Una sustancia pura puede existir en las fases sólida, líquida y vapor, dependiendo de las condiciones de
temperatura y presión.
Diagrama de fases en equilibrio Diagrama de fase unario
presión-temperatura para el agua para el magnesio
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Punto triple: presión y temperatura a la que están en equilibrio
(coexisten) tres fases de un material
Diagrama presión-temperatura carbono
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Un diagrama de fases muestra las fases y sus composiciones en
cualquier combinación de temperatura y composición de la aleación.
Se tienen 3 tipos de diagramas:
• Tipo I: Solubilidad total al estado sólido y liquido
• Tipo II: Solubilidad total al estado liquido e insolubilidad al estado
sólido
• Tipo III: Solubilidad total al estado liquido y solubilidad parcial al
estado sólido.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo I
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo II
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo III
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo I: Solubilidad total al
estado sólido y liquido
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) Temperatura liquidus y solidus
b) Fases presentes
c) Composición de cada fase
d) Cantidad de cada fase (regla de
la palanca)
e) Solidificación de aleaciones
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) Temperatura liquidus y solidus
La temperatura liquidus o de
líquido se define como aquella
arriba de la cual un material es
totalmente líquido.
La temperatura solidus o de
sólido, es aquella por debajo de la
cual esa aleación es 100% sólida
La diferencia de temperaturas
entre la de líquido y la de sólido es
el intervalo de solidificación de
la aleación
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
b) Fases presentes
El diagrama de fases puede
considerarse como un mapa
de caminos; si se conocen las
coordenadas, temperatura y
composición de la aleación,
se pueden determinar las
fases que se encuentren
presentes.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
c) Composición de cada fase
Cada fase presente en una aleación tiene una
composición, expresada como el porcentaje de
cada elemento en la fase.
Cuando se encuentra presente sólo una fase en la
aleación, la composición de la fase es igual a la
composición general de la aleación.
Cuando coexisten dos fases, como líquido y
sólido, la composición de ambas difiere de la
composición general original.
Usualmente la composición está expresada en
porcentaje en peso.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo:
Determine la composición de cada fase
en una aleación de Ag - 45% Pd a
1450 ºC, 1300 ºC, 1250 ºC y 1000 ºC
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
d) Cantidad de cada fase
Se utiliza una línea de enlace o
isoterma para determinar la
composición de las dos fases
Una línea de enlace o isoterma es
una línea horizontal en una región
de dos fases, que se traza a la
temperatura de interés.
Los extremos de la isoterma
representan la composición de las
dos fases en equilibrio.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
d) Cantidad de cada fase (regla de la palanca)
Conocer las cantidades relativas de cada fase presentes en la aleación
Considere el diagrama de
fases del cobre-níquel y la
aleación de composición C0 a
1250°C, donde C y CL
representan la concentración
de níquel en el sólido y en el
líquido y W y WL las
fracciones de masa de las
fases presentes.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
La deducción de la regla de la palanca se fundamenta en dos expresiones de conservación de la
masa:
En primer lugar, tratándose de una aleación bifásica, la suma de las fracciones de las fases presentes
debe ser la unidad:
W WL 1
En segundo lugar, las masas de los componentes (Cu y Ni) deben coincidir con la masa total de la
aleación
W C WL CL C0
Las soluciones simultáneas de estas dos ecuaciones conducen a la expresión de la regla de la
palanca para esta situación particular
C C0 C0 C L
WL W
C CL C C L
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
En general, la regla de la palanca se puede enunciar como:
brazo de palanca opuesto
Porcentaje de fase x 100
longitud total de la línea de enlace
Se puede aplicar la regla de la palanca en cualquier región de dos fases de un diagrama de fases binario.
Se utiliza para calcular la fracción relativa o porcentual de una fase en una mezcla de dos fases.
Los extremos de la palanca indican la composición de cada fase (es decir, la concentración química de
los distintos componentes)
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplos:
1. Con el diagrama de equilibrio Cu-Ni que se adjunta,
describir el enfriamiento lento de una aleación de 30%
de Ni y determinar su composición a 1200 ºC.
2. Una aleación compuesta de 2 kg de Cu y 2 kg de Ni
se fundió y posteriormente se enfrió lentamente hasta
1300 ºC. Utilizando el diagrama de equilibrio Cu-Ni,
calcular la concentración y el peso de las fases
presentes a dicha temperatura.
3. En el sistema Cu-Ni, haga el análisis de fase para
una aleación del 50% de Cu a: 1400 ºC, 1300 ºC, 1200
ºC y 1100 ºC.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
e) Solidificación de una aleación
Dependiendo de la velocidad de enfriamiento se
presentan dos tipos de solidificación:
Si la solidificación es extraordinariamente lenta, ésta
ocurre según el diagrama de equilibrio de fases.
En la práctica la velocidad de enfriamiento es mayor a
la ideal y por ello se produce una distribución no
homogénea del soluto en el sólido, esto es conocido como
segregación.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
e) Solidificación de una aleación en el equilibrio
Acero de baja aleación
Cambio de la estructura de una aleación Cu – 40% Ni durante su solidificación
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solidificación fuera de equilibrio y
segregación:
Un proceso de enfriamiento normal se
realiza en unos pocos minutos o a lo más
unas pocas horas, por lo cual las
condiciones de equilibrio no se logran. Al
solidificar el metal se producen gradientes
de concentración que no logran
equilibrarse debido al insuficiente tiempo
del que se dispone, originando pérdidas
de propiedades mecánicas.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Esta segregación puede reducirse mediante un tratamiento de homogenización, que consiste en calentar por
tiempo prolongado la pieza sólida, para que por difusión se homogenice el contenido de soluto.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo
Considere una aleación, cuya composición
promedio contienen 60% de antimonio.
Comenzando a 550 ºC y a intervalos de 50 ºC,
hasta 300 ºC, suponiendo que prevalecen
condiciones de equilibrio, determine: (a) Las
fases presentes (b) La composición de cada
fase (c) La cantidad de cada fase (d) La
microestructura
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo II: Solubilidad total al estado liquido e insolubilidad al estado sólido
Técnicamente no existe ningún par de
metales que sean totalmente insolubles
uno en otro. Sin embargo, en algunos
casos la solubilidad es tan limitada que
prácticamente pueden considerarse
como insolubles.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
El punto de intersección
de las líneas liquidus, se
denomina punto
eutéctico.
La temperatura correspondiente a este punto, se llama temperatura de solidificación del
eutéctico
La composición 40%A-60%B, correspondiente a este punto, se conoce como composición
eutéctica.
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Cuando el líquido de composición eutéctica se enfría lentamente hasta la
temperatura eutéctica, la fase líquida se transforma simultáneamente en
dos fases sólidas. Esta transformación se conoce como reacción
eutéctica y se escribe:
temperatur a eutéctica
Líquido solído A sólido B
enfriamien to
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Diferentes microestructuras de enfriamiento lento de composición eutéctica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Aleación 1: aleación eutéctica
Aleación 3: aleación hipoeutéctica
Aleación 2: aleación hipereutéctica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) Microestructura enfriamiento lento Aleación 1
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
b) Microestructura enfriamiento lento Aleación 2
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
c) Microestructura enfriamiento lento Aleación 3
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Sistema Al-CuAl2 Sistema Fe – C
Eutéctico - Fe3C
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Aleación hipereutéctica Al-Si
(Silicio primario)
Aleación hipereutéctica Fe-C
(cementita primaria)
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo
El Bi y el Cd son totalmente solubles en fase líquida y totalmente insoluble en fase sólida,
formando un eutéctico a con un contenido en Cd del .
Dibujar el diagrama de equilibrio del sistema, indicando los puntos, líneas y zonas
características y sus grados de libertad, suponiendo que las líneas del diagrama son rectas.
a) Indicar el proceso de solidificación y su curva de enfriamiento para una aleación que
contiene el de Cd.
b) En una aleación con un de Bi, trazar la curva de enfriamiento y determiner el
porcentaje de fases a y a temperature ambiente.
c) Calcular los porcentajes de fases presentes en la aleación de composición eutéctica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo
Para las aleaciones As-15% Au,
aleación de composición eutéctica y
As-85% Au, Comenzando a 1100 ºC y
a intervalos de 50 ºC, hasta 500 ºC,
suponiendo que prevalecen
condiciones de equilibrio, determinar
(a) las fases presentes (b) la
composición de cada fase (c) la
cantidad de cada fase (d) la
microestructura
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Tipo III : Totalmente soluble al estado líquido y parcialmente solubles
al estado sólido
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Solvus: líneas llamadas curvas de solubilidad, indican la solubilidad
máxima (solución saturada) de B en A (solución ) o de A en B
(solución ) en función de la temperatura.
El punto E, como en el tipo II, es el punto eutéctico
Reacción eutéctica:
temperatur a eutéctica
Líquido solución sólida solución sólida
enfriamien to
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
a) Aleaciones de
solución sólida
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
b) Aleaciones que
rebasan el límite de
solubilidad
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
c) Aleaciones hipoeutécticas
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
d) Aleación eutéctica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplos:
El sistema de aleaciones Sb – Pb , forma una eutéctica con un de Sb y a una temperatura de
solidificación de . Suponiendo que las líneas del diagrama son rectas y que estos metales son
insolubles en fase sólida, trazar el diagrama de fases. Determinar para estas tres aleaciones:
de Pb, de Pb y de Pb:
a) Curva de enfriamiento y transformaciones desde líquido hasta temperatura ambiente.
b) Porcentajes de fases a temperatura ambiente para todas.
c) Si en este sistema de enfriamiento no pasa por estados de equilibrio, ¿qué defecto se
produce?
2)
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplos:
Una
aleación compuesta por 1 kg de Pb y 1 kg de Sb se fundió y se enfrió lentamente hasta .
Aplicar el diagrama de equilibrio del problema anterior para determinar:
a) Las fases que contienen la aleación
b) Las concentraciones de cada fase
c) Las cantidades en peso de cada fase
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo
En una aleación Pb-15% Sn que se solidifica lentamente, determine:
a) La composición del primer sólido que se forma
b) La temperatura de liquidus, la del solidus, la de solvus y el
intervalo de solidificación
c) Las cantidades y composiciones de cada fase a 260 ºC
d) Las cantidades y composiciones de cada fase a 183 ºC
e) Las cantidades y composiciones de cada fase a 184 ºC
f) Las cantidades y composiciones de cada fase a 182 ºC
g) Las cantidades y composición de cada fase a 25 ºC
h) Repetir de a hasta g para una aleación Pb-70% Sn
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo
En una aleación Cu-10% Ag que se solidifica lentamente, determine:
a) La composición del primer sólido que se forma
b) La temperatura de liquidus, la del solidus, la de solvus y el
intervalo de solidificación
c) Las cantidades y composiciones de cada fase a 1000 ºC
d) Las cantidades y composiciones de cada fase a 850 ºC
e) Las cantidades y composiciones de cada fase a 781 ºC
f) Las cantidades y composiciones de cada fase a 779 ºC
g) Las cantidades y composición de cada fase a 600 ºC
h) Repetir de a hasta g para :aleación Cu-30% Ag y Cu-80% Ag
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ejemplo:
Considere 1 kg de una aleación de moldeo de aluminio con un 10% en
peso de Si.
a) ¿Cuál es la primera fase sólida y cual es su composición?
b) ¿A qué temperatura solidificará completamente la aleación?
c)¿Qué cantidad de fase proeutéctica se encontrará en la
microestructura?
d) ¿Cómo se distribuye el silicio en la microestructura a 576 ºC?
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Ms. Víctor H. Peláez Chávez
Ingeniería Mecánica
Regla de Fase de Gibbs
Esta regla representa un criterio para el número de fases que coexistirán dentro de un
sistema en equilibrio, y se expresa por la ecuación simple
P = número de fases presentes.
P+F=C+N
F = número de grados de libertad.
C = número de componentes del sistema
N = número de variables no composicionales
Ms. Víctor H. Peláez Chávez
También podría gustarte
- ProblemasfasesDocumento10 páginasProblemasfasesapi-26360100Aún no hay calificaciones
- Practica No3Documento12 páginasPractica No3Nayely A. CalderónAún no hay calificaciones
- Fabricacion de Polvos MetalurgicosDocumento72 páginasFabricacion de Polvos MetalurgicosJjmc JjmcAún no hay calificaciones
- Qué Es Una Arena para FundiciónDocumento2 páginasQué Es Una Arena para FundiciónLau Mora EsquivelAún no hay calificaciones
- Contaminacion Acustica en El Sector Industrial de Tacna - 1Documento20 páginasContaminacion Acustica en El Sector Industrial de Tacna - 1Litman Ramos OrtegaAún no hay calificaciones
- PC-3A Calculo IIIDocumento3 páginasPC-3A Calculo IIIJavier Rojas TrujilloAún no hay calificaciones
- Problemas Propuestos CM - Grupo 6 - 4II131Documento9 páginasProblemas Propuestos CM - Grupo 6 - 4II131Rolex50% (2)
- Coeficiente de Resistencia para Accesorios PDFDocumento11 páginasCoeficiente de Resistencia para Accesorios PDFRodrigo Paucar AedoAún no hay calificaciones
- Mecnica de Materiales-APENDICEDocumento17 páginasMecnica de Materiales-APENDICEIngeniería Mecánica ItespAún no hay calificaciones
- UNIDAD 13 - MC 118-2019-2 Mat. Comp - CLASEDocumento66 páginasUNIDAD 13 - MC 118-2019-2 Mat. Comp - CLASElides fernandez saldivarAún no hay calificaciones
- Ejercicios de RecristalizacionDocumento5 páginasEjercicios de RecristalizacionFrancisco Xavier Valenzuela GuerraAún no hay calificaciones
- Endurecimiento por deformación y recocidoDocumento9 páginasEndurecimiento por deformación y recocidoRaybert MartinezAún no hay calificaciones
- Caracterización de CerámicosDocumento4 páginasCaracterización de CerámicosFranco PetrosinoAún no hay calificaciones
- Quimica General - Uso Del Mechero y BalanzaDocumento6 páginasQuimica General - Uso Del Mechero y BalanzaGerard MattAún no hay calificaciones
- I Examen - 2020BDocumento2 páginasI Examen - 2020BJosep Brayan Loza100% (1)
- PulvimetalurgiaDocumento40 páginasPulvimetalurgiajuan pablo0% (1)
- Ciencia de los Materiales - Taller 7Documento4 páginasCiencia de los Materiales - Taller 7lina sofiaAún no hay calificaciones
- Tablas de Flujo Compresible (Version 1)Documento67 páginasTablas de Flujo Compresible (Version 1)Arturo Tipacti QuijanoAún no hay calificaciones
- Resistencia de Materiales-Remaches y SoladurasDocumento23 páginasResistencia de Materiales-Remaches y SoladurasGerardo Herbas0% (1)
- FormatO para ManualesDocumento14 páginasFormatO para ManualesHans AbantoAún no hay calificaciones
- Balbín Molina, José Antonio TesisDocumento202 páginasBalbín Molina, José Antonio TesisAlex PorteroAún no hay calificaciones
- Flujo Turbulento en TuberiasDocumento3 páginasFlujo Turbulento en TuberiasRicardo CampuzanoAún no hay calificaciones
- Influencia Del Ambiente en La Velocidad de CorrosiónDocumento5 páginasInfluencia Del Ambiente en La Velocidad de CorrosiónJairo AlvarezAún no hay calificaciones
- Análisis Granulométrico - Funciones de DistribuciónDocumento48 páginasAnálisis Granulométrico - Funciones de DistribuciónoscarmaumarAún no hay calificaciones
- Fractografia de La ConstruccionDocumento72 páginasFractografia de La ConstruccionAnonimus Anonimus anonimusAún no hay calificaciones
- Propiedades mecánicas de materiales medibles en ensayos de tracción y flexiónDocumento3 páginasPropiedades mecánicas de materiales medibles en ensayos de tracción y flexiónStiward SotoAún no hay calificaciones
- El Arte de Soldar RevisarDocumento4 páginasEl Arte de Soldar RevisarVeronica Ku100% (1)
- Endurecimiento y soluciones sólidas en materialesDocumento2 páginasEndurecimiento y soluciones sólidas en materialesPaola RadaAún no hay calificaciones
- Materiales Compuestos Reforzados Con FibrasDocumento7 páginasMateriales Compuestos Reforzados Con FibrasAngel KlineAún no hay calificaciones
- Instalación de Pilas GalvánicasDocumento2 páginasInstalación de Pilas GalvánicasManuel HTAún no hay calificaciones
- Ensayo de Embutido-Mc 214Documento6 páginasEnsayo de Embutido-Mc 214H Rivera Oki AntonioAún no hay calificaciones
- PASIVACIÓNDocumento5 páginasPASIVACIÓNJairo AlvarezAún no hay calificaciones
- Calculo Del Sistema de AlimentaciónDocumento16 páginasCalculo Del Sistema de AlimentaciónAnthony Quiroz LeonAún no hay calificaciones
- Analasis de Los Ladrillos PanderetaDocumento4 páginasAnalasis de Los Ladrillos PanderetaSamir Fernandez RamosAún no hay calificaciones
- 04 RelacionesComportamientoDocumento3 páginas04 RelacionesComportamientoarnolAún no hay calificaciones
- Ecuación diferencial del esfuerzo plano en coordenadas polaresDocumento7 páginasEcuación diferencial del esfuerzo plano en coordenadas polaresJuanAún no hay calificaciones
- Arbol de FallasDocumento2 páginasArbol de FallasMaycol James Perez TisnadoAún no hay calificaciones
- Informe 1 de Metalurgia Fisica PDFDocumento10 páginasInforme 1 de Metalurgia Fisica PDFjheysonAún no hay calificaciones
- Exposicion Propiedades MecanicasDocumento15 páginasExposicion Propiedades MecanicasBubuu LoveAún no hay calificaciones
- Número de Coordinación y GeometríasDocumento5 páginasNúmero de Coordinación y GeometríasMartín AlvarezAún no hay calificaciones
- Elaboración de muestras de concretoDocumento10 páginasElaboración de muestras de concretoKiko Perez EscobarAún no hay calificaciones
- Diagrama de Fases Tipo IDocumento63 páginasDiagrama de Fases Tipo IMichael alanyaAún no hay calificaciones
- Iram 1612Documento16 páginasIram 1612Andrés Zardo GarcíaAún no hay calificaciones
- Guía Metalografía. - Práctica 1-5Documento19 páginasGuía Metalografía. - Práctica 1-5pedro00736Aún no hay calificaciones
- Lab 2Documento5 páginasLab 2Abigail MontoyaAún no hay calificaciones
- Lab 1 H ImprimirDocumento14 páginasLab 1 H Imprimircamila uribeAún no hay calificaciones
- CuestionarioDocumento6 páginasCuestionarioWilmer Lemache0% (1)
- Ensayo de Desgaste A La Abrasión de AgregadosDocumento9 páginasEnsayo de Desgaste A La Abrasión de AgregadosLucia VasqueAún no hay calificaciones
- Guia 1 Ciencia y Resistencia de MaterialesDocumento4 páginasGuia 1 Ciencia y Resistencia de Materialeshistorias del aleAún no hay calificaciones
- Laboratorio de Ensayos de ArenaDocumento14 páginasLaboratorio de Ensayos de ArenaMarco ManAún no hay calificaciones
- Guia 3 Diagramas de Fase FeFe3CDocumento10 páginasGuia 3 Diagramas de Fase FeFe3CGregory GoncalvezAún no hay calificaciones
- Que Es El Ensayo de TensiónDocumento11 páginasQue Es El Ensayo de TensiónAlejandro José LópezAún no hay calificaciones
- Ceramics InternationalDocumento8 páginasCeramics InternationalMaria Paula Villanueva JaraAún no hay calificaciones
- Cuestionario Acero - EditableDocumento17 páginasCuestionario Acero - EditableHarold VieraAún no hay calificaciones
- Sesión 14 IM1Documento73 páginasSesión 14 IM1Jemito :vAún no hay calificaciones
- Cristalografía de Materiales MecánicosDocumento25 páginasCristalografía de Materiales MecánicosCARLOS DANIEL HUACANJULCA AYAYAún no hay calificaciones
- Diagramas de FaseDocumento32 páginasDiagramas de FaseOrlandoChirinosAún no hay calificaciones
- CLASE 9, Aleaciones y Diagrama de Fases (Fe-C)Documento38 páginasCLASE 9, Aleaciones y Diagrama de Fases (Fe-C)ARNOLD DIONICIO ROSALES VENEGASAún no hay calificaciones
- Clase Diagramas de FaseDocumento17 páginasClase Diagramas de FaseVera Alejandra AlvarezAún no hay calificaciones
- Tarea N°9Documento7 páginasTarea N°9Nícolas LeyvaAún no hay calificaciones
- Campo Magnético AdicionalDocumento2 páginasCampo Magnético AdicionalNícolas LeyvaAún no hay calificaciones
- Campo MagnéticoDocumento1 páginaCampo MagnéticoNícolas LeyvaAún no hay calificaciones
- Integrales ContabilidadDocumento25 páginasIntegrales ContabilidadNícolas LeyvaAún no hay calificaciones
- Campo Magnético AdicionalDocumento2 páginasCampo Magnético AdicionalNícolas LeyvaAún no hay calificaciones
- FORO N°9docx PDFDocumento15 páginasFORO N°9docx PDFNícolas LeyvaAún no hay calificaciones
- Tarea N°9 PDFDocumento7 páginasTarea N°9 PDFNícolas LeyvaAún no hay calificaciones
- Práctica DeltaDocumento1 páginaPráctica DeltaNícolas LeyvaAún no hay calificaciones
- Curso: Tema: Docente:: Física Movimiento Circular Uniforme (M.C.U) Leyva Bartolo, Miguel NícolasDocumento25 páginasCurso: Tema: Docente:: Física Movimiento Circular Uniforme (M.C.U) Leyva Bartolo, Miguel NícolasNícolas LeyvaAún no hay calificaciones
- Tarea N°11Documento12 páginasTarea N°11Nícolas LeyvaAún no hay calificaciones
- FORO N°9docxDocumento15 páginasFORO N°9docxNícolas LeyvaAún no hay calificaciones
- Tarea N°4 PDFDocumento13 páginasTarea N°4 PDFNícolas LeyvaAún no hay calificaciones
- Tarea N°4Documento13 páginasTarea N°4Nícolas LeyvaAún no hay calificaciones
- Foro N°4Documento15 páginasForo N°4Nícolas LeyvaAún no hay calificaciones
- Tarea 2Documento7 páginasTarea 2Nícolas LeyvaAún no hay calificaciones
- Foro N°4Documento15 páginasForo N°4Nícolas LeyvaAún no hay calificaciones
- Tarea N°11 PDFDocumento12 páginasTarea N°11 PDFNícolas LeyvaAún no hay calificaciones
- 01 Soluciones y Diagrama de Fase PDFDocumento24 páginas01 Soluciones y Diagrama de Fase PDFNícolas LeyvaAún no hay calificaciones
- FORO N°11docx PDFDocumento5 páginasFORO N°11docx PDFNícolas LeyvaAún no hay calificaciones
- Tarea N°6Documento10 páginasTarea N°6Nícolas LeyvaAún no hay calificaciones
- FORO N°6docxDocumento16 páginasFORO N°6docxNícolas LeyvaAún no hay calificaciones
- FORO N°11docxDocumento5 páginasFORO N°11docxNícolas LeyvaAún no hay calificaciones
- Sesión 01 TFDocumento79 páginasSesión 01 TFNícolas LeyvaAún no hay calificaciones
- Tarea N°6Documento10 páginasTarea N°6Nícolas LeyvaAún no hay calificaciones
- Examen 1Documento35 páginasExamen 1Nícolas LeyvaAún no hay calificaciones
- FORO N°6docxDocumento16 páginasFORO N°6docxNícolas LeyvaAún no hay calificaciones
- Trabajo 2Documento17 páginasTrabajo 2Nícolas LeyvaAún no hay calificaciones
- Termodinámica I: Variables intensivas y extensivasDocumento29 páginasTermodinámica I: Variables intensivas y extensivasNícolas LeyvaAún no hay calificaciones
- Grupo 04 Tarea02Documento17 páginasGrupo 04 Tarea02Nícolas LeyvaAún no hay calificaciones
- Fundamentos de Manufactura Moderna 3edi Groover-106-143Documento38 páginasFundamentos de Manufactura Moderna 3edi Groover-106-143Julio Flores0% (1)
- Soluciones Sólidas Y Equilibrio de Fases Semana 8 - L1Documento4 páginasSoluciones Sólidas Y Equilibrio de Fases Semana 8 - L1isabelAún no hay calificaciones
- Ejercicios de Materiales TerminadoDocumento8 páginasEjercicios de Materiales Terminadovibehuan60% (5)
- Diagramas de Fases BinlollllariosDocumento76 páginasDiagramas de Fases BinlollllariosEsteban Muñoz SalazarAún no hay calificaciones
- Reglas de fases y diagramas de estado sólido-líquidoDocumento12 páginasReglas de fases y diagramas de estado sólido-líquidoCarlos Rodriguez CerdaAún no hay calificaciones
- MetalografiaDocumento44 páginasMetalografiaJavierPañahuaAún no hay calificaciones
- Diagramas de FasesDocumento30 páginasDiagramas de FasesmonserrathAún no hay calificaciones
- Curvas de Enfriamiento Labortorio Teoria Waldo BalarezoDocumento11 páginasCurvas de Enfriamiento Labortorio Teoria Waldo BalarezoBillyBonillaPauloAún no hay calificaciones
- Diagramas fases tipo II resueltosDocumento6 páginasDiagramas fases tipo II resueltosSamantha TabaniAún no hay calificaciones
- Tarea 4 Resistencia de Los Materiales IACCDocumento7 páginasTarea 4 Resistencia de Los Materiales IACCJosé moreira lopez88% (8)
- Fundamentos de La MetalurgiaDocumento92 páginasFundamentos de La MetalurgiaJhonatan Vb100% (1)
- Diagramas T-X: cristalización y fusiónDocumento25 páginasDiagramas T-X: cristalización y fusiónDanilo Noel Gonzalez SeguelskiAún no hay calificaciones
- Metalurgia para No Metalurgicos (Hierros)Documento75 páginasMetalurgia para No Metalurgicos (Hierros)Zachary Smith83% (6)
- PERITECTICODocumento10 páginasPERITECTICOYu Evelyn IbañezAún no hay calificaciones
- Diagramas ternarios y multicomponentesDocumento17 páginasDiagramas ternarios y multicomponentesLisbeth Rubin NeriAún no hay calificaciones
- Diagrama TernarioDocumento20 páginasDiagrama TernarioH Marquez R Graciela100% (1)
- Fusionado ManufacturaDocumento237 páginasFusionado ManufacturaEduardo ChavezAún no hay calificaciones
- Diagrama de FasesDocumento67 páginasDiagrama de FasessandyozAún no hay calificaciones
- Fundamentos de Sistemas Mecánicos Evidencia 3Documento6 páginasFundamentos de Sistemas Mecánicos Evidencia 3rubio946Aún no hay calificaciones
- Trabajo-Semana-10-Ciencias MaterialesDocumento22 páginasTrabajo-Semana-10-Ciencias MaterialesJosé Alberto MuñozAún no hay calificaciones
- Diagramas de FaseDocumento94 páginasDiagramas de FaseJUAN CARLOS REVELES LIRAAún no hay calificaciones
- Introducción Al Análisis Térmico de MetalesDocumento4 páginasIntroducción Al Análisis Térmico de MetalesfusionfetAún no hay calificaciones
- Ejercicios Diagramas de Fases IsomorfosDocumento3 páginasEjercicios Diagramas de Fases Isomorfosyoneiker molinaAún no hay calificaciones
- Diagramasdefases EjerciciosyproblemasDocumento43 páginasDiagramasdefases EjerciciosyproblemasMIKAELSMAún no hay calificaciones
- Cuestionario Unido Hasta El Cap 11xdDocumento16 páginasCuestionario Unido Hasta El Cap 11xdWaldir de la CruzAún no hay calificaciones
- Ingenieria de Materiales - Diagrama de FasesDocumento48 páginasIngenieria de Materiales - Diagrama de FasesKatt Ramos0% (2)
- Diagramas de fases: estabilidad mineral y condiciones de formación rocasDocumento6 páginasDiagramas de fases: estabilidad mineral y condiciones de formación rocasRosa VillabAún no hay calificaciones
- Sistemas cristalinos y formas mineralesDocumento47 páginasSistemas cristalinos y formas mineralesGary Edson Andamayo YayaAún no hay calificaciones
- Problemass PDFDocumento18 páginasProblemass PDFteneraxAún no hay calificaciones
- Maron PruttonDocumento40 páginasMaron PruttonJorge Martín Cabrera RochaAún no hay calificaciones