Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Infografía Línea Del Tiempo Timeline Historia Moderno Creativo Multicolor
Cargado por
RosannksDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Infografía Línea Del Tiempo Timeline Historia Moderno Creativo Multicolor
Cargado por
RosannksCopyright:
Formatos disponibles
UNIVERSIDA NACIONAL AUTONOMA DE NICARAGUA
RECINTO UNIVERSITARIO “RUBEN DARIO”
FACULTAD DE CIENCIAS BASICAS Y TECNOLOGICAS
DEPARTAMENTO DE QUIMICA
Elaborado por: Rosannis Ester Morales Díaz.
BOA: Línea de tiempo modelos atómicos.
AÑO: 1°.
COMPONENTE: Química General I
CARRERA: Química Farmacéutica.
DOCENTE: Lic. Indira Mejía.
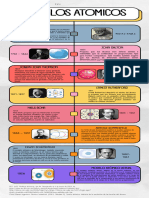
DESCUBRIMIENTO DE LAS
PARTÍCULAS FUNDAMENTALES
Y MODELOS ATÓMICOS
Modelo Atómico
450 (a.c)
Su teoría esquematizaba que los átomos eran homogéneos,
eternos, indivisibles, invisibles e incomprensibles, y que se
caracterizaban por sus formas y tamaños..
los átomos se unían por sus diferentes formas, pero que se
podían distinguir entre ellos, y que se dividían por un periodo de
tiempo determinado.
Demócrito
1808
los elementos están formados por partículas muy pequeñas a las que
se pueden llamar átomos.
Los compuestos están formados por átomos de mas de un elemento
químico.
John Dalton
1897
Sugirió el primer modelo del átomo, considerándolo como
una esfera compactada, homogénea e indivisible con
carga positiva en la que estaban incrustados los
electrones como si fueran pasas en un pudin.
Joseph
Thomson
1903
Modelo saturnino, con núcleo atómico de carga positiva y
electrones dispuestos como los anillos de Saturno.
Según su modelo, los electrones giraban en órbitas circulares
cerradas, lo que mantenía el átomo estable y evitaba que los
electrones cayeran en el núcleo, como se pensaba en ese momento
según el modelo de Rutherford.
Hantaro
Nagaoka
1909
sugirió que los átomos estaban prácticamente huecos y que
no eran una masa homogénea positiva. Tambien concluyo
que si el átomo tenia electrones para neutralizar la carga
negativa debían existir particulars de carga positiva en la
misma cantidad y este debía estar muy concentrada, a lo que
Ernest llamo núcleo atómico.
Rutherford
1913
Propuso su modelo de estructura atómica, concluyo que:
Los electrones describen orbitas circulares alrededor del núcleo
atómico sin irradiar energía.
Los electrones solo pueden girar alrededor del núcleo en los
niveles para las cuales el momento angular del electron es un
múltiplo entero. Niels Bohr
DESCUBRIMIENTO DE LAS
PARTÍCULAS FUNDAMENTALES
Y MODELOS ATÓMICOS
1916
Los electrones orbitan alrededor del núcleo en diferentes niveles
energéticos, describiendo trayectorias circulares o elípticas.
incorporó el concepto de momento angular cuántico y el número
cuántico azimutal, que ayudaron a explicar las líneas espectrales
finas observadas en el espectro de átomos con más de un electrón.
Arnold
Sommerfeld
1932
Teoria de Mecánica cuántica:
Los electrones son partículas materiales cuyo comportamiento
energético es similar a la de los cuantos de energía de radiación
electromagnética.
Los electrones se encuentran alrededor del núcleo atómico en
espacios definidos llamados orbitales.
Erwin
Schrödinger
1964
.
postuló que los protones, neutrones y otras partículas subatómicas
estaban compuestas por partículas aún más pequeñas llamadas
quarks. Propuso que los quarks venían en diferentes "sabores"
(up, down, strange, charm, top y bottom) y que las combinaciones de
estos quarks daban lugar a la gran variedad de partículas observadas
Murray en experimentos de colisionadores de partículas.
Gell-Mann
También podría gustarte
- Autoevaluación 1 - MECANICA DE FLUIDOS (11721)Documento7 páginasAutoevaluación 1 - MECANICA DE FLUIDOS (11721)Elias QcheAún no hay calificaciones
- Anexo No 2 Modelos AtómicosDocumento4 páginasAnexo No 2 Modelos AtómicosLuz Nelly Maya OrtizAún no hay calificaciones
- Gravimetría y Volumetría. 10Documento27 páginasGravimetría y Volumetría. 10ThuLokithaMerma100% (1)
- Lab Química, Práctica #9. - "Equilibrio Químico"Documento5 páginasLab Química, Práctica #9. - "Equilibrio Químico"Carlos GutiérrezAún no hay calificaciones
- El AtomoDocumento35 páginasEl AtomoAlejandro Torrano LopezAún no hay calificaciones
- Ejercicios Fisica Aplicada Al BuceoDocumento8 páginasEjercicios Fisica Aplicada Al BuceoEvangelina Morales100% (1)
- Teoria AtomicaDocumento6 páginasTeoria AtomicaAnthonyAún no hay calificaciones
- Infografía Línea Del Tiempo Modelos AtómicosDocumento2 páginasInfografía Línea Del Tiempo Modelos AtómicosRosannksAún no hay calificaciones
- Modelos Del AtomoDocumento2 páginasModelos Del Atomocamiv14ygAún no hay calificaciones
- InfografíaDocumento1 páginaInfografíaLorena CastroAún no hay calificaciones
- Taipe Chachayma Edith Sesión 5Documento14 páginasTaipe Chachayma Edith Sesión 5Edith Rosmery Taipe ChachaymaAún no hay calificaciones
- Linea de Tiempo Aportaciones en El Modelo AtomicoDocumento5 páginasLinea de Tiempo Aportaciones en El Modelo AtomicoJuan PabloAún no hay calificaciones
- Linea de Tiempo Modelos AtomicosDocumento1 páginaLinea de Tiempo Modelos AtomicosMARCO ANTONIO RAMIREZ REYESAún no hay calificaciones
- Tarea Evidencias de Estructura AtómicaDocumento5 páginasTarea Evidencias de Estructura Atómicaalanntorres09ctrlAún no hay calificaciones
- CONFORMACION DE LA MATERIA - PPT (Autoguardado)Documento35 páginasCONFORMACION DE LA MATERIA - PPT (Autoguardado)ABISAI BENITEZ CRUZAún no hay calificaciones
- Resumen Modelos AtómicosDocumento6 páginasResumen Modelos Atómicosyour.worst.nightmare79417873Aún no hay calificaciones
- Ciencia Del Futuro Basada en Los Modelos AtómicosDocumento2 páginasCiencia Del Futuro Basada en Los Modelos AtómicosCarolina AvilaAún no hay calificaciones
- ModelosDocumento3 páginasModelosricky hernandezAún no hay calificaciones
- Modelo AtomicoDocumento2 páginasModelo AtomicoJustiber Ibarra100% (1)
- Actividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelDocumento3 páginasActividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelGustavo RubioAún no hay calificaciones
- Los Modelos Atomicos y Su HistoriaDocumento5 páginasLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaAún no hay calificaciones
- Teorias Atomicas en Orden Cronologico PDFDocumento1 páginaTeorias Atomicas en Orden Cronologico PDFManuel José Rodríguez MillánAún no hay calificaciones
- Linea Del Tiempo Modelos AtómicosDocumento1 páginaLinea Del Tiempo Modelos AtómicosBEIDA ISABEL PEREZ MIRANDAAún no hay calificaciones
- Guía N°3 - Módelo y Estructura AtómicaDocumento6 páginasGuía N°3 - Módelo y Estructura AtómicaAngrySquirl 24Aún no hay calificaciones
- Guia N°0 REPASO MODELOS ATOMICOSDocumento8 páginasGuia N°0 REPASO MODELOS ATOMICOSpiratacoquiAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosErnesto RamosAún no hay calificaciones
- Teoría AtómicaDocumento26 páginasTeoría Atómicaalcatraso perezAún no hay calificaciones
- Atomos y Enlaces QuimicoDocumento5 páginasAtomos y Enlaces Quimicogevipo7855Aún no hay calificaciones
- Quimica de 8 y 9 Modelos AtomicosDocumento9 páginasQuimica de 8 y 9 Modelos AtomicosAlejandra HenaoAún no hay calificaciones
- Modelos AtomicosDocumento20 páginasModelos AtomicosElkin Javier RodriguezAún no hay calificaciones
- Guia QuímicaDocumento20 páginasGuia Químicaswtdny89bhAún no hay calificaciones
- Estructura Atomica II - QuimicaDocumento4 páginasEstructura Atomica II - QuimicaBrinny VelazcoAún no hay calificaciones
- Guía N°3 - Módelo y Estructura AtómicaDocumento6 páginasGuía N°3 - Módelo y Estructura AtómicaAngrySquirl 24Aún no hay calificaciones
- Informe de Modelos AtómicosDocumento7 páginasInforme de Modelos AtómicosDagna C3rdanoAún no hay calificaciones
- Modelo de Esfera SolidaDocumento4 páginasModelo de Esfera Solidaamezcuasantiago2006Aún no hay calificaciones
- Química PREDocumento4 páginasQuímica PREVictor Huerta RojasAún no hay calificaciones
- El ÁtomoDocumento15 páginasEl ÁtomoCONSTANZA OSSAAún no hay calificaciones
- Linea Del Tiempo AtomoDocumento8 páginasLinea Del Tiempo AtomoLESLY MICHEL MORALES GARCIAAún no hay calificaciones
- Actividad 1. Investigación de Modelos AtómicosDocumento3 páginasActividad 1. Investigación de Modelos Atómicos2Jose Alberto Meza VelázquezAún no hay calificaciones
- Historia de Los Modelos AtómicosDocumento1 páginaHistoria de Los Modelos Atómicosedudediana18Aún no hay calificaciones
- Resumen Atomo y Configuracion ElecronicaDocumento14 páginasResumen Atomo y Configuracion Elecronicapemp1996Aún no hay calificaciones
- Unidad 2 Estructura Atómica PDFDocumento16 páginasUnidad 2 Estructura Atómica PDFmynoa rinetteAún no hay calificaciones
- Jennifer Uni TareaDocumento14 páginasJennifer Uni TareaJennifer CabezaAún no hay calificaciones
- Linea Del Tiempo PDFDocumento1 páginaLinea Del Tiempo PDFFranklin Enmanuel Cordero BobadillaAún no hay calificaciones
- Modulo 4 QT 2021Documento7 páginasModulo 4 QT 2021Carina BogadoAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosSantiago San MiguelAún no hay calificaciones
- INFOGRAFÍADocumento1 páginaINFOGRAFÍAcarreradiego175Aún no hay calificaciones
- Infografia Linea Del Tiempo Timeline Historia Moderno Minimalista AzulDocumento1 páginaInfografia Linea Del Tiempo Timeline Historia Moderno Minimalista Azullevimunozhdz27Aún no hay calificaciones
- 2.1 Estructura Atómica Modelos EvoluciónDocumento41 páginas2.1 Estructura Atómica Modelos EvoluciónAle PerezAún no hay calificaciones
- 1 Modelos Atomicos 8 Basico PDFDocumento17 páginas1 Modelos Atomicos 8 Basico PDFFelix Bastias VargasAún no hay calificaciones
- Historia de Los Modelos Atómicosy Modelo Mecanico CuanticoDocumento20 páginasHistoria de Los Modelos Atómicosy Modelo Mecanico CuanticoDELMY ISABEL ÁLVAREZ VILLAFRANCOAún no hay calificaciones
- Segundo Parcial Ondas y ParticulasDocumento21 páginasSegundo Parcial Ondas y ParticulasJuan Jose Villamizar LAún no hay calificaciones
- Quimica - 4 ToDocumento5 páginasQuimica - 4 ToVictor Huerta RojasAún no hay calificaciones
- Actividad Nº8 Ficha de Estudio Sobre Átomo y EjerciciosDocumento6 páginasActividad Nº8 Ficha de Estudio Sobre Átomo y EjerciciosNasheAún no hay calificaciones
- Mi Clase - Teoría y Modelos AtómicosDocumento22 páginasMi Clase - Teoría y Modelos AtómicosDavid SysAún no hay calificaciones
- Fusión NuclearDocumento30 páginasFusión NuclearTrapGameAún no hay calificaciones
- Modelos AtómicosDocumento5 páginasModelos AtómicosTrapGameAún no hay calificaciones
- Guia QuimicaDocumento26 páginasGuia QuimicaANA KAREN HERNANDEZ BERUMENAún no hay calificaciones
- Modelos AtomicosDocumento12 páginasModelos AtomicosXtian LopezAún no hay calificaciones
- Historia Modelo AtomicoDocumento3 páginasHistoria Modelo Atomicopocholo9415Aún no hay calificaciones
- Quimica Farmacéutica Como CarreraDocumento1 páginaQuimica Farmacéutica Como CarreraRosannksAún no hay calificaciones
- Trabajo Integrador Fase 1 y Fase 2Documento3 páginasTrabajo Integrador Fase 1 y Fase 2RosannksAún no hay calificaciones
- DocumentoDocumento1 páginaDocumentoRosannksAún no hay calificaciones
- Resultados de La en CuestaDocumento3 páginasResultados de La en CuestaRosannksAún no hay calificaciones
- Trabajo Integrador Fase 1 y Fase 2Documento3 páginasTrabajo Integrador Fase 1 y Fase 2RosannksAún no hay calificaciones
- DocumentoDocumento1 páginaDocumentoRosannksAún no hay calificaciones
- Bases Orientadoras de La Accion 04 FinalDocumento5 páginasBases Orientadoras de La Accion 04 FinalRosannksAún no hay calificaciones
- Documento Completo - pdf-PDFADocumento45 páginasDocumento Completo - pdf-PDFALorena VanegasAún no hay calificaciones
- Entrevistamedica 1Documento16 páginasEntrevistamedica 1RosannksAún no hay calificaciones
- Science Subject For Elementary - 1st Grade - Inquiry - by SlidesgoDocumento5 páginasScience Subject For Elementary - 1st Grade - Inquiry - by SlidesgoRosannksAún no hay calificaciones
- Lectura #3 - Teoría de Los 5 ElementosDocumento10 páginasLectura #3 - Teoría de Los 5 ElementosRosannksAún no hay calificaciones
- Science Subject For Elementary - 1st Grade - Inquiry - by SlidesgoDocumento5 páginasScience Subject For Elementary - 1st Grade - Inquiry - by SlidesgoRosannksAún no hay calificaciones
- Sesión 14 - Moreno Romo - Viernes 10-12Documento6 páginasSesión 14 - Moreno Romo - Viernes 10-12Joaly MorenoAún no hay calificaciones
- Acido Clorhidrico - AvantorDocumento9 páginasAcido Clorhidrico - AvantorMagaly RojasAún no hay calificaciones
- Triptico de QuimicaDocumento2 páginasTriptico de QuimicaPedro BelloAún no hay calificaciones
- Practica 3Documento12 páginasPractica 3Tatiana Pila FonsecaAún no hay calificaciones
- F9 - Óptica - Espejos - LentesDocumento6 páginasF9 - Óptica - Espejos - LentesPatricio AcostaAún no hay calificaciones
- 2 Compuestos Organicos El Atomo de CarbonoDocumento38 páginas2 Compuestos Organicos El Atomo de CarbonoBeatriz BeaAún no hay calificaciones
- Repaso Fin Bioq2Documento2 páginasRepaso Fin Bioq2BastianAún no hay calificaciones
- Efecto de La TemperaturaDocumento12 páginasEfecto de La TemperaturaMiguel AngelAún no hay calificaciones
- Síntesis y Propiedades de PolímerosDocumento3 páginasSíntesis y Propiedades de PolímerosJOSE ANTONIO HERNANDEZ VERAAún no hay calificaciones
- Cuadro SinópticoDocumento1 páginaCuadro SinópticoOliAún no hay calificaciones
- Guia de HidrolisisDocumento12 páginasGuia de HidrolisisCristhian CrespoAún no hay calificaciones
- Serie Actividad Metales, Celda Electroquimica EntalpiaDocumento5 páginasSerie Actividad Metales, Celda Electroquimica EntalpiaAlexis71% (7)
- Taller Enlace QuímicoDocumento3 páginasTaller Enlace QuímicoConsultores Inversiones industriales y de serviciosAún no hay calificaciones
- Hierro Solucion Patrón de 1,00 MG-LDocumento17 páginasHierro Solucion Patrón de 1,00 MG-LAlvaro RenjifoAún no hay calificaciones
- III BIM - QUIM - 5TO. AÑO - GUIA #2 - Peso EquivalenteDocumento7 páginasIII BIM - QUIM - 5TO. AÑO - GUIA #2 - Peso EquivalenteCarlos LopezAún no hay calificaciones
- Determinacion Espectrofotometrica de MnO4Documento4 páginasDeterminacion Espectrofotometrica de MnO4Piña Ruiz SaulAún no hay calificaciones
- Practica 1 Determinación Del Punto de FusiónDocumento11 páginasPractica 1 Determinación Del Punto de FusiónCamila CincoAún no hay calificaciones
- Informe MaterialesDocumento9 páginasInforme MaterialesDarwin Apaza LazarteAún no hay calificaciones
- Recuperación de Química Segundo BimestreDocumento2 páginasRecuperación de Química Segundo BimestreJuan Carlos Beltran Bustos100% (1)
- Practica 11 - LEQIDocumento3 páginasPractica 11 - LEQIMARCO ANTONIO MORALES RINCONAún no hay calificaciones
- Métodos de IntegraciónDocumento4 páginasMétodos de IntegraciónMichelle CoutiñoAún no hay calificaciones
- Risgos Físicos - Stress TérmicoDocumento17 páginasRisgos Físicos - Stress TérmicoPaul Tello GarayAún no hay calificaciones
- Guia - 03 - Sistemas Amortiguadoras en Sistemas Biologicos-1Documento13 páginasGuia - 03 - Sistemas Amortiguadoras en Sistemas Biologicos-1juan lopezAún no hay calificaciones
- SP Ygp Chap IDocumento8 páginasSP Ygp Chap IJavier GarridoAún no hay calificaciones