Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CD 070243
Cargado por
yael1991Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
CD 070243
Cargado por
yael1991Copyright:
Formatos disponibles
NOTA CLÍNICA
Miopatía miotubular ligada al cromosoma X:
informe clínico y revisión del fenotipo leve
Ricardo Barreto-Mota, Joana Figueirinha, Rita Quental, Jacinta Fonseca, Cláudia Melo,
Mafalda Sampaio, Raquel Sousa
Introducción. La miopatía miotubular ligada al X es una miopatía centronuclear rara que afecta aproximadamente a 1 de Unidad de Neurología Pediátrica
(J. Fonseca, C. Melo, M. Sampaio,
cada 50.000 recién nacidos varones causada por variantes patógenas en el gen de la miotubularina 1 (MTM1). La grave- R. Sousa). Departamento de
dad clínica varía; sin embargo, la necesidad de soporte ventilatorio ocurre casi invariablemente. Pediatría (R. Barreto-Mota).
Departamento de Genética
Caso clínico. Presentamos el caso de un niño de 4 años que presentaba hipotonía muscular leve a los 12 meses, trastor- Médica. Centro Hospitalar
no del lenguaje expresivo, retraso global del desarrollo y trastorno del procesamiento sensorial. La secuenciación clíni- Universitário São João. Oporto
(R. Quental). Departamento de
ca del exoma identificó la variante hemicigótica c.722G>A p.(Arg241His) en el exón 9 del gen de la miotubularina 1 Pediatría. Centro Hospitalar do
(NM_000252.2). La madre es portadora heterocigota de la misma variante. Se estableció el diagnóstico de una forma Médio Ave. Braga, Portugal
(J. Figueirinha).
leve de miopatía miotubular ligada al cromosoma X de herencia materna. El niño presentó una mejoría significativa con
terapias del habla, ocupacional y física, sin intercurrencias respiratorias ni dependencia de ventilador. Correspondencia:
Dr. Ricardo Barreto Mota. Centro
Conclusión. La presentación de una forma leve de esta miopatía miotubular, al notificarse más raramente, añadió desafío Hospitalar Universitário São João.
al diagnóstico. La combinación de hipotonía leve, dificultades de alimentación y trastorno del lenguaje expresivo debe Alameda Prof. Hernâni Monteiro,
4200-319 Porto.
hacer sospechar una enfermedad neuromuscular. Se carece de puntuaciones motoras o de desarrollo verificadas específi-
cas de esta miopatía para determinar el pronóstico y la necesidad de otras terapias. Aunque actualmente la gravedad de E-mail:
la miopatía miotubular se clasifica según la dependencia del ventilador, esto puede ser insuficiente e inaplicable a los ca- rjdmota@gmail.com
sos más leves. Es evidente la necesidad de un sistema de clasificación para los casos leves y moderados que evalúe la de- Aceptado tras revisión externa:
bilidad muscular y la fatiga, las limitaciones de la vida diaria, el retraso del desarrollo motor, las puntuaciones fenotípicas 03.03.23.
tempranas o las infecciones respiratorias recurrentes. Conflicto de intereses:
Los autores declaran no tener
Palabras clave. Consejo genético. Hipotonía muscular. Miopatía miotubular. Miotubularina. Retraso en el desarrollo. conflictos de interés.
Trastornos del lenguaje.
Cómo citar este artículo:
Barreto-Mota R, Figueirinha J,
Quental R, Fonseca J, Melo C,
Sampaio M, et al. Miopatía
Introducción [3]. Los pacientes con las formas más graves requie- miotubular ligada al cromosoma
X: informe clínico y revisión del
ren asistencia ventilatoria precoz y con frecuencia fenotipo leve. Rev Neurol 2023;
La miopatía miotubular ligada al cromosoma X es fallecen durante el primer año de vida, mientras 76: 243-6. doi: 10.33588/
rn.7607.2021447.
una miopatía centronuclear rara que afecta aproxi- que los supervivientes a largo plazo presentan insu-
madamente a 1 de cada 50.000 recién nacidos varo- ficiencia respiratoria crónica con dependencia de la English version available
nes. Esta miopatía fue descrita por primera vez por asistencia ventilatoria y no son ambulantes [4]. Se at www.neurologia.com
A. Spiro en 1966 en un niño de 12 años con debili- han descrito formas leves en pacientes sin necesi- © 2023 Revista de Neurología
dad motora generalizada progresiva e, histológica- dad de asistencia ventilatoria o alimentaria y con
mente, miotubos con núcleos centrales y ausencia poca o ninguna afectación motora. Presentamos el
de miofibrillas [1]. Está causada por variantes pató- caso de un niño de 4 años con antecedentes de re-
genas en el gen de la miotubularina 1 (MTM1), en traso en el desarrollo e infecciones del tracto infe-
la región cromosómica Xq28, responsable de codi- rior, por lo demás sano.
ficar la fosfatasa ubicua miotubularina. Un reciente
análisis retrospectivo multicéntrico reveló que las
variantes de pérdida de función debidas a cambios Caso clínico
de marco y variantes sin sentido son el tipo más co-
mún de cambio [2]. La gravedad clínica varía y se Varón de 12 meses que ingresó en la consulta exter-
clasifica según el grado de soporte ventilatorio. La na de neurología infantil debido a un retraso en el
mayoría de los pacientes presenta un fenotipo gra- desarrollo. Era un recién nacido a término, nacido
ve (55-79%), mientras que el 6-16% son moderados de un embarazo sin complicaciones, con padres
y el 15-29% tienen una forma leve de la enfermedad sanos no consanguíneos y dos hermanos mayores
www.neurologia.com Rev Neurol 2023; 76 (7): 243-246 243
R. Barreto-Mota, et al
sanos. El niño presentaba antecedentes de dos in- muscular reveló miofibras atróficas, algunas miofi-
fecciones respiratorias víricas de las vías bajas des- bras redondeadas con núcleos localizados interna-
de los 6 meses, con dos ingresos hospitalarios, sin mente y, aunque no era frecuente, acumulación de
necesidad de soporte ventilatorio, y era seguido en tinciones localizadas centralmente con tinciones
consultas externas de neumología por sibilancia oxidativas, algunas con centralización nuclear, co-
recurrente. En la exploración f ísica presentaba bra- múnmente relacionadas con miopatías del gen
quicefalia, hipotonía leve, reflejos osteotendinosos MTM1. Las pruebas genéticas en la madre mostra-
normales y una sindactilia bilateral de 2-3 dedos. El ron que es portadora heterocigota de la misma va-
perímetro cefálico se situaba entre los percentiles riante en el gen MTM1, lo cual no es inesperado, ya
85 y 97. La estatura y la talla estaban por encima del que sólo el 10-20% de los pacientes son portadores
percentil 97. No presentaba ptosis ni oftalmoplejía. de mutación de novo [5]. Además, descubrimos que
A los 12 meses era capaz de sentarse sin ayuda, presenta síntomas neuromusculares leves desde la
pero no podía llegar a la posición sentada. Parecía juventud que antes no se valoraban.
entender órdenes sencillas, pero no era capaz de
vocalizar. Los padres también estaban preocupados
por la alimentación; aunque describieron que no Discusión
tenía problemas con los líquidos, informaron de
una aparente dificultad para masticar. Se inició lo- Nuestro paciente nunca presentó deficiencia respi-
gopedia, terapia ocupacional y fisioterapia, con una ratoria con dependencia ventilatoria ni hipotonía
mejora significativa. Desde su nacimiento hasta los grave, los síntomas más graves y, por tanto, más
4 años presentó una evolución psicomotriz lenta, frecuentes de esta afección. El hecho de que pre-
pero positiva. Comenzó a caminar de forma inde- sente una forma leve de esta afección, al ser menos
pendiente a los 18 meses, mientras que el lenguaje comúnmente descrita, añadió un reto al diagnósti-
expresivo presentaba un retraso significativo, con co. Consideramos relevante destacar la alta preva-
palabras a partir de los 3 años y frases a los 4 años. lencia de retraso del desarrollo motor en los casos
Las habilidades sociales estaban siempre preserva- leves descritos en la bibliograf ía, así como la debili-
das; sin embargo, la comunicación estaba afectada. dad muscular en los pacientes de mayor edad, ya
La evaluación del desarrollo reveló un retraso glo- que esto podría dar pistas sobre el pronóstico y la
bal del desarrollo (cociente global del desarrollo 70) evolución de nuestro paciente. Nuestro caso se
y un trastorno del procesamiento sensorial. No pre- ajusta a la mayoría de las características clínicas
senta problemas respiratorios desde los 3 años y 6 más comunes, incluyendo hipotonía leve, dificulta-
meses de edad. La evaluación cardiológica no reve- des de deglución y ausencia de dependencia de ven-
ló ninguna anomalía cardíaca estructural. Las eva- tilador. Curiosamente, carece de algunos rasgos fe-
luaciones otorrinolaringológicas, incluidos los po- notípicos casi ubicuos, a saber, facies miotónica,
tenciales auditivos evocados, fueron normales. Una paladar alto arqueado, oftalmoplejía o debilidad de
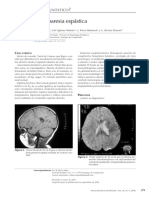
resonancia magnética cerebral a la edad de 2 años la parrilla escapular. Este caso pone de relieve que
reveló braquicefalia, parénquima cerebral normal, la presentación de hipotonía leve, dificultades de
mielinización adecuada para la edad, agrandamien- alimentación y trastorno del lenguaje expresivo
to de los espacios subaracnoideos en el cerebro también debe hacer sospechar una enfermedad
frontal-parietal, con reducción del volumen paren- neuromuscular. Nuestro paciente presentaba tras-
quimatoso, una fosa posterior amplia con ligera ro- torno del lenguaje expresivo. Amburgey et al [4], en
tación del vermis en sentido contrario a las agujas una revisión en la que describen la historia natural
del reloj y un quiste aracnoideo que comprimía el de esta enfermedad, informan de una alta inciden-
hemisferio izquierdo del cerebelo. Un array de hi- cia de problemas de aprendizaje (43%), probable-
bridación genómica comparativa mostró variantes mente asociados a anomalías del habla, como voz
no relevantes y el estudio metabólico fue normal. La hipofónica, dificultades en la articulación del habla,
secuenciación clínica del exoma identificó la varian- y primeras palabras y frases tardías. La discapaci-
te hemicigótica c.722G>A p.(Arg241His) en el exón dad intelectual, sin embargo, presenta informes
9 del gen MTM1 (NM_000252.2), asociada a miopa- contradictorios en la bibliograf ía. Mientras que se
tía miotubular. Esta variante se clasificó como pro- ha descrito en trastornos neuromusculares como la
bablemente patógena según las directrices de clasi- distrofia miotónica de tipo 1, en pacientes con mio-
ficación de variantes del American College of Medi- patía miotubular, el deterioro cognitivo se ha des-
cal Genetics and Genomics y, que nosotros sepa- crito como secundario a la encefalopatía isquémica
mos, nunca se había comunicado antes. La biopsia hipóxica perinatal [4]. En 1999, Herman et al no
244 www.neurologia.com Rev Neurol 2023; 76 (7): 243-246
Miopatía miotubular ligada al cromosoma X
describieron ningún deterioro cognitivo en super- utilizó un vector AAV para anular la expresión de
vivientes a largo plazo; informaron de convulsiones DMN2 en ratones knock-out Mtm1, basándose en
clínicas en cuatro pacientes que probablemente se la hipótesis de que la actividad GTPasa de la dina-
debían a encefalopatías metabólicas [6]. A pesar de mina 2 conduce a un fenotipo similar a la miopatía
que la miotubularina se expresa en el cerebro, no se centronuclear. El resultado fue una mejora de la
han descrito malformaciones del sistema nervioso fuerza muscular y de la histología [9]. El ensayo
central en animales, pero faltan investigaciones so- ASPIRO (NCT03199469) es un estudio clínico mul-
bre este tema [4]. Un desarrollo cognitivo adecuado tinacional, abierto, de fase 1/2, en el que se está ad-
y una creatincinasa normal deberían orientar el ministrando un vector AAV8 portador del gen
diagnóstico hacia una afección miopática. A pesar MTM1 (AT132) a personas con miopatía miotubu-
de la variación fenotípica, se trata de una enferme- lar ligada al cromosoma X menores de 5 años.
dad progresiva que conduce inexorablemente a la Aunque las mujeres portadoras suelen ser asin-
regresión del desarrollo motor, incluso en pacientes tomáticas, se han descrito mujeres afectadas con
con fenotipos más leves [3]. El máximo desarrollo síntomas que van de leves a graves. Los mecanis-
adquirido parece estar determinado por el genotipo mos propuestos para explicar esta característica in-
[3]. En la actualidad, la gravedad de la miopatía cluyen la inactivación sesgada del cromosoma X
miotubular se clasifica única y variablemente en y/o variantes genéticas en genes adicionales que
función de la dependencia del respirador [3]. Aun- pueden modular el fenotipo [10]. El análisis de la in-
que las pruebas de función respiratoria son útiles activación del cromosoma X en la madre de nuestro
para determinar la necesidad de terapias respirato- paciente mostró un patrón ligeramente sesgado
rias para mejorar este resultado [3], es una forma (70:30). Incluso cuando la madre es asintomática,
incompleta de caracterizar esta afección. Faltan es importante conocer su estado de portadora para
puntuaciones motoras o de desarrollo específicas ofrecer un asesoramiento genético adecuado a la
de esta miopatía para determinar el pronóstico y la familia.
necesidad de otras terapias. Creemos que existe
una necesidad evidente de un sistema de clasifica- Informamos del diagnóstico de un niño con una
ción para los casos leves y moderados distintos de afección neuromuscular que presenta característi-
la dependencia del respirador, como la debilidad cas no clásicas, como retraso global del desarrollo y
muscular y la fatiga, las limitaciones de la vida dia- trastornos del lenguaje expresivo, al tiempo que pre-
ria, el retraso del desarrollo motor (especialmente senta hipotonía y retraso motor más leves. En pre-
la marcha independiente y el control de la cabeza), sencia de un retraso global del desarrollo con rasgos
las puntuaciones fenotípicas tempranas (paladar motores más leves, debe considerarse un trastorno
alto arqueado, facies miotónica e hipotonía) o las neuromuscular en el diagnóstico diferencial.
infecciones respiratorias recurrentes. El manejo de
esta afección se propone en un consenso de cuida- Bibliograf ía
dos estándar, que describe un tratamiento de apo- 1. Spiro AJ, Shy GM, Gonatas NK. Myotubular myopathy:
yo, ya que no existen, en la actualidad, terapias cu- persistence of fetal muscle in an adolescent boy. Arch
rativas para las miopatías congénitas [7]. Los pa- Neurol 1966; 14: 1-14.
2. Beggs AH, Byrne BJ, De Chastonay S, Haselkorn T, Hughes
cientes se benefician de un estrecho seguimiento I, James ES, et al. A multicenter, retrospective medical
multidisciplinar guiado por un especialista neuro- record review of X-linked myotubular myopathy: the
muscular, que debe vigilar los problemas del habla, recensus study. Muscle Nerve 2018; 57: 550-60.
3. Annoussamy M, Lilien C, Gidaro T, Gargaun E, Chê V,
la deglución y la respiración. A pesar de no ser una Schara U, et al. X-linked myotubular myopathy. Neurology
presentación frecuente, deben excluirse anomalías 2019; 92: e1852.
4. Amburgey K, Tsuchiya E, de Chastonay S, Glueck M,
cardíacas y del ritmo. Actualmente se está investi- Alverez R, Nguyen CT, et al. A natural history study of
gando la terapia génica para la miopatía miotubular X-linked myotubular myopathy. Neurology 2017; 89: 1355.
ligada al cromosoma X. En ensayos aleatorizados 5. Laporte J, Biancalana V, Tanner SM, Kress W, Schneider V,
Wallgren-Pettersson C, et al. MTM1 mutations in X-linked
doble ciego y abiertos no aleatorizados, la adminis- myotubular m yopathy. Hum Mutat 2000; 15: 393-409.
tración de un vector recombinante de virus ade- 6. Herman GE, Finegold M, Zhao W, De Gouyon B,
noasociado de serotipo 8 (rAAV8) que expresa Metzenberg A. Medical complications in long-term
survivors with X-linked myotubular myopathy. J Pediatr
miotubularina canina (cMTM1) bajo el promotor 1999; 134: 206-14.
de desmina específico del músculo (rAAV8-cMTM) 7. Wang CH, Dowling JJ, North K, Schroth MK, Sejersen T,
produjo una mejora dependiente de la dosis en la Shapiro F, et al. Consensus statement on standard of care for
congenital myopathies. J Child Neurol 2012; 27: 363-82.
supervivencia, la fuerza y la estructura muscular en 8. Mack DL, Poulard K, Goddard MA, Latournerie V, Snyder
perros sin efectos adversos [8]. En otro estudio, se JM, Grange RW, et al. Systemic AAV8-mediated gene
www.neurologia.com Rev Neurol 2023; 76 (7): 243-246 245
R. Barreto-Mota, et al
therapy drives whole-body correction of myotubular 10. Biancalana V, Scheidecker S, Miguet M, Laquerrière A,
myopathy in dogs. Mol Ther 2017; 25: 839-54. Romero NB, Stojkovic T, et al. Affected female carriers of
9. Tasfaout H, Lionello VM, Kretz C, Koebel P, Messaddeq N, MTM1 mutations display a wide spectrum of clinical and
Bitz D, et al. Single intramuscular injection of AAV-shRNA pathological involvement: delineating diagnostic clues. Acta
reduces DNM2 and prevents myotubular myopathy in mice. Neuropathol 2017; 134: 889-904.
Mol Ther 2018; 26: 1082-92.
X-linked myotubular myopathy: a clinical report and a review of the mild phenotype
Introduction. X-linked myotubular myopathy is a rare centronuclear myopathy that affects approximately 1 in 50,000
male newborns caused by pathogenic variants in the myotubularin 1 gene (MTM1). The clinical severity varies, however
the need for ventilatory support occurs almost invariably.
Case report. We report the case of a 4-year-old boy presenting mild muscle hypotonia at 12 months-old, expressive
language disorder, global developmental delay, and a sensory processing disorder. Clinical exome sequencing identified
the hemizygous variant c.722G>A p.(Arg241His) in exon 9 of the myotubularin 1 gene (NM_000252.2). The mother is a
heterozygous carrier of the same variant. A diagnosis of a mild form of maternal inherited X-linked myotubular myopathy
was established. The child presented significant improvement with speech, occupational, and physical therapies, with no
respiratory intercurrences or ventilator dependency.
Conclusion. The presentation of a mild form of this myotubular myopathy, being less commonly reported, added
challenge to the diagnosis. The combination of mild hypotonia, feeding difficulties and expressive language disorder
should raise suspicion of a neuromuscular disease. There is a lack of verified motor or developmental scores specific to this
myopathy to further determine prognosis and need of other therapies. While currently the severity myotubular myopathy
is classified according to ventilator dependency, this may be insufficient and unapplicable to milder cases. There is an
evident need for a grading system for mild and moderate cases assessing muscle weakness and fatigue, daily life
limitations, motor developmental delay, early phenotypical scores, or recurrent respiratory infections.
Key words. Developmental delay. Genetic counselling. Language disorders. Muscle hypotonia. Myotubular myopathy.
Myotubularin.
246 www.neurologia.com Rev Neurol 2023; 76 (7): 243-246
También podría gustarte
- Principios básicos de patología para fisioterapia: Volumen IDe EverandPrincipios básicos de patología para fisioterapia: Volumen IAún no hay calificaciones
- Miopatia Nemalinica PDFDocumento6 páginasMiopatia Nemalinica PDFMauricio LaraAún no hay calificaciones
- Hipoacusia Neurosensorial Secundaria A EnfermedadDocumento4 páginasHipoacusia Neurosensorial Secundaria A EnfermedadPerla YedroAún no hay calificaciones
- 354-Texto Del Artículo-883-1-10-20190413Documento3 páginas354-Texto Del Artículo-883-1-10-20190413OLA MILLERAún no hay calificaciones
- s3 NascimentoDocumento5 páginass3 NascimentoMartin CenicerosAún no hay calificaciones
- MIELITISDocumento2 páginasMIELITISanon-742064100% (1)
- Miopatías Congénitas, Síndromes Miasténicos Congénitos y MiasteniaDocumento10 páginasMiopatías Congénitas, Síndromes Miasténicos Congénitos y MiasteniaMartin CenicerosAún no hay calificaciones
- BCM - I-5 - Los Trastornos Mitocondriales Como Ventanas Hacia Una Antigua OrganelaDocumento10 páginasBCM - I-5 - Los Trastornos Mitocondriales Como Ventanas Hacia Una Antigua OrganelaJhon CarrascoAún no hay calificaciones
- SESIÓN 6 - Lectura - Mitochondrial Disorders As Windows Into An Ancient Organelle - TRADUCCIÓN PDFDocumento10 páginasSESIÓN 6 - Lectura - Mitochondrial Disorders As Windows Into An Ancient Organelle - TRADUCCIÓN PDFrossie del carmenAún no hay calificaciones
- Arritmias en Pacientes Con Miopatía Miotubular Ligada Al Cromosoma XDocumento3 páginasArritmias en Pacientes Con Miopatía Miotubular Ligada Al Cromosoma XMaria del Carmen Heras MorenoAún no hay calificaciones
- Caso Clinico Miopatia NemalinicaDocumento6 páginasCaso Clinico Miopatia NemalinicaAndi Monasterios TejerinaAún no hay calificaciones
- Distrofia Miotónica de SteinertDocumento3 páginasDistrofia Miotónica de SteinertEmi OjedaAún no hay calificaciones
- SX Otahara DR RodriguezDocumento7 páginasSX Otahara DR RodriguezEdu RotAún no hay calificaciones
- Art 19Documento2 páginasArt 19Dhamar RiosAún no hay calificaciones
- Distrofia Muscular. 2014Documento5 páginasDistrofia Muscular. 2014pameAún no hay calificaciones
- Síndrome de Steinert PDFDocumento4 páginasSíndrome de Steinert PDFlithium2203Aún no hay calificaciones
- Tumor Teratoide Rabdoide Atipico en Un ADocumento7 páginasTumor Teratoide Rabdoide Atipico en Un AnivekmedAún no hay calificaciones
- Anomalias CongénitasDocumento16 páginasAnomalias CongénitasrosaAún no hay calificaciones
- Manifestaciones de La Enfermedad NeuromuscularDocumento10 páginasManifestaciones de La Enfermedad NeuromuscularLuisa Fernanda Martinez SiachoqueAún no hay calificaciones
- Anatomia 2 ParcialDocumento3 páginasAnatomia 2 Parcialgraciela tocasAún no hay calificaciones
- TFG Metodo Le Métayer, Tratamiento de La Paralisis Cerebral Infantal (Revision Bibliografica) PDFDocumento47 páginasTFG Metodo Le Métayer, Tratamiento de La Paralisis Cerebral Infantal (Revision Bibliografica) PDFDigoDiegoBuendia100% (2)
- 2351 8224 1 PBDocumento26 páginas2351 8224 1 PBTahysse Andrea Varela SilvaAún no hay calificaciones
- EsclerosisDocumento8 páginasEsclerosisLizeth LorancaAún no hay calificaciones
- Articulo Moya Moya RevisadoDocumento11 páginasArticulo Moya Moya RevisadoPEREZOSORIOAún no hay calificaciones
- Mielitis Transversa - En.esDocumento9 páginasMielitis Transversa - En.esmonsecatalinaAún no hay calificaciones
- Miastenia Gravis en PediatríaDocumento11 páginasMiastenia Gravis en PediatríaNeuro_GuruAún no hay calificaciones
- RM 9 4 13Documento6 páginasRM 9 4 13Daniela RojasAún no hay calificaciones
- Caso Clínico. FeohifomicosisDocumento6 páginasCaso Clínico. FeohifomicosisSOLEYVEN MARGARITA LOPEZ ESTRADAAún no hay calificaciones
- Articulo de Miastenia GravisDocumento23 páginasArticulo de Miastenia GravisFernando Siles OrellanaAún no hay calificaciones
- ANENCEFALIADocumento25 páginasANENCEFALIAKike SifuentesAún no hay calificaciones
- Super HembraDocumento4 páginasSuper HembraJeison LopezAún no hay calificaciones
- 2 CR 6920 Castillo EspDocumento2 páginas2 CR 6920 Castillo Esp7cs74jx95zAún no hay calificaciones
- TESIS Dr. NaimDocumento33 páginasTESIS Dr. NaimGrecia RamosAún no hay calificaciones
- Síndrome HipotónicoDocumento33 páginasSíndrome HipotónicoKTcat89Aún no hay calificaciones
- Nota Clinica MiopatiaDocumento5 páginasNota Clinica MiopatiaConsuelo SalazarAún no hay calificaciones
- MeningiomaDocumento5 páginasMeningiomaNatali R BerriosAún no hay calificaciones
- Artal 2010 MucormicosisDocumento5 páginasArtal 2010 MucormicosisMishel TrinidadAún no hay calificaciones
- 3143-Texto Del Artículo-11019-1-10-20140222Documento6 páginas3143-Texto Del Artículo-11019-1-10-20140222Edwin Nicko EspinoAún no hay calificaciones
- Mielopatia Espondilotica Cervical Lo Que El MedicoDocumento11 páginasMielopatia Espondilotica Cervical Lo Que El MedicoMonse Gonzalez AkeAún no hay calificaciones
- Protocolo Neurofibromatosis Tipo 1Documento10 páginasProtocolo Neurofibromatosis Tipo 1ogmgxehuivdnivlcgiAún no hay calificaciones
- Histoplasmosis CerebralDocumento4 páginasHistoplasmosis CerebralNubia GonzalezAún no hay calificaciones
- ELA Con MeningiomaDocumento5 páginasELA Con MeningiomaAnghel V. AriasAún no hay calificaciones
- pdf24 - Converted 6Documento5 páginaspdf24 - Converted 6EDUARDO CARRILLO GODINEZAún no hay calificaciones
- Atrofia Muscular EspinalDocumento5 páginasAtrofia Muscular Espinalirving castroAún no hay calificaciones
- Carta Clínica: Amigdalitis Unilateral: Angina de Plaut-VincentDocumento2 páginasCarta Clínica: Amigdalitis Unilateral: Angina de Plaut-VincentCamilaAún no hay calificaciones
- NEONATOLOGIADocumento18 páginasNEONATOLOGIAMacho Peruano Que se RespetaAún no hay calificaciones
- Articulo Masas LinfaticasDocumento8 páginasArticulo Masas LinfaticasDarcy Pitalua JimenezAún no hay calificaciones
- Parálisis Oculomotoras en El Paciente Diabético - PRT 7Documento5 páginasParálisis Oculomotoras en El Paciente Diabético - PRT 7Dany BerlinAún no hay calificaciones
- Monoparesia Espástica: Uál Es Su IagnósticoDocumento2 páginasMonoparesia Espástica: Uál Es Su IagnósticoNadir Mohamed HassanAún no hay calificaciones
- Perfil Clínico y Sociodemográfico de La NeurosífilisDocumento6 páginasPerfil Clínico y Sociodemográfico de La NeurosífilisChristian EspinosaAún no hay calificaciones
- 7 Pectus Excavatum 69 77 1Documento9 páginas7 Pectus Excavatum 69 77 1Ramon HernandezAún no hay calificaciones
- Endocarditis en UCIDocumento3 páginasEndocarditis en UCIYamelis CorderoAún no hay calificaciones
- Posible Etiologia de NarcolepsiaDocumento4 páginasPosible Etiologia de NarcolepsiaMiriamAún no hay calificaciones
- Sindrome Le Leigh 1Documento5 páginasSindrome Le Leigh 1Jeison Cabos SanchezAún no hay calificaciones
- Mielitis Transversa Aguda en Buenos Aires - Htal Italiano, 2011-12-15Documento6 páginasMielitis Transversa Aguda en Buenos Aires - Htal Italiano, 2011-12-15Ricardo ForlanoAún no hay calificaciones
- BL 040161Documento5 páginasBL 040161Pamela GutteAún no hay calificaciones
- Amnesia Del Desarrollo NiñosDocumento10 páginasAmnesia Del Desarrollo NiñosCeci IsaacAún no hay calificaciones
- Bioenergetica - Metabolismo de CarbohidratosDocumento41 páginasBioenergetica - Metabolismo de CarbohidratosRosa AlvaradoAún no hay calificaciones
- 14894-Texto Del Artículo-76613-1-10-20231208Documento2 páginas14894-Texto Del Artículo-76613-1-10-20231208Abel Abelito Jimenez Jimenez Jr.Aún no hay calificaciones
- Epidemiología Del Mielomeningocele en Niños Menores de Un Año de Edad en El Instituto Nacional de PediatríaDocumento5 páginasEpidemiología Del Mielomeningocele en Niños Menores de Un Año de Edad en El Instituto Nacional de PediatríaEmily Liscano GuaranAún no hay calificaciones
- Grado 9Documento18 páginasGrado 9Portal 3D El CopeyAún no hay calificaciones
- Tarea de Genetica FarmacogenéticaDocumento14 páginasTarea de Genetica FarmacogenéticaRodriguez CarlaAún no hay calificaciones
- Actividad 2. La CélulaDocumento4 páginasActividad 2. La CélulaGonzález Ruano Alma LuiginaAún no hay calificaciones
- AutoinflamatoriasDocumento17 páginasAutoinflamatoriasClaudia RitaAún no hay calificaciones
- Lectura Genesis de La SociedadDocumento3 páginasLectura Genesis de La SociedadFrancisco Javier Hernández GudiñoAún no hay calificaciones
- Formato de Entrega Tarea 3Documento9 páginasFormato de Entrega Tarea 3Jaimee QuiñonesAún no hay calificaciones
- Guía de Actividades y Rúbrica de Evaluación - Tarea 2 - Estudiar Tipos de Células y Los Organismos AcelularesDocumento11 páginasGuía de Actividades y Rúbrica de Evaluación - Tarea 2 - Estudiar Tipos de Células y Los Organismos AcelularesJorge Luis Caceres CalvoAún no hay calificaciones
- Ensayo SCDocumento4 páginasEnsayo SCSarita ChimboAún no hay calificaciones
- Planificación Anual Biología 3º AñoDocumento2 páginasPlanificación Anual Biología 3º AñoSonia ColosimoAún no hay calificaciones
- Competencias Comunicativas en Lenguaje - LecturaDocumento10 páginasCompetencias Comunicativas en Lenguaje - LecturaNUBIAELENAPA8476Aún no hay calificaciones
- Diapositiva de Recursos Humanos 1: Osteogenesis ImperfectaDocumento8 páginasDiapositiva de Recursos Humanos 1: Osteogenesis ImperfectaNoah RodríguezAún no hay calificaciones
- Celular Biolog Ia: 1. Elabore Un Mapa Conceptual de Transporte de MembranaDocumento14 páginasCelular Biolog Ia: 1. Elabore Un Mapa Conceptual de Transporte de MembranaTatiana Taborda garciaAún no hay calificaciones
- Arellano 2020 Plantas Vasculares Sin SemillasDocumento11 páginasArellano 2020 Plantas Vasculares Sin SemillasSaique ArAún no hay calificaciones
- Producción y Recuperación de AminoácidosDocumento35 páginasProducción y Recuperación de AminoácidosRob HBAún no hay calificaciones
- Juez Dredd y Eugenesia - Univ. CádizDocumento15 páginasJuez Dredd y Eugenesia - Univ. CádizRodrigo HMAún no hay calificaciones
- Silabo Biología Celular y Molecular MédicaDocumento39 páginasSilabo Biología Celular y Molecular MédicaMile MiAún no hay calificaciones
- 17 Instructivo 3,4 LecturasDocumento3 páginas17 Instructivo 3,4 LecturasXimena100% (1)
- Tecia Solanivora MIPDocumento17 páginasTecia Solanivora MIPCESAR TORRESAún no hay calificaciones
- AntibiogramaDocumento82 páginasAntibiogramaUYIAún no hay calificaciones
- Nucleo CelularDocumento41 páginasNucleo CelularAlex RodriguezAún no hay calificaciones
- Genes YEspondilitis AnquilosanteDocumento13 páginasGenes YEspondilitis Anquilosantejezy2014Aún no hay calificaciones
- Casos Clínicos - 4H1 - Albarran Torres Viviana Jasmin 2Documento6 páginasCasos Clínicos - 4H1 - Albarran Torres Viviana Jasmin 2chat gptAún no hay calificaciones
- Informe. FSCDocumento8 páginasInforme. FSCYajaira SeguraAún no hay calificaciones
- Embriología - Parcial - 2021-IiDocumento37 páginasEmbriología - Parcial - 2021-IiXimena del Rosario Espíritu VilcapomaAún no hay calificaciones
- Biolg - La CélulaDocumento40 páginasBiolg - La CélulaSergio Gonza LauraAún no hay calificaciones
- Dilemas Éticos de Los Profesionales de La SaludDocumento3 páginasDilemas Éticos de Los Profesionales de La SaludParis CidAún no hay calificaciones
- Informe PCRDocumento2 páginasInforme PCRSebastián DroppelmannAún no hay calificaciones
- ReyesJimenezNathanUlises 3OV4 Cuadro Comparativo de Los Órdenes de RhodophytasDocumento1 páginaReyesJimenezNathanUlises 3OV4 Cuadro Comparativo de Los Órdenes de RhodophytasNathan Ulises Reyes JimenezAún no hay calificaciones
- Taller 1 - Andrea LopezDocumento7 páginasTaller 1 - Andrea LopezGabriela Timana MartinezAún no hay calificaciones
- Clase 2 Tejido EpitelialDocumento141 páginasClase 2 Tejido Epitelialsuhey espinozaAún no hay calificaciones