Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Instituto Politécnico Nacional: Escuela Superior de Ingeniería Química E Industrias Extractivas
Instituto Politécnico Nacional: Escuela Superior de Ingeniería Química E Industrias Extractivas
Cargado por
natalia martinezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Instituto Politécnico Nacional: Escuela Superior de Ingeniería Química E Industrias Extractivas
Instituto Politécnico Nacional: Escuela Superior de Ingeniería Química E Industrias Extractivas
Cargado por
natalia martinezCopyright:
Formatos disponibles
INSTITUTO POLITÉCNICO NACIONAL
ESCUELA SUPERIOR DE INGENIERÍA
QUÍMICA E INDUSTRIAS EXTRACTIVAS
“SÍNTESIS DE NANOPARTÍCULAS DE AU EMPLEANDO SÁBILA
(ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA
CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN LOS REDUCTORES ORGÁNICOS
COMPARANDO LA SÍNTESIS CON REDUCTORES INORGÁNICO DE
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6”
T E S I S
PARA OBTENER EL TÍTULO DE
INGENIERO QUÍMICO INDUSTRIAL
PRESENTAN
VIRIDIANA PÉREZ LÓPEZ
DIRECTOR DE TESIS
DR. JESÚS ISRAEL GUZMÁN CASTAÑEDA
CIUDAD DE MÉXICO.DICIEMBRE DEL 2018
Powered by TCPDF (www.tcpdf.org)
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6
EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Índice
RESUMEN I
ABSTRACT IV
INTRODUCCIÓN VI
OBJETIVO GENERAL IX
OBJETIVOS ESPECÍFICOS IX
JUSTIFICACIONES X
CAPÍTULO I. GENERALIDADES DE LAS NANOPARTICULAS DE ORO
I.1.- La nanociencia y la nanotecnología 1
I.1.1.- Antecedentes históricos 3
I.1.2.- Impacto social de la nanotecnología 5
I.1.2.- La Nanotecnología en México y en el mundo 7
I.2.- Nanomateriales 9
I.3.- Las nanopartículas 11
I.4. Las nanopartículas metálicas 12
I.4.1. Propiedades de las nanopartículas metálicas. 13
I.4.1.1 Propiedades Físicas. 13
I.4.1.2. Propiedades ópticas 15
I.4.1.2.1. Teoría de MIE 17
I.4.1.3. Propiedades químicas 20
I.4.1.3.1. Fotocatálisis 20
I.4.1.4. Propiedades mecánicas 20
I.4.2. Estabilidad y funcionalización de las nanopartículas. 21
I.4.2.1. Tipos de estabilización 22
I.5. Nanopartículas de Oro 24
I.5.1. Características de las nanopartículas de oro. 25
I.5.2 Aplicación de las nanopartículas de oro 26
I.6. Síntesis común de obtención de nanopartículas metálicas 29
I.6.1. Técnicas top-down (de arriba y abajo). 31
VIRIDIANA PÉREZ LÓPEZ
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6
EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.6.2. Técnicas bottom-uno (de abajo arriba) 32
I.7. Obtención de nanopartículas de oro 36
I.8 La química verde 37
I.8.1. Importancia de la química verde 38
I.8.2 Los doce principios de la química verde. 39
I.8.3. Perspectivas de la química verde. 40
I.8.4. Contaminación química 41
I.8.4.1. Contaminantes químicos 41
I.9. Contaminación en México 43
I.10. Desarrollo de la química verde en México 44
I.11. Síntesis verde 46
I.12. Reductores Orgánicos naturales 48
I.12.1. Ácido ascórbico. 49
I.12.1.1. Fuentes de ácido ascórbico. 51
I.12.2. Polifenoles. 52
I.12.3. Azúcares. 55
I.13. Aloe vera (Aloe Barbadensis) 56
I.13.1. GEL de aloe 57
I.13.2. Composición química. 59
I.13.3. Aplicaciones 60
I.14. Uva (Vitis vinifera) 61
I.14.1. Composición química. 63
I.14.2. Aplicaciones 64
CAPÍTULO II. TÉCNICAS DE CARACTERIZACIÓN
II.1. Espectroscopia de absorción molecular ultravioleta visible UV VIS 66
II.1.1. Fundamento teórico 68
II.1.1.1. Teoría de orbitales moleculares. 69
II.1.1.2. Ley de LAMBERT-BEER 73
II.1.1.3. Curva de calibración. 74
II.1.2 Instrumentación. 78
II.1.2.1. Espectrofotómetro UV-VIS de doble haz. 78
VIRIDIANA PÉREZ LÓPEZ
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6
EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.1.3. Muestras. 84
II.1.3.1. Disolvente, concentración, pH y temperatura. 86
II.2. Microscopia electrónica de transmisión (TEM) 87
II.2.1. Fundamento teórico 88
II.2.1.1. Resolución 89
II.2.2. Instrumentación. 91
II.2.3. Muestras. 94
II.3. Espectroscopia de absorción molecular infrarroja por transformadas 94
de Fourier (FT-IR)
II.3.1. Fundamento teórico. 95
II.3.1.1. Modelo mecánico-cuántico de vibraciones: oscilador armónico. 96
II.3.1.2. Modos normales de vibración. 98
II.3.2. Instrumentación. 100
II.3.3. Muestra. 103
CAPITULO III. DESARROLLO EXPERIMENTAL.
III.1. Preparación de la solución precursora de 𝐻𝐴𝑢𝐶𝑙4 105
III.2. Preparación de soluciones de agentes reductores para química 106
convencional.
III.2.1. Solución de tartrato de sodio y potasio. 106
III.2.2. Soluciones madre de ácido ascórbico a diferentes concentraciones 107
III.2.2.1. 𝐶6 𝐻8 𝑂6 a 100ppm. 107
III.2.2.2. 𝐶6 𝐻8 𝑂6 100ppm. a 5x10-4molL 107
III.3. Preparación de soluciones de agentes reductores para química verde 108
III.3.1 Extracto de Aloe vera (Aloe Barbadensis) 108
III.3.2. Mosto de Uva (Vitis vinifera) 109
III.4. Síntesis de nanopartículas de oro por química convencional 110
III.4.1. Nanopartículas de oro con tartrato de sodio y potasio 110
III.4.2. Nanopartículas de oro con ácido ascórbico 111
III.5. Síntesis de Nanopartículas de oro por química verde 112
VIRIDIANA PÉREZ LÓPEZ
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6
EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.5.1. Nanopartículas de oro con aloe vera 112
III.5.2. Nanopartículas de oro con mosto de Uva 113
III.6. Cuantificación de ácido ascórbico en los reductores orgánicos 114
naturales por la técnica de espectroscopia ultravioleta-visible (UV-VIS).
III.6.1 Preparación de los agentes reductores: aloe vera y uva morada 114
III.6.2. Preparación de la curva de calibración de ácido ascórbico 115
III.7. Secado de los reductores orgánicos naturales para determinar 117
grupos funcionales por la técnica FT-IR con el uso de ATR
III.8. Depósito de nanopartículas de oro para determinación de tamaño 118
por la técnica de de icroscopia electrónica de transmisión TEM.
CAPÍTULO IV. RESULTADOS
IV.1. Caracterización por espectroscopia UV-VIS 119
IV.1.1. Precursor y soluciones de agentes reductores para química 119
convencional
IV.1.2 Soluciones de los agentes reductores para química verde 121
IV.1.3. Cuantificación de ácido ascórbico en los agentes reductores para 122
química verde
IV.1.3.1. Curva de calibración del ácido ascórbico 122
IV.1.4. Soluciones de nanopartículas de oro 124
IV.1.4.1. Síntesis por química convencional 124
IV.1.4.1.1. Con agente reductor 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 124
IV.1.4.1.2. Con agente reductor de 𝐶6 𝐻8 𝑂6 126
IV.1.4.2. Síntesis por química verde 128
IV.1.4.2.1. Agente reductor de aloe vera 128
IV.1.4.2.2. Agente reductor uva morada 130
IV.2. Caracterización por espectroscopia FT-IR 132
IV.3. Caracterización por microscopia TEM 134
CAPÍTULO V. ANÁLISIS Y DISCUSIÓN DE RESULTADOS
VIRIDIANA PÉREZ LÓPEZ
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6
EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
V.1.Precursor y soluciones de agentes reductores para química 137
convencional
V.2. Soluciones de agentes reductores para química verde 138
V.2.1. Caracterización por espectroscopia FT-IR 139
V.3. Soluciones de nanopartículas de oro. 143
V.3.1. Síntesis por química convencional 143
V.3.1.1. Con agente reductor de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 143
V.3.1.2. Nanopartículas de oro sintetizadas con 𝐶6 𝐻8 𝑂6 143
V.3.2. Síntesis por química verde 144
V.3.2.1. Agente reductor de aloe vera 144
V.3.2.2. Agente reductor de uva morada 145
CAPÍTULO VI. CONCLUSIONES 146
Anexo A. Nomenclatura química 148
Anexo B. Símbolos y abreviaturas 149
Anexo C. Índice de figuras 151
Anexo D. Índice de tablas 155
Anexo E. Espectrofotómetro UV-VIS 156
Anexo F. Espectrofotómetro FT-IR 157
Anexo G. Microscopio electrónico de transmisión 158
Anexo H. Espectro de absorción UV-VIS del 𝐻𝐴𝑢𝐶𝑙4 159
Anexo I. Espectros de absorción UV-VIS del 𝐶6 𝐻8 𝑂6 160
Anexo J. Espectro de absorción FT-IR del 𝐶6 𝐻8 𝑂6 162
Anexo K. Espectro de absorción FT-IR del (C6 H8 O6 )n 165
Anexo L. Espectro de absorción FT-IR del 𝐶6 𝐻7 𝑂5 167
Anexo M. Espectros de absorción UV-VIS del 𝐶6 𝐻7 𝑂5 169
Anexo N. Espectro de absorción de AuNP´s sintetizadas con 𝐶6 𝐻8 𝑂6 170
Anexo O. Colores característicos de AuNP´s sintetizadas con uva 171
Anexo P. Espectro UV-VIS de AuNP´s sintetizadas con mosto de uva 172
REFERENCIAS 173
VIRIDIANA PÉREZ LÓPEZ
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Resumen
Como ya se sabe en el siglo XXI la nanociencia y la nanotecnología se presentan como
un área nueva de investigación en el estudio de los materiales, donde convergen
diversas ramas del conocimiento que permiten estudiar fenómenos inéditos que
ocurren a nivel atómico y molecular. [Serena, 2005]. Ahora se le suma la química verde
que se ha desarrollado los últimos años; la misión de la química verde es “promover el
desarrollo y usos de tecnologías químicas innovadoras que reduzcan o eliminen el uso
o generación de sustancias dañinas en el diseño, manufactura y uso de productos
químicos” [Meléndez, et. al., 2008].
Se han desarrollado síntesis para obtener partículas metálicas a escala manométrica,
como las reacciones oxido-reducción del ácido tetracloroaurico en solución acuosa en
presencia de reductores inorgánicos, cada resultado con propiedades fisicoquímicas,
formas, tamaños y características estructurales muy variadas; los reductores más
utilizados últimamente son el Tartrato de sodio y potasio [Tovar, 2016], el citrato trisódico
[Chetwani, 2015] y el borohidruro de sodio [Corzo, 2012]; entre las que destacan
nanopartículas de 33 a 35 nanómetros, con longitud de onda entre 540 a 550
nanómetros, soluciones coloidales con un pH de 5. La síntesis verde la ha desarrollado
con diversos extractos como lo son el mosto de uva [De Lamo, 2015], aloe vera [Quilantan, et.
al., 2017], Geranio [Belmares, et. al., 2013], Nopal [Rico, et. al., 2010] y alga marina [Colín, 2017] por
mencionar algunos, obteniéndose nanopartículas de oro de 30 a 40 nm, con longitud
de onda de 460 a 590 a condiciones muy variables dependiendo el tipo de extracto que
se utilice, pero si obteniendo mejores resultados comparados con una síntesis con
reductores inorgánicos.
El objetivo de este trabajo es comparar metodología y resultados de la síntesis
tradicional y la síntesis verde; se analizan las propiedades ópticas de todas las muestras
por espectroscopia de absorción molecular ultravioleta visible (UV-VIS).
VIRIDIANA PÉREZ LÓPEZ Página I
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Para ambas síntesis se utilizó ácido tetracloroaurico como precursor dando una banda
de absorción en 304 nm; como reductores para química tradicional el tartrato de sodio
y potasio y el ácido ascórbico, dando una banda de absorción en 293 nm y 264 nm
respectivamente y como reductores para química verde la uva y la sábila, dando una
banda de absorción en 270 y 264 respectivamente. Las soluciones coloidales de las
nanopartículas de oro obtenidas por ambas síntesis (tradicional y verde) y con variación
en tiempos de reacción y volúmenes de precursor y reductores dan como resultado
bandas de absorción en un intervalo de longitud de onda de 523 a 536 nm que registran
un pH entre 2.9 y 4.7.
El compuesto principal en la síntesis verde es el ácido ascórbico y se cuantifica en los
reductores orgánicos naturales por curva de calibración en UV-VIS dando para el aloe
𝑚𝑔 𝑚𝑔
vera 1,445 y para la uva morada 710 y para conocer los grupos funcionales de
𝐿 𝐿
los reductores orgánicos se empleó la espectroscopia de infrarrojo por transformadas
de Fourier (FT-IR) donde se observan bandas en la región 3207, 2931.6, 2542.5, 2159.2,
2030.4, 1975.8, 1617.7, 1419.4, 1310.2, 1262.4 y 1016.6 𝑐𝑚−1para la uva y 3327.52, 2924.5,
2104.6, 1632.07, 419, 1370, 1321.3, 1244.2, 1102.1 y 1018.7 𝑐𝑚−1 para el aloe vera,
pertenecientes a los grupos funcionales: 𝑂 − 𝐻, 𝐶 = 𝑂, 𝐶 − 𝐻, 𝐶 − 𝑂 − 𝐻.
El tamaño y la morfología de las nanopartículas de oro, se determinó por microscopia
electrónica de transmisión (TEM) donde se observó un intervalo de tamaño de 10 a 27
nm para las AuNP´s sintetizadas con tartrato de sodio y potasio; para la uva de 3 a 14
nm y para el aloe vera de 5 a 19 nm.
Con esto concluimos que se logró sintetizar nanopartículas de oro mediante química
verde, obteniendo soluciones coloidales de la uva y el aloe vera, con resultados muy
similares en el espectro de absorción e incluso mejor definidas que las nanopartículas
de oro sintetizadas con las soluciones inorgánicas de tartrato de sodio y potasio
corroborado por la respuesta plasmónica de las nanopartículas de oro mediante UV-
VIS.
VIRIDIANA PÉREZ LÓPEZ Página II
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En cuanto a los reductores orgánicos, la extracción del agente activo (ácido ascórbico)
del aloe vera y la uva se pudo cuantificar e identificar los grupos funcionales por FT-IR.
La distribución de las nanopartículas de oro que se observan en las micrografías por
TEM es muy semejante entre las diferentes soluciones coloidales de nanopartículas de
oro lo que nos indica que los tamaños y la alta homogeneidad son aceptables para las
distintas aplicaciones de las nanopartículas de oro en diferentes campos.
VIRIDIANA PÉREZ LÓPEZ Página III
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Abstract
As we already know in the 21st century, nanoscience and nanotechnology are presented
as a new area of research in the study of materials, where diverse branches of knowledge
converge that allow the study of unprecedented phenomena that occur at the atomic
and molecular level. [Serena, 2005]. Now we add the green chemistry that has developed
in recent years; the mission of green chemistry is "to promote the development and use
of innovative chemical technologies that reduce or eliminate the use or generation of
harmful substances in the design, manufacture and use of chemical products" [Meléndez,
et. al., 2008].
A synthesis has been developed to obtain metallic particles with a nanometric scale, such
as the oxidation-reduction reactions of tetrachloroauric acid in the presence of inorganic
reducers, each result with physicochemical properties, shapes, sizes and very varied
characteristics; the most used reductants are sodium and potassium tartrate [Tovar, 2016],
trisodium citrate [Chetwani, 2015] and sodium borohydride [Corzo, 2012]; Among those that
appear nanoparticles of 33 to 35 nanometers, with wavelength between 540 and 550
nanometers, colloidal solutions with a pH of 5. The green synthesis has been developed
with various extracts such as grape must [De Lamo, 2015], aloe vera [Quilantan, et. al., 2017],
Geranium [Belmares, et. al., 2013], Nopal [Rico, et. al., 2010] and seaweed [Colin, 2017] to say
some, obtaining gold nanoparticles from 30 to 40 nm, with wavelength from 460 to 590
to very variable conditions, it has to do with the type of extract that is used in the
reaction, but it is a good result if we compare it with the organic reducers.
The objective of this work is to compare results of the traditional synthesis and the green
synthesis; analyze the optical properties of all the samples by ultraviolet visible molecular
absorption spectroscopy (UV-VIS). For information on how to determine
tetrachloroauric acid as a precursor that gives an absorption band at 304 nm; as
inorganic reducers Sodium and potassium tartrate and ascorbic acid, giving an
absorption band at 293 nm and 264 nm.
VIRIDIANA PÉREZ LÓPEZ Página IV
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
The colloidal solutions of the gold nanoparticles are published by means of the green
synthesis of a wavelength of 523 to 536 nm that register a pH between 2.9 and 4.7.
The main compound in the green synthesis is ascorbic acid and is quantified in the
𝑚𝑔
organic reducers by UV-VIS calibration curve for aloe Vera 1,445 and for the purple
𝐿
𝑚𝑔
grape 710 and to know the functional groups of The organic reducers is carried out
𝐿
by infrared spectroscopy by Fourier Transforms (FT-IR) where bands are observed in the
region 3207, 2931.6, 2542.5, 2159.2, 2030.4, 1975.8, 1617.7, 1419.4, 1310.2, 1262.4 y 1016.6
𝑐𝑚−1 for the grape and 3327.52, 2924.5, 2104.6, 1632.07, 419, 1370, 1321.3, 1244.2, 1102.1
y 1018.7 𝑐𝑚−1 for aloe vera, belonging to the functional groups: 𝑂 − 𝐻, 𝐶 = 𝑂, 𝐶 −
𝐻, 𝐶 − 𝑂 − 𝐻.
The size and morphology of gold nanoparticles is carried out by transmission electron
microscopy (TEM) where a size range of 27 nm is observed for sodium and potassium
tartrate, for the grape of 3 a 14 nm and for aloe Vera of 5 a 19nm.
With this we conclude that gold nanoparticles are synthesized by green chemistry,
obtaining colloidal solutions of the grape and aloe Vera, with very similar results in the
absorption spectrum and even better definitions of the gold nanoparticles synthesized
with the inorganic solutions of Tartrate sodium and potassium corroborated by the
plasmonic response of gold nanoparticles by UV-VIS. As for the organic reducers, the
extraction of the active agent (ascorbic acid) from the aloe Vera and the grape can be
quantified and the functional groups identified by FT-IR. The distribution of the gold
nanoparticles observed in the TEM micrographs are very similar in the different solutions
of the gold nanoparticles in which it is indicated that the sizes and the high homogeneity
are acceptable for the different applications of the gold nanoparticles in different fields.
VIRIDIANA PÉREZ LÓPEZ Página V
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Introducción
El término “nanotecnología” fue usado por primera vez en 1974 por Norio Taniguchi, un
investigador de la Universidad de Tokio, quien señalaba así la capacidad de manejar
materiales a nivel manométrico, en un artículo publicado con el siguiente título:
“Nanotecnología consiste en el procedimiento de separación, consolidación y
deformación de materiales átomo por átomo o molécula por molécula”.
Durante ese año de 1974 la nanotecnología comenzó a crecer con fuerza y condujo a
los científicos más optimistas a trabajar con empeño en distintos temas. [Quintili, 2012]
En el siglo XXI las nanotecnologías tendrán un fuerte impacto en la vida humana, no fue
importante como el que tuvieron en el siglo XX los antibióticos, los circuitos integrados,
la microelectrónica y los polímeros hechos por el hombre.
La nanotecnología representa la revolución tecnológica del siglo XXI, por lo que México
debe estar en el avance de los recursos humanos como tecnológicos para hacerle frente.
EU, Japón y la Unión Europea ya se han dado cuenta de la importancia de financiar la
nanociencia y las nanotecnologías, por lo que han creado institutos específicamente
dedicados a la investigación en estas áreas.
Las nanopartículas de metales nobles han atraído la atención de los científicos desde la
antigüedad debido a sus propiedades ópticas únicas dependientes de la forma y el
tamaño de las mismas. Los colores brillantes de las nanopartículas de 𝐴𝑔, 𝐴𝑢 𝑦 𝐶𝑢 fueron
utilizados por los romanos en obras de arte decorativas. [De Lamo, 2015] El oro es un metal
químicamente inerte y normalmente se considera un catalizador pobre. Ha sido uno de
los materiales más preciados para el hombre desde la antigüedad por sus excelentes
propiedades, entre las que destaca su hermoso color y brillo, su maleabilidad y su
estabilidad química.
VIRIDIANA PÉREZ LÓPEZ Página VI
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En las últimas décadas, el interés por este material se ha incrementado al encontrar que
el oro en forma de nanopartículas presenta fenómenos físicos nuevos que incrementan
su potencial tecnológico. [Haza et. al., 2013].
Las partículas de oro han despertado gran interés en los sectores, biomédico y
alimentario. Por tanto, se cree que la exposición humana a las nanopartículas de oro
aumentará considerablemente en los próximos años, pudiendo tener esto repercusiones
sobre la salud. Actualmente ya se utilizan algunos materiales nanoestructurados en
cosméticos, arcillas, recubrimientos, pinturas y herramientas de corte. Otra aplicación
que también se investiga es la de los nanocatalizadores que ya se usan ampliamente en
las industrias química, petroquímica, farmacéutica, etc. [Luckie et. al., 2013].
Las nanopartículas monometálicas y bimetálicas pueden prepararse mediante diversas
vías, tanto métodos físicos, químicos y biológicos. Muchos métodos de preparación
coloidal de nanopartículas se han desarrollado para obtener partículas metálicas a escala
nanométrica, como la reducción directa en solución acuosa. También se utilizan agentes
reductores como: citrato de sodio, borohidruro de sodio, tartrato de sodio y potasio y
cada uno de ellos se utiliza para preparar nanopartículas con propiedades
fisicoquímicas, formas, tamaños y características estructurales muy variadas.
La síntesis de nanopartículas de oro que emplearemos en este trabajo es mediante
reacciones de óxido-reducción a temperatura de ebullición, partiendo de soluciones
diluidas de ácido tetracloraurico como precursor, en presencia de reductores orgánicos,
como lo es el tartrato de sodio y potasio y el ácido ascórbico.
El método de reducción de complejos metálicos, como el ácido tetracloroaurico en
soluciones diluidas es, en general, el método de síntesis de dispersiones metálicas
coloidales más empleado.
VIRIDIANA PÉREZ LÓPEZ Página VII
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
De unos años a la fecha la conciencia ambientalista ha permeado en diversas áreas de
investigación, explorando métodos de síntesis de nanopartículas, amigables con el
medio ambiente.
La síntesis por química verde de nanopartículas está basada en la reducción de
materiales mediante especies naturales con poder antioxidante en lugar de reductores
químicos como el citrato de sodio, en el presente trabajo se sintetizan nanopartículas
de oro utilizando agentes reductores orgánicos como el aloe vera y la uva,
comprobando así los beneficios que genera utilizar alternativas innovadoras, de igual
manera se cuantifica el agente activo presente en estos reductores orgánicos, con el fin
de verificar su presencia en la reacción oxido-reducción.
VIRIDIANA PÉREZ LÓPEZ Página VIII
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Objetivo general
Sintetizar nanopartículas de oro utilizando agentes reductores de tipo orgánicos
obtenidos de frutos y plantas y así comparar la obtención de nanopartículas de oro por
la síntesis química tradicional y la síntesis por química verde.
Objetivos específicos
Cuantificar el contenido de ácido ascórbico en los extractos orgánicos de uva y
aloe vera mediante espectroscopia de absorción molecular ultravioleta visible.
Determinar grupos funcionales de los agentes reductores orgánicos naturales
utilizados, mediante espectroscopia de absorción infrarroja.
Comparar y conocer las condiciones de síntesis más estables entre la química
tradicional y la química verde para obtener nanopartículas de oro.
Caracterizar las nanopartículas de oro obtenidas con reductores orgánicos e
inorgánicos mediante espectroscopia de absorción molecular ultravioleta y por
microscopia electrónica de transmisión.
VIRIDIANA PÉREZ LÓPEZ Página IX
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Justificación
Actualmente los tóxicos peligrosos y la industrial se han visto juzgados por la gran
contaminación que generan, residuos principalmente durante los diversos procesos son
los que más que afectan al medio ambiente, contaminación del suelo, el agua y aire.
La síntesis tradicional de nanopartículas de oro en su sistema utiliza reactivos
inorgánicos como reductores que por sí solos son agresivos con el medio ambiente y
las condiciones de reacción son más restringidas y con tiempos de reacción largos,
también al momento de centrifugar la solución de nanopartículas en una etapa más
avanzada les queda la parte liquida que no puede desecharse tan fácilmente. La síntesis
por química verde de nanopartículas de oro es una innovación ecológica que
principalmente busca utilizar reductores orgánicos naturales para evitar tantos
contaminantes durante y después de la reacción, ahorrar tiempo de reacción, así como
obtener mayor seguridad en condiciones de síntesis como lo es la temperatura y lograr
tamaños de nanopartículas estables que servirán para nuevos estudios de campo de
aplicación. Se busca también reducir costos, ya que las soluciones precursoras son muy
caras y así se logra utilizar equipo y material de laboratorio más convencional y
reductores orgánicos que nos generen un ahorro.
Las nanopartículas de oro tienen una gran gama de aplicaciones, debido a que dado el
tamaño de dichas partículas varía sus propiedades ya sea óptica, magnética, eléctrica,
química o morfológica. Entre las aplicaciones destacan muchas, la detección de drogas,
explosivos, gases contaminantes, donde el sistema encuentra una sola molécula “Diana”
entre 10,000 billones de moléculas de agua. Otra muy especial en la rama biomédica,
donde dichas partículas detectan células cancerígenas a cierto tamaño de diámetro, que
le permite diferenciar células enfermas y sanas, con el objetivo de trasportar el
medicamento antitumoral a las células malignas y esté actué con mayor eficacia y menos
efecto adverso; esto resulta útil para la detección y tratamiento de esta enfermedad.
VIRIDIANA PÉREZ LÓPEZ Página X
CAPÍTULO I. GENERALIDADES DE LAS NANOPARTÍCULAS
DE ORO
En el presente capitulo se conocerán aspectos importantes sobre la nanociencia y la
nanotecnología, dando lugar a diversos estudios de las nanopartículas de oro para
importantes aplicaciones en el avance tecnológico.
Se abarcan temas de suma importancia para comprender la síntesis verde de
nanopartículas de oro, desde la síntesis tradicional con agentes reductores orgánicos
sintetizados y la relación de los agentes reductores orgánicos naturales en la
composición química del aloe vera y la uva.
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.1. La nanociencia y la nanotecnología
La nanociencia y la nanotecnología son dos relativamente, recientes disciplinas
definidas en la escala de longitud, donde científicos e ingenieros de múltiples campos
descubren fascinantes fenómenos y aplicaciones y nos proveen con nuevas y
exquisitas herramientas para diseñar novedosos materiales y componentes en la
electrónica, avances fundamentales y aplicaciones en la física, la química, la biología
molecular, la medicina, el medio ambiente, las industrias químicas, las farmacéuticas,
etc. [Mendoza, et. al., 2007].
En términos sencillos, nano es un prefijo griego que significa “enano”. La nanociencia y
nanotecnología se refiere al control y manipulación de estructuras naturales y/o
artificiales a escala nanométrica, es decir, un nanómetro 1𝑛𝑚 = 10−9 𝑚, es más o
menos la distancia de un extremo al otro de una línea de cinco átomos vecinos en un
sólido normal. Para dimensionar lo anterior; una batería de 1𝜇𝑚 mide 1000 𝑛𝑚; un
grano de polen de nopal 80 𝜇𝑚 equivalente a 80,000 𝑛𝑚 de diámetro y un cabello
humano tiene 75,000 𝑛𝑚 de diámetro. (Figura I.1) [Zavaleta et. al., 2017].
Para ser más precisos, el prefijo “nano” se refiere a la posibilidad de conocer los
fundamentos y propiedades de objetos (Nanociencia) y diseñar objetos o dispositivos
con funciones específicas (Nanotecnología) cuyas dimensiones son de unos pocos
nanómetros.
La importancia de la nanotecnología radica en que en el mundo nanométrico, los
materiales pueden adquirir o realzar propiedades diferentes a las que tienen a escala
macroscópica. Actualmente ya se encuentran algunas aplicaciones prácticas de la
nanotecnología y se prevé que habrá muchas más, por lo cual es necesario evaluar el
impacto que tendrían; los países desarrollados ya cuentan con programas para
financiar investigaciones en este campo y, recientemente, México y otros países
latinoamericanos han hecho lo propio. [Serena, 2005].
VIRIDIANA PÉREZ LÓPEZ Página 1
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.1. Comparación de unidades de longitud. [Zavaleta et. al., 2017].
VIRIDIANA PÉREZ LÓPEZ Página 2
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.1.1. Antecedentes históricos
La nanotecnología y nanociencia existen porque hace medio siglo que los cuánticos
hicieron a un lado los conceptos de la física clásica y crearon la física cuántica, donde
los átomos fueron desnudados hasta entender el funcionamiento del núcleo de los
electrones y los fotones. De esta manera descubrimos, que ellos son los responsables
principales, donde todo comienza en términos de energía, dando lugar a la creación
de una vida que no se puede ver a simple vista, en principio.
Las referencias iniciales a la nanotecnología fueron presentadas en 1959 por el físico
norteamericano Richard Feynmann en una conferencia titulada: There’s Plenty of
Room at the Bottom, en la cual vislumbró la posibilidad de manipular materiales a
escala atómica y molecular:
[...] Las leyes de la física, hasta donde yo puedo comprender, no nos prohíben la
posibilidad de manipular la naturaleza átomo por átomo... no es un intento de violar
ninguna ley [...] pero en la práctica, no se ha hecho porque somos muy grandes [...] los
problemas de la química y la biología pueden ser en gran parte resueltos si nuestra
habilidad para ver lo que estamos haciendo y para hacer cosas a nivel atómico
finalmente es desarrollada [...] un desarrollo el cual creo que finalmente no puede ser
evitado [...]
El término “nanotecnología” fue usado por primera vez en 1974 por Norio Taniguchi,
un investigador de la Universidad de Tokio, quien señalaba así la capacidad de
manejar materiales a nivel nanométrico, en un artículo publicado con el siguiente
título: “Nanotecnología consiste en el procedimiento de separación, consolidación y
deformación de materiales átomo por átomo o molécula por molécula”.
Durante ese año de 1974 la nanotecnología comenzó a crecer con fuerza y condujo a
los científicos más optimistas a trabajar con empeño en distintos temas. [Quintili, 2012].
VIRIDIANA PÉREZ LÓPEZ Página 3
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Ya en los primeros años de la década del 80´s hubo una evolución significativa en la
nanociencia. En 1985 los Profesores Kroto y Smalley, cuando estaban realizando
experimentos en los que se trataba de convertir carbono gaseoso en partículas (hollín),
fenómeno que se produce en las estrellas, encontraron nuevas estructuras estables de
las cuales la más abundante fue una molécula de fórmula 𝐶60 (Carbono sesenta), la
cual constituye una nueva forma de carbono. La estructura del 𝐶60 es similar a la de
una pelota de fútbol (de ahí el nombre de futbolanos o buckybolas como también se
les conoce) (Figura I.2.).
Figura I.2. Estructura del 𝐶60 . [Zavaleta et. al., 2017].
En 1991, Sumio Lijima descubrió nanotubos de carbón de 1 nm de diámetro a los
cuales llamo fullerenos (en honor del arquitecto Buckminster Fuller).
Los nanotubos de carbón son las fibras más fuertes que se conocen, un solo nanotubo
perfecto es de 10 a 100 veces más fuerte que el acero y posee propiedades físicas y
químicas antioxidantes muy interesantes. El grafeno es una lámina formada por
átomos de carbono con un arreglo de “panal de abeja”, mientras que el nanotubo es
una lámina de grafeno enrollada en forma de cilindro. (Figura I.3.).
VIRIDIANA PÉREZ LÓPEZ Página 4
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
A)
B)
Figura I.3. Estructuras A) Grafeno, B) Nanotubo. [Zavaleta, et. al. 2017].
El ser humano, ha usado las “nanotecnologías” durante siglos, por ejemplo, las
nanopartículas de oro y plata, se han utilizado como pigmentos colorantes para
cristales desde el siglo X.D.C. Dependiendo de su tamaño, las nanopartículas pueden
parecer rojos, azules o doradas. El reto de los químicos antiguos era lograr que todas
las nanopartículas fueran del mismo tamaño, lo cual, aún, constituye un desafío para
los científicos modernos. [Serena, 2005].
La nanociencia y la nanotecnología, abren un abanico de innumerables posibilidades,
para el crecimiento de las áreas tecnológicas, científicas y económicas de cualquier
país que quiera crecer.
I.1.2 Impacto social de la nanotecnología
En el siglo XXI las nanotecnologías tendrán un fuerte impacto en la vida humana, al
menos tan importante como el que tuvieron en el siglo XX los antibióticos, los circuitos
integrados, la microelectrónica y los polímeros hechos por el hombre.
Existen algunas aplicaciones de las nanotecnologías que es necesario evaluar el
impacto que tendrán en la sociedad puesto que en la nanotecnología convergen
varias disciplinas, es previsible que su efecto se perciba en muchos y en variados
ampos, desde la ciencia de materiales hasta la electrónica, desde la computación hasta
la medicina.
VIRIDIANA PÉREZ LÓPEZ Página 5
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En la ciencia de los materiales habrá uno de los mayores impactos debido a que son
indispensables para fabricar objetos útiles en la vida humana que siempre han tenido
un alto valor social y económico, de lo que son ejemplos el acero y los plásticos. Las
propiedades de los materiales nanoestructurados están determinadas por su
estructura a escalas micro y nanométrica, por lo que una de las claves para desarrollar
materiales de nueva generación es la habilidad de controlar su estructura a escalas
cada vez más pequeñas. [Cardeño et. al. 2014].
De igual modo, en los campos de la electrónica, la optoelectrónica y las tecnologías de
la información y comunicaciones las nanotecnologías comienzan a jugar un papel en
la fabricación de chips para computadora y en dispositivos para almacenamiento de
datos.
En el futuro próximo también habrá microprocesadores nanoestructurados, métodos
de comunicación en bandas diez veces más anchas que las actuales, sistema de
almacenamiento informativo con dimensiones cada vez más reducidas y capacidades
mil veces superiores; también se vislumbran aplicaciones en sistemas integrados de
nanosensores.
En cuanto a la medicina, el diagnóstico de enfermedades y el suministro de fármacos
se investigan intensamente. Dado que en estas áreas es indispensable realizar
exámenes y procedimientos de validación rigurosos, el avance no será evidente hasta
dentro de 10 años aproximadamente; se puede prever que para entonces habrá
algunas aplicaciones como el uso de proteínas, ADN y biopolímeros en biosensores.
Actualmente está en fase de experimentación el uso de nanopartículas para curar
enfermedades genéticas como la fibrosis quística o cística. Y en la misma situación se
encuentran las nanopartículas magnéticas que permitirían posicionar fármacos en
sitios específicos mediante sistemas de campos magnéticos externos.
VIRIDIANA PÉREZ LÓPEZ Página 6
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Hasta donde se ha visto, la nanotecnología traerá grandes beneficios a la vida
humana, pero se necesita revisar los efectos negativos que puedan haber; las
propiedades especiales que poseen los dispositivos nanométricos y que son las que se
intenta explotar (alta reactividad superficial, habilidad de cruzar membranas celulares,
etc.). Tal vez causen riesgos para la salud y el medio ambiente. Algunos científicos han
expresado su preocupación acerca de los efectos a largo plazo asociados con las
aplicaciones médicas de las nanotecnologías y de si los materiales nanoestructurados
serían biodegradables. [Mendoza, et. al., 2007].
I.1.3. La nanotecnología en México y en el mundo
A lo largo de la última década la Nanociencia y la Nanotecnología han pasado de ser
unas ramas científico-tecnológicas emergentes, restringidas al ámbito de la
investigación y cargadas de espectaculares promesas, a convertirse en unas de las
principales líneas temáticas de la investigación que se desarrolla en los países más
avanzados. Además, la nanotecnología se ha convertido en un tema de impacto social,
con grandes repercusiones mediáticas, a pesar de que muchos de los frutos
prometidos se esperan a medio o largo plazo. Como ejemplo basta mencionar que el
término "nanotechnology" aparece citado en el buscador "Google" más de cuarenta y
cinco millones de veces, o la gran cantidad de referencias a este tema que aparecen
en periódicos o revistas generalistas. [Correia, et. al., 2006].
Esta transición se debe al impulso que desde los gobiernos de los E.U, Japón, Reino
Unido, Alemania, Francia, etc., y de la Comisión Europea, se ha dado a las
nanotecnologías como elemento clave que permitirá mantener a medio y largo plazo
la competitividad de las empresas e industrias del denominado primer mundo.
Esa competitividad se basará en la generación de una era de nuevos conocimientos,
que se transformarán en dispositivos, materiales, productos, e incidirán de forma
significativa en nuestra calidad de vida. Esta era de conocimientos estará
VIRIDIANA PÉREZ LÓPEZ Página 7
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
fundamentada en los avances en las Tecnologías de la Información y de las
Comunicaciones, la Biotecnología, la Nanotecnología, las Neurociencias, las Ciencias
Medioambientales, etc. [Correia, et. al., 2006].
Desde el desarrollo del primer microscopio electrónico de transmisión (TEM,
Transmission Electron Microscope) en 1931 por W. Knoll y E. Ruska, y del primer
microscopio electrónico de barrido (SEM, Scanning Electron Microscope) en 1937 por
M. Von Ardenne hasta nuestros días, el hombre ha sido capaz de seguir
sumergiéndose más y más en la búsqueda de lo pequeño usando estas refinadas
herramientas.
Hoy en día el poder de resolución logrado con un microscopio de transmisión es de
unas pocas décimas de nanómetro, lo que sin duda permite afirmar que la limitación
de adentrarse en la nanoescala como observador ha desaparecido. [Serena, 2005].
La nanotecnología representa la revolución tecnológica del siglo XXI, por lo que
México debe estar a la vanguardia tanto en recursos humanos como tecnológicos
para hacerle frente.
EU, Japón y la Unión Europea ya se han dado cuenta de la importancia de financiar la
nanociencia y las nanotecnologías, por lo que han creado institutos específicamente
dedicados a la investigación en estas áreas.
En México existen 17 centros académicos que realizan investigación en nanociencia y
nanotecnologías, principalmente en nuevas estructuras, nanopartículas, nanopelículas
y polímeros nanoestructurados.
En el periodo 19982002 el presupuesto destinado por el CONACYT para investigación
en nanotecnologías fue de 7.4 millones de pesos; en 2003 el fondo total para 19
instituciones fue de 12.5 millones de pesos.
VIRIDIANA PÉREZ LÓPEZ Página 8
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La Secretaria de Investigación y Posgrado (SIP) en el Instituto Politécnico Nacional
designa proyectos multidisciplinarios y transdiciplinarios de investigación en
nanociencia. En octubre del 2009 se inauguró el Centro de Nanociencias y Micro y
Nanotecnologías por propuesta de la ESFM y ESIME y diversos investigadores de
diferentes Unidades académicas, coordinados por la SIP se crea el Centro con
laboratorios de caracterización y MEMS. [IPN, 2018].
En 2002, por iniciativa de investigadores del Instituto de Física de la UNAM, se fundó la
Red de Grupos de Investigación en Nanociencia (REGINA), cuyo objetivo es promover
la colaboración multidisciplinaria para generar proyectos de investigación en
nanociencia, optimizando el uso de recursos humanos y materiales. [Mendoza, et. al.,
2007].
I.2. Nanomateriales
Se utiliza el término nanomateriales o bien materiales nanoestructurados para referirse
a aquellos materiales en los cuales al menos una de sus dimensiones cae en la escala
nanométrica.
Los nanomateriales son interesantes debido a que tienen propiedades
fundamentalmente diferentes al material en escala mayo, debido a una mayor relación
de área de superficie/volumen. [Zavaleta, et. al., 2017].
Las nanoestructuras de formas esféricas e isodiametricas pueden agruparse en seis
familias con características particulares cada familia. (Figura I.4.).
VIRIDIANA PÉREZ LÓPEZ Página 9
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Nanoesferas y nanotubos carbono.
Están formados solo de atomos de carbono con un arreglo en panal
(Hexágonos y pentágonos) y reciben el nombre de fulleros, son muy
ligeros, poseen alta dureza, elasticidad y conductividad eléctrica.
Nanoparticulas sólidas.
Pueden estar formadas de un solo elemento, como el 𝐴𝑢 o la
𝐴𝑔, o de algun compuesto reactivo como 𝑇𝑖𝑂2 , 𝐹𝑒𝑂, 𝐴𝐿2 𝑂3 ,
etc.
Nanopartículas core-shell.
Son nanopartículas que poseen un núcleo con propiedades
físicas o químicas diferentes a la cubierta. Ëstas pueden
funcionalizarse con moleculas biológicas.
Dendrímeros.
Polímeros con numerosas ramas de dimensiones
nanométricas, con funciones químicas especificas.
Nanocápsulas.
Reservorio o cápsula polimérica, conteniendo el principio o
material activo en un nucleo sólido, líquido o bien adsorbido en
la pared polimérica de la nanocápsula.
Nanoesferas.
Esferas matriciales formadas lípidos o polímeros sintéticos, cuyo principio
activo se encuentra disperso en la matriz. La matriz puede albergar
nanodominios.
Figura I.4. Familias de los nanomateriales. [Zavaleta, et. al., 2017].
VIRIDIANA PÉREZ LÓPEZ Página 10
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.3. Las nanopartículas
Son consideradas como nanopartículas a aquellas partículas de 20 a 30 nm, se definen
como agregados aislados de átomos rodeados de una cápsula protectora o
estabilizadora que evita su aglomeración. Donde las propiedades físicas de los
materiales sólidos cambian drásticamente.
Por otro lado, las partículas en el intervalo de los tres dígitos de nanómetros, es decir,
de 1 nm a 999 nm podrían ser llamadas nanopartículas, sin embargo, el intervalo de
partículas de 1 a 100 nm generalmente es la definición más aceptada por la comunidad
científica.
Las nanopartículas especialmente, han existido en el planeta por siglos, algunos
ejemplos son dentro del humo o de bacterias. [Wing, 2017].
Las nanopartículas tienen una relación área de la superficie/volumen (masa) muy
elevada, como se puede observar en la figura I.5. Esta elevada área superficial relativa
es la causa de que se manifiesten algunas propiedades novedosas, como:
• Actividades catalíticas de nanopartículas de metales nobles.
• Interacción con microorganismos.
• Reducción de los puntos de fusión y de ebullición.
• Súper difusión.
• Mecánicas: dureza, rigidez, flexibilidad, adherencia, fricción, resistencia a
tracción y durabilidad elevadas, con una menor densidad.
• Magnéticas (súper magnetismo)
• Efecto de auto limpiado.
VIRIDIANA PÉREZ LÓPEZ Página 11
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.5. Crecimiento de la superficie. [Wing, 2017].
I.4. Las nanopartículas metálicas
Las nanopartículas más estudiadas son aquellas formadas por materiales metálicos
(como el Au), semiconductores (como los halogenuros de cadmio, 𝐺𝑎𝐴𝑠) o aislantes
(como el 𝐹𝑒𝑂 o de 𝑇𝑖𝑂2) [Rodríguez, 2012].
Los nanoclústeres son tipos de nanopartículas metálicas formados por unos pocos
aproximadamente cientos de átomos, cuya propiedad fundamental es la
fotoluminiscencia. Actualmente no se ha descrito un mecanismo general para explicar
esta característica de los nanoclústeres pero estas tienen un gran interés sobre todo en
el desarrollo de nuevas tecnologías. [Shang, et. al., 2011].
Las nanopartículas de metales nobles han atraído la atención de los científicos desde
la antigüedad debido a sus propiedades ópticas únicas dependientes de la forma y el
tamaño de las mismas. Los colores brillantes de las nanopartículas de
𝐴𝑔, 𝐴𝑢 𝑦 𝐶𝑢 fueron utilizados por los romanos en obras de arte decorativas tan
antiguas como la copa de Lycurgo mostrada en la figura I.6, con nanopartículas de oro
y planta, muestra color diferente dependiendo de si la luz pasa o no a través.
VIRIDIANA PÉREZ LÓPEZ Página 12
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.6. Copa Romana de Lycurgo. [De Lamo, 2015].
Pero no fue hasta 100 años después de que Faraday realizará el primer experimento
en el que sintetizo coloides de 𝐴𝑢 puro por reducción química de una solución de
𝐴𝑢𝐶𝑙3. De entre todos los metales nobles, el oro ha sobresalido por sus interesantes
propiedades ópticas, magnéticas, eléctricas, catalíticas y antimicrobianas al aplicarlas
en distintas áreas tales como en farmacología, medicina, industria alimentaria,
tecnología, biología, etc.
I.4.1. Propiedades de las nanopartículas metálicas
Aparecen estos fenómenos cuando las dimensiones de los materiales se reducen a
escala nanométrica.
I.4.1.1 Propiedades Físicas
El punto de fusión disminuye, generalmente, como consecuencia de su gran área
superficial específica y el mayor número de átomos en la superficie; esto afecta al
comportamiento termodinámico del volumen de la nanopartícula.
VIRIDIANA PÉREZ LÓPEZ Página 13
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Los átomos de la superficie necesitan menos energía para moverse porque hay
menos átomos en el interior de la nanopartícula y necesitan menor energía para
vencer las fuerzas intermoleculares de atracción. [Tehuacanero, et. al., 2013].
Como es sabido, la distancia entre los estados de energía continuos aumenta de
manera inversa a como lo hace el volumen de las partículas, Por lo tanto, el espacio
continuo de bandas que refleja la situación del material masivo, cambia hacia un
conjunto de estados discretos al disminuir el tamaño hasta llegar al régimen
nanométrico, como se muestra en la figura I.7.
Figura I.7. Estados electrónicos. [Tehuacanero, et. al., 2013].
Otras propiedades físicas de las nanopartículas son:
• Súper paramagnetismo (𝐹𝑒, 𝐶𝑜, 𝑁𝑖).
• Conversión de algunos metales en semiconductores (𝑍𝑛𝑂, 𝑆) algunos
semiconductores se convierten en aislantes.
• Fluidos con propiedades magnéticas (ferrofluidos).
• Fotoluminiscencia efecto cuántico.
• Cambio de las propiedades magnéticas de materiales como: 𝐹𝑒, 𝐶𝑜, 𝑁𝑖, 𝐹𝑒3 𝑂4 ,
en los que varía el momento magnético con el tamaño de la nanopartícula.
• Incremento de la absorción de la radiación solar con la disminución del tamaño
de la nanopartícula.
• Elevada conductividad eléctrica y térmica de algunas nanopartículas, como la
𝐴𝑔; baja conductividad eléctrica y térmica de otras nanopartículas como el 𝐴𝑢.
VIRIDIANA PÉREZ LÓPEZ Página 14
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.4.1.2. Propiedades ópticas.
Las nanopartículas de los metales nobles, también conocidas como nanopartículas
plasmonicas se caracterizan por la Resonancia del Plasmón Superficial (SPR, Surface
Plasmón Resonance) causante de las propiedades ópticas y fototérmicas de las
nanopartículas de oro.
El SPR consiste en una oscilación colectiva de los electrones de conducción dentro de
las nanopartículas cuando estas son excitadas con luz (radiación electromagnética)
(Figura I.8.). La naturaleza de la banda SPR se puede explicar con base en la teoría de
Mie. [Salicio, 2005].
Figura I.8. Resonancia del Plasmón superficial. [Belmares, et. al., 2013].
Existe gran interés de la comunidad científica en el estudio de las propiedades ópticas
de nanopartículas, esta propiedad que le da color a los vitrales de la edad media.
Esto se debe principalmente a la alta dependencia de esta propiedad con la
morfología y tamaño de la nanopartículas; así como con otros parámetros como el
medio ambiente que las rodea, es decir, con cualquier medio polarizable como el
medio dieléctrico, su interacción con otras partículas y substratos.
VIRIDIANA PÉREZ LÓPEZ Página 15
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La sensibilidad de la respuesta óptica a estos parámetros proporciona una forma fácil,
no destructiva y en tiempo real de investigar diferentes muestras. Como podemos ver
en la figura I.9, el tamaño y la temperatura determinan la morfología de las
nanopartículas de oro, mientras que la morfología y el tamaño determinan el color de
la nanopartículas.
Figura I.9. Mapa de fase de la morfología de nanopartículas de oro en función del tamaño y
temperatura de la muestra. [Volke et. al., 2013].
La forma de la nanopartículas metálica en este caso de la nanopartículas de oro
desempeña un papel crítico en sus posibles aplicaciones tecnológicas. Es conocido que
las nanopartículas de oro que miden el nanómetro (SI) que equivale a unas mil
millonésimas partes de un metro (1 nm = 10−9 m) muestran morfologías que incluye
formas hexaédricas, pentagonales, octaédricas, etc. [Tehuacanero et. al., 2013].
VIRIDIANA PÉREZ LÓPEZ Página 16
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.4.1.2.1. Teoría de MIE
Una buena aproximación para caracterizar los fenómenos de dispersión que se
producen en una partícula esférica, isotrópica y homogénea, iluminada por ondas
planas homogéneas, fue dada por Lorenz (1890) y por Gustav Mie (1908).
De la dispersión y absorción de la luz por partículas pequeñas. Cuando se hace incidir
luz sobre una partícula metálica, su campo electromagnético induce una excitación
colectiva en los electrones de valencia de la partícula, por lo que la partícula a su vez
irradiará radiación electromagnética dando lugar a un proceso de dispersión.
Por otro lado, en el proceso de transferencia de energía de la luz a la partícula, parte
de la energía se disipa en forma de calor. A este proceso se le denomina absorción.
Este método de cálculo, se basa en la descomposición de las ondas electromagnéticas
indecentes dentro y fuera de las esferas dispersoras, en ondas esféricas en término de
funciones armónicas, adaptadas a las condiciones de contorno de la partícula.
El campo total dispersado, en campo lejano, se obtiene sumando un número
suficiente de ondas parciales esféricas, dando como resultado dos soluciones
independientes en función de la excitación paralela y/o perpendicular del campo
incidente.
El campo dispersado, en un punto en el espacio definido por el vector r, en función del
campo incidente y de las características de la partícula, se define respecto a un sistema
de coordenadas esféricas (Figura I.10) con el origen en el centro de la partícula, donde la
onda plana incidente se propaga en la dirección z, con una polarización lineal respecto
al plano x-y. [Rastar, 2013].
VIRIDIANA PÉREZ LÓPEZ Página 17
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.10. Coordenadas utilizadas en la teoría de MIE, respecto al plano de dispersión. [Rastar, 2013].
Para describir teóricamente este problema físico, consideremos las ecuaciones de
Maxwell:
Ecuación de GAUSS de campo eléctrico 𝛻 . 𝐷(𝑟, 𝑡) = 𝜌𝑙 (𝑟, 𝑡) …Ecuación I.1
Ecuación de FARADAY …Ecuación I.2
𝜕𝐵
𝛻𝑥𝐸 = − 𝜕𝑡
Ecuación de GAUSS de campo magnético 𝛻 . 𝐵(𝑟, 𝑡) = 0 …Ecuación I.3
Ecuación de AMPERE 𝛻𝑥𝐻(𝑟, 𝑡) = 𝐽𝐼 (𝑟, 𝑡) + 𝜕𝐷(𝑟, 𝑡)/𝜕𝑡 …Ecuación I.4
Donde:
𝐷 𝑦 𝐸 : Permitividad eléctrica
𝐵 𝑦 𝐻 : Permeabilidad magnética
𝜌𝑙 : Densidad volumétrica de carga eléctrica
𝐽𝐼 : Densidad superficial de corriente
VIRIDIANA PÉREZ LÓPEZ Página 18
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Las condiciones de contorno asociadas a estas ecuaciones son:
𝑛̂ 𝑥 [𝐸2 (𝑟, 𝑡) − 𝐸1 (𝑟, 𝑡)]𝑓𝑟𝑜𝑛𝑡𝑒𝑟𝑎 = 0 …Ecuación I.5
𝑛̂ 𝑥 [𝐻2 (𝑟, 𝑡) − 𝐻1 (𝑟, 𝑡)]𝑓𝑟𝑜𝑛𝑡𝑒𝑟𝑎 = 𝐾1 …Ecuación I.6
𝑛̂. [𝐷2 (𝑟, 𝑡) − 𝐷1 (𝑟, 𝑡)]𝑓𝑟𝑜𝑛𝑡𝑒𝑟𝑎 = 𝜎1 …Ecuación I.7
𝑛̂. [𝐻2 (𝑟, 𝑡) − 𝐻1 (𝑟, 𝑡)]𝑓𝑟𝑜𝑛𝑡𝑒𝑟𝑎 = 0 …Ecuación I.8
Donde:
𝜎1 y 𝐾1 : las densidades de carga y corriente asociadas a las cargas libres de la
superficie frontera 𝑛̂: vector unitario normal a dicha superficie.
De las ecuaciones I.1 a la I.4 se pueden desacoplar dando lugar a ecuaciones de ondas
que describen a la radiación electromagnética en un medio metal. De este modo, los
campos eléctricos y magnéticos de una onda electromagnética plana y
monocromática (con longitud de onda) que se propaga en un medio determinado con
permitividad eléctrica 𝜖 y permeabilidad magnética 𝜇 son soluciones de la ecuación de
onda:
𝛻2𝐸 + 𝑘2𝐸 = 0 y 𝛻2𝐻 + 𝑘2𝐻 = 0 …Ecuación I.9
2𝜋√𝜀𝜇
Donde 𝑘 = ( ) = w√𝜀 𝜇 = w 𝑛 es el número de ondas de la onda en el medio en
7𝜆
cuestión.
En muchos medios, 𝜇 toma un valor cercano a 1 y por tanto. 𝑛 ≈ √𝜀.
En la frontera entre la partícula metálica y el medio en el que se inmersa, tanto 𝜀 cmo
𝜇 cambiaran bruscamente presentando una discontinuidad. En el caso de las
partículas con morfología esférica, las ecuaciones del problema se pueden resolver
analíticamente cuyas soluciones fueron propuestas por primera vez por MIE . [Criado et.
al., 2013].
VIRIDIANA PÉREZ LÓPEZ Página 19
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.4.1.3. Propiedades químicas
Las nanopartículas metálicas manifiestan propiedades químicas muy importantes: el
auto ensamblado y las excepcionales propiedades que pueden tener como
catalizadores.
Su elevada reactividad química es consecuencia de su elevada superficie específica y
del importante número de átomos en la superficie que originan una elevada energía
de superficie de las nanopartículas. [Shang et. al., 2011].
I.4.1.3.1. Fotocatálisis
Un caso particular del comportamiento catalítico de las nanopartículas, es la
fotocatálisis. Cuando la luz tiene una apropiada energía puede mover algún electrón
de la banda de valencia a la banda de conducción de las nanopartículas de 𝑇𝑖𝑂2,
produciéndose pares de electrón-agujero. Se origina un exceso de carga negativa en
la banda de conducción que produce un efecto reductor, aportando electrones a las
moléculas de oxígeno y formándose iones hiperóxido (𝑂2− ) que oxidan los materiales
orgánicos. [Salicio, 2005].
I.4.1.4. Propiedades mecánicas.
Las propiedades mecánicas de las nanopartículas y de los materiales
nanoestructurados cambian con el tamaño; a escala nano métrica se modifica la
estructura atómica de los nanocristales, haciéndose más resistentes y adquiriendo
propiedades mecánicas superiores a las de los macromateriales. Para un determinado
material, a escala nano métrica, se incrementan su dureza y su resistencia, siguiendo,
generalmente, un crecimiento inversamente proporcional a su diámetro. Algunas de
las propiedades mecánicas, más importantes, que pueden experimentar importantes
incrementos son:
VIRIDIANA PÉREZ LÓPEZ Página 20
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
• Límite de cedencia
• Módulo de elasticidad E (hasta un diámetro d ≥ 5 nm)
• Resistencia a tracción
• Tenacidad
• Deformación
• Resistencia a flexión
• Resistencia al impacto
• Resistencia a la fatiga
• Resistencia a la corrosión
I.4.2. Estabilidad y funcionalización de las nanopartículas
Las soluciones coloidales de metales se conocen desde hace mucho tiempo y ahora se
dispone de una gran variedad de técnicas preparativas. Dependiendo de las
condiciones de síntesis, las nanopartículas tienden a aglomerarse lentamente,
eventualmente pierden su carácter disperso y floculan. La eliminación de disolventes
generalmente conduce a la perdida completa de la capacidad de formar una solución
coloidal.
Las nanopartículas metálicas presentan un área superficial muy grande con respecto a
una masa, por lo que tienen un exceso de energía libre superficial en comparación con
su energía de formación, haciéndolas termodinámicamente inestables, Por ello, las
partículas coloidales deben ser estabilizadas tanto cinética como termodinámicamente
por agentes protectores, que son capaces de superar las fuerzas repulsivas
electrostáticas y esféricas.
Las partículas colídales que se encuentran dispersas en un disolvente polar como el
agua, adquieren a menudo una carga superficial debido a la perdida de iones de su
especie o a la ganancia de iones procedentes de la disolución. [Brust et. al., 2014].
VIRIDIANA PÉREZ LÓPEZ Página 21
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.4.2.1. Tipos de estabilización.
La utilización de un agente estabilizante origina una fuerza de repulsión que
contrarresta las fuerzas de Van der Waals que atraen dos partículas a distancias cortas.
La estabilización se puede dar por efectos electrostáticos, por impedimento estérico o
por una combinación de los dos.
a) Estabilización electrostática.
Los compuestos iónicos disueltos en solución pueden causar este tipo de
estabilización. La presencia de iones sobre la superficie de las nanopartículas y
sus respectivos contraiones, producen una doble capa (cada capa tiene una
carga y opuesta a la otra) a su alrededor. Esto genera una repulsión de tipo
electrostático entre las nanopartículas (Figura I.11) y evita la agregación si la
diferencia de potencial en la doble capa es lo suficientemente alta.
Figura I.11. Estabilización electrostática. [Roucoux, 2002].
VIRIDIANA PÉREZ LÓPEZ Página 22
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
b) Estabilización estérica.
La adsorción de moléculas (polímeros, oligomeros, dendrímeros) o la coordinación de
ligandos sobre la superficie de las nanopartículas proporcionan una capa protectora
que evita la agregación (Figura I.12). Cuando dos capas protectoras comienzan a
interpenetrarse se da un aumento local de la concentración de moléculas adsorbidas,
originando una repulsión osmótica ya que el disolvente trata de restablecer el
equilibrio mediante la dilución de las moléculas y separando de este modo las
nanopartículas.
Figura I .12. Estabilización estérica. [Roucoux, 2002].
c) Estabilización electrostérica.
Se puede combinar la estabilización electrostática y la estérica. Los compuestos usados
(agentes tenso activos iónicos) contienen un grupo polar capaz de generar una doble
capa eléctrica y una cadena lipofílica capaz de proporcionar la repulsión estérica (Figura
I.13)
Figura I.13. Estabilización electrostérica. [Roucoux, 2002].
VIRIDIANA PÉREZ LÓPEZ Página 23
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.5. Nanopartículas de Oro
Las nanopartículas de metales nobles se han convertido en uno de los tipos de
nanomateriales más importantes en nanociencia y de la investigación en
nanotecnología.
De entre todos los metales el oro es uno de los más estudiados en nanotecnología. El
oro coloidal se conoce desde la antigüedad, así que la síntesis de nanopartículas de
oro es una de las que se encuentra más avanzada. Sus propiedades ópticas y eléctricas
hacen de estas nanopartículas un buen candidato para numerosas aplicaciones dentro
del campo de la biología o la medicina. [Rodríguez, 2012].
El oro es un metal químicamente inerte y normalmente se considera un catalizador
pobre. Ha sido uno de los materiales más preciados para el hombre desde la
antigüedad por sus excelentes propiedades, entre las que destaca su hermoso color y
brillo, su maleabilidad y su estabilidad química.
En las últimas décadas, el interés por este material se ha incrementado al encontrar
que el oro en forma de nanopartículas presenta fenómenos físicos nuevos que
incrementan su potencial tecnológico. [Haza et. al., 2013].
Las nanopartículas de oro pueden ser producidas en distintos tamaños y formas, y
pueden ser fácilmente funcionalizadas con un amplio abanico de ligandos (anticuerpo,
polímeros, sondas, fármacos, etc.)
VIRIDIANA PÉREZ LÓPEZ Página 24
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.5.1. Características de las nanopartículas de oro.
a) Biocompatibilidad y baja toxicidad.
Se ha demostrado que las características superficiales de las nanopartículas de oro
influyen en su toxicidad. Las nanoestructuras catiónicas presentan mayor toxicidad que
las aniónicas: las nanopartículas aniónicas con núcleo de tamaño 2 nm son
prácticamente no tóxicas mientras que las equivalentes catiónicas son
moderadamente tóxicas encontrándose la toxicidad probablemente relacionada con la
lisis celular (mediada inicialmente por una unión electrostática) dependiente de la
concentración. [Al Qadi et. al., 2009].
b) Facilidad de síntesis y multifuncionalidad.
Las nanopartículas de oro se pueden preparar fácilmente, obteniéndose sistemas
coloidales monodispersos estables con un tamaño entre 1 nm y 150 nm y una
distribución de tamaños bien controlada. Se encuentran distintos tipos de
nanopartículas de oro, preparadas utilizando diversas técnicas, que se diferencian en el
tamaño, la forma y las propiedades físicas. En la Figura I.14 se representan algunos
ejemplos de estas nanopartículas de oro y sus denominaciones: nanoesferas,
nanocilindros, nanocubiertas, nanojaulas, nanopartículas y «SERS».
Figura I.14. Diversas nanoestructuras conteniendo oro. [Al Qadi et. al., 2009].
VIRIDIANA PÉREZ LÓPEZ Página 25
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.5.2 Aplicación de las nanopartículas de oro.
Las partículas de oro han despertado gran interés en los sectores biomédicos y
alimentario. Por tanto, se cree que la exposición humana a las nanopartículas de oro
aumentará considerablemente en los próximos años, pudiendo tener esto
repercusiones sobre la salud. Otra aplicación que también se investiga es la del
nanocatalizador que ya se usa ampliamente en las industrias química, petroquímica,
farmacéutica, etc. (Figura I.15).
Figura I.15. Aplicaciones nanotecnológicas. [Luckie et. al., 2013].
Actualmente ya se utilizan algunos materiales nanoestructurados en cosméticos,
arcillas, recubrimientos, pinturas y herramientas de corte.
VIRIDIANA PÉREZ LÓPEZ Página 26
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Las aplicaciones actuales abarcan los siguientes campos descritos en la tabla I.1.
Tabla I.1. Aplicaciones de las nanopartículas de oro. [Luckie et. al., 2013].
Aplicación Descripción
Medicina Hoy en día, las 𝐴𝑢𝑁𝑃´𝑠 destacan especialmente por sus
propiedades fototerapéuticas. En presencia de luz láser se
activan y desprenden calor, siendo muy útiles en el
tratamiento selectivo de células tumorales; por ello, se han
realizado notables esfuerzos en la investigación y
aplicación de las 𝐴𝑢𝑁𝑃´𝑠 para la detección precoz, el
diagnóstico y tratamiento de cáncer. También pueden
utilizarse en la elaboración de partículas nanoestructuradas
para el trasporte y la vectorización selectiva de fármacos y
macromoléculas terapéuticas, así como terapia genética.
Los materiales sintetizados por la técnica de sol-gel
Aislantes térmicos resultan ser aerogeles. Como estos son porosos y el aire
está atrapado en sus grietas, se pueden usar para el
aislamiento de habitaciones; de esta manera se reduce
drásticamente tanto el calentamiento como el
enfriamiento, por lo que disminuye el consumo de energía,
y simultáneamente la contaminación ambiental.
Producción de Otro campo importante de aplicación de las 𝐴𝑢𝑁𝑃´𝑠 es la
alimentos industria de los alimentos, donde se utilizan como parte
integrante de nano compuestos poliméricos.
Estos se utilizan en la fabricación de envases, con
propiedades antimicrobicas o para incrementar la
resistencia a la abrasión de los envases.
Máquina herramienta. Las herramientas de corte son mucho más duras,
resistentes al desgaste y a la erosión y tienen un mayor
periodo de vida útil.
Cerámicos. Algunos cerámicos pueden ser presionados y sinterizados
VIRIDIANA PÉREZ LÓPEZ Página 27
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
en varias formas a temperaturas significativamente más
bajas para producir objetos sólidos más flexibles; algo que
sería muy difícil, si no imposible, en los mismos cerámicos
convencionales, aún a temperaturas altas.
Óptico y electrónico. La resolución de un televisor o un monitor depende en
gran medida del tamaño de píxel que se compone
esencialmente por materiales llamados “fósforos”, los
píxeles brillan cuando chocan con un torrente de
electrones en el interior de un tubo de rayos catódicos. La
resolución mejora cuando los píxeles, o los fósforos, son
más pequeños.
Imanes de alto La fuerza de un imán aumenta con el incremento del área
potencial. superficial por unidad de volumen. Sus aplicaciones
típicas involucran alternadores para automóviles,
instrumentos analíticos ultrasensibles, motores de barcos,
etc.
Fármacos. Es posible producir nuevos medicamentos en estado sólido
al generarlos en forma de nanopartículas, cuyas altas áreas
superficiales permiten que se solubilicen en la corriente
sanguínea, donde las micro o macropartículas no pueden,
ya que más de un 50 % de las nuevas formulaciones de
medicamentos no se llevan al mercado a causa de los
problemas de solubilidad.
Celdas solares. Las nanopartículas semiconductoras con brechas de
energía dependientes del tamaño son importantes en el
diseño de celdas solares más eficientes, sobre todo para
producción de electricidad e hidrógeno (electrólisis del
agua).
Catalítico. La creciente proporción de átomos superficiales con la
disminución del tamaño de partícula, comparada con los
VIRIDIANA PÉREZ LÓPEZ Página 28
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
metales en condición masiva, hace que las pequeñas
partículas metálicas se conviertan en catalizadores
altamente reactivos.
Sector energético. La nanotecnología es clave en la fabricación de nuevos
tipos de baterías con una duración mucho más
prolongada, en la fotosíntesis artificial para la generación
de energía limpia o en el ahorro energético que supone el
uso de materiales más ligeros y de circuitos más pequeños.
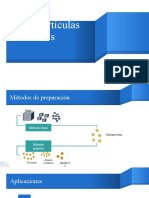
I.6. Síntesis común de obtención de nanopartículas metálicas
Las nanopartículas monometálicas y bimetálicas pueden ser preparadas mediante
diversas vías, tanto métodos físicos, químicos y biológicos.
Existen muchos métodos de preparación coloidal de nanopartículas para obtener
partículas metálicas a escala nanométrica, como la reducción directa en solución
acuosa, o las reacciones de transferencia de fase. [Belmares et. al., 2013].
En la fabricación de nanomateriales se pueden distinguir dos estrategias (Figura I.16):
Las técnicas top-down (de arriba y abajo): consisten en la descomposición de
grandes piezas de material para generar a partir de ellas las nanoestructuras
requeridas. Subdivisión mecánica.
Las técnicas bottom-uno (de abajo arriba) que consiste en el ensamble de
átomos y moléculas individuales para dar nanoestructuras de mayor tamaño.
Método químico.
VIRIDIANA PÉREZ LÓPEZ Página 29
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.16. Técnicas de fabricación de nanomateriales. [Tan et. al., 2007].
La investigación de las propiedades físicas de las nanopartículas requiere: métodos
que posibiliten su fabricación y métodos experimentales de caracterización estructural.
Los métodos de fabricación pueden clasificarse como físicos o químicos. La molienda
mecánica de partículas micrométricas, la nanolitografía o la pulverización catódica
constituyen ejemplos característicos de los métodos físicos.
Sin embargo, recientemente los métodos químicos se vienen utilizando con mayor
frecuencia. [Hernando, 2007].
I.6.1. Técnicas top-down (de arriba y abajo).
Este enfoque puede involucrar la molienda o el desgaste y la volatilización de un
sólido seguido por la condensación de los componentes volatilizados.
Ya no son tan empleados, por la dificultad de obtener tamaños de nanopartículas
estables y pequeños. En la tabla I.2 se muestran algunos ejemplos de los métodos
también llamados métodos físicos.
VIRIDIANA PÉREZ LÓPEZ Página 30
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Tabla I.2. Métodos físicos para obtener nanopartículas metálicas. [Zanella, 2012].
Método Descripción
La evaporación Consiste en el calentamiento hasta la evaporación del
térmica material que se pretende depositar. Se lleva a cabo en una
cámara de vacío en la que se condensa el vapor sobre una
lámina fría requiriendo en todo momento un control preciso
de las condiciones de crecimiento para no producir una
modificación de la morfología de la capa depositada.
El depósito químico Consiste en la descomposición de uno o varios compuestos
en fase vapor (CVD) volátiles, en el interior de una cámara de vacío (reactor), en o
cerca de la superficie de un sólido para dar lugar a la
formación de un material en forma de capa delgada o de
nanopartículas.
La preparación Utiliza un láser pulsado de alta potencia para producir
de clusters gaseosos vapores atómicos metálicos que son acarreados en un gas
inerte y posteriormente son depositados en un óxido
monocristalino u otro sustrato, bajo condiciones de ultra-alto
vacío.
Consiste en que los iones de un material pueden ser
implantados en un sólido, cambiando por tanto las
propiedades físicas y químicas de este último, ya que el ion
La implantación de implantado puede ser de un elemento distinto al que lo
iones compone, también se pueden causar cambios estructurales
en el sólido implantado, puesto que la estructura cristalina
del objetivo puede ser dañada.
La molienda De partículas de tamaño macro o micrométrico, por medio
de molinos de alta eficiencia; las partículas resultantes son
clasificadas por medios físicos, recuperándose las de tamaño
nanométrico. Dado que la molienda enérgica y continua de
VIRIDIANA PÉREZ LÓPEZ Página 31
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
los materiales iniciales puede inferir cambios energéticos en
los sólidos, debido a la acumulación de defectos en situación
de no-equilibrio, lo que puede causar una disminución de las
energías de activación, activando los sólidos para llevar a
cabo reacciones químicas en estado sólido.
I.6.2. Técnicas bottom-uno (de abajo arriba).
Existen diversos métodos que utilizan la aproximación de “abajo hacia arriba” para la
síntesis de nanopartículas, los más empleados son aquellos que utilizan
procedimientos químicos. Por lo general, inician con la reducción de los iones
metálicos a átomos metálicos, seguido por la agregación controlada de estos átomos.
El método químico es el más conveniente para la obtención de nanopartículas
uniformes y pequeñas. En la tabla 1.3 se muestran los métodos químicos.
Tabla I.3. Métodos químicos para obtener nanopartículas metálicas. [Zanella, 2012].
Métodos Descripción
El método coloidal Los coloides son partículas individuales, que son más grandes
que las dimensiones atómicas, pero lo suficientemente
pequeño como para exhibir movimiento browniano. Este
método consiste en disolver una sal del precursor metálico o
del óxido a preparar, un reductor y un estabilizante en una
fase continua o dispersante (un líquido en este caso). Este
último puede jugar el papel de reductor, de estabilizante o
ambos. En principio el tamaño promedio, la distribución de
tamaños y la forma o morfología de las nanopartículas
pueden ser controlados variando la concentración de los
reactantes, del reductor y del estabilizante así como la
naturaleza del medio dispersante.
VIRIDIANA PÉREZ LÓPEZ Página 32
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Reducción La síntesis de nanopartículas metálicas modificando el
fotoquímica y sistema químico por medio de altas energías se asocia con la
radioquímica generación de reductores fuertes altamente activos como
electrones, radicales y especies excitadas. La reducción
fotoquímica (fotolisis) y la radicación-química (radiólisis)
difieren en el nivel de energía utilizado. La síntesis
fotoquímica está caracterizada por energías por debajo de 60
eV, mientras que la radiólisis utiliza energías de 103-104 eV.
Los métodos de reducción fotoquímica y radioquímica tienen
la ventaja sobre el método de reducción química. Debido a la
ausencia de impurezas formadas cuando se usan reductores
químicos, estos métodos producen nanopartículas de alta
pureza. Además, la reducción fotoquímica y radioquímica
permiten producir nanopartículas en condiciones de estado
sólido y a bajas temperaturas
Irradiación con La técnica de irradiación con microondas produce
microondas nanopartículas con una muy baja dispersión de tamaño,
aunque no siempre se logre un control preciso en la
morfología. Las microondas actúan como campos eléctricos
de alta frecuencia, capaces de calentar cualquier material
conteniendo cargas eléctricas como las moléculas polares en
un disolvente o iones conductores en un sólido. Los
solventes polares se calientan y sus componentes
moleculares se ven obligados a girar con el campo y pierden
energía en colisiones.
Utilización de La síntesis de nanopartículas también se ha llevado a cabo
dendrímeros usando micelas, emulsiones y dendrímeros como
nanorreactores que permiten la síntesis de partículas de
forma y tamaño definidos. Esto se logra alterando la
naturaleza de los dendrímeros. Los dendrímeros son
moléculas altamente ramificadas, las que incluyen un núcleo
VIRIDIANA PÉREZ LÓPEZ Página 33
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
central, unidades intermediarias repetitivas y grupos
funcionales terminales. Los dendrímeros representan nuevos
tipos de macromoléculas que combinan el alto peso
molecular y baja viscosidad de sus soluciones con su forma
molecular tridimensional y la presencia de una estructura
espacial. El tamaño de los dendrímeros varía de 2 a 15 nm y
representan nanorreactores naturales.
Método sol-gel El método sol-gel es un proceso químico en fase húmeda
ampliamente utilizado en la ciencia de los materiales. Este
método se utiliza principalmente para la fabricación de
nanomateriales (normalmente un óxido metálico). Se parte
de una solución química o sol que actúa como precursor de
una red integrada ya sea de partículas discretas o de una red
de polímeros. Los precursores típicos del proceso sol-gel son
los alcóxidos metálicos y los cloruros metálicos, que sufren
varias reacciones de hidrólisis y policondensación para formar
una dispersión coloidal, que luego de una polimerización
lenta forma un gel. El método sol-gel ha sido usado en los
últimos años para preparar una amplia variedad de
materiales nanoestructurados. El método es atractivo porque
involucra procesos a baja temperatura. También la alta
pureza y homogeneidad son atribuibles a su forma de
preparación en sistemas multicomponente.
El método de reducción química más extendido es la síntesis coloidal, esta técnica
consiste en la reducción de iones metálicos a átomos cerovalentes que
inmediatamente actúan como centros de nucleación para dar lugar a la formación de
clústers (aglomeración de átomos metálicos) que continúan creciendo a medida que
se siguen agregando más átomos.
VIRIDIANA PÉREZ LÓPEZ Página 34
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Principales ventajas:
• Simple y reproducible
• Obtienen nanopartículas homogéneas
• La estructura, el tamaño y la forma de las partículas pueden ser controladas
variando las condiciones de reacción.
I.7. Obtención de nanopartículas de oro
Se han desarrollado síntesis para obtener partículas metálicas a escala nanométrica,
como la reducción directa en solución acuosa o las reacciones de transferencia de
fase. Se utilizan agentes reductores como: 𝐾𝑁𝑎𝐶4 𝑂6 , 𝑁𝑎𝐻4 , 𝑁2 𝐻4 ,
𝑁𝑎2 𝐶6 𝑂7 , 𝐿𝑖(𝐶2 𝐻5 )3 𝐵𝐻 y cada uno de ellos se utiliza para preparar nanopartículas con
propiedades fisicoquímicas, formas, tamaños y características estructurales muy
variadas.
Además, el método POLIOL ha sido considerado uno de los mejores métodos de
reducción directa porque se pueden preparar por este método nanopartículas muy
pequeñas con un control de la composición y de tamaños de partícula de manera
precisa. Esta técnica no requiere un agente reductor especial porque el mismo
solvente, el etilenglicol realiza esa función directamente. Por otro lado, uno de los
parámetros de proceso importantes es la temperatura y en el caso del método POLIOL
es muy sensible a ésta, porque se ha encontrado que se pueden desestabilizar las
nanopartículas y el agente que modifica la superficie de las mismas el polímero
polivinilpirrolidona (PVP) por la temperatura, la cinética de nucleación y crecimiento de
las nanopartículas también se ve alterada por este efecto. [Belmares et. al., 2013].
VIRIDIANA PÉREZ LÓPEZ Página 35
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La síntesis de nanopartículas de oro que más trataremos por ser el tema de interés es
mediante reacciones de óxido-reducción a temperatura de ebullición, partiendo de
soluciones diluidas de 𝐻𝐴𝑢𝐶𝑙4 como precursor, en presencia de reductores orgánicos,
como 𝐾𝑁𝑎𝐶4 𝑂6 y 𝑁𝑎𝐵𝐻4 .
El método de reducción de complejos metálicos, como el 𝐻𝐴𝑢𝐶𝑙4 en soluciones
diluidas es, en general, el método de síntesis de dispersiones metálicas coloidales más
empleado.
Los diferentes métodos de síntesis de nanocristales de oro en solución acuosa han
sido estudiados desde hace muchísimos años.
En 1857 Michael Faraday publicó un estudio acerca de la preparación y propiedades
del oro coloidal. Desde entonces se desarrolló una gran variedad de métodos de
síntesis de nanopartículas de oro que emplean ácido tetracloroáurico 𝐻𝐴𝑢𝐶𝑙4 como
precursor de oro y 𝑁𝑎3 𝐶6 𝐻5 𝑂7 como agente reductor; reacción llevada a cabo a
ebullición en solución acuosa diluida. [Corzo, 2012].
I.8 La química verde
Uno de los mayores inconvenientes de la química y de la industria es el problema de la
generación de residuos y productos que afectan el medio ambiente. Esto ha
ocasionado que la química tenga una imagen negativa ante la sociedad, ya que en
muchas ocasiones se destacan más los aspectos negativos que los positivos. Es
importante mencionar que la industria química no es la única causante de la emisión
de contaminantes al medio ambiente.
El concepto de química verde está íntimamente asociado con la prevención de la
contaminación ambiental mediante el diseño de procesos y productos químicos que
no posean propiedades dañinas al medio ambiente.
VIRIDIANA PÉREZ LÓPEZ Página 36
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La misión de la química verde es “promover el desarrollo y usos de tecnologías
químicas innovadoras que reduzcan o eliminen el uso o generación de sustancias
dañinas en el diseño, manifactura y uso de productos químicos”.
Los objetivos de la química verde han sido definidos de manera más específica como
“el establecimiento de los principios para síntesis y aplicación de productos y procesos
químicos que reduzcan o eliminen completamente el uso y producción de materiales
dañinos para el medio ambiente”. [Meléndez et. al., 2008].
I.8.1. Importancia de la química verde
En 1993, 30 mil millones de libras de sustancias químicas se liberaron en el aire, la
tierra y el agua, según el inventario de emisiones toxicas de la Agencia de protección
Ambiental de los Estados Unidos. (Figura I.17).
Si bien estos datos cubren los lanzamientos de una variedad de sectores industriales,
incluye solo 365 de los aproximadamente 70 mil químicos disponibles en la actualidad;
de los sectores industriales que están cubiertos por el inventario de emisiones toxicas,
el sector de fabricación de productos químicos es comprensiblemente el mayor
liberador de químicos para el medio ambiente, liberando 4 veces más de libras al
medio ambiente. [Anastas et. al., 2002].
VIRIDIANA PÉREZ LÓPEZ Página 37
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Inyección subterránea
Superficie del agua
Aire
Tierra
Figura I.17. Distribución de emisiones químicas al medio ambiente. [Anastas et. al., 2002].
La misión de la química: “promover el desarrollo y uso de tecnologías químicas
innovadoras que reduzcan o eliminen el uso o generación de sustancias dañinas en el
diseño, manufactura y uso de productos químicos” (Figura I.18).
Deshechos
Materiales
Riesgos
Reducir Daños
Energía
Costos
Figura I.18. Objetivo de la química verde.
VIRIDIANA PÉREZ LÓPEZ Página 38
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.8.2 Los doce principios de la química verde.
Estos principios desarrollados por Warner y Amas permiten analizar procesos y
establecer que tan VERDE puede ser una reacción química. [Anónimo, 2018].
I. Es preferible evitar la producción de un residuo que tratar de limpiarlo una vez
que se haya formado.
II. Los métodos de síntesis deberán diseñarse de manera que incorporen al
máximo, en el producto final, todos los materiales usados durante el proceso.
III. Siempre sea posible, los métodos de síntesis deberán diseñarse para utilizar y
generar sustancias que tengan pocas o ninguna toxicidad, tanto para el hombre
como para el medio ambiente.
IV. Los productos químicos deberán ser diseñados de manera que mantengan su
eficacia a la vez que reduzca su toxicidad.
V. Se evitará, en lo posible, el uso de sustancias auxiliares (disolventes, reactivos,
etc.) y en el caso de que se utilicen se procurará que sea lo más inocuas
posible.
VI. Los requerimientos energéticos serán catalogados por su impacto ambiental y
económico, reduciéndose todo lo posible.
VII. La materia prima ha de ser preferiblemente renovable en vez de agotable.
VIII. Se evitará en lo posible la formación de derivados.
IX. Se emplearán catalizadores en vez de reactivos estequiométricos.
X. Los productos químicos se diseñarán de tal manera que al finalizar su función
no persistan en el medio ambiente, sino que se transformen.
XI. Las metodologías analíticas serán desarrolladas posteriormente para permitir
una monitorización y control de tiempo de proceso, precio a la formación de la
sustancia peligrosa.
XII. Se elegirán las sustancias empleadas en los procesos químicos de forma que se
minimice el potencial de accidentes químicos.
VIRIDIANA PÉREZ LÓPEZ Página 39
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.8.3. Perspectivas de la química verde
A pesar de ser un concepto relativamente reciente, la química verde ha tenido un
desarrollo notable, sobre todo en los años recientes. Así se han desarrollado
tecnologías para optimizar el uso de energía en los procesos químicos, como la
utilización de ultrasonido y microondas en la aceleración de reacciones químicas.
Además, se han desarrollado tecnologías que permiten la reducción en el consumo de
disolventes, como la tecnología de extracción con fluidos supercríticos. El polémico
desarrollo de los biocombustibles es otra área que se ha desarrollado intensamente.
El desarrollo de mejores catalizadores para el proceso de refinación del petróleo,
especialmente de petróleos pesados, que son cada vez los más disponibles, es
también un área de intensa investigación. [Vargas et. al., 2007]. No obstante, estos
avances, la química, y en especial la química verde, tienen frente a sí desafíos muy
interesantes. Entre estos desafíos podemos mencionar el desarrollo de:
• Materiales estructurales mejorados para la industria.
• Métodos para hacer una reutilización de los materiales de reciclaje.
• Desarrollo molecular de biopolímeros y pequeñas moléculas.
• Productos químicos no perjudiciales.
• Biocatalizadores que no generen residuos.
• Agroquímicos amigables con el medio ambiente
I.8.4. Contaminación química
La contaminación química presente en tierra, agua y aire es un problema que afecta a
nivel mundial, y causan efectos tóxicos sobre los seres vivos y serios problemas de
contaminación en los ecosistemas.
VIRIDIANA PÉREZ LÓPEZ Página 40
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Entre algunos de los contaminantes químicos peligrosos se encuentran los metales
pesados, los nutrientes como compuestos nitrogenados y compuestos del fosforo, así
como los materiales que pueden provenir de residuos domésticos, industriales y
agrícolas. [Salgo et. al., 2016].
La síntesis de materiales a escala nanométrica es un proceso complejo y muchas veces
requiere un alto consumo de reactivos químicos, los que implica un elevado consto,
además del daño ambiental asociado.
I.8.4.1. Contaminantes químicos
Se consideran agentes químicos aquellas sustancias orgánicas o inorgánicas, naturales
o sintéticas y carentes de vida propia, que estando presentes en el medio laboral
puedan ser absorbidas por el organismo y causar efectos adversos a las personas
expuestas. (Figura I.19). [Balears, 2003].
Atendiendo a su forma molecular los agentes químicos se pueden clasificar en:
• GASES: Son fluidos amorfos que ocupan el espacio que los contiene.
• LÍQUIDOS: Tienen volumen y ocupan el recipiente que lo contienen.
• VAPORES: Proceden de un proceso de evaporación y en condiciones normales
de presión y temperatura, coexisten con la fase líquida.
• AEROSOLES: son dispersiones de partículas sólidas o líquidas en un medio
gaseoso (aire). Dentro de los aerosoles se presentan:
Aerosoles Líquidos (Nieblas): es una suspensión en el aire de pequeñas
gotas de líquido.
Aerosoles Sólidos: Se presentan en el aire en forma de pequeñas
partículas que pueden hallarse en suspensión.
Polvos: suspensión en el aire de partículas sólidas de tamaño
pequeño procedentes de procesos de disgregación o mecánicos.
VIRIDIANA PÉREZ LÓPEZ Página 41
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Fibras: el diámetro de las partículas es menor a un tercio de su
longitud.
Humos: suspensión en el aire de partículas sólidas provenientes
de procesos de combustión incompleta, de origen térmico.
Figura I.19. Ciclo de vida de las sustancias químicas. [Balears, 2003].
I.9. Contaminación en México
México tiene una superficie terrestre de casi 2 millones de kilómetros cuadrados, más
de 103 millones de habitantes y se encuentra en los primeros cinco países
megadiversos del plantea, es decir, aquellos que albergan la mayor parte de las
especies del planeta.
México es el país con el mayor número de especies de pinos, encinos, cactáceas y
reptiles, el segundo en mamíferos y el cuarto en anfibios, además, alberga a 12 de
cada 100 especies de plantas, de las cuales más de 50 por ciento solo existen aquí, es
decir, son endémicas, Además cuenta con abundantes recursos tales como mar,
litorales, petróleo, metales, irradiación solar y viento.
VIRIDIANA PÉREZ LÓPEZ Página 42
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Bien conservados, estos recursos regulan el clima, aseguran el abasto de agua, la
generación de oxígeno, el control de la erosión, la generación, conservación y
recuperación de suelos, la captura del carbono y otros contaminantes, la protección de
las diversas formas de vida, la reproducción de las plantas, el control biológico en
plagas, el reciclaje de desechos orgánicos, la recreación y disfrute de los paisajes y la
producción y provisión de alimentos para todos, por mencionar algunos.
Los problemas vienen de no conservar y proteger nuestros ecosistemas, de la muy
desigual distribución de los recursos y de la impunidad con la que cuentan quienes
destruyen el patrimonio natural del país.
Las tendencias ambientales del país no han cambiado, A pesar de las alertas de
organizaciones y de académicos, México aún presenta uno de los mayores índices de
degradación ambiental del mundo, De acuerdo con el Instituto Nacional de Estadística,
Geográfica e Informática (INEGI) la destrucción ambiental del país equivale a 8.8 por
ciento del Producto interno Bruto (PIB).
En el año 2003 el costo anual de la destrucción ambiental del país equivalió a 10 por
ciento del PIB que en dinero representa 754 000 millones de pesos. En el año 2006 el
deterioro ambiental equivalió a 903,724 millones de pesos, es decir, 149,724 más que
en el año 2003. Estos datos son graves, pero a la luz de los impactos del cambio
climático global se vuelven alarmantes. Los ecosistemas bien conservados nos ayudan
a mitigar los impactos del cambio climático. [Lara, 2009].
Actualmente la Ciudad de México y su Zona Metropolitana afrontan serios problemas
de contaminación la cual se ve reflejada en la calidad del aire, así como en el suelo,
subsuelo y acuíferos de esta ciudad. Parte de esta contaminación es generada por
Fuentes Fijas ubicadas en la entidad federativa, es por ello que la Secretaria del Medio
Ambiente del Gobierno del Distrito Federal a través de la Dirección de Hidrología y
Suelo instrumenta vistas de verificación a Fuentes Fijas, que son emisoras de
contaminantes. [Escobedo et. al., 2011].
VIRIDIANA PÉREZ LÓPEZ Página 43
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1.10. Desarrollo de la química verde en México
En México se han realizado diversas actividades para el desarrollo de tecnología, así
como para la optimización de procesos mediante el uso de sustancias químicas
amigables con el ambiente, tanto por instituciones de investigación públicas o
privadas, motivadas principalmente por incentivos económicos a través de los
programas del Consejo Nacional de Ciencia y Tecnología (CONACYT). En el sector
industrial también se han desarrollado programas para la mejora de procesos o
sustitución de sustancias peligrosas, con la finalidad de reducir la generación de
residuos peligrosos, mejorar el rendimiento de los procesos, y eliminar gastos por el
manejo de residuos y optimizar el consumo de materias primas. [CONACYT, 2018].
Basándose en investigaciones de campo, así como en la base de datos de
investigadores del CONACYT, se identificaron los siguientes centros que realizan
investigación y desarrollo de tecnología dentro de los cuales se han llevado a cabo
algunos trabajos que involucran las prácticas de química verde:
Tabla I.4. Centros de investigación y desarrollo de la República mexicana. [CONACYT, 2018].
Centros De Investigación Y Desarrollo De La República Mexicana.
Benemérita Universidad Autónoma de Puebla
Centro de Investigación Científica de Yucatán, A.C.
Centro de Investigación Científica y de Educación Superior de Ensenada, B.C.
Centro de Investigación en Química Aplicada
Centro de Investigación y de Estudios Avanzados del IPN
Centro de Investigaciones Biológicas del Noroeste, S.C.
Instituto Politécnico Nacional
Universidad Autónoma de Baja California
Universidad Autónoma de Baja California Sur
Universidad Autónoma de Campeche
Universidad Autónoma de Chiapas
VIRIDIANA PÉREZ LÓPEZ Página 44
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Universidad Autónoma de Coahuila
Universidad Autónoma de Nuevo León
Universidad Autónoma de San Luis Potosí
Universidad Autónoma de Yucatán
Universidad Autónoma del Estado de Hidalgo
Universidad Autónoma del Estado de México
Universidad Autónoma Metropolitana
Universidad de Guadalajara
Universidad de Guanajuato
Universidad Nacional Autónoma de México
Universidad Veracruzana
I.11. Síntesis verde
De unos años a la fecha la conciencia ambientalista ha permeado en diversas áreas de
investigación, explorando métodos de síntesis de nanopartículas, amigables con el
medio ambiente. La síntesis por química verde de nanopartículas está basada en la
reducción de materiales mediante especies naturales con poder antioxidante en lugar
de reductores químicos como el 𝑁𝑎𝐵𝐻4.
Uno de los pilares fundamentales de la síntesis verde es la utilización de plantas para
la obtención de extractos con alto poder antioxidante como polifenoles, azucares
reducidos, bases nitrogenadas y aminoácidos, que son capaces de reducir cationes en
una disolución de sal metálica.
La reducción inicial de iones metálicos induce a la formación de centros de nucleación,
estos centros secuestran iones metálicos adicionales y también incorporan lugares
vecinos de nucleación que, a veces, conducen a la formación de nanopartículas.
Además, con estas partículas están asociadas a restos orgánicos de los extractos de
VIRIDIANA PÉREZ LÓPEZ Página 45
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
plantas, en ocasiones, se consigue estabilizar esas partículas de tamaño nanométrico e
impedir que se agreguen.
Otra gran ventaja que presenta el empleo de métodos de química verde es la
posibilidad de controlar el tamaño de las nanopartículas variando la concentración del
extracto vegetal empleado sin necesidad de usar agentes surfactantes, estabilizadores
o pastillas. [Lago, 2015]. El proceso de la síntesis verde de nanopartículas de oro consta
de cuatro etapas (Figura I.20):
1. Obtención de los átomos metálicos en estado de oxidación cero 𝐴𝑢0 , mediante
la reacción de óxido-reducción.
2. Nucleación: En esta etapa dos o más átomos chocan y se unen para formar
cumulo. El núcleo critico es el tamaño más pequeño del cumulo que es estable
para las condiciones experimentales en que se realiza la síntesis de
nanopartículas.
3. Crecimiento: Se adicionan los núcleos de 𝐴𝑢0 unos a otros para dar lugar a la
formación de la nanopartículas. Se produce por agregación de átomos
provenientes de la etapa de reducción y cúmulos ya existentes, o bien por
colisión entre cúmulos.
Figura I.20. Etapas de la síntesis verde de AuNP´s. [Lago, 2015].
VIRIDIANA PÉREZ LÓPEZ Página 46
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
El tamaño y la forma de las nanopartículas obtenidas dependen de las velocidades
relativas de cada una de estas etapas, que pueden ser controladas a través de la
modificación de los parámetros de reacción (concentración, temperatura, pH, etc.)
[Moctezuma et. al., 2010].
En este trabajo se presenta una alternativa de síntesis económica, sencilla y amigable
con el medio ambiente, ya que no requiere de agentes reductores fuertes y tóxicos, ni
de disolventes orgánicos.
En este trabajo, las nanopartículas de oro fueron sintetizadas por medio de un
procedimiento sencillo empleando extracto de aloe vera ( Aloe barbadensis), y uva
(Vitis vinifera) como agentes reductores. Cada extracto acuoso reacciona con la
solución precursora de 𝐻𝐴𝑢𝐶𝑙4 .
I.12. Reductores Orgánicos naturales
En el año 1954 la doctora Rebeca Gerschman sugirió que los radicales libres eran
agentes tóxicos y generadores de patologías, y estableció en este trabajo 3 postulados
básicos:
1. Los radicales libres constituyen un mecanismo molecular común de daño
cuando los animales de experimentación son sometidos a altas presiones de
oxígeno y a radiaciones ionizantes.
2. El desequilibrio entre oxidantes y antioxidantes produce efectos tóxicos.
3. La producción de radicales libres es un fenómeno continuo con implicaciones
en el envejecimiento y la carcinogénesis.1
Todos los seres vivos que utilizan el oxígeno para la generación de energía liberan
radicales libres, lo que es incompatible con la vida a menos que existan mecanismos
de defensa contra estas especies.
VIRIDIANA PÉREZ LÓPEZ Página 47
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Esta defensa se realiza a través de los antioxidantes y se considera como tal a
cualquier sustancia que, en concentraciones normales, posee una afinidad mayor que
cualquier otra molécula para interacciones con un radical libre.
De hecho, se puede definir como antioxidante a toda sustancia que hallándose
presente a bajas concentraciones respecto a las de una molécula oxidable
(biomolécula), retarda o previene la oxidación de este sustrato. [Bacallao et. al., 2017].
El ácido ascórbico (vitamina C) tiene un efecto mediado por la interacción directa con
varias especies reactivas del oxígeno incluidos el ozono y el óxido nítrico, este
neutraliza otras especies reactivas como el ácido hipocloroso y regenera la forma
activa de otros antioxidantes directos.
Además inhibe de forma directa la reacción de formación de especies reactivas del
oxígeno mediada por el hierro de las ferroproteínas y 𝐻2 𝑂2.
I.12.1. Ácido ascórbico.
La vitamina C o 𝐶6 𝐻8 𝑂6 también conocido como ácido cevilámico o antiescorbútico
tiene características reductoras por sus dos grupos donadores de protones. Se
sintetiza químicamente a partir de la glucosa, mediante una serie de reacciones
enzimáticas, siendo L-gulono-lactona oxidasa (GLO) la última encima involucrada.
(Figura I.21); también es hidrosoluble y termolábil, y se oxida en el aire con facilidad.
VIRIDIANA PÉREZ LÓPEZ Página 48
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.21. Mecanismo de reacción de obtención del ácido ascórbico a partir de glucosa. [Aquino et. al.,
2013].
Interviene en muchas reacciones metabólicas importantes en todos los animales y
plantas; por ejemplo, actúa como cofactor en la reacción de hidroxilación en la síntesis
del colágeno. Es esencial para la formación normal de huesos y dientes. Es un
nutriente esencial para los mamíferos, y es creada internamente por casi todos los
organismos, siendo los humanos una notable excepción.
El fármaco de la vitamina C es el ion escorbuto. En organismos vivos, el escorbuto es
un antioxidante, pues protege el cuerpo contra la oxidación. [Anónimo, 1998]. Las dos
moléculas principales del 𝐶6 𝐻8 𝑂6 se encuentran en equilibrio y ambas presentan
actividad biológica. (Figura I.22.).
VIRIDIANA PÉREZ LÓPEZ Página 49
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.22. Formas moleculares de ácido ascórbico en equilibrio. [Aquino et. al., 2013].
La Vitamina C es sintetizada en el hígado de algunos mamíferos y en el riñón de aves y
reptiles. Sin embargo, varias especies, incluyendo los humanos, los primates no
humanos, los murciélagos indios, entre otros, no son capaces de sintetizar la vitamina
C. Cuando no hay suficiente vitamina C en la dieta, los humanos sufren una
enfermedad potencialmente letal llamada escorbuto. [Englard, 1986].
La mayoría de las reacciones metabólicas del ácido ascórbico se deben a su fuerte
potencial reductor. Su actividad antioxidante deriva del desplazamiento de ácido L-
ascórbico a su forma oxidada L- dehidroascorbico, esto le permite a la molécula
combatir radicales oxidativos (𝑂−2 𝑦 𝑂𝐻 + ) y radicales acuosos como el oxígeno.
La vitamina C tiene dos pKa y el grado de ionización va a influir en la formación de su
forma pro-oxidante o antioxidante, entre más ionizado se encuentre mayor
probabilidad tendrá de ser pro-oxidante si hay hierro disuelto. (Figura I.23).
Si el ácido ascórbico se encuentra en solución y su pH es equivalente o inferior a su
pKa la carga negativa responsable del acomplejamiento con metales de transición
puede ser estabilizada por pronotación, esto impide el flujo de electrones en el
sistema. [Sandoval, 2010].
VIRIDIANA PÉREZ LÓPEZ Página 50
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.23. Ácido ascórbico (vitamina C) y sus pK´s de sus grupos. [Aquino et. al., 2013].
I.12.1.1. Fuentes de ácido ascórbico
El ácido ascórbico se encuentra en muchas frutas y vegetales. Las frutas acidas son
prácticamente ricas en fuentes de vitamina C, pero otras frutas incluyendo sandía,
melón, kiwi, papaya, etc, contienen variables de vitamina C. Vegetales como brócoli,
coliflor, mostaza, pimiento verde, papas, pueden ser fuentes más importantes de
vitamina C. [Aquino et. al., 2013].
El ácido ascórbico es de los micronutrientes más fácilmente asociados con las verduras
y frutas.
El contenido varía considerablemente entre las diferentes verduras crucíferas que
contienen generalmente altos niveles de 50 mg a 100 mg. En la tabla I.5. Podemos
observar distintos alimentos y cantidad de ácido ascórbico por porción.
Tabla I.5. Alimentos fuente de ácido ascórbico. [Aquino et. al., 2013].
Alimentos Porción Mg de Ácido
Jugo de naranja 200 mL 124
Pimiento rojo 1 pieza 225
Pimiento verde 1 pieza 120
Fresa 220 mL 105
VIRIDIANA PÉREZ LÓPEZ Página 51
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Jugo de arándanos 220 mL 107
Coles de Bruselas 220 mL 95
Brócoli 180 g 90
Kiwi 75 g 70
Coliflor 100 g 50
Moras 180 g 30
Tomate rojo 180 g 23
En el mundo países en desarrollo, la fuente de vitamina C está a menudo determinada
por factores estacionales (por ejemplo, el agua). Del clima en el que se haya cultivado
y de la forma en que se haya procesado.
I.12.2. Polifenoles
Los polifenoles son constituyentes fundamentales del mundo vegetal, se encuentran
comúnmente en los alimentos retardando o previniendo su oxidación.
Están representados por centenares de compuestos de diversa estructura química,
pero que comparten la característica de poseer en su estructura varios grupos
bencénicos que llevan asociados uno o varios grupos hidroxilo.
En los últimos años, los polifenoles de los vinos han sido sujeto de un creciente interés
debido a sus magníficas propiedades antioxidantes, es decir, a su capacidad de
retardar o prevenir la oxidación de otras moléculas, lo que tiene potenciales efectos
sobre la salud humana. [Julibert, 2013].
Los compuestos químicos en forma de polifenoles, son abundantes en el vino y en el
mosto, son importantes por su contribución en los atributos amargos, y su capacidad
de envejecimiento. Es por ello que definir el momento en el cual la uva ha llegado a su
madurez fenólica es uno de los objetivos perseguidos por los científicos. [Constantin,
2011].
VIRIDIANA PÉREZ LÓPEZ Página 52
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Los compuestos fenólicos se clasifican en dos tipos: compuestos no flavonoides y
flavonoides (Figura I.24):
En los compuestos no flavonoides se incluyen los ácidos fenoles, divididos en
benzoicos (C6-C1) y cinámicos (C6-C3), y otros derivados fenólicos como los
estilbenos.
Dentro de los flavonoides encontramos las antocianos (malvidol, peonidol,) que
dan el color a los vinos tintos, los taninos catequinos (flavanoles o flavan3-oles)
principales responsables de la astringencia y de la estructura de jugos y vinos, y
los flavonoles (quercetol, miricetol, etc) que parecen contribuir al gusto amargo.
VIRIDIANA PÉREZ LÓPEZ Página 53
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.24. (A) Flavonas, (B) flavonoles, (C) flavanoles, (D) flavanonas, (F)isoflavonas, (G) antocianidinas.
[Julibert, 2013].
VIRIDIANA PÉREZ LÓPEZ Página 54
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.12.3. Azúcares
Los azúcares son compuestos orgánicos polihidroxilados que presentan un grupo
aldehído o cetona (aldosa o cetosa respectivamente) en su molécula.
Son incoloros e inodoros, presentan sabor dulce y son solubles en agua e insolubles
en algunos compuestos orgánicos. Sus propiedades químicas se deben a las funciones
aldehído y cetona libres, de allí su capacidad reductora, la facilidad con que se oxidan
en ácidos y la aptitud para polimerizar.
Ofrecen múltiples ventajas, se utilizan para endulzar los alimentos y como
conservantes, aunque su principal característica nutricional es su importancia como
fuente de energía. Por otra parte, los azúcares aumentan la viscosidad de los mostos,
factor que también interviene en la lágrima que se forma en las paredes de la copa,
pues se trata de compuestos que son untuosos en la boca. [Petkovsek, 2010].
Por regla general la presencia de una concentración de azúcares de menos de 1.5
g/litro hace que el paladar no detecte el sabor dulce, por encima de un 0.2% del
volumen los sentidos empiezan a detectar el sabor dulce.
Se clasifican en función del número de unidades de monosacáridos de los que están
formados en: monosacáridos (un monosacárido), disacáridos (dos monosacáridos
unidos mediante un enlace glicosídico) y oligosacáridos (de dos a diez monosacáridos
unidos mediante enlaces glicosídicos). (Figura I.25.) [Almeida, 2013].
Los azúcares son hidratos de carbono y por tanto contienen 4 calorías por gramo. Se
encuentran de forma natural en muchos alimentos como frutas, verduras, cereales y
leche.
VIRIDIANA PÉREZ LÓPEZ Página 55
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.25. Azucares, [Almeida, 2013].
Los principales azúcares en el mosto son dos monosacáridos: la glucosa y fructosa,
existen otros como la galactosa, la xilosa, la arabinosa o la ribosa, pero en
concentraciones insignificantes. La concentración de estos azúcares en la uva depende
del momento de maduración en la que esta se encuentra, de forma que antes de
madurar predomina la glucosa y en las uvas bien maduras la fructosa.
I.13. Aloe vera (Aloe Barbadensis)
En el antiguo Egipto, el áloe fue la planta cuya “sangre” ofrecía la belleza, la salud y la
eternidad. Para los emperadores de la China mítica, las espinas curativas del áloe
personificaban a las uñas sagradas de la Divinidad. En cuanto a los Indios del Nuevo
Mundo, el áloe formaba parte de las 16 plantas sagradas adoradas como dioses.
VIRIDIANA PÉREZ LÓPEZ Página 56
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
El aloe vera, así denominado y descrito por Linneo, y el aloe barbadensis descrito por
Miller, así como el aloe vulgaris de Lamarck, son una misma y única planta.
El asunto del “nombre” se complica aún más por el hecho de que Miller también había
descrito y bautizado como “aloe vera” a un áloe que no tiene nada que ver con el de
Linneo, y que no parece poseer ninguna de las propiedades medicinales de la planta
descrita por el botánico sueco. [Vogler, 1999].
El aloe barbadensis (o aloe vera de Linneo) alcanza una altura media situada entre 60
y 90 cm. Sus hojas, de 40 a 50 cm de largo, adornadas con púas, tienen una anchura
de 6 a 10 cm en la base. Las hojas del áloe están revestidas por una cutícula (capa
protectora) cuyas estomas filtran el aire y el agua. Bajo esta membrana se halla una
primera dermis celulósica, que abriga cristales de oxalato de calcio, y las células
pericíclicas de la savia amarilla y rojiza con propiedades laxantes llamada “sangre” del
áloe. Finalmente, dentro de esta triple protección vegetal, he aquí el parénquima
incoloro, que forma el gel buscado de la planta. La calidad de este gel depende
mucho del suelo y de las condiciones climáticas de la zona de cultivo. [Arzate et. al.,
2012].
I.13.1. GEL de aloe.
Un 99,4% del peso del gel de aloe vera es agua. Más del 60% de los sólidos totales
son polisacáridos mucilaginosos ligados a azúcares como glucosa, manosa, ramnosa,
xilosa, arabinosa, galactosa y ácidos urónicos. El mucílago está compuesto de
diferentes polisacáridos neutros, ácidos y acetilados (mananos, glucomananos,
galactomananos.), responsables de la gran capacidad que tiene la planta para retener
agua y gracias a la cual puede sobrevivir en condiciones de sequía. (Figura I.26).
En la figura se muestran imágenes de microscopıa de luz tomadas a una magnificación
de 5x de las células del parénquima (e) y de un corte seccional de la hoja de Aloe vera
(f) donde se observan con gran detalle células internas del exocarpio (ce), células del
parénquima (cp) y conductos de aloína (c). [Arzate et. al., 2012].
VIRIDIANA PÉREZ LÓPEZ Página 57
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Los polisacáridos mucilaginosos son los principios activos responsables de la actividad
biológica del gel de aloe vera, y entre ellos Ricardo Gampel destaca el acemanano:
“Que ha despertado gran interés por sus propiedades farmacológicas y como
componente activo importante del gel de aloe” y el aloérido: “Polisacárido de elevado
peso molecular recientemente identificado, constituído por glucosa, galactosa, manosa
y arabinosa, y que según parece posee una actividad inmunoestimulante superior a la
del acemanano”. [Calderón et. al., 2011].
Fig. I.26. Estructura y microestructura de la hoja de Aloe vera: exocarpio (a), pulpa o tejido
parenquimatico (b), conductos de aloına (c) y cutícula (d). [Arzate et. al., 2012].
1.13.2. Composición química
Las “ligninas” penetran fácilmente en la epidermis, pero sus cualidades medicinales son
aún poco conocidas. Las “saponinas”, descubiertas en 1951 por Wasicky y Hoehne, son
heterósidos (glúcidos) que actúan de modo antiséptico y saponífico. Las
“antraquinonas*" son conocidas desde hace tiempo por su efecto laxante y analgésico.
VIRIDIANA PÉREZ LÓPEZ Página 58
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
A lo largo de los últimos períodos, los investigadores han confirmado sus cualidades
bactericidas y antibióticas desprovistas de toda toxicidad. En la siguiente tabla I.6
podemos observar, los componentes químicos agrupados del aloe vera.
Tabla I.6. Composición del aloe vera. [Schweizer, 2007]
Composición química
Lignina, saponinas, Aloína, Barbaloína (glicósido barbaloico), Isobarbaloína, Ácido
antraquinonas aloético, Emodina de áloe, Ácido cinámico, Ester de ácido
cinámico, Aceite estéreo, Ácido crisofánico, Aloe ulcino,
Resestanol.
Vitaminas Vitamina B1 (tiamina), Vitamina B2 (niacina y riboflavina),
Vitamina B6, Niacinamida, Vitamina B6 (piridoxin, Vitamina
B9, Vitamina del complejo B, Vitamina B12, Vitamina C (ácido
ascórbico) , Vitamina E (tocoferol).
Minerales El aloe vera contiene más de 20 sales minerales.
Calcio, Fósforo, Potasio, Hierro, Cloro, Manganeso, Magnesio,
Cobre, Cromo, Zinc.
Mono y Celulosa, Glucosa, Manosa, Aldonentosa Acido urónico
polisacáridos (Hexo), Lipasa, Aliinasa, L–ramnosa, Carrisyn
Aminoácidos Ácido aspártico, Ácido glutámico, Alanina, Arginina, Glicina,
secundarios Histidina, Hidroxiprolina, Prolina, Serina, Tirosina.
1.13.3. Aplicaciones
La reputación adquirida por el áloe en los 5 continentes no parece usurpada. Así como
en Europa se contentaron durante mucho tiempo en utilizarla como planta amarga,
laxante o vermífugo, bajo la forma de extracto seco y molido ya que no se sabía
conservar el gel fresco, actualmente está comprobado que este gel extraído de la
pulpa de sus hojas cura muchos males cotidianos de la vida doméstica (picaduras de
insectos, quemaduras, cortes, trastornos digestivos, eczema).
VIRIDIANA PÉREZ LÓPEZ Página 59
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Es también un cicatrizante excelente, y nos ofrece, en forma de jugo, un asombroso
complemento alimenticio tónico y vivificante.
Desde hace tiempo algunos atletas lo utilizan para prevenir y curar esguinces,
torceduras, tendinitis y otros accidentes. Otros deportistas lo absorben discretamente
como estimulante natural, sin correr ningún riesgo en los controles anti-doping.
Las mujeres lo usan como mascarillas de belleza, cremas rejuvenecedoras, champúes o
lociones capilares. Algunos dicen que no hay nada mejor en cuanto a tratamiento de
fondo de la hepatitis, el asma, la lepra y las enfermedades de la piel. Es pues la planta
de “primeros auxilios” por excelencia. [Schweizer, 2007].
Actualmente sus propiedades han sido comprobadas clínicamente y los científicos se
interesen cada vez más por sus aplicaciones médicas. La NASA lo utiliza porque
absorbe el 90% de la toxicidad de sustancias como: el PVC, la fibra de vidrio, los
barnices, las pinturas, las radiaciones de los ordenadores, los televisores y demás
aparatos electrónicos. [Ramírez, 2003].
I.14. Uva (Vitis vinifera)
Originaria del Cáucaso y Asia occidental, se supone que ya era recolectada en el
Paleolítico. Los egipcios conocían la vid, pero los griegos y los romanos fueron dos de
las civilizaciones que desarrollaron en gran medida la viticultura e introdujeron la vid
en sus colonias. Fueron los colonos españoles los que introdujeron la vid en América
del Norte, desde donde se extendió por todo el continente; pero el intento fracasó a
consecuencia de los ataques de parásitos y las enfermedades. Y a finales del siglo XIX,
la explotación de la vid en Europa sufrió un gran golpe tras la contaminación por un
insecto americano llamado filoxera.
En 30 años se propagó la plaga por todos los viñedos y éstos estuvieron a punto de
desaparecer, lo que obligó a adoptar las vides americanas resistentes a la plaga como
VIRIDIANA PÉREZ LÓPEZ Página 60
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
patrones de la vid europea, y se obtuvieron variedades resistentes, fruto de la
hibridación de ambos tipos de plantas.
Hoy en día, la vid se cultiva en las regiones cálidas de todo el mundo. Cuando llega el
mes de marzo y comienza el calor, empiezan a formarse los frutos de la vid,
inicialmente verdes pues están saturados de clorofila.
El momento en el que la uva cambia de color, pasa de verde a amarillo si la variedad
es blanca o al rojo claro si la variedad es tinta, recibe el nombre de envero.
Durante esta etapa ocurren otros fenómenos en el interior de la uva como es el
crecimiento y ablandamiento del grano, la modificación de la consistencia de los
tejidos, la acumulación de azúcares, disminución de ácidos, modificación en los
elementos minerales, variaciones en la composición y contenido de sustancias
nitrogenadas, desaparición de clorofila y acumulación de pigmentos colorantes en el
hollejo, incremento de los polifenoles y síntesis de sustancias aromáticas. [Visuet, 2017].
Se pueden diferenciar dos partes en el racimo de uva: el raspón, o parte leñosa, y las
bayas o granos. Éstos se unen al racimo mediante el pedicelo, a través del cual se
nutren. Las bayas, a su vez, están formadas por una película exterior denominada
hollejo o piel, una masa que rellena su interior de la que se extrae el mosto conocida
como pulpa y, en el centro de la misma, una numero variable de semillas o pepitas
(Figura I.27), cada una de ellas con un aporte específico de características y
componentes.
El hollejo contiene la mayor parte de los componentes colorantes y aromáticos de los
mostos; la pulpa los azúcares, el agua y los ácidos orgánicos; y las pepitas
proporcionan los taninos al mosto. [De Lamo, 2015].
VIRIDIANA PÉREZ LÓPEZ Página 61
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.27. Morfología de la uva. [Visuet, 2017].
I.14.1. Composición química.
El mosto antes de la fermentación se compone principalmente de agua y azúcares, así
como de ácidos (málicos y tartáricos) y de otros componentes químicos en menor
cantidad. Tras la fermentación alcohólica gran parte de los azúcares del mosto se
transforman en alcohol etílico. Los componentes principales presentes en el mosto se
presentan en la tabla I.7.
VIRIDIANA PÉREZ LÓPEZ Página 62
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Tabla I.7. Composición del mosto de uva. [Garcés, 2010].
Composición química
Agua: Es el componente principal del mosto y según su grado de
madurez puede encontrarse entre un 70 y 85%.
Azúcares: Son el segundo componente más importante en la uva,
existiendo mayor cantidad en la uva blanca que en la tinta.
Están esencialmente representados por los monosacáridos
glucosa y fructosa que se encuentran en el mosto en
concentraciones comprendidas entre 150 y 250 g/L.
Ácidos orgánicos: Los ácidos orgánicos presentes en el mosto están representados
principalmente por el ácido tartárico, cítrico y málico, también
existen pequeñísimas cantidades de muchos otros ácidos
orgánicos tales como glioxílico, oxálico, salicílico, ascórbico y
glicólico. Los ácidos tartárico y málico representan el 90% de la
acidez total del mosto.
Sustancias Los compuestos nitrogenados son fundamentales en el mosto
nitrogenadas: para que sea posible la correcta fermentación. Entre los
aminoácidos predominantes en las uvas está la prolina y la
arginina.
Enzimas: Las enzimas son sustancias muy complejas producidas por las
células de los microorganismos. Aunque estén en pequeñas
cantidades, son capaces de activar reacciones importantes.
Sustancias En los mostos existen siempre pequeñas cantidades de sulfatos,
minerales: fosfatos y cloruros de potasio, calcio, magnesio y sodio
procedentes del suelo. Se localizan principalmente en las partes
sólidas de la uva: hollejos, semillas y paredes celulares de la
pulpa.
Compuestos Los compuestos aromáticos caracterizan el sabor y olor de los
aromáticos: mostos, algunos grupos principales son: los terpenos, lactonas,
ésteres, compuestos azufrados, etc.
Sustancias Están presentes en las paredes celulares del hollejo y de la
VIRIDIANA PÉREZ LÓPEZ Página 63
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
pépticas: pulpa, y se solubilizan en el mosto tras la degradación
enzimática de dichas paredes. Originan la turbidez típica de los
mostos.
Compuestos Cuantitativamente representan solo el 0.3% de los componentes
fenólicos: del mosto, pero son fundamentales en las características
organolépticas y en la calidad del producto.
Están localizados mayoritariamente en las pepitas y el hollejo.
I.14.2. Aplicaciones
Múltiples estudios muestran que los fitonutrientes presentes en la uva y el vino pueden
tener un efecto preventivo frente a enfermedades degenerativas como las
cardiovasculares, ciertos tipos de cáncer, trastornos neurodegenerativos, e incluso
patologías como las cataratas.
Entre los compuestos implicados están los compuestos fenólicos, destacando los
estilbenos (resveratrol) y los flavonoides. Algunos autores indican que, tanto la uva
negra como el vino tinto, poseen una mayor cantidad de fitonutrientes que las otras
variedades de uva y vino, pudiendo contribuir mejor a la prevención de las
enfermedades degenerativas. [De Lamo, 2015].
Existen unas 3.000 variedades, que se pueden clasificar en dos grandes grupos:
Uvas de mesa. Se consumen frescas o como uvas pasas. Son más carnosas y de
semillas grandes. Pueden ser amarillas, verdes, granates o violetas. Las más
consumidas son: albillo, moscatel (la más dulce de todas), aledo, villanueva,
chelva, vinalopó y palomino.
VIRIDIANA PÉREZ LÓPEZ Página 64
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Uvas viníferas. Son menos dulces que las de mesa y más ácidas, aunque para
hacer vino blanco se utilizan algunas especies dulces como: palomino,
macabeo, malvasía, moscatel, chardonnay y garnacha blanca.
Para elaborar vino tinto se utilizan mayormente: garnacha tinta, cabernet
sauvignon, merlot, pinot noir, syrah, cariñena, tempranillo, tintorera y graciano.
VIRIDIANA PÉREZ LÓPEZ Página 65
CAPÍTULO II. TÉCNICAS INSTRUMENTALES
Como ya se ha mencionado anteriormente, las propiedades ópticas son las de mayor
importancia para la caracterización de las nanopartículas de oro, de allí que las técnicas
espectroscópicas sean las que se utilizan con mayor frecuencia.
En el presente capítulo se hablara de la caracterización de las nanopartículas de oro
sintetizadas primeramente, el tamaño y la morfología de las nanopartículas de oro
sintetizadas, ha sido estudiada por microscopia de barrido (SEM) o bien por microscopia
electrónica de transmisión (TEM. Se analizan las propiedades ópticas de todas las
muestras por espectroscopia de absorción molecular (UV-VIS). Y los grupos funcionales
de los reductores orgánicos por espectroscopia de absorción molecular infrarroja por
transformadas de Fourier con ATR (FT-IR).
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.1. Espectroscopia de absorción molecular ultravioleta visible UV
VIS
La espectroscopia de UV-VIS proporciona, en general, información acerca de las
transiciones electrónicas de los electrones de valencia, pero en el caso de las
nanopartículas, la utilidad de esta técnica reside en determinar la posición y forma de la
banda del Plasmón superficial que se relaciona con la morfología y tamaño de la
nanopartícula, así como, con la dispersión de tamaños de la muestra y la concentración
de un compuesto en solución.
La radiación ultravioleta (UV) y visible comprende sólo una pequeña parte del espectro
electromagnético, que incluye otras formas de radiación como radio, infrarrojo (IR),
cósmica y rayos X (Figura II.1).
Cuando la radiación interacciona con la materia, pueden ocurrir varios procesos como
reflexión, dispersión, absorbancia, fluorescencia/fosforescencia (absorción y reemisión)
y una reacción fotoquímica (absorbancia y rotura de enlaces).
En general, cuando se miden espectros UV-visible, sólo es deseable que ocurra
absorbancia. [Owen, 2000].
Figura II.1. Espectro electromagnético. [Owen, 2000].
VIRIDIANA PÉREZ LÓPEZ Página 66
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Para que una substancia sea activa en el visible debe ser colorida: el que una substancia
tenga color, es debido a que absorbe ciertas frecuencias o longitudes de onda del
espectro visible y transmite otras más. Por ejemplo: una solución es amarilla debido a
que dentro de la región visible absorbe radiación en el rango de 435 a 480 nm. (Figura
II.1.)
En este rango de longitud de onda se encuentra el color azul del visible, por lo que este
compuesto absorbe el color azul y transmite los colores complementarios que dan
origen al color amarillo de la solución mencionada. (Tabla II.1). [Méndez, 2016].
La tabla II.1 nos da una relación entre rango de longitudes de onda en que absorbe un
compuesto, color absorbido y color observado o transmitido. El rango visible se
considera de los 380 a los 750 nm. El rango del Ultravioleta cercano o del Cuarzo es de
190 a 380 nm.
Tabla II.1 Relación de rangos de longitud de onda. [Méndez, 2016].
Rango de longitudes de Color absorbido Color Transmitido
Onda (nm) (Observado)
100-190 Ultravioleta del vacío Ninguno
190-380 Ultravioleta Cercano Ninguno
380-435 Violeta Amarillo-Verde
435-480 Azul Amarillo
480-500 Verde-Azul Naranja-Rojo
500-560 Verde Púrpura
560-580 Amarillo-Verde Violeta
580-595 Amarillo Azul
595-650 Naranja Verde-Azul
650-780 Rojo Azul-Verde
VIRIDIANA PÉREZ LÓPEZ Página 67
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La base de la espectroscopia Visible y Ultravioleta consiste en medir la intensidad del
color (o de la radiación absorbida en UV) a una longitud de onda específica
comparándola con otras soluciones de concentración conocida (soluciones estándar)
que contengan la misma especie absorbente. Para tener esta relación se emplea la Ley
de Beer, que establece que para una misma especie absorbente en una celda de espesor
constante, la absorbancia es directamente proporcional a la concentración. [Méndez,
2016].
II.1.1. Fundamento teórico
El espectro Ultravioleta y Visible de las moléculas está asociado a transiciones
electrónicas entre los diferentes niveles energéticos en ciertos grupos o átomos de la
molécula y no caracterizan a la molécula como entidad. En contraste la absorción de
energía en la región Infrarroja estimulan la molécula completa y causa cambios
vibracionales y rotacionales en esta lo cual caracteriza la entidad estructural de la
molécula. [Sturm, 2012].
Los grupos de átomos que dan origen a la absorción en el UV cercano o UV se conocen
como grupos cromóforos. La mayoría de los grupos insaturados y heteroatómicos que
tienen pares de electrones no compartidos, son cromóforos potenciales y estos grupos
son la base de la elucidación de grupos estructurales en las moléculas activas en el UV
cercano.
Para esto se requiere de un control de ciertas condiciones, que inhiben o favorecen la
formación de compuestos coloridos:
El pH es un factor determinante en la formación de ciertos complejos o
compuestos coloridos. Cuando el pH influye en la técnica analítica, se requiere
de un control adecuado de este valor para lo cual se agrega alguna solución
buffer, o estabilizador de pH.
VIRIDIANA PÉREZ LÓPEZ Página 68
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Temperatura: La temperatura es factor importante, sobre todo en reacciones en
las cuales el factor cinético es la base del análisis.
Tiempo: En ciertas reacciones, se requiere de un tiempo determinado para que
se tenga una lectura estable de absorbancia de la solución producida.
Es también factible que los complejos o compuestos formados sean lábiles, estos es que
después de un cierto tiempo se descompongan a otros productos diferentes, por lo que
el tiempo indicado al que debe hacerse la lectura debe establecerse con base a la
experiencia y los resultados que se tengan. [Cannor, 1980].
II.1.1.1. Teoría de orbitales moleculares
La energía asociada con la radiación electromagnética se define por la siguiente
ecuación:
𝐸 = ℎ ∗ 𝑣 … 𝐸𝑐𝑢𝑎𝑐𝑖ó𝑛 𝐼𝐼. 1
Siendo:
𝐸: 𝐸𝑛𝑒𝑟𝑔𝑖𝑎 𝑒𝑛 𝐽𝑢𝑙𝑖𝑜𝑠
ℎ: 𝐶𝑜𝑠𝑡𝑎𝑛𝑡𝑒 𝑑𝑒 𝑃𝑙𝑎𝑛𝑐𝑘 (6.62𝑥10−34 𝐽𝑠)
𝑣: 𝐿𝑎 𝑓𝑟𝑒𝑐𝑢𝑒𝑛𝑐𝑖𝑎 𝑒𝑛 𝑠𝑒𝑔𝑢𝑛𝑑𝑜𝑠
La radiación electromagnética puede considerarse una combinación de campos
eléctricos y magnéticos alternos que viajan por el espacio con un movimiento de onda.
Como la radiación actúa como una onda, puede clasificarse según la longitud de ésta o
la frecuencia, relacionadas por:
𝒄
𝒗= … 𝑬𝒄𝒖𝒂𝒄𝒊ó𝒏 𝟐. 𝟐
𝝀
Donde:
𝑐: 𝑣𝑒𝑙𝑜𝑐𝑖𝑑𝑎𝑑 𝑑𝑒 𝑙𝑎 𝑙𝑢𝑧 (3𝑥108 𝑚𝑠 −1 )
𝜆: 𝐿𝑜𝑛𝑔𝑖𝑡𝑢𝑑 𝑑𝑒 𝑜𝑛𝑑𝑎 𝑒𝑛 𝑚𝑒𝑡𝑟𝑜𝑠
VIRIDIANA PÉREZ LÓPEZ Página 69
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Cuando una onda encuentra a una molécula, puede cambiar la dirección de
propagación (dispersión) de esa onda, o puede ser absorbida. En este último caso, una
molécula absorbe un fotón y su energía interna aumenta para entrar a un estado
inestable, por lo que rápidamente vuelve a liberar esa energía sobrante y vuelve al
estado inicial que es más estable.
El estado inicial se denomina estado fundamental y el estado más energético se llama
estado excitado.
La absorción de radiación produce un paso del estado fundamental al excitado
(excitación) y en el proceso contrario (llamado relajación) hay una liberación de energía.
Esta energía liberada en la relajación puede ser en forma de calor o en forma de
radiación electromagnética otra vez. Este último proceso de desprendimiento de
radiación se llama de emisión.
Estos procesos se pueden representar como una reacción química y en un diagrama de
energía. (Figura II.2.) [Arena et. al., 2004].
Figura II.2. Desprendimientos de radiación. [Arena et. al., 2004].
VIRIDIANA PÉREZ LÓPEZ Página 70
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Cuando dos átomos forman un enlace químico, los orbitales atómicos de cada uno de
ellos se combinan para formar dos orbitales moleculares, uno de baja energía que es el
orbital enlazante y otro de energía mayor, que es el orbital antienlazante (Figura II.3).
Los enlaces covalentes que se originan entre los orbitales de dos átomos que se enlazan
químicamente pueden ser de dos tipos y se conocen como enlaces 𝜎 y enlaces 𝜋.
Figura II.3 Formación de los orbitales 𝜎 y 𝜎 ∗ por traslapamiento frontal de dos orbitales, así como
enlaces 𝜋 y 𝜋 ∗ por traslapamiento lateral de los orbitales p. [Menrdez, 2016].
Al efectuarse dicho enlace covalente se forman simultáneamente orbitales
antienlazantes 𝜎 en el caso de un orbital molecular enlazante 𝜎 y 𝜋 ∗ en el caso de un
orbital molecular enlazante 𝜋.
Los electrones que no participan en la formación de enlaces covalentes en la molécula,
se denominan electrones n o no enlazantes. En las moléculas orgánicas los electrones n
están localizados principalmente en los orbitales atómicos de átomos como: Nitrógeno,
Oxígeno, Azufre y del grupo de los halógenos.
VIRIDIANA PÉREZ LÓPEZ Página 71
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En la Figura II.4 se representan las transiciones posibles en una molécula. De acuerdo a
este diagrama el orden energético en estas transiciones el de mayor energía es 𝜎 → 𝜎 ∗
y el de menor energía 𝑛 → 𝜋 ∗.
Mientras mayor sea la energía requerida para una determinada transición, menor es la
longitud de onda de la radiación que debe suministrarse para conseguir tal fin; por
ejemplo: la transición 𝜎 → 𝜎 ∗ para el propano requiere de radiación de 135 nm, la cual
se encuentra en la región del Ultravioleta lejano por lo que es necesario un equipo de
alto vacío si se desea estudiar dicha región del espectro.
La transición 𝑛 → 𝜋 ∗es la que requiere de menor energía y mayor longitud de onda.
Las cetonas y aldehídos saturados efectúan esta transición a una longitud de onda de
aproximadamente 285 nm. [Méndez, 2016].
Figura II.4 Diagrama de niveles energéticos para diferentes orbitales moleculares y las transiciones
posibles en éstos. [Méndez, 2016].
VIRIDIANA PÉREZ LÓPEZ Página 72
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Los orgánicos se basa en transiciones de electrones n ó 𝜋 al estado excitado 𝜋 ∗, ya que
las energías que se requieren para estos procesos conducen a picos en una región
espectral conveniente experimentalmente (200-700 nm ), ambas transiciones requieren
la presencia de un grupo funcional que suministre los orbitales 𝜋 .
Estrictamente, es a estos centros absorbentes insaturados a los que se les aplica el
término cromóforo y un uxocromo es un grupo funcional que no absorbe por si solo en
la región del ultravioleta pero tiene en efecto de desplazar los picos de los cromóforos
hacia longitudes de onda largas, además de aumentar su intensidad.
Los picos asociados a transiciones 𝑛 → 𝜋 ∗ se desplazan, generalmente, hacia
longitudes de onda más cortas (un desplazamiento hacia el azul) a medida que aumenta
la polaridad del disolvente. Este efecto se conoce como efecto hipsocrómico
En los sistemas en que son posibles transiciones 𝜋 → 𝜋 ∗, el estado excitado es más polar
que el estado basal; como resultado de esto, la transición 𝜋 → 𝜋 ∗ ocurrirá a mayores
longitudes de onda en solventes polares que en solventes no polares. Este
desplazamiento hacia el rojo del espectro visible se conoce como efecto batocrómico.
[Skoog, 2013].
II.1.1.2. Ley de LAMBERT-BEER
Es el resumen de dos leyes que nos permiten relacionar la fracción de radiación
absorbida con la concentración del analito y el espesor del medio. Se cumple para
cualquier proceso de absorción en cualquier zona del espectro y se basa en que cada
unidad de longitud a través de la cual pasa la radiación absorbe la misma fracción de
radiación.
Si tenemos un haz de luz monocromática “𝐼0 ”, que pasa a través de un material de
espesor “𝑙”, la disminución de la intensidad de luz transmitida, “𝐼𝑇 ”, será proporcional al
camino recorrido y a la concentración de la sustancia absorbente “c”.
VIRIDIANA PÉREZ LÓPEZ Página 73
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
𝐼 = 𝐼0 𝑒 −𝜀.𝑙.𝑐 …Ecuación II.3
El factor de proporcionalidad, “𝜀”, se denomina absortividad molar y está relacionado
con la probabilidad de absorción de radiación por parte de la sustancia en análisis.
Tomando logaritmos y reorganizando la ecuación tenemos:
…Ecuación II.4
𝐼0
𝑙𝑜𝑔 = 𝜀𝑙𝑐
𝐼
Donde 𝑙𝑜𝑔 = 𝐴 se denomina absorbancia (A)
𝐼0
𝐼
Si tenemos una sustancia cualquiera, X, que absorbe en el rango ultravioleta visible,
debido a su configuración electrónica no lo hará a una única energía sino que podrá
absorber en un rango de energías con distinta eficiencia en cada una de ellas, esto da
lugar al espectro de absorción de esta sustancia que indica la intensidad de luz
absorbida de cada longitud de onda o energía. [Rodríguez, 2012].
Cada sustancia tiene un espectro de absorción característico que dependerá de la
configuración electrónica de la molécula, átomo o ion y de los posibles tránsitos
electrónicos que se puedan producir con la radiación que incide sobre ella. [Skoog, 2013].
II.1.1.3. Curva de calibración
Un procedimiento analítico muy utilizado en análisis cuantitativo es el llamado de
calibración que implica la construcción de una curva de calibración. Una curva de
calibración es la representación gráfica de una señal que se mide en función de la
concentración de un analito. La calibración incluye la selección de un modelo para
estimar los parámetros que permitan determinar la linealidad de esa curva, y en
consecuencia, la capacidad de un método analítico para obtener resultados que sea
directamente proporcionales a la concentración de un compuesto en una muestra,
dentro de un determinado intervalo de trabajo. [García, 2016].
VIRIDIANA PÉREZ LÓPEZ Página 74
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Los estándares o disoluciones patrón para construir la recta de calibrado deben ser
preparadas en forma independiente, a partir de una o varias soluciones madre; el
número de puntos a escoger dependerá del uso que se dé a la recta de calibrado.
La figura 2.5 muestra un aproximado en volumen de las alícuotas a considerar para
realizar los estándares de manera creciente.
Figura 2.5. Estándares para curva de calibración. [Danzer, et. al., 1998].
Si bien con dos puntos se puede construir una curva, estadísticamente se requieren por
los menos tres para que la curva sea confiable. Hay que considerar que un aumento en
el número de puntos experimentales implicara mayor fiabilidad en la recta de calibrado.
La verificación del comportamiento de un analito mediante una curva de calibración
requiere un mínimo de cinco puntos para un intervalo de confianza del 95 % y de ocho
puntos para uno del 99 %. [Harris, 2001].
Independientemente de la técnica instrumental responsable de la señal analítica (cuyas
características se estudian en forma particular) los parámetros que se determinan a partir
de las curvas de calibración obtenidas con cualquiera de ellas son:
la linealidad
la sensibilidad
el límite de detección
el límite de cuantificación
el intervalo analítico
VIRIDIANA PÉREZ LÓPEZ Página 75
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En el procedimiento se compra una propiedad del analito con la de estándares de
concentración conocida del mismo analito (los estándares deben aproximarse en lo
posible a la composición general de la muestra).
La etapa de calibración analítico se realiza mediante un modelo de línea recta que
consiste en encontrar la recta de calibrado que mejor se ajuste a una serie de “n” puntos
experimentales, donde cada punto se encuentra definido por una variable “x” (variable
independiente, generalmente concentración del analito) y una variable “y” (variable
independiente, generalmente respuesta instrumental).
La recta de calibrado se encuentra definida por una ordenada al origen (b) y una
pendiente (m), mediante la ecuación 𝑦 = 𝑚𝑥 + 𝑏. [Dosal, et. al., 2008].
A partir de la curva de calibración (conjunto de concentraciones que describen el
intervalo en el cual se deberá cuantificar el compuesto por analizar) y a fin de asegurar
que la recta encontrada con los puntos experimentales se ajuste correctamente al
modelo matemático de la ecuación se calculan lo1s valores de la ordenada al origen, la
pendiente y coeficiente de determinación (𝑅 2 ).
Por tener una buena exactitud y confiabilidad estadística, el método más empleado para
encontrar los parámetros de la curva de calibración es el método de los mínimos
cuadrados. Este método busca la recta del calibrado que haga que la suma de los
cuadrados de las distancias verticales entre cada punto experimental y la recta de
calibrado sea mínima o tienda a cero.
A la distancia vertical entre cada punto experimental y la recta de calibrado se le conoce
como residual. En forma gráfica se representa por la figura II.6.
VIRIDIANA PÉREZ LÓPEZ Página 76
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura II.6. Ejemplo de curva de calibración. [Dosal, et. al., 2008].
Aplicaciones:
a) Compuestos orgánicos
Los compuestos que tienen un coeficiente de absortividad molar alto se pueden
determinar directamente; en caso contrario, se debe preparar un derivado con
coeficiente molar alto.
Cuando un compuesto es puro o se encuentra en una mezcla en la que dicho
compuesto es el único que absorbe, la determinación es relativamente sencilla.
La absorbancia se mide a la longitud de onda máxima, la cual se puede encontrar
en tablas o bien obteniendo previamente un espectro del compuesto.
b) Compuesto inorgánicos
Es necesario preparar complejos, usualmente se leen como complejos coloridos.
Esta aplicación se usa mucho para las mediciones de compuestos metálicos
tóxicos en el campo de las ciencias ambientales.
VIRIDIANA PÉREZ LÓPEZ Página 77
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.1.2. Instrumentación
Un espectrofotómetro es un instrumento para medir la transmitancia o absorbancia de
una muestra, en función de la longitud de onda de la radiación electromagnética.
II.1.2.1. Espectrofotómetro UV-VIS de doble haz
En un espectrofotómetro convencional de haz simple, el blanco y la muestra se miden
consecutivamente, con un intervalo de varios segundos para una medida a una longitud
de onda y hasta de varios minutos en una medida de un espectro completo. Las
variaciones de la lámpara pueden dar lugar a errores significativos en intervalos largos
de tiempo.
El espectrofotómetro de doble haz fue desarrollado para compensar los cambios de
intensidad de la lámpara entre las medidas de blanco y muestra. En esta configuración,
se coloca un chópper en el paso óptico, cercano a la fuente. El chópper hace que al
detector llegue intermitentemente la luz de referencia y la luz que atraviesa la muestra.
Gira a una velocidad tal que las medidas alternas de blanco y muestra ocurren varias
veces por segundo, corrigiendo, por lo tanto, los cambios a medio y largo plazo de la
intensidad de la lámpara (deriva). [Owen, 2000]
La Figura II.7 muestra un esquema de un espectrofotómetro de doble haz. Comparado
con los diseños de haz simple, los instrumentos de doble haz contienen más
componentes ópticos, lo que reduce el rendimiento y la sensibilidad. Para obtener alta
sensibilidad, pueden requerirse largos tiempos de medida.
Además, el diseño mecánico más complejo del espectrofotómetro de doble haz, puede
resultar en una menor fiabilidad.
VIRIDIANA PÉREZ LÓPEZ Página 78
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura II.7. Espectrofotómetro UV-VIS de doble haz. [Owen, 2000]
Tradicionalmente, la mayor estabilidad de los instrumentos de doble haz, ha sido
fundamental en el diseño de los espectrofotómetros de alto rendimiento. Sin embargo,
recientes avances en el diseño de lámparas y de la electrónica han mejorado la
estabilidad de los espectrofotómetros de haz simple y han llevado a un resurgimiento
de esta configuración.
Los instrumentos de haz simple ofrecen mayor sensibilidad y más facilidad de uso, con
derivas sólo un factor de dos, peores que las de los instrumentos de doble haz.
Los componentes clave de un espectrofotómetro, son:
Fuente que genera una banda ancha de radiación electromagnética
Dispositivo de dispersión que selecciona una longitud de onda particular (o más
correctamente, una banda de ondas) de la radiación de la fuente
Un área de muestra
Uno o más detectores para medir la intensidad de la radiación
Otros componentes ópticos, como lentes o espejos, transmiten la luz a través del
instrumento.
VIRIDIANA PÉREZ LÓPEZ Página 79
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1.-Fuentes
Dos son las fuentes utilizadas, comúnmente, en los espectrofotómetros UV-visible:
c) Lámpara de arco de deuterio: Produce un buen haz continuo de intensidad en la
región UV y ofrece una intensidad útil en la región visible. Aunque las modernas
lámparas de arco de deuterio tienen bajo ruido, éste, a menudo, es un factor
limitante en el ruido general del instrumento. Con el tiempo, la intensidad de luz
de una lámpara de arco de deuterio disminuye de modo homogéneo. Estas
lámparas tienen una vida media (el tiempo requerido para que la intensidad caiga
a la mitad de su valor inicial) de, aproximadamente, 1000horas.
d) Lámpara halógena de wolframio: Ofrece buena intensidad en parte del espectro
UV y sobre el rango visible completo. Este tipo de lámpara tiene muy bajo ruido
y poca deriva y tiene, típicamente, una vida útil de 10000 h. La mayoría de los
espectrofotómetros utilizados para medir el rango UV-visible contienen ambos
tipos de lámparas.
En estos instrumentos, se utiliza un selector de fuente para cambiar de lámpara según
corresponda, o se mezcla la luz procedente de las dos fuentes para dar lugar a una sola
banda ancha.
Una fuente alternativa de luz es la lámpara de xenón: Produce un buen haz continuo en
las regiones completas UV y visible. Sin embargo, debido a que el ruido de las lámparas
actuales de xenón es significativamente peor que el de las lámparas de deuterio o
wolframio, las lámparas de xenón se utilizan sólo para aplicaciones como medidas de
reflectancia difusa, en las que el factor principal en una intensidad elevada. [Owen, 2000].
VIRIDIANA PÉREZ LÓPEZ Página 80
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
2.-Dispositivos de dispersión
Estos dispositivos causan que diferentes longitudes de onda de luz sean dispersadas
con ángulos distintos. Cuando se combinan con una rendija adecuada de salida, pueden
utilizarse para seleccionar una longitud de onda (o, más exactamente, una estrecha
banda de onda) de luz de una fuente continua. Comúnmente, se utilizan dos dispositivos
de dispersión, prismas y redes holográficas de difracción, en los espectrofotómetros UV-
visible.
a) Prismas: cuando la luz solar incide sobre un prisma, se genera un arcoíris. Este
principio se utiliza en los espectrofotómetros. Los prismas son simples y baratos,
pero la dispersión resultante es angularmente no lineal (Figura II.8.a), Además, el
ángulo de dispersión depende de la temperatura. Por esto, la mayoría de los
espectrofotómetros modernos contienen redes holográficas en lugar de prismas.
b) Redes holográficas: estos dispositivos son de cristal, en los que se realizan
hendiduras muy estrechas. Tradicionalmente esto se realizaba mecánicamente,
pero actualmente se utiliza un proceso óptico holográfico. Las dimensiones de
las hendiduras son del mismo orden que las longitudes de onda de la luz que se
va dispersar.
Finalmente, se aplica un recubrimiento de aluminio para crear una superficie reflectante.
La luz que incide sobre la red se refleja con diferentes ángulos, dependiendo de λ. Las
redes holográficas producen una dispersión angular lineal con la longitud de onda y son
insensibles a la temperatura. Sin embargo, reflejan luz de diferentes órdenes, que se
solapan (Figura II.8.b).
Como resultado, deben utilizarse filtros para asegurar que sólo la luz del orden deseado
alcanza el detector. Una red cóncava dispersa y enfoca la luz, simultáneamente.
VIRIDIANA PÉREZ LÓPEZ Página 81
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura II.8. Dispositivos de dispersión (a) prisma y (b) Red de difracción. [Owen, 2000].
3.-Monocromador
Un monocromador consta de una rendija de entrada, un dispositivo de dispersión y una
rendija de salida. Idealmente, lo que sale es luz monocromática. En la práctica, sin
embargo, es una banda, óptimamente, simétrica.
La anchura de la banda a la mitad de su altura, es la anchura de banda instrumental
(IBW). [Sturm, 2012].
4.-Detector
Un detector convierte una señal de luz en una señal eléctrica. Idealmente, debe ofrecer
una respuesta lineal en un amplio rango, con bajo ruido y alta sensibilidad.
Normalmente, los espectrofotómetros contienen un tubo fotomultiplicador o un tubo
fotodiodo, como detector.
a) Tubo fotomultiplicador (Figura II.9): combina la conversión de la señal con varias
etapas de amplificación, dentro del cuerpo del tubo. El material del cátodo
determina la sensibilidad espectral. Un solo fotomultiplicador da lugar a una
buena sensibilidad en el rango UV-visible completo.
VIRIDIANA PÉREZ LÓPEZ Página 82
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Este tipo de detector ofrece alta sensibilidad a bajos niveles de luz. Sin embargo,
en aplicaciones analíticas espectroscópicas, una alta sensibilidad está asociada
con bajas concentraciones, lo que resulta en bajas absorbancias, lo que al final
da lugar a altos niveles de intensidad. Para detectar con exactitud pequeñas
diferencias entre las medidas de blanco y de muestra, el detector debe tener bajo
ruido a altos niveles de intensidad.
Figura II.9. Detector de tubo fotomultiplicador. [Owen, 2000].
b) Fotodiodos (Figura II.10): Tienen un rango dinámico más ancho y son más
robustos que los fotomultiplicadores. En un fotodiodo, la luz que incide sobre el
material semiconductor permite que los electrones fluyan a través, reduciendo la
carga en un condensador conectado a él. La carga necesaria para recargar el
condensador, a intervalos regulares, es proporcional a la intensidad de la luz. Los
primeros fotodiodos tenían baja sensibilidad en el rango UV, pero este problema
se ha corregido en los detectores modernos. Los límites de detección son,
aproximadamente, 170–1100 nm para detectores de silicio.
Figura II.10. Detector de fotodiodos [Owen, 2000].
VIRIDIANA PÉREZ LÓPEZ Página 83
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
5.-Óptica
Para transmitir y enfocar la luz por el instrumento, se utilizan lentes o espejos cóncavos.
Las lentes son baratas pero sufren de aberración cromática, es decir, luz de diferentes
longitudes de onda no se enfoca en exactamente el mismo punto del espacio.
Sin embargo, con un diseño cuidadoso, la aberración cromática de las lentes
individuales de un sistema óptico, puede utilizarse para cancelarse mutuamente, y
puede construirse un sistema óptico eficaz con estos componentes simples y baratos.
Las lentes acromáticas combinan múltiples lentes de diferentes cristales con distintos
índices de refracción, en una lente bastante libre de aberración cromática. Estas lentes
se utilizan en las cámaras. Ofrecen un buen rendimiento, pero a un coste relativamente
alto. Los espejos cóncavos son menos costosos de fabricar que las lentes acromáticas,
completamente libres de aberración. Aún así, la superficie de aluminio se corroe
fácilmente, resultando en una pérdida de eficacia. En cada superficie óptica, incluyendo
las interfases entre los componentes de una lente acromática, el 5–10 % de la luz se
pierde por absorbancia o reflexión. Por lo tanto, idealmente, los espectrofotómetros
deberían estar diseñados con un mínimo número de superficies ópticas. [Sturm, 2012].
II.1.3. Muestras
Idealmente, los porta muestras (las cubetas) deberían ser completamente transparentes
a todas las longitudes de onda, ya que la absorbancia de la propia cubeta reduce el
rango dinámico lineal efectivo para la muestra.
Tenemos tres tipos de cubetas:
a) Cubetas de plástico: normalmente acrílico y son las más baratas. Estas cubetas
no son resistentes a todos los disolventes y absorben fuertemente por debajo de
VIRIDIANA PÉREZ LÓPEZ Página 84
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
300 nm, haciéndolas inadecuadas para medir en esta región. La consistencia
(absorbancia y paso óptico) puede variar entre cubetas, depende del fabricante.
b) Cubetas de vidrio: son ligeramente más caras que las de plástico pero son más
duraderas y, con el cuidado apropiado, pueden durar años. El vidrio absorbe por
debajo de 320 nm y por tanto, no es adecuado para medir en esta área.
c) Cubetas de cuarzo fundido: son razonablemente transparentes por debajo de
210 nm. Las mejores cubetas son de sílice fundida sintética de alta pureza, siendo
razonablemente transparentes por debajo de 190 nm.
Puede disponerse de cubetas de flujo de varios tamaños de apertura y geometrías, con
amplio rango de paso óptico. La cubeta más utilizada es la rectangular abierta (Figura
II.11a.). Estas cubetas pueden tener pasos ópticos de 1 a 100 mm, pero el más popular es
10 mm. Si el volumen de muestra es muy limitado, pueden utilizarse microcubetas que
reducen la apertura del área de muestra a una sección muy pequeña (2 × 2.5 mm). Sólo
se requieren aproximadamente 60 𝜇𝐿 de muestra para medir.
Con ultramicrocubetas especiales, pueden medirse volúmenes por debajo de 5 𝜇𝐿. Para
aplicaciones automatizadas, se utilizan cubetas de flujo (Figura II.11b). Las cubetas
modernas se conectan a un tubo de transferencia de muestra.
Figura II.11. (a) Cubetas estándar, (b) cubeta con apertura. [Owen, 2000].
VIRIDIANA PÉREZ LÓPEZ Página 85
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.1.3.1. Disolvente, concentración, pH y temperatura
Varios factores, que incluyen el disolvente utilizado, junto con la concentración, pH y
temperatura de la muestra, pueden afectar a la posición e intensidad de las bandas de
absorción de las moléculas. Estos parámetros deben controlarse para asegurar máxima
precisión y para poder comparar espectros medidos bajo diferentes condiciones.
La polaridad de un disolvente puede modificar el entorno electrónico de un cromóforo
absorbente. En general, la magnitud de la variación puede correlacionarse con la
polaridad del disolvente. Por tanto, por ejemplo, el máximo de absorción de la acetona
puede variar de 259 a 279 nm, dependiendo del disolvente. Para análisis comparativo,
debe utilizarse un solo disolvente para todas las medidas. [Sturm, 2012].
La concentración, normalmente, sólo afecta a la intensidad de las bandas. A
concentraciones más altas, sin embargo, las interacciones moleculares (por ejemplo,
dimerización) pueden causar cambios en la forma y posición de la banda de
absorbancia. En último término, estos cambios afectan a la linealidad de la
concentración frente a la relación de absorbancia y puede llevar a resultados
cuantitativos inexactos.
Los efectos del pH sobre los espectros de absorbancia pueden ser muy grandes y
resultar, principalmente, de las variaciones del equilibrio entre dos formas diferentes.
Por ejemplo, los indicadores de pH cambian de color a diferentes valores. Si el espectro
de la muestra se afecta por el pH, debe utilizarse un regulador para controlar este
parámetro. Sin embargo, que la mayoría de los reguladores exhiben una absorbancia
significativa, lo que puede afectar al rango de longitud de onda sobre el que pueden
realizarse las medidas.
VIRIDIANA PÉREZ LÓPEZ Página 86
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La temperatura también puede afectar a las medidas UV-visible. Una simple expansión,
especialmente en algunos disolventes orgánicos, puede ser suficiente para cambiar la
absorbancia aparente y, por lo tanto, la exactitud de los resultados cuantitativos.
Además, la temperatura puede afectar a los equilibrios, químicos o físicos.
Finalmente, sobre todo en disolventes orgánicos, pueden ser significativos los cambios
del índice de refracción con la temperatura. Si las corrientes de convección causan que
haya diferencias de temperatura en distintas partes de la cubeta, el efecto Schlieren
resultante puede cambiar la absorbancia aparente. Si se observa que la temperatura
tiene efecto considerable sobre las medidas, debe controlarse este parámetro utilizando
un soporte termostatizado. Este puede ser un simple soporte envuelto por agua,
utilizado junto a un baño de agua circulante, o un controlador Peltier de temperatura,
más sofisticado. Con disolventes orgánicos, es aconsejable utilizar una cubeta cerrada
para minimizar el efecto Schlieren. [Arena et. al., 2004].
II.2. Microscopia electrónica de transmisión (TEM)
La microscopia electrónica de transmisión (TEM) tiene como objetivo determinar la
forma y distribución de tamaños de las nanopartículas. A su vez, en las micrografías
obtenidas durante el análisis, se puede observar si las nanopartículas se encuentran
dispersas o aglomeradas.
TEM del inglés “Transmission Electron Microscopy”. Los electrones difractados al pasar
a través de la muestra generan un difractograma que puede ser transformado
directamente en imagen mediante lentes magnéticas que es la proyección de la
estructura cristalina a lo largo de la dirección de los electrones.
Tanto el difractograma de electrones como la imagen reconstruida se pueden proyectar
en una pantalla. [Anónimo, 2005].
VIRIDIANA PÉREZ LÓPEZ Página 87
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.2.1. Fundamento teórico
La microscopía electrónica de transmisión (TEM) es una técnica que se basa en incidir
sobre una muestra delgada un haz de electrones de densidad de corriente uniforme
con una energía en el rango de 100 a 200 keV. Al irradiar la muestra con el haz de
electrones algunos son transmitidos, otros dispersados y otros dan lugar a distintos
fenómenos como la emisión de luz, electrones secundarios o rayos X. (Figura II.12).
La información a partir de los electrones transmitidos es en forma de imágenes de la
muestra por películas fotográficas o pantallas fluorescentes y es la base de TEM. La
transmisión y la dispersión de los electrones se emplean para la formación de imágenes
de la muestra, la difracción de los electrones permite conocer la estructura cristalina de
ella y la emisión de rayos X se utiliza para obtener información acerca de la composición
elemental de la muestra. [Neira, 2015].
Figura II.12. Señales generadas por un haz de electrones en una muestra. [Pescador, 2006].
VIRIDIANA PÉREZ LÓPEZ Página 88
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.2.1.1. Resolución
El concepto de resolución está relacionado con la capacidad de distinguir detalles finos
en una imagen. Se puede definir como la mínima distancia medible entre dos objetos
para ser distinguidos separadamente.
Cuando rayos de luz emanan de un punto y pasan a través de una lente con apertura
semiangular, forman la imagen de un punto, con una intensidad difusa alrededor de él,
llamada disco de Airy. [Heimendahi, 1980]. Este fenómeno es debido al efecto de difracción
producido por las imperfecciones de la lente. Si se grafica la distribución de intensidades
a su alrededor, se puede asumir que toda la intensidad está concentrada en una región
de diámetro 𝑑1 , siendo:
1
𝑑1 = (𝑑𝑖𝑎𝑚𝑒𝑡𝑟𝑜 𝑑𝑒 𝑎𝑝𝑒𝑟𝑡𝑢𝑟𝑎) …Ecuación 2.5
Si en lugar de un objeto tenemos dos objetos puntuales separados una distancia 𝑑.
Según el criterio propuesto por Rayleigh, estos dos puntos podrán distinguirse cuando
el máximo de intensidad de un disco de Airy coincide con el primer mínimo del segundo
𝑑1
disco. De acuerdo con esto, es fácil ver que la distancia 𝑑 deberá ser mayor que para
2
𝑑1
reconocer los puntos como entidades individuales. El valor se denomina límite de
2
𝑑1
resolución. Para distancias menores que , los puntos aparecerán como una mancha
2
difusa y será imposible discriminarlos. (Figura II.13).
Figura II.13. Distribución de intensidad de resolución. [Heimendahi, 1980].
VIRIDIANA PÉREZ LÓPEZ Página 89
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
De la teoría de difracción de Rayleigh, podemos derivar:
0.61 𝑥 𝜆
𝑟1 = 𝑑1 = …Ecuación II.6
2 𝜇 𝑥 𝑠𝑖𝑛 𝛼
Donde:
𝑟1: es la longitud de onda de la luz
𝜇 : es el índice de refracción del medio entre el objeto y la lente.
El denominador de la expresión anterior se le llama apertura numérica (NA).
Es importante notar, que la separación entre puntos no depende de alguna propiedad
de la lente excepto de su apertura semiangular. En un microscopio de luz usando aceite
de inmersión para aumentar 𝜇, empleando luz verde con una longitud de onda de 400
nm y una apertura numérica de 1.4, el límite de resolución es de 2000 Å
aproximadamente.
En un microscopio electrónico, las lentes generan campos magnéticos y no hay cambio
apreciable en el índice de refracción cuando los electrones pasan a través de ellos. Por
esta razón, se asume un valor de 𝜇 = 1 .
Además, los ángulos en los que se desvían los rayos al ser desviados por la lente son
pequeños y puede hacerse la aproximación sin 𝛼 tan 𝛼 con cierto grado de precisión.
[Anónimo, 2005]. Con lo asumido anteriormente, la resolución teórica del microscopio
electrónico es:
Para valores de 𝜆 = 0.037 Å y 𝛼 = 0.1 radianes, La resolución nominal es 0.2 Å.
…Ecuación II.7
0.61 𝑥 𝜆
𝑟1 = 𝛼
VIRIDIANA PÉREZ LÓPEZ Página 90
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.2.2. Instrumentación
Un microscopio electrónico de transmisión está formado por tres componentes
principales que son: una columna óptica eléctrica, un sistema de vacío y el sistema de
control y registro.
El elemento más importante es la columna, cuyo corte se observa en la figura II.12.
Algunas características pueden variar según el diseño del constructor, sin embargo
presentan los mismos componentes y las diferencias se muestran más bien en el número
y calidad de los lentes electromagnéticos, medios de control y sistemas de vacío. [Guerra,
1991].
La formación de la imagen de resultado puede ser en campo claro (con el haz
transmitido), en campo oscuro (con electrones dispersados) o imagen difractada.
[Heimendahi, 1980].
Figura II.14. Esquema de una columna de TEM. [Lozano et. al., 2014].
VIRIDIANA PÉREZ LÓPEZ Página 91
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1.-Cañón electrónico
El tipo más usa de cañón electrónico consiste de un filamento de alambre de tungsteno
doblado en forma de V. El electrodo de control se denomina cilindro de Wehnelt, y tiene
una apertura de 1 a 3 mm de diámetro centrada en el ápice del filamento. La superficie
cóncava hace las funciones de ánodo y utilizando una superficie convexa la imagen de
la fuente electrónica puede reducirse en tamaño respecto al electrodo cóncavo. La
intensidad total del haz de cátodo a ánodo puede ser de 10 a 300 microamperios, pero
solamente una pequeña fracción de este llega hasta la muestra. [Naik, 2000].
2.-Condensadores
Los dos condensadores son capaces de dar una amplia gama de intensidad ajustando
el cañón electrónico. Esto reduce el área iluminada en la muestra, sin embargo, otras
partes de la muestra también sufren los efectos del haz electrónico. El primer
condensador reduce la imagen de la fuente mientras que el segundo condensador
obtiene la adecuada intensidad de eliminación.
3.-Plataforma para la colocación de la muestra
La plataforma para colocar la muestra está situada en frente del objetivo. Se introduce
la muestra en la columna del microscopio a través de una abertura.
4.-Objetivo
Es la lente más importante en el microscopio electrónico. La distancia focal de esta lente
está comprendida entre 1 y 5 milímetros, siendo 1.1 mm la más frecuente. Cuando menor
es la distancia focal, mayor es la resolución. Debido a que el haz tiene la máxima
apertura angular en el primero objetivo, esta lente controla la calidad de la imagen
producida.
VIRIDIANA PÉREZ LÓPEZ Página 92
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Otro accesorio importante, permite regular la apertura del objetivo, la cual limita la
dispersión de los electrones, evitando así la degradación de la imagen. Esta apertura
mejora el contraste de 20 y 40 micrómetros os más frecuentes. [Ribadeneira, 1998].
5.-Lente intermedia
La lente intermedia puede aumentar o disminuir la imagen, Se puede conseguir esto,
aumentado o disminuyendo la imagen real sobre la pantalla fluorescente y permite una
amplia gama de aumentos. Se puede variar la ampliación de 199 por hasta 3000.00X
usando lentes intermedias y de proyecciones. Los lentes electromagnéticos son
variables, mediante la variación de la corriente que pasa a través de su bobina, esto
permite variar la distancia focal, la misma que determina el poder de amplificación.
6.-Cámara de observación
La cámara de observación y la pantalla fluorescente están situada en el fondo de la
columna. La imagen enfoca sobre un punto marcado y l enfoque fino se consigue con
unos binoculares de 6 a 10 X. El diámetro del punto de enfoque es de 100 micrómetros,
por lo tanto debe ser mayor que este diámetro para ser resuelta. La cámara de
observación está protegida por un vidrio grueso de plomo para evitar la emisión de
rayos X.
6.-Pantalla fluorescente
La misma que es la emite luz cuando los electrones se impactan a gran velocidad. La
trayectoria completa del haz de electrones, desde la fuente hasta la pantalla, debe
realizarse a través de una unidad sellada y a vacío, porque los electrones son fácilmente
detenidos o desviados por los átomos. [Ribadeneira, 1998].
VIRIDIANA PÉREZ LÓPEZ Página 93
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
6.-Cámara fotográfica
Está situada debajo de la planta fluorescente. La pantalla fluorescente está sujeta por un
lado y al quitar el paso del haz electrónico la imagen se centra sobre la película
fotográfica, Se pueden usar varios tipos de película y placas de vidrio.
II.2.3. Muestras
Para utilizar un microscopio electrónico de transmisión debe cortarse la muestra en
capas finas, no mayores de un par de miles de angstroms. Muchas muestras se
transforman ya que pueden perder el agua de hidratación o las moléculas orgánicas se
pueden volatilizar o reaccionar
El porta muestras debe ser transparente a los electrones (espesor entre 10 y 500nm)
La muestra sobre rejilla o anillo circular perpendicular al eje óptico del microscopio y
cerca del foco delante del objetivo.
Las partículas pequeñas, microorganismos, virus y macromoléculas necesitar una
película que actué como soporte. La muestra puede desplazarse lateralmente 1mm.
Algunos porta muestras se pueden calentar. [Kevtun e. al., 2007]
II.3. Espectroscopia de absorción molecular infrarroja por
transformadas de Fourier
La espectroscopia de infrarrojo técnica analítica instrumental que permite conocer los
grupos funcionales presentes en la muestra, así como, de los enlaces que ésta presenta
inorgánicos u organometálicos que contienen átomos pesados (masa atómica superior
a 19) y proporciona información útil de sus estudios estructurales.
VIRIDIANA PÉREZ LÓPEZ Página 94
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Para que una molécula absorba energía en el IR, los enlaces deben vibrar con la misma
frecuencia que la energía incidente para así sufrir un tránsito energético a un estado
vibracional superior al que se encuentra inicialmente, siempre y cuando éste emita un
cambio en el momento dipolar de la molécula.
La espectroscopia de absorción infrarroja (IR) recibe su nombre de la región del espectro
electromagnético implicada. La región del espectro IR normal queda comprendida entre
4000 𝑐𝑚−1 𝑦 666 𝑐𝑚−1 . Tabla II.2. [Mata et. al., 2017].
II.2. Tabla de regiones del espectro infrarrojo. [Piqué et. al., 2012].
REGIÓN LONGITUD DE Número De onda Frecuencia Hz
ONDA λ cm -1
Cercana 0.78 a 2.5 128000 a 4000 3.8 𝑥 1014 𝑎 12 𝑥 1014
Media 2.5 a 50 4000 a 200 1.2 𝑥 1014 𝑎 6 𝑥 1012
Lejana 500 a 1000 200 a 10 6 𝑥 1012 𝑎 3 𝑥 1011
La más utilizada 2.5 a 15 4000 a 670 1.2 𝑥 1014 𝑎 2 𝑥 1013
II.3.1. Fundamento teórico
Como primera aproximación, un espectro IR se obtiene al pasar radiación a través de
una muestra y determinar que fracción de esta radiación incidente ha sido absorbida.
La energía particular a la que aparece cada pico en un espectro guarda relación con la
frecuencia de vibración de una parte de la molécula.
El espectro de infrarrojo de un compuesto es una representación gráfica de los valores
de onda (𝜇) o de frecuencia (𝑐𝑚−1 ) ante los valores de % de transmitancia (%𝑇). La
absorción de radiación IR por un compuesto a una longitud de onda dada, origina un
descenso en el %𝑇, lo que se pone de manifiesto en el espectro en forma de un pico o
banda de absorción. [Arellano, 2016].
VIRIDIANA PÉREZ LÓPEZ Página 95
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.3.1.1. Modelo mecánico-cuántico de vibraciones: oscilador armónico.
En el caso concreto de la absorción de radiación infrarroja, es posible adoptar un
modelo clásico, visual e intuitivo, que matizado desde el punto de vista de la mecánica
cuántica ilustra la aparición de los espectros en función de los movimientos vibratorios
en la molécula. Una simple molécula diatómica como el monóxido de carbono (C≡O)
mantiene unidos sus átomos mediante el solapamiento de varios orbitales.
A una cierta distancia internuclear hay un balance entre las fuerzas atractivas y las
interacciones repulsivas que tienen lugar entre los electrones internos de los dos
átomos. Esta distancia de equilibrio se puede modificar suministrando energía, y en este
sentido podemos pensar en la molécula como dos masas conectadas por un resorte: un
enlace químico actuaría como un muelle que conecta dos átomos con masas M1 y M2 .
[Murillo, 2006]
Las masas vibran con unas frecuencias características que dependen de ellas y de la
fortaleza del muelle (k) según la expresión de la física clásica:
1 k
v= √μ …Ecuación II.10
2π
M1 x M 2
μ= …Ecuación II.11
M1 +M2
Donde:
ν : La frecuencia natural de vibración de las masas
k : La constante de fuerza del muelle (enlace químico) que es una de medida de su
rigidez
μ : La masa reducida.
VIRIDIANA PÉREZ LÓPEZ Página 96
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Las tendencias que marca esta expresión se observan experimentalmente y por tanto
permiten su aplicación con cierto logro:
Cuanto más fuertes o rígidos son los enlaces químicos mayores son las
frecuencias observadas.
Las masas atómicas menores tienden a originar frecuencias mayores.
Los cambios en la frecuencia debidos a las masas se aprecian bien cuando el hidrógeno
se sustituye por deuterio. Así, es frecuente conseguir asignaciones de las vibraciones de
diferentes partes de una molécula observando los cambios de los espectros
vibracionales al realizar sustituciones isotópicas.
A pesar del auge de esta analogía, encontramos limitaciones en algunos aspectos, sobre
todo en los extremos de la vibración donde esta expresión debería contemplar por un
lado la repulsión interelectrónica y por otro la posible disociación de la molécula.
Además, a escala atómica la teoría cuántica requiere que sólo sean posibles ciertos
niveles de energía, en otras palabras, el “muelle molecular” sólo podría ser estirado en
porciones de magnitud determinada. [Murillo, 2006]. Así, una vez realizada esta transición
entre la mecánica clásica y la cuántica, la solución de la ecuación de Schrödinger para
un oscilador armónico de masa 𝜇 muestra que las energías permitidas son:
1
𝐸 = ℎ𝑣 (𝑣 + ) … 𝐸𝑐𝑢𝑎𝑐𝑖ó𝑛 𝐼𝐼. 12
2
Donde:
𝐸 : Energías érmitidas
ℎ𝑣 : Separación de dos niveles
VIRIDIANA PÉREZ LÓPEZ Página 97
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II.3.1.2. Modos normales de vibración
Las vibraciones en moléculas poliatómicas son mucho más complejas que en la simple
molécula diatómica que sólo puede vibrar en un modo (stretching). El número de modos
independientes de vibración en una molécula de N átomos se calcula asumiendo que
el movimiento de cada átomo se puede describir en términos de desplazamientos a lo
largo de tres direcciones espaciales, de modo que tendremos 3N desplazamientos a
considerar (la molécula posee 3N grados de libertad) (Tabla II.3.).
Tres combinaciones de esos desplazamientos resultan en el movimiento en el espacio
de toda la molécula y por tanto se corresponden con traslaciones de su centro de masas.
[Piqué, 2012].
Tabla. II.3 Modos de vibración en una molécula. [Piqué et. al., 2012].
Movimiento Grados de libertad requeridos para
describir el movimiento
Traslación (centro de masas) 3
Rotación (en torno al centro de masas) 2 (para moléculas lineales) 3 (para
moléculas no lineales)
Vibración 3N-5 (para moléculas lineales) 3N-6 (para
moléculas no lineales)
Si la molécula es no-lineal, otras tres combinaciones de desplazamientos especifican la
rotación de toda la molécula alrededor de su centro de masas, por lo que quedan 3N-
6 combinaciones de desplazamientos en los átomos que dejan el centro de masas y la
orientación de la molécula inalterados, y que son las distorsiones de la molécula que
nos interesan. (Figura II.15)
VIRIDIANA PÉREZ LÓPEZ Página 98
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura II.15. Modos de vibración en una molécula [Piqué et. al., 2012].
Estos modos normales son por tanto movimientos particulares del colectivo de átomos
que conforman la molécula, independientes unos de otros y con su frecuencia de
vibración característica. Estos cambios de posición de los elementos de una molécula
no pueden realizarse de manera discontinua sino que requieren la absorción de cierta
cantidad de energía.
Para que sea posible la absorción de la energía infrarroja por parte de una sustancia, es
necesario que la energía que incide sobre ella, sea del mismo valor que la energía de
vibración que poseen las moléculas de esa sustancia. Ya que en una molécula existen
diferentes átomos que forman distintos enlaces, en el espectro de infrarrojo aparecerán
bandas de absorción a distintos valores de frecuencia y de longitud de onda. [Mondragón,
2017].
La región situada ente 1400 𝑦 4000 𝑐𝑚−1 , es de especial utilidad para la identificación
de la mayoría de los grupos funcionales presentes en las moléculas orgánicas. Las
absorciones que aparecen en esta zona, proceden fundamentalmente de las vibraciones
de estiramiento.
VIRIDIANA PÉREZ LÓPEZ Página 99
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La zona situada a la derecha de 1400 𝑐𝑚−1 , es por lo general, compleja, debido a que
en ella aparecen vibraciones de alargamiento como de flexión. Cada compuesto tiene
una absorción característica en esta región, esta parte del aspecto se denomina como
la región de las huellas dactilares.
II.3.2. Instrumentación
Existen dos tipos de espectrómetros infrarrojos, los dispersivos y los de transformada de
Fourier. Por lo que respecta al IR, existen espectrofotómetros comerciales desde 1940,
aunque los avances más significativos en la técnica se produjeron con el desarrollo de
instrumentos que incorporan el método de transformada de Fourier (FT-IR), que ha
mejorado la calidad de los espectros, los obtienen con más rapidez ya que la energía
absorbida por la molécula es medida a la vez que todas as longitudes de onda en la
zona espectral del infrarrojo y minimizado el tiempo requerido para la obtención de
datos. Además la identificación de la longitud de onda que incide es mucho más exacta,
la perdida de intensidad de la radiación en un recorrido a la muestra es mucho menos
pues posee menos elementos por los que pase la radiación electromagnética. [Serrano,
2014].
El espectro IR se puede usar como “huella dactilar” en la identificación de muestras
desconocidas mediante la comparación con espectros de referencia. [Andújar et. al., 2013].
Los componentes de un espectrómetro infrarrojo:
Fuente de radiación (radiación continua)
Sistema óptico de dispersión.
Sistema de detección
VIRIDIANA PÉREZ LÓPEZ Página 100
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura. II.16. Esquema general de un espectrómetro IR-FT. [Andújar et. al., 2013].
1.-Fuente
Tienen un sólido inerte que se calienta eléctricamente hasta un T>1500°C como por
ejemplo óxidos de zirconio.
a) Con arco de mercurio: Se usa en aplicaciones en el infrarrojo lejano, Consiste en
un tubo de cuarzo que contiene mercurio a una presión mayor de 1 atm, a raves
de la cual se hace pasar una corriente eléctrica que forma un plasma interno,
emisor de radiación.
VIRIDIANA PÉREZ LÓPEZ Página 101
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
b) Filamento de Nernst: formado por un tubo de cerámica (óxidos de zirconio, itrio
y torio), que al ser calentado eléctricamente alcanza hasta 1900° y produce
radiación IR con valores de 4000 -200 cm-1.
c) Bobina de Nicrom: formado por espirales de Níquel -Cromo, que al ser sometidos
a corriente eléctrica alcanzan una temperatura de hasta 1100°, produce una radiación
IR en el intervalo de 4000 -200 cm-1.
d) Fuente globar: El globar es una barra de carburo de silicio con calentamiento
eléctrico de uno 5cm de longitud y 3 mm de diámetro, Esta fuente suele producir
una radiación IR más intensa que la lámpara de Nerst. A número de onda menor
a 2000 cm-1.
2.-Detector
Su función es convertir la radiación en una señal eléctrica.
a) Detectores térmicos: Funcionan midiendo los efectos de calentamiento de la
radiación IR sobre un componente diseñado para actuar como cuerpo negro.
b) Detectores Fotoconductores: Consiste en una capa semiconductora delgada, de
un material como telurio de cadmio, que recubre una superficie no conductora
de vidrio encerrada en una envolvente de vidrio a vacío. La exposición del
semiconductor a la radiación IR eleva electores de valencia, desde estados no
conductores hasta estados conductores, aumentando así la conductividad del
dispositivo.
c) Detectores piroeléctricos: Están compuestos por una capa de material
piroeléctrico (sulfato de triglicina deuterada) emparedada entre dos electrodos
(transparente a la radiación IR) que forman un capacitos.
VIRIDIANA PÉREZ LÓPEZ Página 102
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
II 3.3. Muestra
Manejo clásico:
Cuando los sólidos no pueden disolverse en disolventes trasparentes en el IR pueden
ser suspendidos en un medio trasparente apropiado formando una mezcla de dos fases.
Una característica importante es que el tamaño de partícula del sólido suspendido debe
ser menor que la longitud de onda de la radiación ya que si no se cumple esta condición
se pierde parte de la radiación por dispersión. Las técnicas comunes son dos:
1. Técnica del Amasado. Consiste en triturar finamente de 2 a 5 mgrs. de la muestra
en estudio (tamaño de partícula menor de 2 𝜇𝑚), colocar en un portaobjetos una
cantidad mínima de estos cristales y agregar de 1 o 2 gotas de aceite pesado de
hidrocarburo (Nujol). Si interfieren las bandas de hidrocarburos, puede usarse
fluoroluble o perfluorkerosena, y con la esquina del portaobjetos o con una
espátula hacemos una “masa”. Se toma una gota de la muestra y se pone en la
ventana de NaCl.
2. Técnica de Pastillaje. Un miligramo de la muestra finamente triturada se mezcla
íntimamente con 100 mgr. de polvo de KBr desecado. La mezcla puede hacerse
en un mortero de ágata. Después se vierte con una espátula y con mucho
cuidado la cantidad suficiente de muestra para cubrir la matriz, para uniformar la
superficie cubierta se le pueden dar golpecitos. Después se cubre con el émbolo
y se le lleva a un prensa hidráulica a 240 Kg/cm2 para obtener un disco
trasparente, al llegar a esa presión se deja unos 2 minutos y se descomprime
lentamente para evitar la ruptura de la pastilla. Después el portamuestras que
contiene la pastilla se coloca en el paso del haz del instrumento colocando el
atenuador al 80% de transmitancia se corre el espectrograma y se obtiene el
espectro de absorción.
VIRIDIANA PÉREZ LÓPEZ Página 103
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
3. Film. Se recorta una cartulina de 4.9 cm de ancho por 7.6 cm de largo. A 2 cm de
uno de los extremos se dibuja una ranura exactamente centrada de 0.9 cm de
ancho por 2 cm de largo y se recorta. Sobre esta base se monta el polímero:
poliestireno, celofán, etc. Se pone frente al haz del aparato colocando el
atenuador de tal manera que el graficador quede al 80% de transmitancia y se
corre el espectrograma.
Manejo con accesorio de reflectancia total atenuada RTA o en ingles ATR:
Estos dispositivos son especialmente útiles para obtener espectros IR de muestras que
no pueden ser colocadas en soportes habituales para el método de transmisión.
Son apropiados para estudiar solidos gruesos insolubles o muy absorbentes, muestras
líquidas, incluyendo láminas, recubrimientos, polvos, hilos, adhesivos, polímeros y
muestras acuosas.
RTA requiere poca o ninguna preparación para la mayoría de las muestras y es una de
las técnicas de muestreo más versátiles.
VIRIDIANA PÉREZ LÓPEZ Página 104
CAPÍTULO III. DESARROLLO EXPERIMENTAL
Como ya se ha mencionado anteriormente, las propiedades ópticas son las de mayor
En el presente capítulos se muestran la preparación de la solución precursora para la
obtención de nanopartículas de oro por el método convencional y por química verde.
El procedimiento para la síntesis de nanopartículas de oro, es a partir del uso de los
agentes reductores inorgánicos tales como tartrato de sodio y potasio (𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 ) y
ácido ascórbico (𝐶6 𝐻8 𝑂6) y los agentes reductores orgánicos (aloe vera y uva morada),
estos reductores se hacen reaccionar con el precursor 𝐻𝐴𝑢𝐶𝑙4. Las soluciones obtenidas
se tratan para su análisis en el espectrofotómetro UV-VIS lambda 25 Perkin Elmer (Anexo
A), espectrofotómetro IR-FT 65 Perkin Elmer (Anexo B) y microscopio electrónico de
transmisión JEOL- JEM-ARM200CF (Anexo C).
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.1. Preparación de la solución precursora de ácido
tetracloroaurico
Esta solución consiste en disolver una sal metálica precursora de 𝐻𝐴𝑢𝐶𝑙4 en 20 ml de
agua desionizada para obtener una concentración de 17 mM, seguida se trasvasa en un
matraz volumétrico y es aforada, obteniendo 100 ml de 𝐻𝐴𝑢𝐶𝑙4 (Figura III.1.). Con un
potenciómetro se toma lectura de pH de 2.77.
Pesar la sal de
Sal de 𝐻𝐴𝑢𝐶𝑙4
𝐻𝐴𝑢𝐶𝑙4
Disolver la sal de 𝐻𝐴𝑢𝐶𝑙4
Aforar a 100 ml con agua desionizada
Figura III.1. Diagrama de preparación de la solución precursora de 𝐻𝐴𝑢𝐶𝑙4 .
VIRIDIANA PÉREZ LÓPEZ Página 105
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.2. Preparación de soluciones de agentes reductores para
química convencional
III.2.1. Solución de tartrato de sodio y potasio
Elaborar una solución acuosa con el agente reductor 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 a una concentración
de 17mM, pesar una porción de la sal mixta y diluirla con 20 ml de agua desionizada,
trasvasar la mezcla a un matraz y aforar a 100 ml. (Figura III.2.). La solución mantiene un
pH de 6.59.
Sal de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Pesar gramos de
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6
Aforar a 100 ml Disolver el 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6
en agua desionizada
Figura III.2. Diagrama de preparación de solución de agente reductor de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 .
VIRIDIANA PÉREZ LÓPEZ Página 106
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.2.2. Soluciones madre de ácido ascórbico a diferentes concentraciones
𝑚𝑔
III.2.2.1. 𝐶6 𝐻8 𝑂6 a 100
𝐿
𝑚𝑔
Preparar 100 ml de solución para obtener una concentración de 100 , pesar el agente
𝐿
reductor 𝐶6 𝐻8 𝑂6 y diluir en 20 ml de agua desionizada, trasvasar y afora en un matraz
volumétrico (Figura III.3.), para obtener la lectura de pH de 3.84.
𝑚𝑜𝑙
III.2.2.2. 𝐶6 𝐻8 𝑂6 a 5𝑥10−4
𝐿
Colocar los gramos necesarios de sal de 𝐶6 𝐻8 𝑂6 para mantener una concentración de
𝑚𝑜𝑙
5𝑥10−4 , solubilizar la sal en una porción de 20 ml de agua desionizada y aforar a
𝐿
100 ml. (Figura III.3.) a la solución se le mide el pH de 3.83.
Sal de 𝐶6 𝐻8 𝑂6 Pesar los gramos de 𝐶6 𝐻8 𝑂6
Aforar a 100 ml Disolver el 𝐶6 𝐻8 𝑂6 con
agua desionizada
Figura III.3. Diagrama de preparación de soluciones madre de 𝐶6 𝐻8 𝑂6 a diferentes concentraciones.
VIRIDIANA PÉREZ LÓPEZ Página 107
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.3. Preparación de soluciones de agentes reductores para
química verde
III.3.1. Extracto de Aloe vera (Aloe Barbadensis)
Cortar una hoja de la planta de sábila (Aloe Barbadensis) con un utensilio de cerámica
para evitar la oxidación, posteriormente dejar derramar el acíbar durante un día, pesar,
lavar y secar para quitar el residuo de acíbar. Para extraer el gel, retirar la piel con un
espátula de plástico; mezclar el gel con 20 ml de agua desionizada y llevar a un sistema
de vacío para filtrar. (Figura III.4.). Se obtienen aproximadamente 30 ml de aloe vera con
un pH de 4.8.
Lavar y enjuagar con Retirar el exceso de Quitar la piel para extraer el
agua desionizada agua y pesar gel de aloe vera
El gel de aloe se filtra Mezclar el gel de aloe Pesar el gel de aloe
por un sistema de vacío vera con 20 ml de vera
agua desionizada
Figura III.4. Diagrama de la extracción de Aloe vera (Aloe Barbadensis).
VIRIDIANA PÉREZ LÓPEZ Página 108
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.3.2. Mosto de Uva (Vitis vinifera)
El mesocarpio de la uva es de donde se extrae el agente reductor que se utiliza para la
obtención de soluciones coloidales de oro, este es tratado previamente de la siguiente
manera, se lavan y secan las uvas en estudio, posteriormente se retirar el epicardio y la
pepita (semilla) quedando únicamente el mesocarpio. Para reducir su tamaño del
mesocarpio (pulpa) emplear un mortero y filtrar por medio de vacío (Figura III.5). A los
150 ml mosto se le mide un pH de 4.27.
Lavar con agua desionizada las
Retirar el epicardio y
uvas y hacer juague hasta
las semillas
observar lustrosa la superficie
Reducir y homogenizar
el epicardio
Filtrar el mosto de uva
Registrar el peso del
epicardio
Figura III.5. Diagrama de la extracción del mosto de Uva (Vitis vinífera).
VIRIDIANA PÉREZ LÓPEZ Página 109
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.4. Síntesis de nanopartículas de oro por química convencional
III.4.1. Nanopartículas de oro con tartrato de sodio y potasio
Las AuNP´s se sintetizan con 10 ml de agente reductor de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 con una
concentración fija de 17 mM (ver sección III.2.1.), se varia en el volumen de alícuota en un
orden de 15, 60 y 125 𝜇𝑙 de 𝐻𝐴𝑢𝐶𝑙4 . En el sistema de obtención de AuNP´s se observa
que el 𝐻𝐴𝑢𝐶𝑙4 y 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 deben mantener una temperatura de 80°C (Figura III.6.).
Se observan vasos de precipitado cubiertos con un vidrio de reloj, y tienen como
finalidad evitar la pérdida de solución coloidal, dejar durante 5 minutos en agitación y
calentamiento. Identificar el cambio de vire en cada una de las soluciones y retirar.
Calentamiento del
Acondicionamiento del
𝐻𝐴𝑢𝐶𝑙4
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 a 80° C
A 80°C
Con los ml de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Obtención de las AuNP´s
reducir el precursor de 𝐻𝐴𝑢𝐶𝑙4 al cambio de vire
Figura III.6. Diagrama de síntesis de AuNP’s con 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 .
VIRIDIANA PÉREZ LÓPEZ Página 110
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.4.2. Nanopartículas de oro con ácido ascórbico
Las AuNP´s son sintetizadas a partir del calentamiento previo de una alícuota de 1.5 ml
de 𝐻𝐴𝑢𝐶𝑙4 y variando el volumen 10 y 20 ml del agente reductor de 𝐶6 𝐻8 𝑂6 con una
concentración de 17 mM (ver sección III.2.2.1). La síntesis se lleva a cabo en dos intervalos
de tiempo en 5 y 10 minutos. Procurar que las soluciones se mangan en agitación
contante y calentamiento a 80°C al momento de adicionar el agente reductor
(Figura III. 7. ). Para evitar la pérdida de solución coloidal en el sistema, los vasos de
precipitados son cubiertos con vidrios de reloj.
Acondicionamiento del Calentamiento del 𝐻𝐴𝑢𝐶𝑙4
𝐶6 𝐻8 𝑂6 a 80°C
Se agregan los microlitros de Observar el cambio de
precursor al reductor vire hasta que se
estabilice.
Figura III.7. Diagrama de síntesis de AuNP’s con 𝐶6 𝐻8 𝑂6 .
VIRIDIANA PÉREZ LÓPEZ Página 111
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.5. Síntesis verde de nanopartículas de oro por química verde
III.5.1. Nanopartículas de oro con extracto de aloe vera
Para obtener las AuNP´s se presentan una serie de pruebas experimentales variando el
volumen del precursor 150, 155 y 1000 𝜇𝑙 de 𝐻𝐴𝑢𝐶𝑙4, el agente reductor de aloe vera es
preparado con 450 𝜇𝑙 y aforado a 10 ml. La síntesis debe mantener una temperatura
de 80°C y una agitación contante (ver sección III.3.1) durante un intervalo de tiempo de 5
minutos, evitar la pérdida de solución coloidal en el sistema de vasos de precipitados
con un vidrios de reloj (FiguraIII3.8)
Acondicionamiento del aloe
Calentar del 𝐻𝐴𝑢𝐶𝑙4 a 80°C
vera
Agregar los microlitros de Observar el cambio de vire
precursor al reductor hasta que se estabilice.
Figura III.8. Diagrama de síntesis de AuNP´s con Aloe vera.
VIRIDIANA PÉREZ LÓPEZ Página 112
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.5.2. Nanopartículas de oro con mosto de Uva.
Las AuNP´s se obtienen a partir de 5 ml del agente reductor de uva morada calentando
a una temperatura de 80°C y una agitación constante (ver sección III.3.2), para la
experimentación se toman una serie de alícuotas de solución precursora 𝐻𝐴𝑢𝐶𝑙4 de 30,
90 y 215 𝜇𝑙. Las soluciones coloidales deben mantenerse durante 5 minutos en agitación
y calentamiento no olvidar cubrir con un vidrio de reloj para evitar la pérdida de solución
coloidal. (Figura III.9.).
Acondicionamiento de Calentamiento del 𝐻𝐴𝑢𝐶𝑙4 a
uva morada 80°C
Agregar los microlitros Observar el cambio de vire
de precursor al hasta que se estabilice.
reductor
Figura III.9. Diagrama de síntesis de AuNP´s con uva.
VIRIDIANA PÉREZ LÓPEZ Página 113
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.6. Cuantificación de ácido ascórbico en los reductores orgánicos
naturales por la técnica de espectroscopia ultravioleta-visible (UV-
VIS)
III.6.1. Preparación de los agentes reductores: aloe vera y uva morada
Las soluciones de aloe vera y uva morada (ver sección III.3.), son preparadas a partir de la
dilución de su solución patrón concentrada, se toma un volumen de alícuota de 2
mililitros de cada una de ellas y es llevado a un matraz volumétrico de 10 ml, terminada
la solución se filtra con un acrodisco de 0.22 micras PTFE, para evitar interferencias en
sus lecturas de absorbancia por la técnica UV-VIS. Identifica la presencia de 𝐶6 𝐻8 𝑂6 en
los agentes reductores (Figura III.10.).
Tomar una alícuota de Medir los estándares
Aforar los estándares a 10
cada reductor orgánico en el UV-VIS
mililitros
Identificar las absorbancias en
la curva de calibración y Leer las absorbancias en
determinar la concentración de UV-VIS
𝐶6 𝐻8 𝑂6
Figura III.10. Diagrama de preparación de los agentes reductores: aloe vera y uva morada para
cuantificar 𝐶6 𝐻8 𝑂6 .
VIRIDIANA PÉREZ LÓPEZ Página 114
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.6.2. Preparación de la curva de calibración de Ácido Ascórbico
Elaborar 5 estándares a partir de una solución Madre de 𝐶6 𝐻8 𝑂6 cuya concentración es
𝑚𝑜𝑙
de 5𝑥10−4 , (ver sección III.2.2.2.). En la tabla III.1 se observa el volumen de alícuota
𝐿
tomada para cada estándar y es aforado a 10 ml con agua desionizada (Figura III.11), se
hace la medición de absorbancias para construir la curva de calibración. Las lecturas de
absorbancias se realizan en el espectrofotómetro UV-VIS lambda 25 Pekín Elmer.
Tabla III.1. Estándares de 𝐶6 𝐻8 𝑂6 .
Numero ml
1 0.5
2 1
3 1.5
4 2
5 2.5
Tomar alícuotas de Aforar a 10 ml con Estándares listos para tu
la solución madre agua desionizada lectura de absorbancia
Figura III.11. Diagrama de preparación de estándares para construir la curva de calibración.
Calcular los volúmenes para la preparación de los estándares en función de la ecuación
III.1 y el coeficiente de correlación lineal 𝑅 2 .
𝐶1 ∗ 𝑉1 = 𝐶2 ∗ 𝑉2 ………. Ecuación III.1.
VIRIDIANA PÉREZ LÓPEZ Página 115
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
𝐷𝑜𝑛𝑑𝑒:
𝑚𝑜𝑙
𝐶1 = 𝐶𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 𝑑𝑒 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝑚𝑎𝑑𝑟𝑒 𝑑𝑒 𝐶6 𝐻8 𝑂6 𝑒𝑛
𝐿
𝑉2 = 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑎𝑓𝑜𝑟𝑜 𝑑𝑒𝑙 𝑒𝑠𝑡𝑎𝑛𝑑𝑎𝑟 𝑒𝑛 𝑚𝑙
𝑚𝑜𝑙
𝐶2 = 𝐶𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 𝑑𝑒 𝑒𝑠𝑡𝑎𝑛𝑑𝑎𝑟 𝑒𝑛
𝐿
𝑚𝑜𝑙
𝑉1 = 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑎𝑙𝑖𝑐𝑢𝑜𝑡𝑎 𝑑𝑒 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝑚𝑎𝑑𝑟𝑒 𝑑𝑒 𝐶6 𝐻8 𝑂6 𝑒𝑛
𝐿
En la tabla III.2 se identifica el volumen de alícuota a utilizar para la preparación de
estándares para cuantificar 𝐶6 𝐻8 𝑂6 por el método de curva de calibración.
Tabla III.2. Concentraciones y volúmenes de los estándares de curva de calibración.
𝑉𝑎𝑓𝑜𝑟𝑜 𝑉 𝐶𝑚𝑜𝑙 𝐶𝑚𝑔
𝑎𝑙𝑖𝑐𝑢𝑜𝑡𝑎 𝐿 𝐿
10 𝑚𝐿 0.5 = 0.0005𝐿 2.5𝑥10−5 4.403
10 𝑚𝐿 1 𝑚𝐿 = 0.001𝐿 5𝑥10−5 8.806
10 𝑚𝐿 1.5 𝑚𝐿 = 0.0015𝐿 7.5𝑥10−5 13.209
10 𝑚𝐿 2 𝑚𝐿 = 0.002𝐿 1𝑥10−4 17.612
10 𝑚𝐿 2.5 𝑚𝐿 = 0.0025𝐿 1.25𝑥10−4 22.015
VIRIDIANA PÉREZ LÓPEZ Página 116
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.7. Secado de los reductores orgánicos para determinar grupos
funcionales por la técnica de FT-IR con el uso de ATR.
Secar los reductores a una temperatura de 80 °C para eliminar la humedad y llevar a
peso constante durante un intervalo aproximado de 4 horas. Obtenido el peso contante
de los reductores, son pulverizados en un mortero de ágata y se colocan en un
desecador para evitar la hidratación de estos, son analizados en el espectrómetro
infrarrojo Perkin Elmer 65 FT-IR. Figura 3.12. (Figura III.12).
Secar los reductores durante
Llevar a peso constante
4 horas
Resguardo de los reductores
Accesorio ATR con reductor secos
Figura III.12. Tratamiento y preparación de los agentes reductores: aloe vera y uva para su detección por
la técnica de IR.
VIRIDIANA PÉREZ LÓPEZ Página 117
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
III.8. Depósito de AuNP´s para determinación de tamaño por la
técnica de microscopia electrónica de transmisión (TEM)
A partir de las soluciones coloidales obtenidas se hace una dilución aproximadamente
50 𝜇𝐿 en un matraz aforado de 5 ml, se toma una alícuota de 50 𝜇𝐿 y se deposita sobre
una rejilla convencional (3mm de diámetro, material de cobre) por 48 horas se mantiene
en un desecador para eliminar la humedad de la rejilla y esté lista para su análisis (Figura
III.13).
Depositar las AuNP´s en
las rejillas
Rejillas con AuNP´s
depositadas
Figura III.13. Diagrama de rejillas con AuNP´s depositadas para TEM.
VIRIDIANA PÉREZ LÓPEZ Página 118
CAPÍTULO IV. RESULTADOS
La síntesis de nanopartículas de oro en esta investigación es comparar los métodos de
reducción convencional y por química verde. Se presenta el color característico de la
solución precursora de 𝐻𝐴𝑢𝐶𝑙4 , agentes reductores y de las soluciones coloidales de
oro y en los espectros de absorción se observan las longitudes de onda máximas de las
transiciones electrónicas de los cromóforos presentes por espectroscopia UV-VIS. Se
cuantifica por el método de curva de calibración el 𝐶6 𝐻8 𝑂6 contenido en el aloe vera y
uva morada. Se observan los espectros de IR producto del resultado del tratamiento
térmico del aloe vera y uva morada y por último el tamaño y forma de las nanopartículas
de oro por microscopia electrónica de transmisión (TEM).
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1. Caracterización por espectroscopia UV-VIS
IV.1.1. Precursor y soluciones de agentes reductores para química
convencional
La solución precursora de 𝐻𝐴𝑢𝐶𝑙4 en medio acuoso presenta un color amarillo con un
valor de pH = 2.77 fuertemente acido (ver figura IV.1), el color traslucido se refiere a los
agentes reductores de la sal mixta de KNaC4 H4 O6 cuyo pH=6.59 y pH=3.8 es
característico del C6 H8 O6 , sección III.1 y III.2 (ver figura IV.B y IV.C.)
B
A C
Figura IV.1. Soluciones A) precursora de HAuCl4 , B) y C) reductoras de KNaC4 H4 O6 y C6 H8 O6 .
El espectro de absorción por espectroscopia UV-VIS de la solución precursora de
𝐻𝐴𝑢𝐶𝑙4 presenta una longitud de onda máxima de 304 nm (ver figura IV.2) y las bandas
características para los agentes reductores de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 y 𝐶6 𝐻8 𝑂6 es 293 nm, y 264
nm (ver figuras IV.3 y IV.4.).
VIRIDIANA PÉREZ LÓPEZ Página 119
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1.2 304
0.8
Absorbancia,A (u.a.)
0.6
0.4
0.2
0
250 300 350 400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.2. Espectro de absorción de la solución precursora de HAuCL4 con un pH= 2.77.
1
293
0.9
0.8
Absorbancia,A (u.a.)
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
250 300 350 400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.3. Espectro de absorción de la solución de KNaC4 O6 con un pH= 6.59.
1.4 264
1.2
Absorbancia, A (u.a.)
0.8
0.6
0.4
0.2
0
200 220 240 260 280 300 320 340
Longitud de onda, λ (nm)
Figura IV.4. Espectro de absorción de la solución C6 H8 O6 con un pH= 3.80.
VIRIDIANA PÉREZ LÓPEZ Página 120
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1.2. Soluciones de los agentes reductores para química verde
Los extractos de aloe vera y uva morada preparados en la sección III.3, son incoloros
con una ligera turbidez dando un valor de pH = 4.8 y un pH = 4.27 comparativamente.
(Figura IV.5).
A B
Figura IV.5. Solución de extracto A) de Aloe vera y B) de Uva morada.
Los espectros de absorción para el reductor de aloe vera y del mosto de la uva morada
presentan longitudes de onda máxima en 264 nm y 270 nm. (Ver figura IV.6 y IV.7.).
1
0.9
0.8 264
Absorbancia,A (u.a.)
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
250 260 270 280 290 300 310 320 330 340 350
Longitud de onda, λ (nm)
Figura. IV.6. Espectro de absorción del aloe vera con pH= 4.80.
VIRIDIANA PÉREZ LÓPEZ Página 121
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1.2 270
Absorbancia,a (u.A 1
0.8
0.6
0.4
0.2
0
250 260 270 280 290 300 310 320 330 340 350
Longitud de onda, λ (nm)
Figura IV.7. Espectro de absorción del mosto de uva morada con pH= 4.27.
IV.1.3. Cuantificación de ácido ascórbico en los agentes reductores para
química verde
IV.1.3.1. Curva de calibración del ácido ascórbico
La cuantificación del C6 H8 O6 se hace mediante los estándares preparados (ver sección
III.6.1) y en la figura IV.8, se presentan sus espectros de absorción a una λmax = 264nm
característica del C6 H8 O6 .
1.2
1
Absorbancia,A (u.a.)
0.8
0.6
0.4
0.2
0
200 220 240 260 280 300 320 340
Longitud de onda, λ (nm)
Figura IV.8. Espectros de absorción de los estándares de C6 H8 O6 .
VIRIDIANA PÉREZ LÓPEZ Página 122
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La grafica de curva de calibración del 𝐶6 𝐻8 𝑂6 se observa en la figura IV.9, presenta una
𝑅 2 = 0.9988. Las concentraciones se determinan a partir de las lecturas de absorbancia
detectadas en el UV-VIS a una longitud de onda máxima de absorción de 264 nm. Las
soluciones se llevaron a dilución de 0.1:10 y 0.3:10 de aloe vera y uva morada
respectivamente. En la tabla IV.1 se observan las concentraciones características de
𝐶6 𝐻8 𝑂6 presentes en los agentes reductores para química verde.
𝑦 = 0.0459𝑥 + 0.0602
𝑅 2 = 0.9988
Aloe vera
Uva
1.2
1
Absorbancia,A (u.a.)
0.8
0.6
0.4
0.2
0
0 5 10 15 20 25
Concentración, C (mg/L
Figura IV.9. Curva de calibración de C6 H8 O6 en mg/L.
Tabla IV.1. Concentraciones características de los agentes reductores para química verde.
Reductores λ (nm) A (u.a.) 𝐶𝐿 (mg/L) 𝐶𝑅 (mg/L)
Aloe vera 264 0.73 14.45 1,445
Uva 270 1.03 21.31 710.33
VIRIDIANA PÉREZ LÓPEZ Página 123
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1.4. Soluciones de nanopartículas de oro
IV.1.4.1. Síntesis por química convencional
IV.1.4.1.1. Con agente reductor 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6
Las AuNP´s sintetizadas con 10 ml de agente reductor de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 (sección III.4.1),
presentan colores característicos, donde se observa diferencia en las tonalidades debido
a la variación del volumen de alícuota del precursor 𝐻𝐴𝑢𝐶𝑙4 . La solución sintetizada
IV.10.A con 125 µl de 𝐻𝐴𝑢𝐶𝑙4 muestra un color rojo atenuado con pH de 3.14, en la
figura IV.10.B con 60 µl de 𝐻𝐴𝑢𝐶𝑙4 se observa un color rojo intenso con un pH de 3.60
y por último en la imagen IV.10.C se emplean 15 µl 𝐻𝐴𝑢𝐶𝑙4 con un pH de 3.30 y una
diferencia en las tonalidades de rojo a un violeta.
A B C
Figura IV.10. Las AuNP´s reducidas con KNaC4 H4 O6 y con diferentes volúmenes de alícuotas A) 125 µl de
HAuCl4 , B) 60 µl de HAuCl4 y C) 15 µl de HAuCl4
Los espectros de absorción de las AuNP´s donde se varían las alícuotas en un orden de
125, 60 y 15 µl del precursor, presentan una longitud de onda máxima en las soluciones
de 528, 527 y 512 nm, esto se observa en las figuras IV.11, IV.12 y IV.13 respectivamente.
VIRIDIANA PÉREZ LÓPEZ Página 124
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
0.35 528
Absorbancia,A (u.a.) 0.3
0.25
0.2
0.15
0.1
0.05
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.11. Espectro de absorción de AuNP´s con 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 y con 125 µl de 𝐻𝐴𝑢𝐶𝐿4 .
0.35
0.3
Absorbancia,A (u.a.)
0.25 527
0.2
0.15
0.1
0.05
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.12. Espectro de absorción de AuNP´s con KNaC4 H4 O6 y con 60 µl de HAuCL4 .
0.35
0.3
Absorbancia,A (u.a.)
0.25
0.2
0.15 512
0.1
0.05
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.13. Espectro de absorción de AuNP´s con KNaC4 H4 O6 y con 15 µl de HAuCL4
VIRIDIANA PÉREZ LÓPEZ Página 125
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1.4.1.2. Con agente reductor de 𝐶6 𝐻8 𝑂6
En la sección III.4.2 se sintetizan las AuNP´s de la figura IV.14, con alícuotas de 1.5 ml del
precursor 𝐻𝐴𝑢𝐶𝑙4 y haciendo variación en el volumen del agente reductor 𝐶6 𝐻8 𝑂6, se
observan diferencias en las tonalidades. La solución sintetizada IV.14.A con 10 ml de
𝐶6 𝐻8 𝑂6 muestra un color rojo con un valor pH = 2.91, y las AuNP´s en IV.14.B con
volumen de 20 ml de 𝐶6 𝐻8 𝑂6, se observa un color rojo atenuado con un pH = 3.10 y
por último en la imagen IV.14.C se observa un color rojo intenso empleando 20 ml de
𝐶6 𝐻8 𝑂6 y con un tiempo de reacción de 10 minutos, registro un valor pH = 2.81.
A B C
Figura IV.14. Las AuNP´s reducidas con 1.5 ml de HAuCl4 y variando el volumen de C6 H8 O6 . A) 10 ml , B)
20 ml y C) 20 ml de 𝐶6 𝐻8 𝑂6 con tiempo de reacción de 10 minutos.
Los espectros de absorción de las AuNP´s variando 10 y 20 ml los volúmenes del agente
reductor de 𝐶6 𝐻8 𝑂6, presentan una longitud de onda máxima para las soluciones como
se citan a continuación 529, 527 y 528 nm, se observan en la figuras IV.15, IV.16 y IV.17
respectivamente.
VIRIDIANA PÉREZ LÓPEZ Página 126
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
529
1
Absorbancia,A (u.a.)
0.8
0.6
0.4
0.2
0
300 350 400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.15. Espectro de absorción de AuNP´s sintetizadas con 10 ml de C6 H8 O6
1
0.9
Absorbancia,A (u.a.)
0.8
0.7
0.6 527
0.5
0.4
0.3
0.2
0.1
0
300 350 400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.16. Espectro de absorción de AuNP´s sintetizadas con 20 ml de C6 H8 O6 ,
1
0.9 528
Absorbancia,A (u.a.)
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
300 350 400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.17. Espectro de absorción de AuNP´s sintetizadas con 20 ml de C6 H8 O6 y un tiempo de 10
minutos.
VIRIDIANA PÉREZ LÓPEZ Página 127
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1.4.2. Síntesis por química verde
IV.1.4.2.1. Agente reductor de aloe vera
Los colores característicos de soluciones de AuNP´s sintetizadas en la sección III.5.1 se
obtienen a partir de 450 µl de agente reductor de aloe vera en 10 ml de 𝐻2 𝑂 desionizada,
se observa una diferencia por el volumen del precursor 𝐻𝐴𝑢𝐶𝑙4 que se empleó. La
solución sintetizada en IV.18.A muestra un color rosa con alícuota de 150 µl de 𝐻𝐴𝑢𝐶𝑙4
y un registro de valor de pH=4.30. En la IV.18.B se indica un color rojo atenuado
utilizando 155 µl de 𝐻𝐴𝑢𝐶𝑙4 y un pH=4.70 y por último, en la IV.18.C se emplea 1 ml de
𝐻𝐴𝑢𝐶𝑙4 con un pH=4.39 indicando un color rojo intenso, la reacción se lleva agregando
unos mililitros de agente reductor a la solución precursora.
A B C
Figura IV.18. Las AuNP´s reducidas con aloe vera y con diferentes volúmenes de alícuotas de 𝐻𝐴𝑢𝐶𝑙4 A)
150 µl B) 155 µl y C) 1 ml
Se varían los volúmenes de 𝐻𝐴𝑢𝐶𝑙4 en estas proporciones 150, 155 y 1000 µl y se
presentan bandas de absorción máximas en un orden de magnitud de 532, 536 y 538
nm como se observan en la figura IV.15, IV.16 y IV.17 respectivamente.
VIRIDIANA PÉREZ LÓPEZ Página 128
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
0.7
0.6
.) Absorbancia,A (u.a
0.5
0.4 532
0.3
0.2
0.1
0
430 480 530 580 630 680
Longitud de onda, λ (nm)
Figura. IV.19. Espectro de absorción de AuNP´s con Aloe vera y 150 µl de HAuCl4 ,
0.7
0.6
Absorbancia,A (u.a.)
0.5
0.4 536
0.3
0.2
0.1
6E-16
430 480 530 580 630 680
-0.1
Longitud de onda, λ (nm)
Figura. IV.20. Espectro de absorción de AuNP´s sintetizadas con Aloe vera y 155 µl de 𝐻𝐴𝑢𝐶𝑙4 ,
0.7
0.6
Absorbancia,A (u.a.)
0.5
0.4
0.3 538
0.2
0.1
6E-16
430 480 530 580 630 680
-0.1
Longitud de onda, λ (nm)
Figura. IV.21. Espectro de absorción de AuNP´s sintetizadas con Aloe vera y 1 ml de 𝐻𝐴𝑢𝐶𝑙4 .
VIRIDIANA PÉREZ LÓPEZ Página 129
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.1.4.2.2. Agente reductor uva morada
Utilizando 5 ml de mosto de uva y variando el volumen del precursor de 𝐻𝐴𝑢𝐶𝑙4 , se
sintetizan AuNP´s (ver sección III.5.2) con los colores característicos observados en la
figura IV.22. La solución coloidal IV.22.A con 30 µl de 𝐻𝐴𝑢𝐶𝑙4 muestra un color rojo
atenuado con un pH de 4.21, se observa un color morado para la figura IV.22.B con 90
µl de 𝐻𝐴𝑢𝐶𝑙4 y un pH de 4.03 y la imagen IV.22.C muestra un color rojo intenso, se
emplean 215 µl de 𝐻𝐴𝑢𝐶𝑙4 y registro un pH de 3.62.
A B C
Figura IV.22. Las AuNP´s reducidas con uva y variando el volumen, A) 30 µl de 𝐻𝐴𝑢𝐶𝑙4 , B) 90 µl de
𝐻𝐴𝑢𝐶𝑙4 y C) 215 µl de 𝐻𝐴𝑢𝐶𝑙4 .
La respuesta de los plasmones de las AuNP´s sintetizadas con el agente reductor de uva
morada, presentan longitudes de onda máximas entre 523, 542 y 533 nm debido a las
diferentes alícuotas 𝐻𝐴𝑢𝐶𝑙4 , indicadas en este orden 30, 90 y 215 µl y se observan en la
figura IV.23, IV.24 y IV.25 respectivamente
VIRIDIANA PÉREZ LÓPEZ Página 130
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
1
0.9 523
Absorbancia,A (u.a.) 0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.23. Espectro de absorción de AuNP´s con uva morada y 30 µl de 𝐻𝐴𝑢𝐶𝑙4 ,
542
1.2
Absorbancia,A (u.a.)
0.8
0.6
0.4
0.2
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.24. Espectro de absorción de AuNP´s con uva morada y 90 µl de HAuCl4 ,
1
0.9
0.8
Absorbancia,A (u.a.)
533
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
400 450 500 550 600 650 700
Longitud de onda, λ (nm)
Figura IV.25. Espectro de absorción de AuNP´s con uva morad y 215 µl de HAuCl4 ,
VIRIDIANA PÉREZ LÓPEZ Página 131
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.2. Caracterización por espectroscopia FT-IR
Los agentes reductores orgánicos Aloe vera y uva morada preparados en la sección III.7
y su análisis por espectroscopia FT-IR con accesorio ATR se explican a continuación.
En la figura IV.26, se observan bandas presentes en el espectro MIR del agente reductor
de Aloe vera y en la tabla IV.2, indican sus diferentes tipos de vibraciones de los grupos
funcionales.
103
93
83
2104.6
Transmitancia, %T
73 2924.5
1632.07
63 1419.00
53 1370
43 1321.3
3327.52 1244.2
33 1102.1 1018.7
23
3900 3400 2900 2400 1900 1400 900 400
Número de onda (cm-1)
Figura IV.26. Espectro MIR del reductor orgánico aloe vera.
Tabla IV.2. Interpretación del espectro MIR del aloe vera.
Número de onda (𝑐𝑚−1 ) Vibración Posible grupo funcional
3327.52 O-H alargamiento 𝑅 − 𝑂𝐻
2924.5 C-H alargamiento 𝐶𝐻3 −, 𝐶𝐻2 −
2104.6 𝐶 ≡ alargamiento 𝐶 ≡ 𝐻, 𝐶 ≡ 𝐶
1632.07 C=O alargamiento −𝐶 = 𝐶 −
1419 C-H flexión −𝐶𝐻2 −
1370 C-H flexión −𝐶𝐻3 −
1321.3 C-H flexión −𝐶𝐻3 −
1244.2 C-O alargamiento 𝑅 − 𝑂𝐻 o 𝑅 − 𝑂 − 𝑅
1102.1 C-O alargamiento 𝑅 − 𝑂𝐻 o 𝑅 − 𝑂 − 𝑅
1018.7 C-O alargamiento 𝑅 − 𝑂𝐻 o 𝑅 − 𝑂 − 𝑅
VIRIDIANA PÉREZ LÓPEZ Página 132
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
En el espectro MIR se observa el agente reductor de la uva morada previamente seca
figura IV.27, donde se presentan señales asociadas a los diferentes tipos de vibraciones
que absorben radiación infrarroja, en la tabla IV.3 se muestra posible interpretación.
124
123
122
121
120
Transmitancia, %T
2542.5
119 1262.4
2931.6 2159.2 1310
118 3307 1617.4
2030.4 1419.4
117
1975.8
116
115 1016.60
114
3950 3450 2950 2450 1950 1450 950 450
Número de onda (cm-1)
Figura IV.27. Espectro de MIR del reductor orgánico uva morada.
Tabla IV.3. Interpretación del espectro MIR de la uva morada.
Número de onda (𝑐𝑚−1 ) Vibración Posible grupo funcional
3307 O-H alargamiento 𝑅 − 𝑂𝐻
2931.6 C-H alargamiento 𝐶𝐻3 −, 𝐶𝐻2 −
2542.5 C-H alargamiento 𝐶𝐻3 −, 𝐶𝐻2 −
2159.2 C-H alargamiento 𝐶𝐻3 −, 𝐶𝐻2 −
2030.4 C=O alargamiento
1975.8 C-H alargamiento 𝐶𝐻3 −, 𝐶𝐻2 −
1617.4 C=C alargamiento -C=C-
1419.4 C-H flexión −𝐶𝐻2 −
1310 C-H flexión −𝐶𝐻3 −
1262.4 C-O alargamiento 𝑅 − 𝑂𝐻
1016.60 C-O alargamiento 𝑅 − 𝑂𝐻
VIRIDIANA PÉREZ LÓPEZ Página 133
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
IV.3. Caracterización por microscopia TEM
La solución resultante de la síntesis de AuNP´s que se realiza mediante el uso de los
agentes reductores de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 , aloe vera y uva morada, se caracterizan por la
técnica de microscopia electrónica de transmisión, a continuación se muestran las
micrografías e histogramas de las distribuciones correspondientes. En la figura IV.28 se
observa un tamaño de AuNP´s entre 10 a 27 nm usando como agente reductor
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 , reduciendo el precursor con aloe vera se tienen tamaños entre 5 a 19 nm
mostrados en la figura IV.29 y finalmente la figura IV.30 indica tamaños de
nanopartículas que oscilan entre 3 a 14 nm reduciendo la solución precursora de oro
con el agente reductor de uva morada.
Figura IV.28. Las AuNP´s sintetizadas con KNaC4 H4 O6 , A) Micrografía por TEM y B) histograma de
distribución de tamaño.
VIRIDIANA PÉREZ LÓPEZ Página 134
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura IV.29. Las AuNP´s sintetizadas con aloe vera, A) Micrografía por TEM y B) histograma de
distribución de tamaño.
VIRIDIANA PÉREZ LÓPEZ Página 135
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura IV.30. Las AuNP´s sintetizadas con uva morada A) Micrografía por TEM y B) histograma de
distribución de tamaño.
VIRIDIANA PÉREZ LÓPEZ Página 136
CAPÍTULO V. ANALISIS Y DISCUSIÓN DE RESULTADOS
En el presente capitulo se muestran el análisis y la discusión de los resultados
experimentales obtenidos por las diferentes técnicas de caracterización para la síntesis
de nanopartículas de oro tradicional y por química verde, con la finalidad de asegurar
su confiabilidad cada resultado experimental es comparado con resultados teóricos.
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
V.1.Precursor y soluciones de agentes reductores para química
convencional
Como se puede observar en la sección IV.1.1, el precursor y los agentes reductores para
química convencional se caracterizaron para valorar su confiabilidad respecto al reactivo
utilizado, el espectro UV-VIS del 𝐻𝐴𝑢𝐶𝑙4 nos presenta una banda de absorción en 304
nm (Figura IV.2.), con un pH de 2.77. El espectro de la solución de 𝐻𝐴𝑢𝐶𝑙4 de la marca
Fluka presenta una banda de absorción a 310 nm [Hernández et. al., 2017] (Anexo H). Este
posible corrimiento de la banda de absorción máxima se presenta en longitudes de
onda menores, debido al corrimiento hipsocrómico respecto la banda del 𝐻𝐴𝑢𝐶𝑙4 de la
marca Fluka. En este caso, estos corrimientos se pudieron dar por efectos de pH de las
soluciones.
La solución reductora de 𝐶6 𝐻8 𝑂6 es ligeramente blanca (Figura IV.2.C.) el espectro UV-VIS
del 𝐶6 𝐻8 𝑂6 nos presenta una banda de absorción en 264 nm con un pH de 2.80 (Figura
IV.4). Mientras que en otros estudios realizados por [Chamorro et. al. 2009, Aquino et.al. 2013,
Hima et. al. 2013, Hamada 2016] reportan una banda de absorción en un intervalo 240-265
nm. (Anexo I). Por lo que nuestra solución de 𝐶6 𝐻8 𝑂6 es equiparable a los resultados
presentados por otros autores. La banda de absorción de 𝐶6 𝐻8 𝑂6 se debe a que al
recibir radiación ultravioleta, produce transiciones electrónicas de 𝑛 → 𝜋 ∗ debido a que
presenta enlace doble (𝐶 = 𝑂). Esta transición es poco intensa, y es el resultado del salto
de un electrón de un orbital molecular no enlazante del oxigeno a un orbital molecular
antienlazante 𝜋 ∗ . También presenta transiciones de 𝜋 → 𝜋 ∗ , para que suceda esta
transición, se requiere una cantidad mayor de energía o menor longitud de onda. Para
el doble enlace (𝐶 = 𝐶), se produce transiciones de 𝜋 → 𝜋 ∗ esto se debe a la excitación
de los electrones que se encuentran en el orbital molecular 𝜋 del doble enlace,
produciendo un salto al orbital molecular 𝜋 ∗ . La banda de baja intensidad (transición
de 𝑛 → 𝜋 ∗ ) no se puede observar debido a que es cubierta por el pico de mayor
absorción (transición de 𝜋 → 𝜋 ∗ ). Normalmente una transición de este tipo proporciona
una señal de longitud de onda en el rango de 200-700 nm.
VIRIDIANA PÉREZ LÓPEZ Página 137
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
La longitud de onda de máxima absorción del ácido ascórbico (teórico) puede variar
entre 243-267 nm. [Chamorro et. al. 2007].
La solución reductora de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 es incolora (Figura IV.1.B.) el espectro UV-VIS del
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 nos presenta una banda de absorción en 293 nm con un pH de 6.59 (Figura
IV.3.). Todos las pruebas realizadas al precursor y a los reductores inorgánicos tuvieron
la finalidad de conocer su banda máxima de absorción, asegurando con esto que no
interfieran con la señal o descartar estas señales con la posible o posibles bandas
plasmónicas de superficie de las futuras AuNP´s.
V.2. Soluciones de agentes reductores para química verde
La figura IV.5 se muestran las soluciones orgánicas preparadas en la sección III.3,
soluciones de extracto de aloe vera y mosto de uva. En estos dos reductores orgánicos
se buscó el agente activo 𝐶6 𝐻8 𝑂6, el extracto de aloe vera es incoloro (Figura IV.5.A), su
espectro UV-VIS presenta una banda de absorción en 264 nm con un de pH= 4.8 (Figura
IV.6.), lo que posiblemente nos indica presencia de 𝐶6 𝐻8 𝑂6 en el extracto de aloe vera
ya que los espectros de UV-Vis reportado por [Chamorro et. al. 2009, Aquino et.al. 2013, Hima
et. al. 2013, Hamada 2016] (Anexo I) nos dicen que el 𝐶6 𝐻8 𝑂6 se encuentran en la misma región
y unos de los componentes principales del aloe vera es precisamente el
𝐶6 𝐻8 𝑂6 . [Schweizer, 2007]. El mosto de uva presento una tonalidad ligeramente amarilla
(Figura IV.5.B) el espectro UV-VIS presenta una banda de absorción en 270 nm con un
pH= 4.27. (Figura IV.7). Teóricamente nos indica [De Lamo, 2015] que el mosto de uva
contiene ácido cítrico, ácido tánico y ácido gálico pero [Garcés, 2010] dice que el mosto
de uva a demás de contener dichos ácidos también contiene el 𝐶6 𝐻8 𝑂6. Comparando
los espectros de absorción de la solución preparada experimentalmente con el del
mosto de uva (Solución IV.2.C.) nos indica la posible presencia de 𝐶6 𝐻8 𝑂6 y comparado
con los espectros de absorción reportado por [Chamorro et. al. 2009, Aquino et.al. 2013,
Hima et. al. 2013 y Hamada 2016] nos dicen que el 𝐶6 𝐻8 𝑂6 se encuentran en la misma
región.
VIRIDIANA PÉREZ LÓPEZ Página 138
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Considerando la presencia de 𝐶6 𝐻8 𝑂6 en el aloe vera y la uva morada, mediante el
método de curva de calibración (Figura IV.9.), con un factor de correlación de 𝑅 2 = 0.9988
indicándonos una confiabilidad optima en los resultados de cuantificación, se
𝑚𝑔
obtuvieron las concentraciones de 𝐶6 𝐻8 𝑂6 . El aloe vera dio como resultado 1,445 ,
𝐿
𝑚𝑔
mientras que la uva morada con 710 ; comparando estas concentraciones con otros
𝐿
resultados reportados en jugos cítricos por [Acosta 2007 y Chamorro et. al. 2009] con valores
𝑚𝑔 𝑚𝑔
de 1,240 y 750 respectivamente, ambos reductores orgánicos utilizados tiene
𝐿 𝐿
una cantidad de 𝐶6 𝐻8 𝑂6 considerablemente amplia para llevar a cabo la reducción del
precursor en la síntesis de NPs metálicas.
V.2.1. Caracterización por espectroscopia FT-IR
La caracterización por FT-IR del aloe vera (Figura IV.26) muestra picos característicos, que
podemos asociar a los grupos funcionales mostrados en la tabla V.1, de igual manera
en la caracterización de la uva morada (Figura IV.27.) se observan los picos característicos
que se pueden relacionar a los grupos funcionales de la tabla V.2. Con esto podemos
hacer una comparación de la presencia de 𝐶6 𝐻8 𝑂6 (agente activo principal para la
síntesis orgánica de NP´s metálicas) y del ácido algínico ((𝐶6 𝐻8 𝑂6 )𝑛 ) en nuestros dos
agentes reductores orgánicos naturales; mientras que para el caso partícula de la uva
además de presentar la presencia de estos dos ácidos, también cuenta con picos
característicos asociados al del ácido gálico (𝐶6 𝐻7 𝑂5 ) . Por tanto correlacionando los
resultados del aloe vera y la uva por UV-Vis y FT-IR la detección del 𝐶6 𝐻8 𝑂6 es inminente
y contundente por la longitud máxima de absorción y los grupos funcionales
presentados como lo reportan [Lohman et. al., 1984, Bunaciu et. al. 2009, Singh et. al. 2010, Umer
et. al. 2014 y Souza 2015] (Anexo J). Mientras para el caso del algínico ((𝐶6 𝐻8 𝑂6 )𝑛 ) [Chhatbar et.
al 2015] reporta que no existe respuesta en la región UV-Vis, mientras que para FT-IR si
se registran los grupos funcionales como lo indican en sus estudios [Leal 2007, Ordoñez
2011, Dekamin 2014] por lo que asumimos que nuestros reductores orgánicos tienen señal
perteneciente al algínico ((𝐶6 𝐻8 𝑂6 )𝑛 ). (Anexo K).
VIRIDIANA PÉREZ LÓPEZ Página 139
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Por otro lado en el reductor orgánico de uva morada también se encuentran
coincidencias con los grupos funcionales del ácido gálico (𝐶6 𝐻7 𝑂5 ), reportados por
[Meenakshi 2009, Singh 2011 y NIST, 2018] (Anexo L), asumiendo que para el resultado por UV-
Vis la región máxima de absorción es de 290nm reportada por [Song et. al. 2015] (Anexo M),
la señal obtenida de la uva morada no presenta una señal intensa o bien definida de
absorción en esa región, ya que la banda perteneciente al 𝐶6 𝐻8 𝑂6 es tan intensa y ancha
que posiblemente opaco o cubrió esa señal puesto que abarca la región de 255nm a
295 nm en el espectro de UV-Vis de la uva morada. Esto puede ser un factor en la
síntesis de las AuNP´s como lo sugirió [De lomo, 2015] indicando que esta síntesis se logró
gracias al acido gálico.
VIRIDIANA PÉREZ LÓPEZ Página 140
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS
CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6Y 𝐶6 𝐻8 𝑂6. “
Tabla V.1. Señales dadas al espectro FT-IR del reductor orgánico aloe vera.
3327.52 2924.5 2104.6 1632.07 1419 1370 1321.3 1102.1 1018.7
Lohmann 3340-3232 1675
et. al. 𝑂−𝐻 𝐶=𝑂
1984 Expansión Tensión
Bunaciu 3216 1675
et. al. 𝑂−𝐻 𝐶=𝐶
2009 Alargamiento Estiramiento
Ácido ascórbico
1041
2917 1730-1630 1389 1155
Sing et. al. 𝐶−𝐻
𝐶−𝐻 𝐶=𝑂 𝐶 − 𝐻2 𝐶−𝑂
2010 Expansión Alargamiento Flexión Tensión
𝐶−𝑂
Tensión
3311 1635 1377
Umer et. 1300
𝑂−𝐻 𝐶=𝑂 𝐶−𝐻
al. 2014 𝐶−𝐻
Expansión Alargamiento Flexión
1668-1760
2750-2981
Souza et. 3522-3217 𝐶=𝐶
𝐶−𝐻 1024
𝑂−𝐻 𝐶=𝑂
al. 2015 𝐶 − 𝐻2 𝐶−𝑂
Alargamiento Estiramiento
𝐶 − 𝐻3
3427.5 2970 1615.6 1415 1301.1 1125.3 1035.6
Leal et. al.
𝑂−𝐻 𝐶−𝐻 𝐶=𝑂 𝐶 − 𝑂𝐻 𝐶𝑂𝑂 − 𝐶−𝑂 𝐶−𝑂
2007
Ácido algínico
Tensión Tensión Alargamiento Vibración Deformación Tensión
3400 1600 1423
Ordoñez 947.9
𝑂−𝐻 𝐶=𝑂 𝐶𝑂𝑂 −
et. al. 201 𝐶−0
Tensión Tensión
Dekamin 3445.6
2921.3 1368.9
et. al. 𝑂−𝐻
𝐶 − 𝐻2 𝐶𝑂𝑂 −
2014 Tensión
VIRIDIANA PÉREZ LÓPEZ Página 141
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS
CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6Y 𝐶6 𝐻8 𝑂6. “
Tabla V.2. Señales dadas al espectro FT-IR del reductor orgánico uva morada.
3307 2931.6 2542.5 2159.2 2030.4 1975.8 1617.4 1419.4 1310.2 1262 1016.6
Lohmann 3340-3232 1675
et. al. 1984 𝑂−𝐻 𝐶=𝑂
Expansión Tensión
Bunaciu et. 3216 1675
al. 2009 𝑂−𝐻 𝐶=𝐶
Ácido ascórbico
Alargamiento Estiramiento
Sing et. al. 1041
2917 1730-1630 1389 1155
2010 𝐶−𝐻
𝐶−𝐻 𝐶=𝑂 𝐶 − 𝐻2 𝐶−𝑂
Expansión Alargamiento Flexión Tensión
𝐶−𝑂
Tensión
Umer et. al. 3311 1635 1377
1300
2014 𝑂−𝐻 𝐶=𝑂 𝐶−𝐻
𝐶−𝐻
Expansión Alargamiento Flexión
Souza et. 1668-1760
3522-3217
al. 2015 2750-2981 𝐶=𝐶 1024
𝑂−𝐻
𝐶 − 𝐻, 𝐶 − 𝐻2 , 𝐶 − 𝐻3 𝐶=𝑂 𝐶−𝑂
Alargamiento
Estiramiento
Leal et. al. 2970 1615.6 1415 1301.1 1125.3 1035.6
2007 3427.5
𝐶−𝐻 𝐶=𝑂 𝐶 − 𝑂𝐻 𝐶𝑂𝑂 − 𝐶−𝑂 𝐶−𝑂
Ácido alginico
𝑂−𝐻 Tensión Alargamiento Vibración Deformación Tensión
Tensión
Ordoñez et. 3400 1600 1423
947.9
al. 201 𝑂−𝐻 𝐶=𝑂 𝐶𝑂𝑂 −
𝐶−0
Tensión Tensión
Dekamin 3445.6
2921.3 1368.9
et. al. 2014 𝑂−𝐻
𝐶 − 𝐻2 𝐶𝑂𝑂 −
Tensión
Meenaksh 3435
2918 2865
1639 1420
1097
et. al. 2009 𝑂−𝐻 𝐶=𝑂 𝐶 − 𝑂𝐻
𝐶 − 𝐻2 𝐶 − 𝐻2 𝐶−𝑂
Ácido galico
Expansión Alargamiento Vibración
Singh et. al. 3438 2920 1612
2011 𝑂−𝐻 𝐶−𝐻 𝐶=𝑂
Tensión Tensión
Book. 3650 2915 1860 1610 1420
2750
NIST O−H C−H C=O C=O C − OH
C − H2
2018 Alargamiento Tensión Tensión Alargamiento
VIRIDIANA PÉREZ LÓPEZ Página 142
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
V.3. Soluciones de nanopartículas de oro.
V.3.1. Síntesis por química convencional
V.3.1.1. Con agente reductor de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6
LA figura IV.10 se muestran las soluciones coloidales de AuNP´s sintetizadas en la sección
III.4.1 con el reductor inorgánico 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 . Observamos que la coloración es similar
sin embargo se obtuvo una longitud de onda menor conforme se fue reduciendo el
volumen agregado de la solución precursora de 𝐻𝐴𝑢𝐶𝑙4. Se tiene una longitud de de
528 nm con 125 𝜇𝑙s de 𝐻𝐴𝑢𝐶𝑙4 (Solución IV.10.A.) comparándola con la longitud de onda
de 527nm, que se obtuvo agregando solo 60 microlitos de 𝐻𝐴𝑢𝐶𝑙4 (solución IV.10.B) y
todavía se obtuvo una longitud de onda de 512 nm (menor) agregando 15 𝜇𝑙 de 𝐻𝐴𝑢𝐶𝑙4
(solución IV.10.C.). Por otro lado [Corzo, 2012] reporto que obtuvo AuNP´s con KNaC4 H4 O6 y
con concentraciones menores de agente precursor 𝐻𝐴𝑢𝐶𝑙4 a las obtenidas en este
trabajo pero con un volumen constante de 10 ml de 𝐻𝐴𝑢𝐶𝑙4 y 20 ml de 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 ,
empleando concentraciones iniciales de 𝐻𝐴𝑢𝐶𝑙4 a 0.125 mM hasta 0.5 mM, por lo que
con el aumento de la concentración, obtuvo nanopartículas de Au reportando el
plasmon de superficie entre 540 a 550 nm y tamaños promedio de 34 nm. Mientras las
obtenidas en este trabajo empleado una concentración de 17 mM, presentan el plasmón
de 512 a 528 nm, con tamaños promedio de 17 nm que se pueden observar en la figura
IV.28.
V.3.1.2. Nanopartículas de oro sintetizadas con 𝑪𝟔 𝑯𝟖 𝑶𝟔
En la figura IV.14 se muestra las soluciones coloidales de AuNP´s sintetizadas en la
sección III.4.2 con el reductor inorgánicos 𝐶6 𝐻8 𝑂6. La solución coloidal de AuNP´s IV.14.A
con solo 10 ml de 𝐶6 𝐻8 𝑂6 nos da una longitud de onda mayor a la solución coloidal de
AuNP´s IV.14.B con 20 ml de 𝐶6 𝐻8 𝑂6 , esto quiere decir que a mayor volumen de la
VIRIDIANA PÉREZ LÓPEZ Página 143
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
solución reductora mas pequeña será la longitud de onda del plasmón de superficie. La
solución coloidal de AuNP´s IV.14.C, solo se dejó 5 minutos más a calentamiento
constante de 80°C con agitación para verificar la repetibilidad y el efecto del tiempo de
síntesis obteniendo la respuesta plasmónica en 528 nm. Las AuNP´s sintetizadas con
𝐶6 𝐻8 𝑂6 nos proporcionó un panorama para verificar que efectivamente el agente
reductor activo en la síntesis es el 𝐶6 𝐻8 𝑂6, que contienen los elementos orgánicos
seleccionados. Tal es el caso de [Malassis et. al. 2016, khan et. al. 2013] (Anexo N), que reportan
síntesis de AuNPs con 𝐶6 𝐻8 𝑂6 variando sus concentraciones además de agregar agentes
estabilizantes obteniendo una plasmon de superficie de las AuNP´s de 515-533 nm y
550 nm respectivamente, por tanto el resultado obtenido en nuestros experimentos con
𝐶6 𝐻8 𝑂6 son equiparables.
V.3.2. Síntesis por química verde
V.3.2.1. Agente reductor de aloe vera
En la figura IV.18 se muestran las soluciones coloidales de AuNP´s donde observamos
que los vires son muy parecidos entre sí. Entre las tres soluciones experimentales IV.18.A,
IV.19.B y IV.20.C podemos observar que en cuanto más volumen agreguemos de
precursor 𝐻𝐴𝑢𝐶𝑙4 existirán corrimientos de la banda de absorción, se obtiene
desplazamiento del plasmón de superficie hacia mayores longitudes de onda por lo que
el intervalo del plasmón oscila entre 532-538 nm y un tamaño promedio de 9 nm que
podemos observar en la figura IV.29, mientras que [Quilantan et. al., 2016] sintetizo AuNP´s
con aloe vera y 𝐻𝐴𝑢𝐶𝑙4 de la marca sigma aldrich y tiempos de reacción de entre de 1
a 24 horas reportando solo la de 1 hora, donde observamos la respuesta plamónica en
545 nm y tamaño de nanopartículas por TEM de 25 nm.
VIRIDIANA PÉREZ LÓPEZ Página 144
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
V.3.2.2. Agente reductor de uva morada
En la figura IV.22 se muestran las soluciones coloidales de AuNP´s donde observamos
diferentes vires, del vino, al morado intenso y al rojo, [De lamo, 2015] reporta vires muy
similares de sus soluciones coloidales de AuNP´s al momento de llevar a cabo la
reacción, sus resultados nos indican que al tener más cantidad de mosto de uva más
rojizo será el vire y entre menos mosto el vire dará una tonalidad marrón. (Anexo O) En
nuestra síntesis variamos el volumen del 𝐻𝐴𝑢𝐶𝑙4 y al agregar más precursor existe un
desplazamiento plasmónico a longitudes de onda mayor, la solución IV.22.B y la
solución IV.22.C, contienen mas 𝐻𝐴𝑢𝐶𝑙4 que la solución 4.22.A y observamos los
cambios en tonalidad de los vires que tienden a ser más a un color vino, la solución con
250 𝜇𝑙 tienen una longitud de onda menor respecto a los demás de 533 nm, mientras
que la solución que contiene 90 𝜇𝑙 se desplaza hacia la región infrarroja que registro un
valor de 542nm. La solución 4.22.A tiene 30 𝜇𝑙 de 𝐻𝐴𝑢𝐶𝑙4 y reporta una longitud de
onda de 523 nm. Estos cambios no indican una condición de proporcionalidad, que si
fue observada en el caso del aloe vera. Algunos reportes [De lamo, 2015] obtuvo
nanopartículas que registran a una longitud de onda de 525 a 540 nm en su plasmón
de superficie con un tiempo de reacción de 1 hora. Menciona que el tamaño de las
AuNP´s depende de la complejidad del mosto a utilizar, ya que hay diferentes tipos de
uva, con lo que reporta tamaños de 3nm (Anexo P).
VIRIDIANA PÉREZ LÓPEZ Página 145
CAPÍTULO VI. CONCLUSIONES
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Basándose en los resultados obtenidos en el presente trabajo de
investigación, podemos concluir:
Si es posible sintetizar y caracterizar las AuNP´s utilizando los reductores orgánico
aloe vera y uva morada, ambas soluciones coloidales obtenidas dan señal en la
zona característica del Plasmón de resonancia de las AuNP´s. Se logró el diseño
de experimento usando los extractos naturales, sin ningún reductor especial ni
agentes encapsulantes.
Las AuNP´s sintetizadas con tartrato de sodio y potasio nos dieron una longitud
de onda ligeramente menor a las sintetizadas con ácido ascórbico, en las
sintetizada con ácido ascórbico la banda de absorbancia resulto más definida y
con un ancho menor diciéndonos que posiblemente logramos una mayor
homogeneidad. Cada AuNP´s sintetizada con estos reductores inorgánicos nos
dan una buena respuesta plasmónica.
Se ha observado que los parámetros que controlan el tamaño de las
nanopartículas en la síntesis tradicional son las cantidades de reductor y de
precursor 𝐻𝐴𝑢𝐶𝑙4 , siendo este último el que mayor influencia ejerce sobre las
características de las nanopartículas. Y en las nanopartículas sintetizadas por
química verde el que mayor influencia presenta es el volumen de reductor en la
síntesis de la reacción.
Comparado los resultados obtenidos por UV-VIS de las AuNP´s sintetizadas con
reductores orgánicos e inorgánicos, encontramos que las AuNP´s de aloe vera y
uva morada presenta una mejor respuesta plasmónica en comparación con la
del tartrato de sodio y potasio. Y en especial las AuNP´s de uva presentan una
mayor homogeneidad en las soluciones coloidales sintetizadas, como se pudo
comprobar por TEM.
VIRIDIANA PÉREZ LÓPEZ Página 146
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
El aloe vera y la uva morada, ambos reductores son considerados antioxidantes
por su contenido de ácido ascórbico el cual se pudo cuantificar de forma exitosa,
además de corroborar esto por espectroscopia FT-IR, asi como encontrar la
presencia de ácido gálico y ácido algínico, en menor cantidad, objetivo que no
era considerado.
Comparando las AuNP´s obtenidas con aloe vera y las de uva morada podemos destacar
que, aunque se encuentran en el mismo intervalo de longitud de onda (523 a 542 nm)
el reductor que favorece la formación y estabilización de nanopartículas de muy
pequeñas dimensiones es la uva morada, con forma casi esférica, distribución uniforme
del tamaño en el intervalo de 3nm a 14 nm.
VIRIDIANA PÉREZ LÓPEZ Página 147
ANEXOS
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo A. Nomenclatura química
Fórmula química Nombre
𝐶60 Carbono 60
𝐴𝑢 Oro
𝐴𝑙 Aluminio
𝐴𝑔 Plata
𝑇𝑒 Telurio
𝐶𝑜 Cobalto
𝑁𝑖 Níquel
𝑆 Azufre
𝑍𝑛 Zinc
𝑇𝑖𝑂2 Óxido de titanio
𝐹𝑒𝑂 Óxido de hierro III
𝐴𝑙2 𝑂3 Óxido de aluminio
𝐺𝑎𝐴𝑠 Arsénico de galio
𝐴𝑢𝐶𝑙3 Cloruro de oro
𝐹𝑒3 𝑂4 Tetraóxido de hierro (magnetita)
𝑁2 𝐻4 Hidracina
𝑁𝑎3 𝐶6 𝐻5 𝑂7 Citrato de sodio
𝐿𝑖(𝐶2 𝐻5 )3 𝐵𝐻 Trietilborohidruro de litio
𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Tartrato de sodio y potasio
𝐻𝐴𝑢𝐶𝑙4 Ácido tetracloroaurico
𝑁𝑎𝐵𝐻4 Borohidruro de sodio
𝐶6 𝐻8 𝑂6 Ácido ascórbico
𝐻2 𝑂2 Peróxido de hidrogeno
𝐶6 𝐻8 𝑂7 Ácido cítrico
(𝐶6 𝐻8 𝑂6)𝑛 Ácido algínico
𝐶7 𝐻6 𝑂5 Ácido gálico
𝑃𝑉𝑃 Polivinilpirrolidona
VIRIDIANA PÉREZ LÓPEZ Página 148
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo B. Símbolos y abreviaturas
Símbolo/ abreviatura Significado
𝑚 metros
𝑛𝑚 Nanómetros
𝜇𝑚 Micrómetros
𝑚𝑙 Mililitro
𝜇𝑙 Microlitros
𝑚𝑀 Milimolar
𝑔 gramo
𝐴̇ Angström
𝐴 Absorbancia
𝑢. 𝑎. Unidades arbitrarias
𝐶 Concentración
𝐶𝐿 Concentración leída
𝐶𝑅 Concentración real
𝐷. 𝐶. Después de Cristo
𝑁𝑃´𝑠 Nanopartículas
𝐴𝑢𝑁𝑃´𝑠 Nanopartículas de oro
𝐴𝐷𝑁 Ácido desoxirribonucleico
𝐸. 𝑈. Estados Unidos
𝑇𝐸𝑀 Transmission electron microscopy (Microscopio
electrónico de transmisión)
𝑆𝐸𝑀 Scanning electron microscope (Microscopio electrónico de
barrido)
𝑈𝑉 − 𝑉𝐼𝑆 Espectrofotometría Ultravioleta-Visible
𝐼𝑅 Infrarrojo
𝑅𝑇𝐴 ATR
𝑈𝑁𝐴𝑀 Universidad Autónoma de México
𝐶𝑂𝑁𝐴𝐶𝑦𝑇 Consejo Nacional de Ciencia y Tecnología
VIRIDIANA PÉREZ LÓPEZ Página 149
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
𝐸𝑆𝐹𝑀 Escuela Superior de Física y Matemáticas
𝐸𝑆𝐼𝑀𝐸 Escuela Superior de Ingeniería Mecánica y Eléctrica
𝑆𝐼𝑃 Secretaria de Investigación y Posgrado
𝑅𝐸𝐺𝐼𝑁𝐴 Registro Nacional de Investigadores en Ciencia y
Tecnología
𝑆𝑃𝑅 Surface Plasmón Resonance (Resonancia del Plasmón
Superficial)
𝑆𝐸𝑅𝑆 Surface Enhanced Raman Spectroscopy (Espectroscopia
Raman amplificada en superficie)
𝑃𝑂𝐿𝐼𝑂𝐿 Método con solventes, alcoholes polihidricos
𝑒𝑉 Electronvoltios
𝐾𝑒𝑉 Kiloelectronvoltios = 103 𝑒𝑉
VIRIDIANA PÉREZ LÓPEZ Página 150
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo C. Índice de figuras
Figura I.1. Comparación de unidades de longitud. (Zavaleta et. al., 2017). ......................... 2
Figura I.2. Estructura del . (Zavaleta et. al., 2017).). .............................................................. 4
Figura I.3. A) Estructura del grafeno, B) Estructura de un nanotubo. (Zavaleta et. al., 2017) ....... 5
Figura I.4. Familias de los nanomateriales. (Zavaleta et. al., 2017). ......................................10
Figura I.5. Crecimiento de la superficie. (Wing, 2017). ............................................................ 12
Figura I.6. Copa Romana de Lycurgo. [De Lamo, 2015]. .........................................................13
Figura I.7. Estados electrónicos. [Tehuacanero, 2013]. ........................................................... 14
Figura I.8. Resonancia del Plasmón superficial. [Belmares et. al., 2013]. .............................15
Figura I.9. Mapa de fase de la morfología de nanopartículas de oro en función del
tamaño y temperatura de la muestra. [Volke et. al., 2013]. ................................................ 16
Figura I.10. Coordenadas utilizadas en la teoría de MIE, respecto al plano de dispersión.
[Rastar, 2013]. .................................................................................................................................. 18
Figura I.11. Estabilización electrostática. [Roucoux, 2002]. .................................................... 22
Figura I.12. Estabilización estérica. [Roucoux, 2002]. ............................................................ 23
Figura I.13. Estabilización electrostérica. [Roucoux, 2002]. .................................................... 23
Figura I.14. Diversas nanoestructuras conteniendo oro. [Al Qadi et. al., 2009].. ............. 25
Figura I.15. Aplicaciones nanotecnológicas. [Luckie et. al., 2013]. ....................................... 26
Figura I.16. Técnicas de fabricación de nanomateriales. [Yang et. al., 2007]. ................. 30
Figura I.17. Distribución de emisiones químicas al medio ambiente. [Anastas et. al., 2002]. ..... 38
Figura I.18. Objetivo de la química verde. .................................................................................. 38
Figura I.19. Ciclo de vida de las sustancias químicas. [Balears, 2003]. ................................ 42
Figura I.20. Etapas de biosíntesis de AuNP´s. [Lago, 2015]. .................................................. 46
Figura I.21. Mecanismo de reacción de obtención del ácido ascórbico a partir de glucosa.
[Aquino et. al., 2013]. ....................................................................................................................... 49
Figura I.22. Formas moleculares de ácido ascórbico en equilibrio. [Aquino et. al., 2013]. ......... 50
Figura I.23. Ácido ascórbico (vitamina C) y sus pK´s de sus grupos. [Aquino et. al., 2013]. .........51
Figura I.24. (A) Flavonas, (B) flavonoles, (C) flavanoles, (D) flavanonas, (F)isoflavonas, (G)
antocianidinas [Julibert, 2013]. ...................................................................................................... 54
VIRIDIANA PÉREZ LÓPEZ Página 151
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura I.25. Azucares, [Almeida, 2013]. ....................................................................................... 56
Figura. I.26. Estructura y microestructura de la hoja de Aloe vera. [Arzate et. al., 2012]. ........... 58
Figura I.27. Morfología de la uva. [Visuet, 2017]. ..................................................................... 62
Figura II.1. Espectro electromagnético. [Owen, 2000]. .......................................................... 66
Figura II.2. Desprendimientos de radiación. [Arena et. al., 2004]. ....................................... 70
Figura II.3 Formación de los orbitales σ y σ ∗ por traslapamiento frontal de dos orbitales, así
como enlaces π y π ∗ por traslapamiento lateral de los orbitales p. [Mendez, 2016]. ................ 71
Figura II.4 Diagrama de niveles energéticos para diferentes orbitales moleculares y las
transiciones posibles en éstos. [Méndez, 2016]. ...................................................................... 72
Figura II.5. Estándares para curva de calibración. [Danzer, et. al., 1998]. .......................... 75
Figura II.6. Ejemplo de curva de calibración. [Dosal, et. al., 2008]. ..................................... 77
Figura II.7. Espectrofotómetro UV-VIS de doble haz. [Owen, 2000]. .................................. 79
Figura II.8. Dispositivos de dispersión (a) prisma y (b) Red de difracción. [Owen, 2000]. ......…. 82
Figura II.9. Detector de tubo fotomultiplicador. [Owen, 2000]. ........................................... 83
Figura II.10. Detector de fotodiodos [Owen, 2000]. ................................................................. 83
Figura II.11. Cubetas estándar (a) y con apertura (b). [Owen, 2000]. .................................. 85
Figura II.12. Señales generadas por un haz de electrones en una muestra. [Pescador,
2006]. ................................................................................................................................................... 88
Figura II.13. Distribución de intensidad de resolución. [Heimendahl, 1980]. .................... 89
Figura II.14. Esquema de una columna de TEM. [Lozano et. al., 2014]. ..............................91
Figura II.15. Modos de vibración en una molécula [Piqué, 2012]. ....................................... 99
Figura. II.16. Esquema general de un espectrómetro IR-FT. [Andújar et. al., 2013].. ..... 101
Figura III.1. Diagrama de preparación de solución precursora de HAuCl4 . ................... 105
Figura III.2. Diagrama de preparación de solución de KNaC4 O6 . ...................................... 106
Figura III.3. Diagrama de preparación de soluciones madre de C6 H8 O6 a diferentes
concentraciones. ............................................................................................................................. 107
Figura III.4. Diagrama de la extracción de Aloe vera (Aloe Barbadensis). ....................... 108
Figura III.5. Diagrama de la extracción de Uva (Vitis vinifera).. .......................................... 109
Figura III.6. Diagrama de síntesis de AuNP’s con KNaC4 H4 O6 . ............................................ 110
Figura III.7. Diagrama de síntesis de AuNP’s con C6 H8 O6 . ................................................... 111
Figura III.8. Diagrama de síntesis de AuNP´s con Aloe vera. .............................................. 112
VIRIDIANA PÉREZ LÓPEZ Página 152
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura III.9. Diagrama de síntesis de AuNP´s con uva. .......................................................... 113
Figura III.10. Figura 3.10. Diagrama de preparación de los agentes reductores: aloe vera
y uva morada para cuantificar C6 H8 O6 . .................................................................................... 114
Figura III.11. Diagrama de preparación de estándares para construir la curva de
calibración. ....................................................................................................................................... 115
Figura III.12. Diagrama de preparación de orgánicos para determinar grupos funcionales
por la técnica de IR. ....................................................................................................................... 117
Figura III.13. Diagrama de rejillas con AuNP´s depositadas para TEM. ........................... 118
Figura I9V.1. Soluciones A) precursora de HAuCl4 , B) y C) reductoras de KNaC4 H4 O6 y
C6 H8 O6 ................................................................................................................................................ 119
Figura IV.2. Espectro de absorción de la solución precursora de HAuCL4 con un pH=
2.77. .................................................................................................................................................... 120
Figura IV.3. Espectro de absorción de la solución de KNaC4 O6 con un pH=
6.59.……………………………………………………………….…………………………….……………………………….120
Figura IV.4. Espectro de absorción de la solución C6 H8 O6 con un pH= 3.80... ............ 120
Figura IV.5. Solución de extracto A) de Aloe vera y B) de Uva morada. ......................... 121
Figura. IV.6. Espectro de absorción del aloe vera con pH= 4.80. ...................................... 121
Figura IV.7. Espectro de absorción del mosto de uva morada con pH= 4.27. . .......... 122
Figura IV.8. Espectros de absorción de los estándares de C6 H8 O6 . .................................. 122
Figura IV.9. Curva de calibración de C6 H8 O6 en mg/L. ........................................................ 123
Figura IV.10. Las AuNP´s reducidas con KNaC4 H4 O6 y con diferentes volúmenes de
alícuotas A) 125 µl de HAuCl4 , B) 60 µl de HAuCl4 y C) 15 µl de HAuCl4 ......................... 124
Figura IV.11. Espectro de absorción de AuNP´s con KNaC4 H4 O6 y con 125 µl de HAuCL4 . .. 125
Figura IV.12. Espectro de absorción de AuNP´s con KNaC4 H4 O6 y con 60 µl de HAuCL4 . ..... 125
Figura IV.13. Espectro de absorción de AuNP´s con KNaC4 H4 O6 y con 15 µl de HAuCL4 . ........ 125
Figura IV.14. Las AuNP´s reducidas con 1.5 ml de HAuCl4 y variando el volumen de C6 H8 O6 . A)
10 ml , B) 20 ml y C) 20 ml de C6 H8 O6 con tiempo de reacción de 10 minutos. ...................... 126
Figura IV.15. Espectro de absorción de AuNP´s sintetizadas con 10 ml de C6 H8 O6 . ..... 127
Figura IV.16. Espectro de absorción de AuNP´s sintetizadas con 20 ml de C6 H8 O6 . .... 127
Figura IV.17. Espectro de absorción de AuNP´s sintetizadas con 20 ml de C6 H8 O6 y un
tiempo de 10 minutos. .................................................................................................................. 127
VIRIDIANA PÉREZ LÓPEZ Página 153
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Figura IV.18. Las AuNP´s reducidas con aloe vera y con diferentes volúmenes de
alícuotas. A) 150 µl de HAuCl4 , B) 155 µl de HAuCl4 y C) 1 ml de HAuCl4 , síntesis de
precursor a reductor.. .................................................................................................................... 128
Figura. IV.19. Espectro de absorción de AuNP´s con Aloe vera y 150 µl de HAuCl4 ,.... 129
Figura. IV.20. Espectro de absorción de AuNP´s sintetizadas con Aloe vera y 155 µl de
HAuCl4 . .............................................................................................................................................. 129
Figura. IV.21. Espectro de absorción de AuNP´s sintetizadas con Aloe vera y 1 ml de
HAuCl4 . .............................................................................................................................................. 129
Figura IV.22. Las AuNP´s reducidas con uva y variando el volumen, A) 30 µl de HAuCl4 ,
B) 90 µl de HAuCl4 y C) 215 µl de HAuCl4 ................................................................................ 130
Figura IV.23. Espectro de absorción de AuNP´s con uva morada y 30 µl de HAuCl4 . .. 131
Figura IV.24. Espectro de absorción de AuNP´s con uva morada y 90 µl de HAuCl4 . 131
Figura IV.25. Espectro de absorción de AuNP´s con uva morad y 215 µl de HAuCl4 . .. 131
Figura IV.26. Espectro MIR del reductor orgánico aloe vera. ............................................. 132
Figura IV.27. Espectro de MIR del reductor orgánico uva morada. ................................ 133
Figura IV.28. Las AuNP´s sintetizadas con KNaC4 H4 O6 . Micrografía por TEM e histograma
de distribución de tamaño. .......................................................................................................... 134
Figura IV.29. Las AuNP´s sintetizadas con aloe vera. Micrografía por TEM e histograma
de distribución de tamaño. .......................................................................................................... 135
Figura IV.30. Las AuNP´s sintetizadas con uva morada. Micrografía por TEM e histograma
de distribución de tamaño. .......................................................................................................... 136
VIRIDIANA PÉREZ LÓPEZ Página 154
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo D. Índice de tablas
Tabla I.1. Aplicaciones de las nanopartículas de oro. [Luckie et. al., 2013]. ....................... 27
Tabla I.2. Métodos físicos para obtener nanopartículas metálicas. [Zanella, 2012]. ....... 31
Tabla I.3. Métodos químicos para obtener nanopartículas metálicas. [Zanella, 2012]. ... 32
Tabla I.4. Centros de investigación y desarrollo de la República mexicana. [CONACYT,
2018]. ................................................................................................................................................... 44
Tabla I.5. Alimentos fuente de ácido ascórbico. [Aquino et. al., 2013]............................... 51
Tabla I.6. Composición del aloe vera. [Schweizer, 2007]. ...................................................... 59
Tabla I.7. Composición del mosto de uva. [Garcés, 2010]. . .................................................. 63
Tabla II.1. Relación de rangos de longitud de onda. [Méndez, 2016]. .............................. 67
Tabla II.2. de regiones del espectro infrarrojo. [Piqué et. al., 2012]. .................................. 95
Tabla. II.3. Modos de vibración en una molécula. [Piqué et. al., 2012]. ............................ 98
Tabla III.1. Alícuotas de C6 H8 O6 para la preparación de estándares de calibración. .... 115
Mol
Tabla III.2. Concentraciones de los estándares de curva de calibración en . ........ 116
L
Tabla IV.1. Concentraciones características de los agentes reductores para química
verde.. ................................................................................................................................................ 123
Tabla IV.2. Interpretación del espectro MIR del aloe vera. .. .............................................. 132
Tabla IV.3. Interpretación del espectro MIR de la uva morada. .. ..................................... 133
Tabla V.1. Señales dadas al espectro FT-IR del reductor orgánico aloe vera. ................ 140
Tabla V.2. Señales dadas al espectro FT-IR del reductor orgánico uva morada. ........... 141
VIRIDIANA PÉREZ LÓPEZ Página 155
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo E. Espectrofotómetro UV-VIS
Espectrofotómetro UV-Vis marca Perkin Elmer LAMBDA 25. Equipo que cuenta con una
fuente de deuterio y tungsteno. El equipo trabaja a un rango de 190 𝑎 1100 𝑛𝑚, el rango
utilizado fue de 250 𝑎 700 𝑛𝑚, con un slit de 1.00 𝑛𝑚 y una velocidad de barrido de
𝑛𝑚
480 𝑚𝑖𝑛.
VIRIDIANA PÉREZ LÓPEZ Página 156
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo F. Espectrofotómetro FT-IR
Espectrofotómetro FT-IR marca Perkin Elmer 65, equipo con una unidad de transmisión
clásica (MIR y NIR), con un accesorio de ATR universal punta diamante marca Perkin
Elmer. El equipo cuenta con un rango de 8300 𝑎 350 𝑐𝑚−1, el rango utilizado fue en la
𝑐𝑚
región MIR de 4000 𝑎 400 𝑐𝑚−1, con una velocidad de barrido de 0.2 , resolución de
𝑠
5 𝑐𝑚−1, en un intervalo de datos de 2 𝑐𝑚−1 .
VIRIDIANA PÉREZ LÓPEZ Página 157
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo G. Microscopio electrónico de transmisión
Microscopio electrónico de transmisión marca JEOL, modelo JEM-ARM200CF. El equipo
cuenta con un voltaje de aceleración de 200 𝑘𝑉, para obtener imagen en campo claro
se empleó un cañón de electrones de cátodo frio (Cold field Emission Gun, CFEG).
VIRIDIANA PÉREZ LÓPEZ Página 158
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo H. Espectro de absorción UV-VIS del 𝐻𝐴𝑢𝐶𝑙4
Espectro de absorción UV-VIS del 𝐻𝐴𝑢𝐶𝑙4 reportado por [Hernández et. al., 2017].
VIRIDIANA PÉREZ LÓPEZ Página 159
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo I. Espectros de absorción UV-VIS del 𝐶6 𝐻8 𝑂6
I.-1. Espectro de absorción UV-VIS del 𝐶6 𝐻8 𝑂6 reportado por [Chamorro, 2007].
I.2. Espectro de absorción UV-VIS del 𝐶6 𝐻8 𝑂6 reportado por [Aquino, 2013].
VIRIDIANA PÉREZ LÓPEZ Página 160
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
I.3. Espectro de absorción UV-VIS del 𝐶6 𝐻8 𝑂6 reportado por [Hima, 2013].
VIRIDIANA PÉREZ LÓPEZ Página 161
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo J. Espectro de absorción FT-IR del 𝐶6 𝐻8 𝑂6
J.1. Espectro FT-IR del 𝐶6 𝐻8 𝑂6 por [Lohman et. al., 1984].
J.2. Espectro FT-IR del 𝐶6 𝐻8 𝑂6 por [Bunaciu et. al., 2009].
VIRIDIANA PÉREZ LÓPEZ Página 162
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
J.3. Espectro FT-IR del 𝐶6 𝐻8 𝑂6 por [Singh et. al., 2010].
J.4. Espectro FT-IR del 𝐶6 𝐻8 𝑂6 por [Umer et. al., 2014].
VIRIDIANA PÉREZ LÓPEZ Página 163
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
J.5. Espectro FT-IR del 𝐶6 𝐻8 𝑂6 por [Souza et. al., 2015].
VIRIDIANA PÉREZ LÓPEZ Página 164
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo K. Espectro de absorción FT-IR del (C6 H8 O6 )n
K.1. Espectro de FT-IR del (𝐶6 𝐻8 𝑂6 )𝑛 por [Leal et. al., 2007]
K.2. Espectro de FT-IR del (𝐶6 𝐻8 𝑂6 )𝑛 por [Ordoñes et. al., 2011]
VIRIDIANA PÉREZ LÓPEZ Página 165
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
K.3.Espectro de FT-IR del (𝐶6 𝐻8 𝑂6 )𝑛 por [Dekamin et. al., 2014]
VIRIDIANA PÉREZ LÓPEZ Página 166
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo L. Espectro de absorción FT-IR del 𝐶6 𝐻7 𝑂5
L.1. Espectro FT-IR del 𝐶6 𝐻7 𝑂5 por [Meenakshi et. al., 2009]
L.2. Espectro FT-IR del 𝐶6 𝐻7 𝑂5por [Singh et. al., 2011]
VIRIDIANA PÉREZ LÓPEZ Página 167
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
L.3. Espectro FT-IR del 𝐶6 𝐻7 𝑂5 por [Webbook: NIST, 2018]
VIRIDIANA PÉREZ LÓPEZ Página 168
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo M. Espectros de absorción UV-VIS del 𝐶6 𝐻7 𝑂5
Espectro de absorción UV-VIS del 𝐶6 𝐻7 𝑂5 reportado por [Song et. al., 2015].
VIRIDIANA PÉREZ LÓPEZ Página 169
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo N. Espectro de absorción de AuNP´s sintetizadas con
𝐶6 𝐻8 𝑂6
N.1. Espectro de absorción de AuNP´s sintetizadas con diferentes concentraciones de
𝐶6 𝐻8 𝑂6 por [Khan et. al., 2013]
N.1. Espectro de absorción de AuNP´s sintetizadas con 𝐶6 𝐻8 𝑂6 por [Malassis et. al.,
2016]
VIRIDIANA PÉREZ LÓPEZ Página 170
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo O. Colores característicos de AuNP´s sintetizadas con
mostos de uva
Colores característicos de las soluciones coloidales de AuNP´s sintetizadas con mosto
de uva por [De lamo, 2015]
VIRIDIANA PÉREZ LÓPEZ Página 171
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Anexo P. Espectro UV-VIS de AuNP´s sintetizadas con mosto de
uva
Espectros UV-Vis de AuNP´s sintetizadas con mosto de uva por [De lamo, 2015]
VIRIDIANA PÉREZ LÓPEZ Página 172
REFERENCIAS BIBLIOGRAFICAS
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Acosta, D. (2007). Cuantificación de Ácido Ascórbico (Vitamina C) en Néctares de
Melocotón y Manzana Comercializados en Supermercados de la Ciudad
Capital. (Tesis de grado). Universidad de San Carlos de Guatemala. Guatemala.
Almeida, J. (2013). Una visión global y actual de los azucares. Hospital de la Virgen de
la vitoria. Diplomado en Nutrición. Malaga España.Pag 10
Al-Qadi, S. y Remuñan, C. (2009). Nanopartículas metálicas: oro. (Tesis de grado).
Universidad de Santiago Compotela. Chile.
Anastas, P. y Williamson, C. (2002). Green Chemistry: An overview. Oficina de prevención
de tóxicos. Washington E.U. 3-5.
Andújar, R. (2013). Espectroscopia infrarrojo. Universidad de puerto rico. San Juan.
Puerto rico. 25-27.
Anónimo. (1998). Vitamin and mineral requirements in human nutrition. Segunda
edición. Library Cataloguing-in-Publication. Tailandia. (6). 130-139.
Anónimo. (2005). Técnicas estructurales: Aplicación de química inorgánica. 5°curso. 6-
10.
Anónimo. (2018). 7/06/2018. 11.02 pm. 12. Lengngjul principles pf greem chemistry.
http:// www.acs.org/greenchemistry.
Aquino, C. y Moran, D. (2013). Determinación de ácido ascórbico como conservador en
brócoli. (Tesis de licenciatura). Escuela Superior de Ingeniería Química e
Industrias Extractivas. CDMX. 14-22.
Arena, I. y López, J. (2004). Espectrofotometría de absorción. (Tesis de Maestría).
Universidad Autónoma de México. CDMX.
VIRIDIANA PÉREZ LÓPEZ Página 173
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Arellano, S. (2016). Espectroscopia infrarrojo. (Tesis de licenciatura). Universidad
Autónoma de México. CDMX.
Arzate, I., Fernández, D. (2012). El gel de aloe vera: estructura, composición química,
procedimientos, actividad biológica e importancia. Revista Mexicana de
Ingenieria Quimica. Escuela nacional de ciencias biológicas IPN. CDMX. ISSN:
1665-2738. 23-30.
Bacallao, L., García L., Mercedes, D. y Sánchez, E. (2017). Plantas con propiedades
antioxidantes. (Trabajo de fin de curso). Instituto Superior de Ciencias Básicas
y Preclínicas “Victoria de Girón”. La habana Cuba.
Balears, F. (2003). Prevención de riesgos laborales. (Trabajo de fin de curso). Universidad
contaminación química. Madrid, España.
Belmares, S., Torres, E., Coparán J., L., Arriaga, J. y Elizondo, N. (2013). Síntesis y
caracterización de nanopartículas de oro, plata y fierro por el método de
fisicoquímica verde (Tesis de grado). Universidad Autónoma de Nuevo León,
Nuevo León, México.
Bunaciu, A., Bacalim, E. y Hassan, Y. (2009). FT-IR Spectrophotometric Analysis of
Ascorbic Acid and Biotin and their Pharmaceutical Formulations. Revista:
Analytical Letters. Universidad de Bucharest, Bucharest, Romania.
Brust, M., Walker, M., Bethell, D., Schiffrin, J. y Whyman, R. (2014). Synthesis of Thiol-
derivatised Gold Nanoparticles in a Two-phase Liquid-Liquid System.
Universidad de Liverpool. Liverpool Londres.
Calderón, O. (2011). Efecto benéfico del Aloe en la salud. Revista especializada en
ciencias de la salud. VERTIENTES. CDMX.
VIRIDIANA PÉREZ LÓPEZ Página 174
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Cannor A., (1980). Curso de análisis farmacéutico. Ed. Reverté.
Cardeño, L. y Londoño, M. (2014). Síntesis verde de nanopartículas de plata mediante el
uso del ajo (Allium sativum). Escuela de Ingeniería de Antioquia-Universidad
CES. Grupo de Investigación en Ingeniería Biomédica EIA-CES. Bogotá.
Colombia.
Chamorro, A., Rubio, J. y Holguín, F. (2009). Determinación de ácido ascórbico en un
jugo comercial por espectroscopia ultravioleta. Facultad de ciencias naturales
y exactas, universidad del valle. Colombia.
CONACYT. 2018. 6/04/2018. http://www.conacyt.gob.mx
Constantin, A., Apetrei, A., De Saja, J y Rodriguez, M. (2011). Carbon paste electrodes
made from different carbonaceous materials: application in the study of
Antioxidants. Revista: Sensors. (11). 1328-1344.
Correia, A. (2006). Nanociencia y nanotecnología I. (Tesis de fin de curso). Universidad
de Madrid. Madrid España.
Corzo, A. (2012). Síntesis de nanopartículas de oro obtenida por reducción de HAUCl_4.
Revista de la Sociedad de Química de Perú, (78), 79-89.
Chetwani, D. (2015). Síntesis, modificación superficial y caracterización de nanopartículas
de oro (Trabajo Fin de Máster). Universidad de Oviedo. Austrias, España.
Colín, J., A. (2017. Síntesis de nanopartículas de oro asistida por extracto de alga marina
(Grado de licenciatura). Universidad Nacional Autónoma de México, Ensenada,
Baja California.
VIRIDIANA PÉREZ LÓPEZ Página 175
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Criado, C., y Castañeda, D. (2013). Fenómenos físicos de las nanopartículas de oro. (Tesis
de grado). Facultad de Ciencias Físico Matemáticas. Universidad Autónoma de
Nuevo León. Nuevo León México.
Danzer, K. y Currie, A. (1998). Guidelines for calibration in analytical chemistry Part I.
Fundamentals and single component calibration. Revista: IUPAC Pure &
Appl. Chem.(70). 993-1014.
De Lamo, B. (2015). Obtención de nanopartículas de oro a partir de mostos. (Tesis de
grado en Ingeniería Química). Universidad de Valladolid, Valladolid, España.
Dekamin, G., Siamand, I., Latifidoost, Z., Hamed, D., Karimi, Z. y Barikani, M. (2014).
Alginic acid: a highly efficient renewable and heterogeneous bio polymeric
catalyst for one-pot synthesis of the Hantzsch 1,4 dihydropyridines. Revista:
The Royal Society of Chemistry. (3). 200-250.
Dosal, M. y Villanueva, M. (2008). Curvas de calibración en los métodos analíticos.
(Trabajo de fin de curso). Universidad Autónoma de México. CDMX.
Englard, S. (1986). THE BIOCHEMICAL FUNCTIONS OF ASCORBIC ACID. Annual Review
of Nutrition.Bronx New York. U.S.A. (4). 365–406.
Escobedo, J., Ayala, R. y Ramírez, A. (2011). La problemática ambiental en la ciudad de
México generada por las fuentes fijas. (Trabajo de curso). Dirección de General
de Prevención y Control de la Contaminación. CDMX.
Garcés, A. y García, E. (2010). El escaramujo: propiedades y sus usos. Medicina naturista.
ISSN: 1576-3080. 150-156.
García, M. (2016). Apuntes para Espectrometría de Radiación Ultravioleta Visible
(UV/VIS). Toluca México.
VIRIDIANA PÉREZ LÓPEZ Página 176
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Guerra, S. (1991). MICROSCOPIA ELECTRONICA DE TRANSMISION Y DIFRACCION DE
ELECTRONES DE POLIMEROS. (Tesis de grado). Universidad Politécnica de
Catalunya. España.
Hamada, Y. (2016). Competition of Fe3+ UV-Vis Absorption between Ascorbic Acid (AA)
and Clofibric Acid (CA). Revista: Division of Natural and Mathematical Sciences.
U.S.A.
Harris, C. (2001). Análisis Químico Cuantitativo. Revista: Reverte. (2). 120-125.
Haza, D. (2013). Nanopartículas de oro: aplicaciones y citotoxicidad in vitro. (Tesis de fin
de grado). Facultad de Veterinaria. Universidad Complutense de Madrid.
Madrid España.
Heimendahl, M. (1980). Electron microscopy of materials : an introduction. Academia
Press, NewYork. U.S.A.
Hernández, K. y Sanguines, Z. (2017). Propuesta de nanopartículas de oro a partir de oro
solido, acido tetracloroaurico y deshechos electrónicos por vía química. (Tesis
de licenciatura). CDMX.
Hernando, A. (2007). Nanotecnología y Nanopartículas magnéticas: La física actual en
lucha contra la enfermedad. Revista: Programa de promoción de la cultura y
tecnología. (10). 322-340.
Hima, V., Rubesh, S., Duganath, N. y Devanna, N. (2013). Quantization of ascorbic acid
in ayurvedic amla capsule by various analytical techniques. Departamento de
Análisis farmacéutico. Anantapur, Andhra Pradesh, India.
IPN. 2018. 6/04/2018. https://www.ipn.mx/
VIRIDIANA PÉREZ LÓPEZ Página 177
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Julibert, A. (2013). Los polifenoles en boca de todos. (Tesis de grado). Universidad de
Navarra. España.
Khan, Z., Taruna, S., Hussain, J. y Hashmi. Au(III)–CTAB reduction by ascorbic acid:
Preparation and characterization of gold nanoparticles. Universidad central de
química. Delhi ,India.
Kovtun, A. (2007). Microscopias electrónicas TEM y SEM. (Tesis de grado). Universidad
Autónoma de México. CDMX.
Lago, F. (2015). Síntesis verde de nanopartículas. (tesis de grado). Universidad de Coruña
Facultad de Ciencias. España.
Lara, A., Olivera, A. y Olivera, B. (2009). La destrucción de México: La realidad ambiental
del país y el cambio climático. Grupo México. CDMX.
Leal, D., Matsuhiro, B., Rossi, M. y Caruso, F. (2007). FT-IR spectra of algínico acid block
fractions in three species of brown seaweeds. Facultad de química, Universidad
de Chile. Santiago de Chile, Chile.
Lohmann, W., Pagel, D y Volker, P. (1983). Structure of ascorbic acid and its biological
function Determination of the conformation of ascorbic acid and isoascorbic
acid by infrared and ultraviolet investigations. Instituto de Biophysik. Alemania.
Lozano, V., Yañez, J. y Morales, A. (2014). Principios y practica de la microscopia
electrónica. Bahia Blanca. Argentina. ISBN:978-987-43-4752-7.
Luckie, A. y López, G. (2013). Nanoestructuras metálicas. (Tesis de fin de grado).
Universidad Autónoma del Estado de México. CDMX.
VIRIDIANA PÉREZ LÓPEZ Página 178
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Malassis, L., Rémi, D., Murphy, R., Lawrence, A. Bertrand, D. y Murray, B. (2016). One step
green synthesis of gold and silver nanoparticles with ascorbic acid and their
versatile surface post-functionalization. Revista: Royal Society of Chemistry. (3).
3 3092–33100.
Mata, M., Guerrero, C., Pérez M., López, D., Delgado, R., Gonzales, G. Monroy, V. y
Vazquez, G. Principal Components by FTIR Spectroscopy as Innovative
Characterization Technique during Differentiation of Pluripotent Stem Cells to
Pancreatic Cells. (Tesis doctoral). Instituto Politécnico Nacional, Escuela
Superior de Medicina, CDMX.
Meenakshi, S., Gnanambigi, D., Tamil, S., Arumugam, M., y Balasubramanian. T. (2009).
Total Flavanoid and in vitro Antioxidant Activity of Two Seaweeds of
Rameshwaram Coast. Universidad de Annamalai. Tamil Nadu, India.
Meléndez, C. y Camacho, A. (2008). Química verde, la química del nuevo milenio.
Synthesis: Aventuras del pensamiento. (45), 2-4.
Mendoza, G. y Rodríguez, J. (2007). La Nanociencia y la nanotecnología: una resolución
en curso. Revista: Perfiles Latinoamericanos. (29). 1661-187.
Moctezuma, R. y Vilchis, N. (2010). Biosíntesis de nanopartículas de oro mediante el
extracto de Opuntia ficus-indica. Centro conjunto de investigación en química
sustentable. UNAM. CDMX. 94-97.
Mondragón, P. (2017). Espectroscopia de infrarrojo para todos y 51 espectros de
alimentos consumidos en México. Centro de Investigación y Asistencia en
Tecnología y Diseño del Estado de Jalisco. ISBN: 978-607-97548-4-6.
Murillo, R. (2006). Espectroscopia Infrarroja. (Tesis de grado). Universidad politécnica de
Madrid. Madrid, España.
VIRIDIANA PÉREZ LÓPEZ Página 179
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Naik, A. (2000). Fundamentos del microscopio electrónico y su aplicación en la
investigación textil. (Trabajo de último grado). Universidad de Córdoba,
Argentina.
Neira, I. (2015). Síntesis verde de Nanopartículas para la eliminación de colorantes en
medios acuosos. (Tesis doctoral). Universidad de Coruña. Coruña España.
Ordóñez, E. (2013). Evaluación nutricional y propiedades biológicas de algas marinas
comestibles. Estudios in vitro e in vivo. (Tesis doctoral). Universidad
complutense de Madrid. Madrid España.
Owen, T. (2000). Fundamentos de la espectroscopia UV-Visible moderna. Alemania.
ISBN: 5980-1397.
Pescador, J. (2006). Nanopartículas Bimetálicas de Au-Ag: Síntesis, Caracterización y su
Aplicación para el Transporte Térmico. (Tesis de maestría). Instituto Politécnico
Nacional. CDMX.
Petkovsek, H. (2010). Changes in sugars, organic acids and phenolics of grape berries of
cultivar Cardinal during ripening. Revista de agricultura. (8) 223 - 227.
Piqué, T. (2012). Uso de espectroscopia infrarroja con transformada de Fourier, en el
estudio de la hidratación de cemento. Revista: Concreto y cemento,
investigación y desarrollo. (2). 60-70.
Quintili, M. (2012). Nanociencia y nanotecnología … un mundo pequeño. Cuaderno 42
Centro de Estudios en Diseño y Comunicación. ISSN 1668-5229.
VIRIDIANA PÉREZ LÓPEZ Página 180
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Quilantan, C., J., Torres, R., O., Segovia, P., Coello, V., M., Obregón, R. y Elizondo, N.
(2017). Síntesis de nanopartículas de oro por el método de química verde con
aloe vera. Universidad Autónoma de Nuevo León, Nuevo León, México.
Ramírez, G. (2003). Sábila (Aloe vera). Revista: Fitoterapia. (3). España. 25-30.
Rastar, A., Yazdanshenas, M., Rashidi, A. y Bidoki, S. (2013). Theoretical review of optical
properties of nanoparticles. (Tesis doctoral). Departamento de Ingeniería textil.
Universidad de Azad. Iran.
Roucoux, A. y Schulz, J. (2002). Reduced transition metal colloids: A novel family of
reusable catalysts. Instituto de Ciencias Químicas de Rennes. Rennes Francia.
Publicado en: American Chemical Society. (8). 102-105.
Ribadeneria, D. (1998). Microscopia Electrónica fundamentos, teoría y aplicaciones. (Tesis
de licenciatura). Facultad de ingeniería eléctrica IPN. CDMX.
Rico, M., Vilchis, A., R., y Sanchez, V. (2010). Biosíntesis de nanopartículas de oro
mediante el extracto de Opuntia ficus-indica. Superficie y Vacío. 23(S). 94-97.
Rodríguez, E. (2012). Síntesis, Propiedades y Funcionalización de Clústeres Metálicos.
(Tesis doctoral). Universidad de Santiago de Compostela. España.
Salgo, I. (2016). Efectos ambientales de la contaminación por químicos. Revista Cubana
de Química. Universidad de Oriente. ISSN: 0258-5995.
Salicio, M. (2005). Colides e interfass. Revista de ediciones. Universidad de Salamanca.
ISBN: 8478005242.
VIRIDIANA PÉREZ LÓPEZ Página 181
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Schweizer, T. (2007). Aloe vera. La planta que cura. Revista: APB. Paris Frnacia. ISBN 2-
912978-02-5
Serena, P.A. (2005). Nanociencia y nanotecnología: Aspectos generales. Instituto de
Ciencia de Materiales de Madrid. Madrid, España.
Serrano, J. (2014). Curso de instrumentación y métodos analíticos. (Trabajo de fin de
grado). Universidad Autónoma de México. CDMX
Shang, L., Dong, S. y Nienhaus G. (2011). Ultra-small fluorescent metal nanoclusters:
Synthesis and biological applications. (Tesis doctoral). Instituto tecnologico de
Karlsruhe. Alemania.
Singh, D., Mohan S. Semalty, A. (2010). Gallic Acid-Phospholipid Complex: Drug
Incorporation and Physicochemical Characterization. Universidad de Srinagar.
Uttarakhand, India.
Singh, D., Rawat, R. y Mona S. (2011). Gallic Acid-Phospholipid Complex: Drug
Incorporation and Physicochemical Characterization. (Trabajo terminal).
Universidad de Srinagar. Uttarakhand, India.
Skoog, D. (2013). Principios de Análisis instrumental. Editorial Cengage Learning. (6).
Song, A., Chaoyin, C., Shenglan, Z. y Feng, G. (2015). Interaction of gallic acid with trypsin
analyzed by spectroscopy. University of Science and Technology, Kunming.
China
Souzaa, C., Siqueiraa, A., Amorima, M., De Moraisa, Tamara., Gonçalvesc, N., Gomesa, P.
y Nágila. (2015). Encapsulação do ácido l-ascórbico no biopolímero natural
galactomanana por spray‑drying: preparação, caracterização e atividade
antioxidante. Quim. Nova. Brasil. (38). 878-890.
VIRIDIANA PÉREZ LÓPEZ Página 182
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Sturm, C. (2012). Química analítica. (Trabajo de fin de grado). Universidad de Madrid.
Madrid, España.
Tan, Y., Yang, L. y Wang D. (2007). Simple and versatile route to the synthesis of
anisotropic bimetallic core-shell and monometallic hollow nanoestructures.
Departamento de ingeniería química. MIT, Cambridge, Massachusetts.
Tehuacanero, S. y Reyes, J. (2013). Simulation of the experimental hrtem contrast of
icosahedral gold nanoparticles of different sizes. (Tesis de fin de curso).
Universidad Nacional Autónoma de México, CDMX.
Tovar, E. (2016). Nanopartículas de Oro. Universidad Autónoma de San Luis Potosí. San
Luis Potosí, México.
Umer, A., Shahid, N., Naveed, R., Muhammad, S. y Muhammad, I . A green method for
the synthesis of Copper Nanoparticles using L-ascorbic acid. Universidad de
technologies. Lahore, Pakistán.
Vargas, A. (2007). Química verde en el siglo XXI: Química verde, una química limpia.
Revista Cubana de química. Santiago de Cuba, Cuba. (2). 30-31.
Visuet, P. (2017). Vitis Vinifera “UVA”. (Trabajo de fin de curso). Revista de las frutas.
Universidad de Madrid, Madrid España. (3). 280-285.
Vogler, T. (2014). Revisión de aloe vera (Barbadensis Miller) en la dermatología actual.
Revista Argentina de dermatología. (5). 1-5.
Volke, K. y Miramontes, O. (2013). Fronteras de la física en el siglo XXI. Editoral CopIt-
arXives. CDMX. ISBN: 978-1-938128-03-5.
VIRIDIANA PÉREZ LÓPEZ Página 183
“SINTESIS DE NANOPARTICULAS DE Au EMPLEANDO SÁBILA (ALOE BARBADENSIS), UVA (VITIS VINIFERA) Y LA CUANTIFICACIÓN DE 𝐶6 𝐻8 𝑂6 EN
LOS REDUCTORES ORGANICOS COMPARANDO LA SINTESIS CON REDUCTORES INORGANICOS DE 𝐾𝑁𝑎𝐶4 𝐻4 𝑂6 Y 𝐶6 𝐻8 𝑂6 . “
Webbook: 27/11/18. Libro del Web de Química del NIST,
https://webbook.nist.gov/chemistry
Wing, G. (2017). Las nanopartículas: pequeñas estructuras con gran potencial. Revista:
Contacto nuclear. El Instituto Nacional de Investigaciones Nucleares. CDMX.
(7). 107-110.
Zanella, R. (2012). Metodologías para la síntesis de Nanopartículas: controlando formas
y tamaños. Artículo: mundo nano. (5). UNAM. CDMX. 2-7.
Zavaleta, M., Vilchis, B., López, C., Arenas, A., Hanako, R. y Crosby, G. (2017). La
nanociencia y la nanotecnología. Universidad Nacional Autónoma de México.
CDMX.
VIRIDIANA PÉREZ LÓPEZ Página 184
También podría gustarte
- Principios básicos de bioquímica de los alimentosDe EverandPrincipios básicos de bioquímica de los alimentosCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Instituto Politécnico Nacional: Tesis Que para Obtener El Título deDocumento91 páginasInstituto Politécnico Nacional: Tesis Que para Obtener El Título deRodrigoEspinosa'fAún no hay calificaciones
- PerfumesDocumento21 páginasPerfumesTamara Cano HerranzAún no hay calificaciones
- Minerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.De EverandMinerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.Calificación: 3 de 5 estrellas3/5 (2)
- APUNTE CURSO DE PROTECCIÓN RADIOLÓGICA ESP Agosto 2017Documento115 páginasAPUNTE CURSO DE PROTECCIÓN RADIOLÓGICA ESP Agosto 2017Marisol Ibarra Ibarra50% (2)
- Curso LIXIVIACIÓNDocumento67 páginasCurso LIXIVIACIÓNCecy DiazAún no hay calificaciones
- Óxidos Mixtos o SalinosDocumento2 páginasÓxidos Mixtos o SalinosAntonia Malecanoza100% (4)
- Libro DQO 2008Documento157 páginasLibro DQO 2008Anthony Imanol Fuentes MendozaAún no hay calificaciones
- Manual de Mantenimiento2021Documento19 páginasManual de Mantenimiento2021Felipe RiescoAún no hay calificaciones
- Manual Curso RX-Agosto 2009 (UICT)Documento104 páginasManual Curso RX-Agosto 2009 (UICT)marco.pinaretamal5298Aún no hay calificaciones
- Guia de Concentracion de Minerales IIDocumento40 páginasGuia de Concentracion de Minerales IIIrvinVizurragaRicappaAún no hay calificaciones
- Tesis NBHDocumento158 páginasTesis NBHAlejandro ManzortAún no hay calificaciones
- FOTOSÍNTESISDocumento5 páginasFOTOSÍNTESISleoAún no hay calificaciones
- Desarrollo de Un Baño Electrolítico Alcalino No-Cianurado para Obtener Recubrimientos de Cinc.Documento139 páginasDesarrollo de Un Baño Electrolítico Alcalino No-Cianurado para Obtener Recubrimientos de Cinc.Alejandro VergaraAún no hay calificaciones
- "Síntesis de Análogos de 7-Cloroquinolil-4-Iltio y Del Benzotiazol. Evaluación de Su Potencial Actividad Antimalárica y Citotóxica-Antitumoral" Autor Lic. Jesús Antonio Romero LugoDocumento279 páginas"Síntesis de Análogos de 7-Cloroquinolil-4-Iltio y Del Benzotiazol. Evaluación de Su Potencial Actividad Antimalárica y Citotóxica-Antitumoral" Autor Lic. Jesús Antonio Romero LugoCristopher RodríguezAún no hay calificaciones
- PresentaciónDocumento34 páginasPresentacióngonzalo lascanoAún no hay calificaciones
- Aplicación de Nanopartículas Magnéticas en BiomedicinaDocumento34 páginasAplicación de Nanopartículas Magnéticas en Biomedicinagonzalo lascanoAún no hay calificaciones
- INMOVILIZACIÓN DE DERIVADOS DE BENCENSULFONAMIDA DENTRO DE MATERIALES MESOPOROSOS TIPO MCM-41 Y SBA-15, Y SU EVALUACIÓN COMO CATALIZADORES EN ADICIÓN ALDÓLICA ENTRE p-NITROBENZALDEHÍDO Y ACETONA EN AGUA”Documento114 páginasINMOVILIZACIÓN DE DERIVADOS DE BENCENSULFONAMIDA DENTRO DE MATERIALES MESOPOROSOS TIPO MCM-41 Y SBA-15, Y SU EVALUACIÓN COMO CATALIZADORES EN ADICIÓN ALDÓLICA ENTRE p-NITROBENZALDEHÍDO Y ACETONA EN AGUA”IrvinSerranoJAún no hay calificaciones
- ESTUIDOPLASTIDIOSDocumento102 páginasESTUIDOPLASTIDIOSYerald TorresAún no hay calificaciones
- Patiño Loján, Jorge XavierDocumento135 páginasPatiño Loján, Jorge XavierYessy Sujey OnofreAún no hay calificaciones
- Obregon Daniel Adsorcion CadmioDocumento110 páginasObregon Daniel Adsorcion CadmioYoel Alfonso AcostaAún no hay calificaciones
- Tesis Revestimientos e Inhibidores de Corrosion MatavargasDocumento107 páginasTesis Revestimientos e Inhibidores de Corrosion MatavargasDaniel BenegasAún no hay calificaciones
- Pra PreDocumento39 páginasPra Prekevin leonAún no hay calificaciones
- CONICET Digital Nro.3437706f 4d1d 4adb Aae5 0dc72aec4dc7 XDocumento35 páginasCONICET Digital Nro.3437706f 4d1d 4adb Aae5 0dc72aec4dc7 XDaniel BustosAún no hay calificaciones
- Tesis - 2018 - Ing Minas - Melithon Caso Alvarez y Nelida Raquel Gutierrez RamosDocumento78 páginasTesis - 2018 - Ing Minas - Melithon Caso Alvarez y Nelida Raquel Gutierrez RamosMayte Mendoza GallegosAún no hay calificaciones
- A.YSIWATA (T) - Desarrollo de Recubrimientos Anticorrosivos A Base de Una Resina Acrílica Con Grafeno, Nitrueo de Boro y Óxido de TitanioDocumento110 páginasA.YSIWATA (T) - Desarrollo de Recubrimientos Anticorrosivos A Base de Una Resina Acrílica Con Grafeno, Nitrueo de Boro y Óxido de TitanioAldo Córdoba GuerreroAún no hay calificaciones
- Degradacion NPDocumento82 páginasDegradacion NPSigilfredo Patiño CoronadoAún no hay calificaciones
- Jiménez CotillasDocumento416 páginasJiménez CotillaspajoderAún no hay calificaciones
- 1994-LIBRO-Trazas Nucleares en SolidosDocumento67 páginas1994-LIBRO-Trazas Nucleares en SolidosFri FriAún no hay calificaciones
- Metodo Fisioterapeutico KabatDocumento46 páginasMetodo Fisioterapeutico KabatnataliAún no hay calificaciones
- Aida RolandoDocumento127 páginasAida Rolandor4pk24822Aún no hay calificaciones
- MacadamiaDocumento175 páginasMacadamiajose64Aún no hay calificaciones
- NanopartículasDocumento12 páginasNanopartículasLaura Carolina PinedaAún no hay calificaciones
- Tesis FractografiaDocumento102 páginasTesis FractografiaThomas EnriquezAún no hay calificaciones
- ?utf 8?b?twfyw 61 Uiff 1 Axjveibfcmljaybbbgv 4 Axmgmjaxosbnqyblbibjts 5 Wzgy ?Documento154 páginas?utf 8?b?twfyw 61 Uiff 1 Axjveibfcmljaybbbgv 4 Axmgmjaxosbnqyblbibjts 5 Wzgy ?Erik PadillaAún no hay calificaciones
- TIJ137575Documento68 páginasTIJ137575Victor alberto Herrera ocampoAún no hay calificaciones
- Ciencia, Tecnología e InnovaciónDocumento120 páginasCiencia, Tecnología e InnovaciónWillmer AcostaAún no hay calificaciones
- Riesgos de La NanotecnologiaDocumento82 páginasRiesgos de La NanotecnologiaALEX DIAZAún no hay calificaciones
- Propuesta Final de GradoDocumento43 páginasPropuesta Final de GradoOscar ToroAún no hay calificaciones
- Preliminares SBQ3 Ref 3397Documento16 páginasPreliminares SBQ3 Ref 3397Casandra GarciaAún no hay calificaciones
- NanotecnologíaDocumento25 páginasNanotecnologíaLis MorantesAún no hay calificaciones
- FCC Metodos de MuestreoDocumento80 páginasFCC Metodos de MuestreoElizama PatiñoAún no hay calificaciones
- Diagnóstico de Plantas Acumuladoras de Metales en Relaves Mineros de La Región PunoDocumento142 páginasDiagnóstico de Plantas Acumuladoras de Metales en Relaves Mineros de La Región PunoEddy SamAún no hay calificaciones
- Rep 378Documento299 páginasRep 378TallarinesAún no hay calificaciones
- Universidad Nacional Daniel Alcides Carrión Facultad de Ingeniería de Minas Escuela de Formación Profesional de Ingenieria de MinasDocumento180 páginasUniversidad Nacional Daniel Alcides Carrión Facultad de Ingeniería de Minas Escuela de Formación Profesional de Ingenieria de MinasAndy Villajulca ReyesAún no hay calificaciones
- Guia de Concentracion de Minerales IIDocumento40 páginasGuia de Concentracion de Minerales IIcarlos solano chavezAún no hay calificaciones
- NanotecnologíaDocumento25 páginasNanotecnologíaCarlenny CardonaAún no hay calificaciones
- Manual Poe RX 40 HrsDocumento130 páginasManual Poe RX 40 Hrssucursal.lboAún no hay calificaciones
- Tesis Completa Archivo Único PDFDocumento270 páginasTesis Completa Archivo Único PDFAlejandra CastañedaAún no hay calificaciones
- Espesante ReologicosDocumento59 páginasEspesante ReologicosErick FaundezAún no hay calificaciones
- Analisis Quimico de Minerales, Rocas y Menas - Calderon Cruz - IF - 2018Documento154 páginasAnalisis Quimico de Minerales, Rocas y Menas - Calderon Cruz - IF - 2018Marcial PerezAún no hay calificaciones
- PROYECTODocumento83 páginasPROYECTOAngelica RojasAún no hay calificaciones
- Libro de QuímicaDocumento189 páginasLibro de QuímicaGrecia Camila Bendezu GranadosAún no hay calificaciones
- El Mercurio Como ContaminanteDocumento252 páginasEl Mercurio Como ContaminanteRudy Calsin PampaAún no hay calificaciones
- Caracterizacion Del Yacimiento de Diatomita PDFDocumento52 páginasCaracterizacion Del Yacimiento de Diatomita PDFMarco AndreAún no hay calificaciones
- Contaminacion en El Lago Peten Itza GuatDocumento123 páginasContaminacion en El Lago Peten Itza GuatMARIA JOSE QUIXCHAN SEGURAAún no hay calificaciones
- Síntesis y Cinética de La Descomposición Alcalina de La Arsenojarosita de Sodio en Medio NaOH y CaO PDFDocumento262 páginasSíntesis y Cinética de La Descomposición Alcalina de La Arsenojarosita de Sodio en Medio NaOH y CaO PDFCynthia GuerraAún no hay calificaciones
- Dinamicas de Carbono y Nitrogeno TolcayucaDocumento58 páginasDinamicas de Carbono y Nitrogeno TolcayucaAG VZAún no hay calificaciones
- Chopard - Sacher - Megamineria y Agua en Intag - 0 PDFDocumento62 páginasChopard - Sacher - Megamineria y Agua en Intag - 0 PDFritopoult100% (1)
- Procesos CatalicosDocumento5 páginasProcesos CatalicosJaen SaurAún no hay calificaciones
- Treball de Recerca (Versión Final)Documento55 páginasTreball de Recerca (Versión Final)david_hurtadoAún no hay calificaciones
- U 239225Documento62 páginasU 239225Yuri nayely Palacios mosqueraAún no hay calificaciones
- Manual QuimicaDocumento143 páginasManual QuimicaAisac GrAún no hay calificaciones
- Contaminación y remediación de suelos en Colombia. Aplicación a la minería de oroDe EverandContaminación y remediación de suelos en Colombia. Aplicación a la minería de oroAún no hay calificaciones
- Configuracion Electronica RVDocumento8 páginasConfiguracion Electronica RVAmauri BautistaAún no hay calificaciones
- 5 Actividad de Aprendizaje VirtualDocumento5 páginas5 Actividad de Aprendizaje VirtualERINSON MARIEL PULACHE VIERAAún no hay calificaciones
- # 9. Caracterización de Aldehídos y CetonasDocumento20 páginas# 9. Caracterización de Aldehídos y CetonasSteves FloresAún no hay calificaciones
- AtomoDocumento5 páginasAtomomonserratAún no hay calificaciones
- HDS Affinity 240 CeDocumento11 páginasHDS Affinity 240 CeMerary Nataly Ramírez MilanesAún no hay calificaciones
- Reporte Práctica 3 - Química Orgánica IIDocumento19 páginasReporte Práctica 3 - Química Orgánica IIROWENA DAYANA RODARTE DIAZAún no hay calificaciones
- Historia de La QuimicaDocumento6 páginasHistoria de La QuimicaNana Sepulveda100% (1)
- Consideraciones Generales para La Ejecución de Ensayos en La Prueba de JarrasDocumento12 páginasConsideraciones Generales para La Ejecución de Ensayos en La Prueba de JarrasJuan Camilo Hernandez LozanoAún no hay calificaciones
- Guia Ciencias 6° Lunes 20Documento5 páginasGuia Ciencias 6° Lunes 20CLAUDIA GARRIDOAún no hay calificaciones
- Guia N9 Circuitos MagneticosDocumento2 páginasGuia N9 Circuitos MagneticosJoaquin MonteroAún no hay calificaciones
- Capitulo 3Documento11 páginasCapitulo 3juan jose de la torreAún no hay calificaciones
- Matemáticas: Únete A Nuestro Canal de Documentos: Https:/t.me/sbdocsDocumento217 páginasMatemáticas: Únete A Nuestro Canal de Documentos: Https:/t.me/sbdocsdanielsuko64Aún no hay calificaciones
- Antoine LavosiereDocumento2 páginasAntoine LavosiereImpresiones ArboledasAún no hay calificaciones
- PC09 Yessenia MendozaDocumento14 páginasPC09 Yessenia MendozaYessenia Maricel Mendoza AlbarránAún no hay calificaciones
- Geles 1Documento14 páginasGeles 1Jorge GuarangoAún no hay calificaciones
- Revista Mexicana de Ingeniería Química 1665-2738: Issn: Amidiq@xanum - Uam.mxDocumento13 páginasRevista Mexicana de Ingeniería Química 1665-2738: Issn: Amidiq@xanum - Uam.mxLUIS FERNANDO PINOAún no hay calificaciones
- TP N°4 Energia LibreDocumento6 páginasTP N°4 Energia Libremauricio.d.posAún no hay calificaciones
- Fluidos EM 732 Ingeniería Mecanicos: Unidad Ii Estatica de Los FluidosDocumento109 páginasFluidos EM 732 Ingeniería Mecanicos: Unidad Ii Estatica de Los FluidosIsrael LeytonAún no hay calificaciones
- 13.FISICA - SEM - 13 - 14 - Al - 18 - Feb - 2022Documento5 páginas13.FISICA - SEM - 13 - 14 - Al - 18 - Feb - 2022Rodrigo ChávezAún no hay calificaciones
- Clase 1 IntroduccionDocumento17 páginasClase 1 IntroduccionPIA . CISTERNAS CABEZASAún no hay calificaciones
- Documento 3Documento6 páginasDocumento 3Cata MarinAún no hay calificaciones
- Practica N3 Quimica PDFDocumento5 páginasPractica N3 Quimica PDFKarla Marcela Tang VelaAún no hay calificaciones
- Trabajo 1 Electrouimica Blanca Falta TerminarDocumento2 páginasTrabajo 1 Electrouimica Blanca Falta TerminarBlanca Mariela Ccari CuentaAún no hay calificaciones
- Trabajo-Semana-10-Ciencias MaterialesDocumento22 páginasTrabajo-Semana-10-Ciencias MaterialesJosé Alberto MuñozAún no hay calificaciones
- Clase - 3 - Funcion AlquenoDocumento3 páginasClase - 3 - Funcion AlquenoAlexis QuipeAún no hay calificaciones
- SeguraCaballero J - MendozaRiera LDocumento74 páginasSeguraCaballero J - MendozaRiera LBryan Roncal LlajarunaAún no hay calificaciones