Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Pasos de La Inmunidad Adaptativa CRISPR
Cargado por
Diego OrellanoDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Pasos de La Inmunidad Adaptativa CRISPR
Cargado por
Diego OrellanoCopyright:
Formatos disponibles
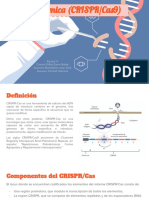
Pasos de la inmunidad adaptativa CRISPR-Cas
Adaptación
El primer paso de la defensa mediada por CRISPR-Cas (Figura 1) se conoce como adaptación o
adquisición. En esta fase, el material genético del fago invasor se incorpora al sistema CRISPR-
Cas, proporcionando así al organismo una forma de reconocer y ajustar su respuesta a nuevas
invasiones de esa cepa de fago en particular. Cas1 y Cas2 son las proteínas clave que median el
paso de adaptación, y son ubicuas en los sistemas CRISPR-Cas, independientemente del tipo.
Ambas proteínas son necesarias para este paso ya que la expresión de Cas1 o Cas2 por sí solas
no potencian la adquisición del espaciador. Otros experimentos mostraron que las mutaciones en
los genes cas1 o cas2 en las secuencias CRISPR de E. coli imposibilitan la adquisición del
espaciador, mientras que la sobreexpresión tanto de Cas1 como de Cas2 mejora la incorporación
del espaciador, confirmando el papel crucial de ambas proteínas en la adquisición del espaciador.
Biogénesis del ARN CRISPR
En todos los tipos de sistemas CRISPR-Cas, el locus CRISPR se transcribe en un precursor de
ARNcr (pre-ARNcr), que posteriormente es escindido y procesado por proteínas Cas o
ribonucleasas celulares, dando lugar a unidades más pequeñas de ARNcr maduro. Este ARNcr
maduro presenta una única secuencia espaciadora flanqueada por fragmentos de la región de
repetición. En el tipo V y el tipo VI, Cas12 y Cas13, respectivamente, son las proteínas que
procesan el pre-ARNcr en un ARNcr maduro, sin necesidad de moléculas de traARNcr. Sin
embargo, en el subtipo VI-A el paso de procesamiento no es esencial, ya que las moléculas de
pre-ARNcr pueden ser utilizadas como guías para la escisión de la diana.
Interferencia
Tras la infección, las moléculas de ARNcr maduras dirigen la maquinaria de interferencia
específica del subtipo hacia los ácidos nucleicos invasores para permitir el silenciamiento del
material genético extraño.
El recientemente caracterizado tipo VI se define por la presencia de la proteína Cas13 (antes
C2c2). Esta proteína contiene dominios de unión a nucleótidos de eucariotas superiores y
procariotas (HEPN), que son ubicuos en las RNasas. Cas13 es única en relación con otros
sistemas de clase 2 debido a su capacidad de escindir moléculas de ARNs homólogas al ARNcr,
que se complementa con la escindida no específica de otros ARNs, similar a la enzima Csm6 de
los sistemas de tipo III. El corte se produce preferentemente antes de los residuos de uridina (U).
Un sitio de flanqueo de protospacer dependiente de la especie (PFS), análogo a los PAMs en las
dianas de ADN, es también relevante para la activación de las proteínas Cas13 [58]. La unión al
ARNcr induce cambios conformacionales en Cas13 que promueven el emparejamiento del ARNs.
Tras la unión a la diana, la actividad RNasa de Cas13 es impulsada por la aproximación de los
sitios catalíticos de ambos dominios HEPN.
Los esfuerzos genómicos y experimentales concertados para la caracterización exhaustiva de los
sistemas CRISPR-Cas de clase 2 han permitido identificar dos nuevos tipos y varios subtipos. Los
sistemas de tipo VI recientemente caracterizados son los primeros entre las variantes de CRISPR-
Cas que se dirigen exclusivamente al ARN. Inesperadamente, en algunos de los sistemas de
clase 2, la proteína efectora es además responsable del procesamiento del pre-ARNc. El análisis
comparativo de los complejos efectores indica que los sistemas de clase 2 evolucionaron a partir
de elementos genéticos móviles en múltiples e independientes ocasiones.
Cas es una forma de inmunidad programable que puede adaptarse para dirigirse a cualquier
secuencia y, por tanto, no está sometida a la presión de evolucionar una inmensa diversidad de
especificidades, como es el caso de las enzimas de modificación de la restricción, la forma más
abundante de inmunidad innata en procariotas [5]. Sin embargo, como cualquier sistema de
defensa, CRISPR-Cas está inmerso en una incesante carrera armamentística con los virus, lo que
se traduce en una rápida evolución de los genes cas [6] y en una notable diversidad de los
repertorios génicos y de las arquitecturas de los loci CRISPR-cas que se traduce en una
diversificación de los propios mecanismos de defensa. Más concretamente, es probable que la
diversificación de los sistemas CRISPR-Cas esté impulsada en parte por su coevolución
competitiva con las proteínas anti-CRISPR específicas codificadas por virus.
A pesar de esta amplia diversificación, un análisis comparativo exhaustivo ha revelado
importantes temas unificadores en la evolución de CRISPR-Cas. Estas tendencias comunes
incluyen múltiples contribuciones de elementos genéticos móviles a la aparición de la inmunidad
CRISPR-Cas y sus distintas variantes; una amplia duplicación de los genes cas que produce
complejos efectores funcionalmente versátiles; y una organización modular, con una amplia
recombinación de los módulos [4,8,13]. Los dos módulos principales de los sistemas CRISPR-Cas
consisten en conjuntos de genes que codifican proteínas implicadas en la adaptación (adquisición
del espaciador) y en las funciones efectoras, es decir, en el procesamiento del pre-ARNc y en el
reconocimiento y corte de la diana. El módulo de adaptación es ampliamente uniforme en toda la
diversidad de los sistemas CRISPR-Cas y consiste en la endonucleasa Cas1 y la subunidad
estructural Cas2 [14]. En cambio, los módulos efectores son muy variables entre los tipos y
subtipos de CRISPRCas. Varias proteínas implicadas en funciones auxiliares, como la regulación
de la respuesta CRISPR y otras funciones aún poco caracterizadas, pueden asignarse a un tercer
módulo accesorio.
La exploración de la diversidad de CRISPR y la clasificación en evolución de los sistemas
CRISPR-Cas
La rápida evolución y variabilidad de los sistemas CRISPR-Cas hace que su clasificación sea una
tarea de enormes proporciones. Dada la ausencia de genes cas universales y la frecuente
recombinación modular, un único criterio de clasificación es es impracticable. Por lo tanto, se ha
adoptado un enfoque múltiple para de CRISPR-Cas que tiene en cuenta los genes cas
característicos en cuenta la firma de los genes cas que son específicos para los tipos y subtipos
individuales de CRISPR-Cas, la similitud de la secuencia entre múltiples proteínas Cas
compartidas, la filogenia de Cas1 (la proteína Cas mejor conservada), la organización del gen en
los loci CRISPR-cas y la estructura de los propios CRISPR.
La aplicación combinada de estos criterios dio como resultado el esquema de clasificación
actualmente adoptado que divide los sistemas CRISPR-Cas en dos clases distintas caracterizadas
por diferentes principios del diseño del módulo efector (Figura 1).
Los módulos efectores de la clase 2 consisten en una sola proteína multidominio de gran tamaño
cada uno, de modo que los respectivos loci CRISPR-cas tienen una organización mucho más
simple y uniforme que los de la clase 1 (Figura 1). En el momento de la construcción de la actual
clasificación formal de CRISPR-Cas [8], la Clase 2 incluía 3 subtipos del tipo II, completamente
caracterizado, con la endonucleasa efectora Cas9, la enzima de edición del genoma ampliamente
utilizada, y el tipo V, con la proteína efectora predicha Cpf1. El tipo V se incluyó en el esquema de
clasificación por primera vez y permaneció sin caracterizar experimentalmente. La posterior
demostración de que Cpf1 era en realidad una endonucleasa activa guiada por ARN que, a
diferencia de Cas9, no requería el ARN transactivador CRISPR (tracr) adicional para la escisión
de la diana [29], suscitó el interés por la caracterización exhaustiva de la diversidad de los
sistemas CRISPR-Cas de clase 2 mediante la extracción de genomas y metagenomas.
requisitos mínimos para un locus CRISPR son la presencia de una matriz de repeticiones CRISPR
y una nucleasa efectora cercana.
También podría gustarte
- Sistemas CRISPRDocumento5 páginasSistemas CRISPRWilber RodriguezAún no hay calificaciones
- TALLER BiotecnologiaDocumento6 páginasTALLER BiotecnologiaJazmin GarciaAún no hay calificaciones
- Sistemas Crispr No ConvencionalesDocumento4 páginasSistemas Crispr No ConvencionalesdayranaAún no hay calificaciones
- Tema 9Documento4 páginasTema 9Miriam González RuizAún no hay calificaciones
- GUIÓN SEMINARIO BIOQUIMICA (Recuperado Automáticamente)Documento5 páginasGUIÓN SEMINARIO BIOQUIMICA (Recuperado Automáticamente)Laopa otrocasAún no hay calificaciones
- 2e. Taller Artículo CRISPR CasDocumento3 páginas2e. Taller Artículo CRISPR CasCarlos Boada ContrerasAún no hay calificaciones
- Tema 3 GmaDocumento29 páginasTema 3 GmaanabelenorcajadapastorAún no hay calificaciones
- Ebook CRISPR Cas PDFDocumento14 páginasEbook CRISPR Cas PDFCRISTIAN ALONSO RODRIGUEZ GONZALEZ100% (1)
- Monografia CrisprcasDocumento22 páginasMonografia CrisprcasMaziel Pamela Cusi CasanovaAún no hay calificaciones
- Crisp Cas 9 PDFDocumento5 páginasCrisp Cas 9 PDFYoli LoutfallahAún no hay calificaciones
- Crisp Cas 9Documento5 páginasCrisp Cas 9Yoli LoutfallahAún no hay calificaciones
- Particpacion EstudioDocumento8 páginasParticpacion EstudioAlis NoriegaAún no hay calificaciones
- CRISPRDocumento33 páginasCRISPRSusana RojasAún no hay calificaciones
- Sistema CasDocumento11 páginasSistema CasWilber RodriguezAún no hay calificaciones
- CRISPr Cas9 y Gateway Cloning TechnologyDocumento32 páginasCRISPr Cas9 y Gateway Cloning TechnologyEsteban Neftalí Portillo SotoAún no hay calificaciones
- Acerca Del Sistema CRISPR Cas9 y Su Aplicación para Editar Genesv2Documento3 páginasAcerca Del Sistema CRISPR Cas9 y Su Aplicación para Editar Genesv2Carolinamcr95Aún no hay calificaciones
- ¿Qué Es La Tecnología CRISPR/Cas9 y Cómo Nos Cambiará La Vida?Documento8 páginas¿Qué Es La Tecnología CRISPR/Cas9 y Cómo Nos Cambiará La Vida?Angel ChavesAún no hay calificaciones
- Expo CRISPR-CasDocumento27 páginasExpo CRISPR-CasLaopa otrocasAún no hay calificaciones
- Unidad 2-Fase 4-Trabajo ColaborativoDocumento14 páginasUnidad 2-Fase 4-Trabajo ColaborativoAlis Noriega0% (1)
- 271-Eq.6-Práctica 14-Biología MolecularDocumento5 páginas271-Eq.6-Práctica 14-Biología MolecularRuben MartinezAún no hay calificaciones
- ¿Qué Es La Tecnología CRISPR/Cas9 y Cómo Nos Cambiará La Vida?Documento8 páginas¿Qué Es La Tecnología CRISPR/Cas9 y Cómo Nos Cambiará La Vida?Angel ChavesAún no hay calificaciones
- Los Sistemas CRISPR-Cas de Defensa MicrobianaDocumento8 páginasLos Sistemas CRISPR-Cas de Defensa MicrobianaMarianaAún no hay calificaciones
- Unidad 2 - Fase 4 - Estudio de Casos 4Documento19 páginasUnidad 2 - Fase 4 - Estudio de Casos 4Mari Ipuz100% (2)
- ¿Qué Es La Tecnología CRISPR - Cas9 y Cómo Nos Cambiará La Vida - Dciencia PDFDocumento6 páginas¿Qué Es La Tecnología CRISPR - Cas9 y Cómo Nos Cambiará La Vida - Dciencia PDFJose Gregorio Ochoa HidalgoAún no hay calificaciones
- Repeticiones Palindrómicas CortasDocumento4 páginasRepeticiones Palindrómicas CortasJoe PertuAún no hay calificaciones
- Farmacologia Molecular 3Documento6 páginasFarmacologia Molecular 3luisgomezgoAún no hay calificaciones
- CASPASASDocumento4 páginasCASPASASJoselyn KarinaAún no hay calificaciones
- Resumen de CRISPR Cas9Documento2 páginasResumen de CRISPR Cas9Dianny PerezAún no hay calificaciones
- Metodo CrisprDocumento4 páginasMetodo Crisprmontanodaniela040Aún no hay calificaciones
- Fase 5 - Estudio de Casos - Grupo 6Documento19 páginasFase 5 - Estudio de Casos - Grupo 6William Cajigas JimenezAún no hay calificaciones
- CRISPRDocumento3 páginasCRISPROscar De La RosaAún no hay calificaciones
- Genomica en Funcion Al Crispr .Documento4 páginasGenomica en Funcion Al Crispr .paolaperaltaa1902Aún no hay calificaciones
- Tarea 1-T Pinargote, M AguilarDocumento2 páginasTarea 1-T Pinargote, M AguilarTania PinargoteAún no hay calificaciones
- Qué Es La Tecnología CrisprDocumento8 páginasQué Es La Tecnología CrisprJRIISSAún no hay calificaciones
- Guía Biomol Tercer ParcialDocumento9 páginasGuía Biomol Tercer ParcialAlexa LeconaAún no hay calificaciones
- Investigacion BiologiaDocumento5 páginasInvestigacion BiologiaRosa lilia GarcíaAún no hay calificaciones
- CRISPRCas 9Documento17 páginasCRISPRCas 9omar barreraAún no hay calificaciones
- Las CaspasasDocumento3 páginasLas CaspasasAlexis ManchegoAún no hay calificaciones
- Que Es La CrisprDocumento3 páginasQue Es La CrisprJoan David Caballero 801Aún no hay calificaciones
- Crispr (Crrna) Es Utilizado para Guiar A La Nucleasa Específica Cas, Que Cuenta ConDocumento2 páginasCrispr (Crrna) Es Utilizado para Guiar A La Nucleasa Específica Cas, Que Cuenta ConMilena MurilloAún no hay calificaciones
- CRISPR Cas9Documento9 páginasCRISPR Cas9Emi SerranoAún no hay calificaciones
- Crispr PDFDocumento4 páginasCrispr PDFrousesAún no hay calificaciones
- Crispr Cas9Documento3 páginasCrispr Cas9ZHARICK JULIETH HERNANDEZ BORJAAún no hay calificaciones
- CRISPR Cas9Documento5 páginasCRISPR Cas9Martinez avila Jose GaelAún no hay calificaciones
- CRISPR-Cas9 DocumentoDocumento21 páginasCRISPR-Cas9 DocumentoSamantha NarváezAún no hay calificaciones
- CRISPRCas 9Documento11 páginasCRISPRCas 9kyriephobiaAún no hay calificaciones
- La Edición Del ADN Ad PortasDocumento12 páginasLa Edición Del ADN Ad PortasAmy LudenaAún no hay calificaciones
- Trabajo Final - Genética Bacteriana - Replicacion, Transcripcion y Traduccion - Rodríguez Rojas José AntonioDocumento6 páginasTrabajo Final - Genética Bacteriana - Replicacion, Transcripcion y Traduccion - Rodríguez Rojas José AntonioJose Antonio Rodriguez RojasAún no hay calificaciones
- Trabajo VihDocumento7 páginasTrabajo Vihbeuka83Aún no hay calificaciones
- Taller Exosomas Juan José SuárezDocumento1 páginaTaller Exosomas Juan José Suárezjuanjose suarezAún no hay calificaciones
- CRISPR/Cas9: Autores: Blanca Blasco Garcia, Gema Molleja Pulido e Ignacio Moratilla RiveraDocumento13 páginasCRISPR/Cas9: Autores: Blanca Blasco Garcia, Gema Molleja Pulido e Ignacio Moratilla RiveraYuki AmaneAún no hay calificaciones
- CRISPRCasDocumento14 páginasCRISPRCasVictor AvilaAún no hay calificaciones
- Ing GeneticaDocumento17 páginasIng GeneticaJose Alberto PumaAún no hay calificaciones
- PlasmidosDocumento62 páginasPlasmidosBrandon Chahua ObregonAún no hay calificaciones
- Principios Básicos y Aplicaciones Clínicas de La Edición Del Genoma Basada en CRISPRDocumento2 páginasPrincipios Básicos y Aplicaciones Clínicas de La Edición Del Genoma Basada en CRISPRAlbeer CortésAún no hay calificaciones
- Arn Origen Del OrigenDocumento3 páginasArn Origen Del Origenjuan_montiveroAún no hay calificaciones
- Exposición Equipo 6 LigasasDocumento17 páginasExposición Equipo 6 LigasasGalo AlvarezAún no hay calificaciones
- Crispr Cas9Documento7 páginasCrispr Cas9J. F.Aún no hay calificaciones
- Muerte Celular Biología MolecularDocumento4 páginasMuerte Celular Biología MolecularLuis Armando Saavedra UbillaAún no hay calificaciones
- Examen 1er Bimestre - 5to AñoDocumento2 páginasExamen 1er Bimestre - 5to AñoDiego OrellanoAún no hay calificaciones
- Examen 1er Bimestre - 3er AñoDocumento1 páginaExamen 1er Bimestre - 3er AñoDiego OrellanoAún no hay calificaciones
- Examen 1er Bimestre - 2do AñoDocumento1 páginaExamen 1er Bimestre - 2do AñoDiego OrellanoAún no hay calificaciones
- Acidos Nucleicos y Dogma Central de La BiologiaDocumento1 páginaAcidos Nucleicos y Dogma Central de La BiologiaDiego OrellanoAún no hay calificaciones
- Guión #01 - La CuaresmaDocumento2 páginasGuión #01 - La CuaresmaDiego OrellanoAún no hay calificaciones
- Clase 1 - Generalidades de Ciencia y TecnologíaDocumento4 páginasClase 1 - Generalidades de Ciencia y TecnologíaDiego OrellanoAún no hay calificaciones
- 1309 Anticorrosivo Marino Pu 403Documento2 páginas1309 Anticorrosivo Marino Pu 403Alejandro 20Aún no hay calificaciones
- Semana 2 - Clases y Estructuras Hidraulicas en El PeruDocumento90 páginasSemana 2 - Clases y Estructuras Hidraulicas en El PeruCarlos Maldonado LopezAún no hay calificaciones
- Biología CelularDocumento4 páginasBiología CelularSandra Estefany Ahon CalongeAún no hay calificaciones
- Informe SomatotipoDocumento10 páginasInforme SomatotipoCamila BelenAún no hay calificaciones
- Subjetivemas y ModalizadoresDocumento7 páginasSubjetivemas y ModalizadoresMelisa GnesuttaAún no hay calificaciones
- Ficha Docentes Seguimiento A Sesiones Aprendo en CasaDocumento11 páginasFicha Docentes Seguimiento A Sesiones Aprendo en CasaLeydi Borda100% (1)
- El Arte de La Normalización PDFDocumento107 páginasEl Arte de La Normalización PDFClaudia TcAún no hay calificaciones
- Análisis No Lineal de CablesDocumento15 páginasAnálisis No Lineal de CablesMisaicoSairitupacKevinAún no hay calificaciones
- Analisis de Estados FinancierosDocumento6 páginasAnalisis de Estados FinancierosSolmar MosquedaAún no hay calificaciones
- Informe Práctica #7 Ondas EstacionariasDocumento11 páginasInforme Práctica #7 Ondas EstacionariasKeidy Mayerli Cortes RozoAún no hay calificaciones
- Tarea 4Documento9 páginasTarea 4diego sanchezAún no hay calificaciones
- NeurulacionDocumento8 páginasNeurulacionCamila Dueñas ZamalloaAún no hay calificaciones
- Cii-Pr-Pc1-0007-Procedimiento de Colocación, Vibrado y Curado Del ConcretoDocumento17 páginasCii-Pr-Pc1-0007-Procedimiento de Colocación, Vibrado y Curado Del ConcretoNoelia Marian Cruz AlemanAún no hay calificaciones
- Presentacion Diplomado IiDocumento19 páginasPresentacion Diplomado IiEDITH OLVERAAún no hay calificaciones
- Practicas DiseñoDocumento76 páginasPracticas Diseñoflor silviaAún no hay calificaciones
- Term I Nosy CondicionesDocumento5 páginasTerm I Nosy Condicionesjuantito522Aún no hay calificaciones
- BOLETASDocumento8 páginasBOLETASHenrry HeisenbergAún no hay calificaciones
- Experiencia de Aprendizaje - Semana de Adaptación 2022Documento6 páginasExperiencia de Aprendizaje - Semana de Adaptación 2022Sorayda Rodríguez G.Aún no hay calificaciones
- Yogurt de ArazaDocumento185 páginasYogurt de ArazaElvikoo Cristina Achina100% (1)
- Morfologia y Clasificacion de Las HojasDocumento8 páginasMorfologia y Clasificacion de Las HojasAnonymous i3uUF68e3I100% (1)
- Paseo Por La Alhambra IIDocumento60 páginasPaseo Por La Alhambra IIlumaromartin100% (1)
- RacionalismoDocumento6 páginasRacionalismoAndrea AlzateAún no hay calificaciones
- When Another Scot Ties The KnotDocumento328 páginasWhen Another Scot Ties The KnotSofía Salamanca75% (4)
- Manual Del Usuario DronDocumento19 páginasManual Del Usuario DronAnaAún no hay calificaciones
- Clasificación de Las Magnitudes Físicas para Tercer Grado de SecundariaDocumento3 páginasClasificación de Las Magnitudes Físicas para Tercer Grado de SecundariaYolanda Carrillo100% (1)
- Libre Pensamiento 105 1Documento120 páginasLibre Pensamiento 105 1nu_01001110Aún no hay calificaciones
- Los Dinamos - Google MapsDocumento7 páginasLos Dinamos - Google Mapsalexbeta1989Aún no hay calificaciones
- La NeurocienciaDocumento6 páginasLa Neurocienciacristhian antonio mejia castroAún no hay calificaciones
- Lab03 2024 1Documento5 páginasLab03 2024 1mark.guerraAún no hay calificaciones
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Las Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónDe EverandLas Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónCalificación: 4 de 5 estrellas4/5 (4)
- Anatomía del caballo: Guía práctica ilustradaDe EverandAnatomía del caballo: Guía práctica ilustradaCalificación: 4 de 5 estrellas4/5 (9)
- Historia del cuerpo humano: Evolución, salud y enfermedadDe EverandHistoria del cuerpo humano: Evolución, salud y enfermedadAún no hay calificaciones
- Cerebro y silencio: Las claves de la creatividad y la serenidadDe EverandCerebro y silencio: Las claves de la creatividad y la serenidadCalificación: 5 de 5 estrellas5/5 (2)
- Química orgánica: ejercicios de aplicaciónDe EverandQuímica orgánica: ejercicios de aplicaciónCalificación: 5 de 5 estrellas5/5 (3)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- Procesos de moda multifocal: Aproximaciones teóricas y prácticas sobre indumentaria latinoamericana del siglo XXIDe EverandProcesos de moda multifocal: Aproximaciones teóricas y prácticas sobre indumentaria latinoamericana del siglo XXICalificación: 3 de 5 estrellas3/5 (2)
- 200 tareas en terapia breve: 2ª ediciónDe Everand200 tareas en terapia breve: 2ª ediciónCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- El chico a quien criaron como perro: Y otras historias del cuaderno de un psiquiatra infantilDe EverandEl chico a quien criaron como perro: Y otras historias del cuaderno de un psiquiatra infantilCalificación: 5 de 5 estrellas5/5 (41)
- Psicología forense: Estudio de la mente criminalDe EverandPsicología forense: Estudio de la mente criminalCalificación: 4.5 de 5 estrellas4.5/5 (18)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- El nacimiento del pensamiento científico: Anaximandro de MiletoDe EverandEl nacimiento del pensamiento científico: Anaximandro de MiletoCalificación: 4.5 de 5 estrellas4.5/5 (4)
- La increíble conexión intestino cerebro: Descubre la relación entre las emociones y el equilibrio intestinalDe EverandLa increíble conexión intestino cerebro: Descubre la relación entre las emociones y el equilibrio intestinalCalificación: 4.5 de 5 estrellas4.5/5 (103)