Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Conclusion Lab CQRH P3
Conclusion Lab CQRH P3
Cargado por
Martin Perez0 calificaciones0% encontró este documento útil (0 votos)
5 vistas2 páginasEl autor concluye que los objetivos de la práctica se cumplieron al obtener datos cinéticos de la reacción a temperatura ambiente y fría. La constante de velocidad es mayor a temperatura ambiente, y una ecuación exponencial describe adecuadamente los datos. El orden de reacción supuesto de 1 fue correcto, y los valores iguales del factor de frecuencia para ambas temperaturas validan la energía de activación obtenida.
Descripción original:
CONCLUSION CINETICA
Título original
CONCLUSION-LAB-CQRH-P3
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl autor concluye que los objetivos de la práctica se cumplieron al obtener datos cinéticos de la reacción a temperatura ambiente y fría. La constante de velocidad es mayor a temperatura ambiente, y una ecuación exponencial describe adecuadamente los datos. El orden de reacción supuesto de 1 fue correcto, y los valores iguales del factor de frecuencia para ambas temperaturas validan la energía de activación obtenida.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas2 páginasConclusion Lab CQRH P3
Conclusion Lab CQRH P3
Cargado por
Martin PerezEl autor concluye que los objetivos de la práctica se cumplieron al obtener datos cinéticos de la reacción a temperatura ambiente y fría. La constante de velocidad es mayor a temperatura ambiente, y una ecuación exponencial describe adecuadamente los datos. El orden de reacción supuesto de 1 fue correcto, y los valores iguales del factor de frecuencia para ambas temperaturas validan la energía de activación obtenida.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
CONCLUSIÓN (FLORES SALAS ALDO)
Habiendo finalizado la práctica puedo concluir que los objetivos de la práctica
fueron cumplidos en su totalidad ya que mediante la experimentación se
obtuvieron datos del volumen de tiosulfato de sodio y agua oxigenada utilizados
para posteriormente aplicar el tratamiento de datos y pasar los datos de volumen a
concentración, tendiendo los datos experimentales en valores de concentración se
hizo uso del método integral para conocer los valores de la constante de velocidad
y el orden de reacción de los datos cinéticos de la temperatura ambiente y la
temperatura fría, cabe mencionar que en ambas temperaturas se observa que al
paso del tiempo la concentración del agua oxigenada va disminuyendo, además
se tiene una mayor concentración inicial de agua oxigenada en la temperatura fría
que en la temperatura ambiente.
Al aplicar el método integral en ambas temperaturas se observa que la constante
de velocidad es un valor muy pequeño con la suposición de un orden de reacción
(n) de 1, se puede observar que al evaluar la constante de velocidad con este
orden de reacción en ambas temperaturas el valor de la k a los diferentes tiempos
oscila entre un valor por lo que se decide obtener una k PROMEDIO, al obtener la
kPROMEDIO de ambas temperaturas se observa que la temperatura ambiente tiene un
valor de k mayor al de la k de la temperatura fría pues se obtuvo una k de 3.0456
X10-3 min-1 en la temperatura ambiente y una k de 1.6986 X10 -4 min-1 en la
temperatura fría, por lo que se concluye que se obtienen estos resultados debido a
que se realizó en mayor tiempo la reacción en la temperatura fría comparándose
con la temperatura ambiente, además de que el uso de una temperatura menor
también es una variable a considerar al comparar los datos cinéticos de la
temperatura fría con la temperatura ambiente así como tener una mayor
concentración inicial con temperatura fría comparándola con la concentración
inicial de la temperatura ambiente.
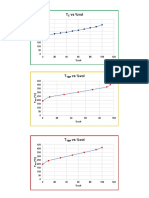
En el caso de la gráfica se observa que en ambas temperaturas la curva de los
datos cinéticos va descendiendo por lo que se decide utilizar una ecuación
exponencial además el modelo cinético también es una ecuación exponencial por
lo se concluye que es correcto suponer una ecuación exponencial para el modelo
de los datos cinéticos. Cabe mencionar que al tener un valor mayor de constante
de velocidad en la temperatura ambiente esto hará que se tenga una velocidad de
reacción mayor, esto se observa en la gráfica ya que la concentración en la
temperatura ambiente tiene una tendencia descendente de forma uniforme en
comparación con la temperatura fría en donde se observa que la curva de los
datos cinéticos no es uniforme al descender con el paso del tiempo.
Por último, es importante tomar un pseudo orden de reacción de 1 para utilizar la
ecuación de Arrhenius y obtener la energía de activación y el factor de frecuencia,
por lo que se concluye que el orden de reacción supuesto al inicio fue correcto. Al
obtener el valor de la energía de activación (E) se obtiene un valor muy alto de
24307.9239 cal/mol, pero al obtener los valores del factor de frecuencia de ambas
temperaturas se observa que el valor es el mismo (4.6699 X10 15 min-1) por lo que
se concluye que el valor de la energía de activación obtenida es correcto por
obtener valores del factor de frecuencia iguales usando la temperatura ambiente y
la temperatura fría.
También podría gustarte
- TP 5 Calorimetría y TermoquímicaDocumento14 páginasTP 5 Calorimetría y TermoquímicaRamiroClericiAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Laboratorio Nº6 - Un Experimento Simple de Cinética QuímicaDocumento11 páginasLaboratorio Nº6 - Un Experimento Simple de Cinética QuímicaRavenbachAún no hay calificaciones
- Tare A 1Documento2 páginasTare A 1moramora156% (9)
- Determinacion Del Coeficiente GammaDocumento11 páginasDeterminacion Del Coeficiente GammaKarito Montenegro CalleAún no hay calificaciones
- Fase# 2 AgroclimatologiaDocumento14 páginasFase# 2 AgroclimatologiaAnonymous C2mCKYZG100% (2)
- Aplicaciones de Ecuacion de Bernoulli en CanalesDocumento7 páginasAplicaciones de Ecuacion de Bernoulli en CanalesNataly Sanchez Ponte67% (3)
- Practica 6Documento2 páginasPractica 6David Alejandro Serrano RodríguezAún no hay calificaciones
- Justificación 3Documento5 páginasJustificación 3AndreamAún no hay calificaciones
- Reporte de TermodinamicaDocumento5 páginasReporte de TermodinamicaMauricio Baltazar PerezAún no hay calificaciones
- Conclusion Lab CQRH P2Documento2 páginasConclusion Lab CQRH P2Martin PerezAún no hay calificaciones
- Conclusion Lab CQRH P4Documento2 páginasConclusion Lab CQRH P4Martin PerezAún no hay calificaciones
- Documento 2Documento3 páginasDocumento 2David Alejandro Serrano RodríguezAún no hay calificaciones
- Medida Del Calor Latente de Fusión Del HieloDocumento7 páginasMedida Del Calor Latente de Fusión Del Hielojorgenitalesthe3rdAún no hay calificaciones
- Presion de VaporDocumento6 páginasPresion de VaporAnthony Ruiz ChavezAún no hay calificaciones
- Determinacion Calor de SolucionDocumento14 páginasDeterminacion Calor de SolucionDionisio MayorgaAún no hay calificaciones
- Informe Fisicoquimica 4 - CompressedDocumento9 páginasInforme Fisicoquimica 4 - CompressedMiel De Abeja Apícola LimahiAún no hay calificaciones
- Informe N°3 - Lab FQIIDocumento2 páginasInforme N°3 - Lab FQIIkarolAún no hay calificaciones
- Practica de Capacidad CalorificaDocumento11 páginasPractica de Capacidad CalorificaArmando Darien Santiago100% (1)
- Determinación de La Razón CP y CVDocumento9 páginasDeterminación de La Razón CP y CVOscar PortilloAún no hay calificaciones
- B91444 - Reporte#1 Propiedades FisicasDocumento12 páginasB91444 - Reporte#1 Propiedades FisicasIgnacio Calvo SolanoAún no hay calificaciones
- Informe 4Documento4 páginasInforme 4arturo saltivañeAún no hay calificaciones
- Practica 7 Capacidad CalorificaDocumento6 páginasPractica 7 Capacidad CalorificaanahiAún no hay calificaciones
- Informe #6 - Presión de VaporDocumento11 páginasInforme #6 - Presión de VaporCARLOS ALBERTO SANCHEZ RUIZAún no hay calificaciones
- Informe Lab FisicoquimicaDocumento11 páginasInforme Lab FisicoquimicaSANTIAGO PIRAGUA VEGAAún no hay calificaciones
- Informe N° 3Documento2 páginasInforme N° 3Carolina Alejandra Cardenas JametAún no hay calificaciones
- Informe 1Documento4 páginasInforme 1Vanessa PelaezAún no hay calificaciones
- Practica 7 CineticaDocumento6 páginasPractica 7 CineticaPoncho Malagón100% (1)
- Diagramas de Paridad UREA - Equipo 5Documento11 páginasDiagramas de Paridad UREA - Equipo 5paola diazAún no hay calificaciones
- Reporte Práctica 4-EvaporadoresDocumento9 páginasReporte Práctica 4-Evaporadoresdanysb244Aún no hay calificaciones
- Conclusiones MMDocumento1 páginaConclusiones MMPedro SanzAún no hay calificaciones
- Entrega Final - Modelación Numérica Del CalentamientoDocumento12 páginasEntrega Final - Modelación Numérica Del Calentamientomajegodi41Aún no hay calificaciones
- Informe. Calor de CombustiónDocumento6 páginasInforme. Calor de CombustiónJavier E. Verni BarruetaAún no hay calificaciones
- Practica 6 - Capacidades CalorificasDocumento11 páginasPractica 6 - Capacidades CalorificasYoali Asiain LeconaAún no hay calificaciones
- TERMOQUIMICADocumento9 páginasTERMOQUIMICACarlos Abel Solis PárragaAún no hay calificaciones
- Laboratorio 4 5 y 6 de QuimicaDocumento19 páginasLaboratorio 4 5 y 6 de QuimicaEnrico Emilio Latorraca100% (1)
- Informe Presion de VaporDocumento6 páginasInforme Presion de VaporElizabeth M. TuberquiaAún no hay calificaciones
- Influencia de La Temperatura Sobre La Velocidad de ReaccionDocumento9 páginasInfluencia de La Temperatura Sobre La Velocidad de ReaccionLuis Reyes SandovalAún no hay calificaciones
- Practica 5-Fisicoquimica 2016Documento9 páginasPractica 5-Fisicoquimica 2016Stephanie Alessandra Carpio VelasquezAún no hay calificaciones
- Reporte MicroMezcladoDocumento7 páginasReporte MicroMezcladoDavid Tapia MtzAún no hay calificaciones
- Seminario TermodinamicaDocumento19 páginasSeminario TermodinamicaJuan Emanuel VGAún no hay calificaciones
- Entalpia de Combustion y Compresion de GasesDocumento16 páginasEntalpia de Combustion y Compresion de GasesCQ YoelAún no hay calificaciones
- Informe EvaporadorDocumento9 páginasInforme EvaporadorJuan David Tuta BoteroAún no hay calificaciones
- Informe 5 Fisica 200Documento12 páginasInforme 5 Fisica 200Kevin TurciosAún no hay calificaciones
- Inf2 Olima Fuentes Visconti V1Documento12 páginasInf2 Olima Fuentes Visconti V1Emilia BrandolinAún no hay calificaciones
- Analisis de Resultados de La Primer Practica de Termodinamica UPIBI-IPNDocumento4 páginasAnalisis de Resultados de La Primer Practica de Termodinamica UPIBI-IPNJuan Emanuel VGAún no hay calificaciones
- Calorimetría Equivalente Térmico Del CalorímetroDocumento9 páginasCalorimetría Equivalente Térmico Del CalorímetroJohan Javier Suarez TiranoAún no hay calificaciones
- Calor Latente de Fusion Del HieloDocumento7 páginasCalor Latente de Fusion Del HieloeliasrtAún no hay calificaciones
- Coeficiente GammaDocumento6 páginasCoeficiente GammaAnonymous S0BZX8Aún no hay calificaciones
- Ejemplo de RedacciónDocumento4 páginasEjemplo de RedacciónJonathan RosasAún no hay calificaciones
- Balance de Energía en Un Régimen No-Estacionario 2011Documento4 páginasBalance de Energía en Un Régimen No-Estacionario 2011jorgchanAún no hay calificaciones
- Determinar El Cero Absoluto de TemperaturaDocumento10 páginasDeterminar El Cero Absoluto de TemperaturaHector Jesus Roca LoaizaAún no hay calificaciones
- Exp 7Documento4 páginasExp 7Gonzalvus Sandoval Riquelme100% (1)
- Reporte 1.Documento5 páginasReporte 1.Oscar de la ParraAún no hay calificaciones
- Termodinamica Gases IdealesDocumento12 páginasTermodinamica Gases IdealesAlex57% (7)
- Capacidad CalorificaDocumento9 páginasCapacidad CalorificaPaula100% (1)
- Calculo de La Conductividad Termica de Sol Sacarosa y AlimentosDocumento14 páginasCalculo de La Conductividad Termica de Sol Sacarosa y AlimentosRoberto MoroniAún no hay calificaciones
- PRÁCTICA 2C: CONDUCCIÓN NO ESTACIONARIA - Universidad Simón Bolívar - Transferencia de CalorDocumento8 páginasPRÁCTICA 2C: CONDUCCIÓN NO ESTACIONARIA - Universidad Simón Bolívar - Transferencia de CalorJorge Osuna100% (2)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Examen 1CDocumento2 páginasExamen 1CMartin PerezAún no hay calificaciones
- Practica 3 CQRHDocumento15 páginasPractica 3 CQRHMartin PerezAún no hay calificaciones
- GRAFICASDocumento2 páginasGRAFICASMartin PerezAún no hay calificaciones
- Formulario CPPDocumento15 páginasFormulario CPPMartin PerezAún no hay calificaciones
- Segunda Serie de ProblemasDocumento1 páginaSegunda Serie de ProblemasMartin PerezAún no hay calificaciones
- Eda Ets Ord A-B Cadena (18 6 2019) RespuestaDocumento12 páginasEda Ets Ord A-B Cadena (18 6 2019) RespuestaMartin PerezAún no hay calificaciones
- (Resolucion) Preguntas de Los S.E.P EN EL PERÚDocumento6 páginas(Resolucion) Preguntas de Los S.E.P EN EL PERÚKevin Pajar GamarraAún no hay calificaciones
- Ensayos LadrillosDocumento21 páginasEnsayos LadrillosLilian Hinostroza BravoAún no hay calificaciones
- Re-10-Lab-125 Refinacion Del Petroleo PDFDocumento20 páginasRe-10-Lab-125 Refinacion Del Petroleo PDFLopez CarlosAún no hay calificaciones
- Sistemas MaterialesDocumento38 páginasSistemas Materialeslautaro pepeAún no hay calificaciones
- Experiencia 5to de Primaria-Agosto.Documento23 páginasExperiencia 5to de Primaria-Agosto.suely FernandezAún no hay calificaciones
- Historia Del RozamientoDocumento11 páginasHistoria Del RozamientoAnonymous BSG6voYkm4Aún no hay calificaciones
- TRIANA - JORGE - Informe Proyecto 2da UnidadDocumento6 páginasTRIANA - JORGE - Informe Proyecto 2da UnidadJ Mario TrianaAún no hay calificaciones
- PHP Guia 1Documento9 páginasPHP Guia 1Edelfré Flores VelásquezAún no hay calificaciones
- Ejercicios de MateDocumento52 páginasEjercicios de MateBryan SanchoAún no hay calificaciones
- RESUMENDocumento3 páginasRESUMENLeidyVargasAún no hay calificaciones
- Memoria de Calculo (Torre Nerea)Documento22 páginasMemoria de Calculo (Torre Nerea)Jordán LopezAún no hay calificaciones
- 1los FluidosDocumento32 páginas1los FluidosKarlos Quiquia100% (1)
- Definición: Ab Ac BCX AbcDocumento30 páginasDefinición: Ab Ac BCX AbcAlto NivelAún no hay calificaciones
- Física Mecánica - Segunda Guía Ciclo VDocumento2 páginasFísica Mecánica - Segunda Guía Ciclo Vjhon gomezAún no hay calificaciones
- Tarea 2Documento6 páginasTarea 2Andrea CisnadoAún no hay calificaciones
- Decreto 3390 y Software LibreDocumento15 páginasDecreto 3390 y Software LibreCesar Alberto Hernandez OvallesAún no hay calificaciones
- Campo Magnético Terrestre PDFDocumento9 páginasCampo Magnético Terrestre PDFjavierjg4esoaAún no hay calificaciones
- Expresiones RegularesDocumento9 páginasExpresiones RegularesJose GonzalesAún no hay calificaciones
- Mercancias PeligrosasDocumento268 páginasMercancias PeligrosasEugenio Contreras100% (2)
- Prueba HidrostaticaDocumento16 páginasPrueba Hidrostaticafavio alejandro paz benavides100% (1)
- Ejercicios de RazonamientoDocumento8 páginasEjercicios de RazonamientoAlejandra RodriguezAún no hay calificaciones
- Ficha 2Documento13 páginasFicha 2Renzo Llontop CoronelAún no hay calificaciones
- Memoria Descriptiva de Carretera ChiguataDocumento80 páginasMemoria Descriptiva de Carretera Chiguata1SALAZARAún no hay calificaciones
- Anexo 5Documento65 páginasAnexo 5Carito PGAún no hay calificaciones
- Capacidad PortanteDocumento12 páginasCapacidad PortanteSmith Antony Bernaldo RamosAún no hay calificaciones
- Práctica 1 PDFDocumento16 páginasPráctica 1 PDFArantxa EscobedoAún no hay calificaciones
- Modelo de Flujo MáximoDocumento4 páginasModelo de Flujo MáximoMariaFernandaFarfanAún no hay calificaciones
- Unidad 3 Actividad 4 Matríz de Analisis Sobre Temperaturas Extremas NRC 4297Documento12 páginasUnidad 3 Actividad 4 Matríz de Analisis Sobre Temperaturas Extremas NRC 4297Cindy Johana BUSTAMANTE CASTANOAún no hay calificaciones