Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Repaso
Repaso
Cargado por
Nadia Sanchez RuizDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Repaso
Repaso
Cargado por
Nadia Sanchez RuizCopyright:
Formatos disponibles
Fisiología: Clasificación de seres Reinos: Célula Procarionte Célula Procarionte Postulados/Teoría Metabolismo: Estados físicos de la materia: Cambios del
/Teoría Metabolismo: Estados físicos de la materia: Cambios del estado de la materia: Bioenergética: Membrana plasmática: Comunicación celular:
vivos: celular: Carbohidratos:
-Celular -Monera: Material genetico libre Uni o pluricelulares. Catabolismo----> Destruir/lisis a) Sóliido: Líquido a Sólido = solidificación Estudio de los procesos de absorción, -Pasivo simple: sin gasto de energía, a Tipos de comunicación:
-Humana Según el número de Unicelulares en el -La célula es la unidad transformación y entrega de energía en los sistemas C, H, O (S y N)
favor de gradiente osmótico, pequeñas
-Organica células: Células procariotas citosol. Nucleo verdadero. estructural de todos los Anabolismo---->Contruir/genesis -Forma Sólido a Líquido = fusión biológicos. moléculas y moléculas apolares. -Endocrina: comunica por medio del
-Sistemica (bacterias y ciano seres vivos. -Volumen Clasificación:
torrente sanguíneo
-Comparada - Unicelulares bacterias) Bacterias. Abundantes Homeostasis: por Walter Bradford -Compresibilidad Líquido a Gas= vaporización Energía---es la capacidad de producir un -Pasivo facilitado: sin gasto de energía,
-Patologica - Pluricelulares membranas. -La célula es la unidad -Fuerzas intermoleculares (atracción) trabajo. 1.Monosacáridos:
Cannon (regulación del medio interno) a favor del gradiente osmótico, pasan -Paracrina: comunica con zonas cercanas
- Colonias celulares -Protista: Organelas funcional de todos los Gas a Líquido= condensación (Triosas y Tetrosas)
moléculas polares como la glucosa. a la célula
Pluricelulares rudimentarias. Organelas seres vivos. b) Líquido: Energética---es la parte de la física que estudia 2.Oligosacáridos
Longitudes: Medio interno: líquido extracelular e
Por la forma en la Unicelulares especializadas o -Adopta la forma del recipiente Gas a Sólido= cristalización las diversas formas de energía. (disacáridos[lactosa, sacarosa y maltosa]
intracelular -Activo: gasta energía, en contra del -Autocrina: comunica consigo misma
obtienen sus alimentos: (protozoos) Carecen de complejas. -La célula es la unidad -Volumen 3.Polisacáridos:
-Micrómetro: 10^-6 gradiente de concentración, precisa de
citoesqueleto. de origen de todos los -Fuerzas intermoleculares (atracción y repulsión igualadas) Sólido a Gas= sublimación Termodinámica---es la ciencia que estudia las (quitina, almidón y celulosa)
-Nanómetro: 10^-9 porcentajes %: transportadores (proteínas) -Yuxtacrina: comunica con otra célula
- Heterótrofos -Fungi: eucariota Tienen citoesqueleto. seres vivos. relaciones entre el calor y las demás formas
-Angstrom: 10^-10 mediante adhesión celular
- Autótrofos Unicelules Biparticion, gemacion. Propiedades del estado líquido: de energía. Hetero y Homopolisacáridos:
40% solidos Transporte macromolécular:
Pluricelulares Si hay mitosis y -La célula es la unidad -Vaporización (ebullición y evaporación) -Neuronal: envia señales a través de
Según su complejidad: (hongos) No mitosis no meiosis. meiosis. genéticas de todos los -Solidifición ATP... a)Hetero-formados por más de un tipo de
60% fluidos -Pinocitosis largas distancias (endocrina) a lo largo del
seres vivos. -Viscosidad monosacárido
-2/3 intracelular -Exocitosis axón.
- Procariontes -Vegetal: eucariota -1/3 extracelular -Tensión superficial -Endocitos
- Eucariontes Pluricelulares El cuerpo humano esta formado por La célula tiene la -Miscibilidad -Primer principio de la termodinámica: b)Homo-formado por un solo tipo de
a) 75% líquido intersticial -Fagocitosis Cascadas de señalización:
(vegetales) (1014) células aproximadamente. ( 100 capacidad de: "la energía no se crea ni se destruye solo se monosacárido (celulosa, glucogeno y
b) 25% plasma
billones de células). transforma de un tipo a otro". almidón)
Transforman señales de una forma
-Animal: eucariota Reproducción Sistemas de control Retroalimentación Ganancia: grado de c) Gaseoso: -Segundo principio de la termodinámica: "la energía molécular a otra más adecuada pra
Pluricelulares Irritabilidad componentes: negativa: eficacia con el que un -Adopta la forma del recipiente se degrada" (entropía= medida de desorden de un Rutas metabólicas:
transmitirla y amplifican la señal recibida.
(metazoos) Metabolismo sistema de control -Volumen completo sistema)
Desarrollo -Estimulo "inhiben los procesos mantiene condiciones -Compresi -Tercer principio de la termodinámica: Glucólisis--> oxidación de la glucosa
Moléculas de señalización extracelular:
Crecimiento -Receptor celulares de los que constantes bilidad "la entropía en el cero absoluta (0°K = -273 C°) es (2ATP, 2NADH y 2Piruvato)
Duplicación -Vía aferente provienen" nula para un sólido cristalino" Moléculas que no atraviesan la
Excreción -Centro integrador Correción LEYES DE LOS GASES Glucogénesis--ruta anabólica, sintesis de
membrana (proteínas y peptídos)
Secreción -Vía eferente Procesos transductores de energía: glucogeno a partir de un precursor más
Conductividad -Efector Retroalimentación Error 1. Ley de Boyle: a temperatura determinada y para una masa definida de gas, el 1. Fosforilación oxidativa (animales) simple (hígado y músculo)
Estados agregados de la materia: Bioelementos: Biomoléculas: Las que sí atraviesan la membrana (oxido
-Respuesta positiva: producto de la presión por el volumen es constante. 2. Fotofosforilación (plantas) nitríco, hormonas esteroideas y tiroideas)
Glucogenólisis--> degradación de
Materia: todo aquello que ocupa un lugar CHONPS Carbohidratos 2. Ley de Gay Lussac: para cierta masa de un gas a una presión constante, el Termoquímica: estudia los cambios energéticos que glucogeno a glucosa
En momentos puntuales Segundos mensajeros: actúan a través de
en el espacio y tiene masa, Proteínas Sistemas de control volumen crece linealmente con la temperatura. acompañan a las reacciones químicas.
(lactancia y parto) un modelo de 3 proteínas, siendo
propiedades de extensión, inercia y Lípidos fisiológico: Gluconeogénesis--> ruta anabólica que
gravitación. Posee propiedades generales y Ácidos nucleicos receptor, traductor (proteína G) y efector
"circulo vicioso" 3. Ley de Dalton: la presión ejercida por una mezcla gases es igual a la suma de las Exergónica: libera (respiración celular) es la sintesis de glucosa a paritr de
particulares. Regulación: Se presiones que ejercería por separado cada uno de ellos, si ocupara el volumen total. Endergónica: absorbe (fotosintesis) precursores no glucidos.
(biomoléculas Inductor (hormona)
entiende
La materia está compuesta por átomos inorgánicas) el proceso o el conjunto 4. Ley de Henry: el coeficiente de solubilidad es la cantidad de gas disuelto por ml Exotérmica: libera calor La molécula hormonal es el primer
de procesos que de líquido a 1atm. Endotérmica: absorbe calor mensajero.
Los átomos están compuestos por: Agua mantienen el estado de
Sales inorgánicas un sistema o el valor de Propiedades fisiológicas del estado gaseoso:
-electrones una determinada Energía libre de Gibbs:
-protones variable. -Solubilidad
-neutrones -Absorción Porción del potencial total de energía de un sistema
-núcleo atómico Control: Se refiere al -Adsorción natural para la ejecución de un trabajo.
mecanismo específico -Difusión
Propiedades de la materia: utilizado para conservar Ley de Hess:
constante la variable Fuerzas intermoleculares
Generales--> masa, peso, volumen, inercia regulada. El efecto calórico de un sistema reaccionante
Particulares--> punto de fusión, ebullición, densidad Fuerzas interatómicas: Fuerzas
intermoleculares: Coloidal: es un sistema heterogéneo dependde de solo los estados inicial y final y es
y reactividad. en el que las fases no se separan. independiente de los intermedios.
Ión (con carga)
Clasificación: Catión (+) -Van der Waals (sustancias
no polares) Las partículas del soluto son Entalpía= variable de estado que se define como la
Anión (-)
-Fuerzas de polaridad mucho más grandes que las del suma de la energía interna de un sistema
Sustancias puras (átomos) disolvente. termodinámico y el producto de su volumen y su
Enlace iónico--> metal con no metal -Enlaces peptidicos
-Enlaces glucosidicos presión:
Mezclas (solución, mezclas homo y heterogéneas) Propiedades del estado coloidal:
Enlace covalente--> no metal y no metal -Puentes de Hidrogeno
H=U+PV
a) Enlace covalente polar: enlaces entre -COACERVACION: La deshidratación
Molécula: parcial de un emulsoide con alcohol. Entropía negativa:
distintos elementos
-Es la particula más pequeña de una sustancia -GELIFICACION : se caracteriza por la Es la entroía que el sistema exporta para mantener
b) Enlace covalente no polar: enlaces entre
mismos elementos inversión de las fases del coloide, de sol su entroía baja.
-Mantiene las propiedades químicas y físicas a gel.
específicas de esa sustancia
Enlace metálico--> entre metales
-IMBIBICION : Los emulsoides
-Limite físico de la materia desecados, al ponerlos en agua, se
hidratan notablemente y aumentan de
volumen.
Elemento: Compuesto: Mezcla:
-ELECTROFORESIS: Las propiedades eléctricas de los coloides constituyen el
-No hay unión química
fundamento de técnicas de
-No pueden ser desdoblados -Sustancia formada por -Se pueden separar por métodos
laboratorio.
-Átomos iguales 2 o más elementos. físicos
-Tienen fórmula química -Homogéneas y Heterogéneas
-PRESION ONCOTICA O COLOIDOSMOTICA:
1. la presión oncótica proporcional a la
concentración de partículas de coloide.
2. más la atracción de agua por el carácter
AGUA ELECTROLITOS DISOLUCIONES pH hidrófilo del emulsoide.
3. más presión correspondiente al exceso de
18 g = masa molar de Sustancia o ion que Solución: mezcla Clasificación de las Sörensen: logaritmo a) Ácidosis respiratoria:
iones producido por el equilibrio de membrana.
H2O disuelto en agua homogenea constituida dispersiones: negativo de la
permite la conducción de un soluto y un concentración de iones -Retención de CO2
Clasificación química de los coloides:
Calor de evaporización= de la electricidad solvente Según el número de H+ en una solución
539 cal/g componentes: b)Alcalosis respiratoria
Bronsted: -Emulsoides/hidrofilos
Anión Componentes: 1.- Binarias
a)ácido---> DONA PROTONES -Suspensoides/hidrofobos
a)Soluto 2.- Compuestas -Perdida excesiva de CO2
Viscosidad= a 20°C es Catión
b)Solvente Clasificación física de los coloides
0.01 gr/cm Según el estado físico: b)base---> CAPTA PROTONES c) Ácidosis metabolica
Unidades:
mOsm/L o mEq/L Disolución: separación 9 combinaciones por los -Soles
Densidad= a 4°C y de un compuesto en estados físicos Escala pH: -Retención de ácidos o
1atm es 1g/cm^3 -Geles:
No° de Avogadro: sus partes (sólido, líquido y gaseoso) perdida de HCO3
6.022x10^23 (bicarbonato)
% de agua en cuerpo= 0 7 14
Componentes: Según la naturaleza de las
-RN= 70-90% Na+ = Principal catión d) Alcalosis metabolica
a)Disolvente particulas dispersas:
-Jovenes= extracelular ácido neutro alcalino
b)Soluto 1.- Atómicas
60% H y 55% M -Gananacia de HCO3 y
2.- Iónicas
-Adultos mayores= Álcali: molécula disminución de K
K+ = Principal catión Dispersión: 3.- Moleculares
55% en M y 45% en M formada por mezcla de
intracelular interposición mecánica 1 o más metales
de las particulas de una Según el tamaño:
alcalinos con un ion
Cl-= Principal anión solución en el seno de 1.- Verdaderas (10 A)
extracelular básico (OH-)
otra 2.- Coloidales (10-1000 A)
3.- Groseras (+1000 A) 1.- Ácido fuerte: disocia rápido, muchos H+
Osmolaridad: no° de Componentes: 2.- Ácido débil: disocia lento, pocos H+
soluto por unidad de a)Dispersante Propiedades coligativas: son 3.- Base fuerte: reacciona rápido y potentemente con H+
agua b)Disperso universales de las 4.- Base débil: reacciona lento
disoluciones
Solubilidad: max. Ley de acción de masas ----> por Guldberg y Waage
cantidad de soluto que a) Descenso relativo "La velocidad de una reacción es proporcional a la
se puede disolver en b) Descenso crioscópico concentración molecular de cada una de las
una cierta cantidad de c) Elevación ebulloscópica sustancias reaccionantes"
disolvente d) Presión osmótica
A+B=C+D
Saturación: el M=mol/L
disolvente no puede N=Eq/L----->mol/valencia Ecuación de Henderson-Hasselbalch:
disolver al soluto m=mol/Kg Usada para calcular el pH plasmático,
relación base/ácido (20/1)
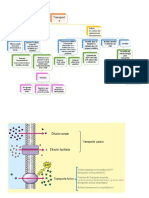
Tipos de membrana: Osmosis: difusión de -HCO3(bicarbonato) ---> 20
líquidos através de una -H2CO3(ácido carbónico) ---> 1
1.- Permeable: pasa membrana
todo menos las
disoluciones groseras Isotónica:280-310 mOsm/L pH = pKa + log (base/ácido)
Hipertónica: +310 mOsm/L
2.- Semipermeable: Hipotónica: -280 mOsm/L
pasa únicamente H2O, 6.1
por las acuaporinas Sistemas "Buffer" o "Amortiguadores":
1.- Plasmático
3.- Impermeable: NO 2.- Pulmonar
PASA NADA 3.- Renal
4.- Dialitica: pasan
solutos verdaderos y
agua
También podría gustarte
- Moldes de Silicona para ResinaDocumento11 páginasMoldes de Silicona para ResinabernyAún no hay calificaciones
- Ensayo Mitosis y MeiosisDocumento3 páginasEnsayo Mitosis y Meiosiswandresolalla100% (3)
- 06.fisiología CelularDocumento106 páginas06.fisiología Celulardieg028Aún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012De EverandAcceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012Aún no hay calificaciones
- Biorremediación de AguaDocumento19 páginasBiorremediación de AguaPhamelitha EdquènAún no hay calificaciones
- Cuadro Sinoptico de La Celula 5Documento1 páginaCuadro Sinoptico de La Celula 5Mariela RodriguezAún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- Es Hi7031 CLP 1 PDFDocumento7 páginasEs Hi7031 CLP 1 PDFLeidy Katherin Becerra UsedaAún no hay calificaciones
- RAEnriquez - Foro - Metabolismo Del Nitrógeno y Lípidos en Los VegetalesDocumento6 páginasRAEnriquez - Foro - Metabolismo Del Nitrógeno y Lípidos en Los VegetalesTotoñito Psicologuito100% (4)
- Biologia Celular Resumen Final PDFDocumento15 páginasBiologia Celular Resumen Final PDFAndy Lore100% (1)
- Celula Eucarita PDF 531596 Downloadable 4578722Documento4 páginasCelula Eucarita PDF 531596 Downloadable 4578722NataliaBragaMenendezAún no hay calificaciones
- Tema 7 PsicobiologíaDocumento12 páginasTema 7 PsicobiologíaJc SgAún no hay calificaciones
- MorfoDocumento50 páginasMorfoabdonsan05Aún no hay calificaciones
- Membrana y Transporte CelularDocumento26 páginasMembrana y Transporte CelularJosue Alejandro OlivaAún no hay calificaciones
- Apuntes de Bioquimic 172096 Downloadable 1142282Documento48 páginasApuntes de Bioquimic 172096 Downloadable 1142282cde.kakashiAún no hay calificaciones
- Wuolah Free Tema 0 1 y 2Documento23 páginasWuolah Free Tema 0 1 y 2Mohammed Mahi morshedAún no hay calificaciones
- Actividad 2.3 Estructura y Tipos Celulares - Vargas Mares - Alexia JudithDocumento1 páginaActividad 2.3 Estructura y Tipos Celulares - Vargas Mares - Alexia JudithAlexia MaresAún no hay calificaciones
- Temario Completo FisiologiaDocumento137 páginasTemario Completo FisiologiaXavi Pallares FernandezAún no hay calificaciones
- Resumen Ser Vivo - Áci. NucleicosDocumento3 páginasResumen Ser Vivo - Áci. NucleicosAnjali Massiel Gamarra PillacaAún no hay calificaciones
- Generalidades FisioGDocumento53 páginasGeneralidades FisioGNaty SamoranoAún no hay calificaciones
- Bioquimica IDocumento24 páginasBioquimica Ifernandagranados.200Aún no hay calificaciones
- MEMBRANADocumento12 páginasMEMBRANAMaria CaresAún no hay calificaciones
- Solemne 1 ResumenDocumento10 páginasSolemne 1 Resumenmikalcastro01Aún no hay calificaciones
- Resumen BiologiaDocumento26 páginasResumen BiologiaMargaritaAún no hay calificaciones
- Respaldo La CelulaDocumento1 páginaRespaldo La CelulaEve GutierrezAún no hay calificaciones
- Juego de Preguntas para Cs. NaturalesDocumento3 páginasJuego de Preguntas para Cs. NaturalesCarlos DarwinAún no hay calificaciones
- t7. HibridacionDocumento6 páginast7. HibridacionluisAún no hay calificaciones
- Relelacion. Fuente-Destino 2018Documento26 páginasRelelacion. Fuente-Destino 2018Javier AbadAún no hay calificaciones
- BTLB U4 Ea AngcDocumento5 páginasBTLB U4 Ea AngcAnastacio GonzalezAún no hay calificaciones
- BIOLOGÍA!!!Documento52 páginasBIOLOGÍA!!!Josefina RojasAún no hay calificaciones
- Parte 1.2Documento57 páginasParte 1.2AntonyAún no hay calificaciones
- Sangre 2022Documento39 páginasSangre 2022Milene LobatoAún no hay calificaciones
- Guía Histo 1par AmmaDocumento20 páginasGuía Histo 1par AmmaMarisol Medina AndresAún no hay calificaciones
- Fisiología 1er CuatrimestreDocumento86 páginasFisiología 1er Cuatrimestrejonatan Cañete RamalloAún no hay calificaciones
- BIOLOGÍADocumento7 páginasBIOLOGÍAvladikelrusoAún no hay calificaciones
- LA CÉLULA Apunte ResumenDocumento6 páginasLA CÉLULA Apunte ResumenthequeenofjealousyAún no hay calificaciones
- 00 Ser Humano Apuntes LenaDocumento44 páginas00 Ser Humano Apuntes LenaMaría Virginia Armas RodríguezAún no hay calificaciones
- Httpsaulavirtual Appoderado Clestudiantedescargar93Documento1 páginaHttpsaulavirtual Appoderado Clestudiantedescargar93Bernardita MarcosAún no hay calificaciones
- Célula Estructura Organelas Y Función: Biología y GenéticaDocumento31 páginasCélula Estructura Organelas Y Función: Biología y GenéticaYuleoYTAún no hay calificaciones
- BiologiaDocumento5 páginasBiologiaNIKIITO /7/Aún no hay calificaciones
- Tema 6 - Proteínas - 2023 - 2024Documento19 páginasTema 6 - Proteínas - 2023 - 2024Agata FernándezAún no hay calificaciones
- Resumen Transporte TransmembranaDocumento8 páginasResumen Transporte Transmembranacarmela dominguezAún no hay calificaciones
- 3°QuímicaBloque3Secuencia14Sesiones1 6Documento6 páginas3°QuímicaBloque3Secuencia14Sesiones1 6Julieta GutlAún no hay calificaciones
- Fisio Celula 1Documento57 páginasFisio Celula 1AntonyAún no hay calificaciones
- Bio Teoría - Semana 3Documento22 páginasBio Teoría - Semana 3Maria Luisa Velasquez VelasquezAún no hay calificaciones
- Guia #1 de NaturalesDocumento8 páginasGuia #1 de NaturalesKiali SanchezAún no hay calificaciones
- BACTERIASDocumento2 páginasBACTERIASDenissa CruzAún no hay calificaciones
- Biología - Semana 3 - TeoríaDocumento22 páginasBiología - Semana 3 - TeoríaBILER QUISPE VARGASAún no hay calificaciones
- Tarea Niveles de Organizaciã N y Cã©lulaDocumento4 páginasTarea Niveles de Organizaciã N y Cã©lulaTheLayl TVAún no hay calificaciones
- HistologiaDocumento1 páginaHistologiaannnemystAún no hay calificaciones
- Capítulo 3 - TeoríaDocumento22 páginasCapítulo 3 - TeoríaElvis GarcíaAún no hay calificaciones
- Wuolah Free Resumen Biologia ParcialDocumento40 páginasWuolah Free Resumen Biologia ParcialLucia OcampoAún no hay calificaciones
- Tejido Sanguíneo - 202292 - 11823Documento2 páginasTejido Sanguíneo - 202292 - 11823Nombre ApellidosAún no hay calificaciones
- Teoría - Semana 3Documento21 páginasTeoría - Semana 3Sofia PeraltaAún no hay calificaciones
- PRACTICA 2 - BiologíaDocumento4 páginasPRACTICA 2 - BiologíaKarla Diaz OrtegaAún no hay calificaciones
- Mapa Conceptual Reproduccion Asexual 4Documento1 páginaMapa Conceptual Reproduccion Asexual 4Ydania Calderon PAún no hay calificaciones
- Bioelemento y Biomoléculas: I.BioelementosDocumento7 páginasBioelemento y Biomoléculas: I.Bioelementospettit girlAún no hay calificaciones
- Clase+1 +biol272Documento37 páginasClase+1 +biol272Cristhofer GonzalezAún no hay calificaciones
- Aminoacidos¿!¡Documento30 páginasAminoacidos¿!¡VERONICA HERNANDEZAún no hay calificaciones
- ?bioquímica?Documento31 páginas?bioquímica?Francisca BelenAún no hay calificaciones
- BiologíaDocumento4 páginasBiologíaVale RuedaAún no hay calificaciones
- Tarjetitas Estudio Solemne 1Documento6 páginasTarjetitas Estudio Solemne 1Antonia CárdenasAún no hay calificaciones
- LeucemiasDocumento3 páginasLeucemiasAna Patricia Borja MartínezAún no hay calificaciones
- Resumen de Histología 1er Semestre (Autoguardado) - 1Documento34 páginasResumen de Histología 1er Semestre (Autoguardado) - 1Evelyn GarciaAún no hay calificaciones
- Hidrostatica e HidrodinamicaDocumento14 páginasHidrostatica e HidrodinamicaCarolina Gomez100% (1)
- Em en PorciculturaDocumento7 páginasEm en Porciculturabilos1992Aún no hay calificaciones
- Examen de Recuperacion Quimica Bloque IIIDocumento2 páginasExamen de Recuperacion Quimica Bloque IIIQfb Mario Lopez MezaAún no hay calificaciones
- Estandar Ventilacion - Alexander Loza Meza 2016-101003Documento8 páginasEstandar Ventilacion - Alexander Loza Meza 2016-101003Alexander Saúl Loza Meza100% (1)
- Guias Practicas de Lab Oratorio 2011Documento26 páginasGuias Practicas de Lab Oratorio 2011Lyre ReinaAún no hay calificaciones
- La ContaminaciónDocumento12 páginasLa ContaminaciónEduardo GarcíaAún no hay calificaciones
- NN Subtransmision PByC Linea Alta Tension 132 KV El Dorado II y Obras Complementarias Pozo Azul Irigoyen LPNº08 2011 Parte IDocumento135 páginasNN Subtransmision PByC Linea Alta Tension 132 KV El Dorado II y Obras Complementarias Pozo Azul Irigoyen LPNº08 2011 Parte IJuan Diego OchoaAún no hay calificaciones
- Ficha 17. - 800 CINTA GOLDENDDocumento2 páginasFicha 17. - 800 CINTA GOLDENDFlavio Medina MAún no hay calificaciones
- FOTOSINTESIS RedoxDocumento9 páginasFOTOSINTESIS RedoxVale ConstanzaAún no hay calificaciones
- Logaritmos Varios y ResueltosDocumento21 páginasLogaritmos Varios y ResueltosReynaldo MartinezAún no hay calificaciones
- Proceso IsasmeltDocumento8 páginasProceso IsasmeltNicolle ZarateAún no hay calificaciones
- Química en La Edad AntiguaDocumento3 páginasQuímica en La Edad AntiguaLore GudiñoAún no hay calificaciones
- GRUPO 3 Farmacoquimicaa-1-16-2-16Documento15 páginasGRUPO 3 Farmacoquimicaa-1-16-2-16Sonia C. OjedaAún no hay calificaciones
- 08 ExplosivosDocumento19 páginas08 ExplosivosDanny DanielAún no hay calificaciones
- Diapositivas Energía Renovable y No RenovableDocumento10 páginasDiapositivas Energía Renovable y No RenovableJubert Angelo Ramos ParedesAún no hay calificaciones
- S13. GravimetriaDocumento28 páginasS13. Gravimetriaeverth sebastian lopez laureanoAún no hay calificaciones
- Despigmental 4%Documento5 páginasDespigmental 4%WenyerAún no hay calificaciones
- Provericyt IIIDocumento3 páginasProvericyt IIIhenricksMcClaudAún no hay calificaciones
- Agitacion 22222Documento8 páginasAgitacion 22222gloriaAún no hay calificaciones
- Lab02 - A - Tarea Previa - 2020 - 01Documento5 páginasLab02 - A - Tarea Previa - 2020 - 01Sebastian Ruiz Torres-CalderonAún no hay calificaciones
- Microbiologia AlimentariaDocumento31 páginasMicrobiologia AlimentariaPatribe Pafeen PafeenAún no hay calificaciones
- Memoria de Insalaciones ElectricasDocumento6 páginasMemoria de Insalaciones ElectricasAntonio Quincho ChilquilloAún no hay calificaciones
- Centrifuga MIADocumento15 páginasCentrifuga MIAOswaldo José RamirezAún no hay calificaciones
- Sindrome SetotoninergicoDocumento16 páginasSindrome SetotoninergicoHumberto Persiles Reyes FloresAún no hay calificaciones
- Línea de Tiempo Completa PDFDocumento19 páginasLínea de Tiempo Completa PDFReyes GardeniaAún no hay calificaciones