Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tampón Bicarbonato - CO2
Cargado por
Bynext HD0 calificaciones0% encontró este documento útil (0 votos)
46 vistas1 páginaEl tampón bicarbonato regula el pH en la sangre mediante la reacción reversible entre el ácido carbónico y el ión bicarbonato, que pueden ceder o aceptar protones para mantener el pH neutro. Este tampón está formado por el ácido carbónico, producido a partir de agua y dióxido de carbono por la anhidrasa carbónica, y su base conjugada, el ión bicarbonato, que puede unirse a un protón o disociarse en protón e ión bicarbonato.
Descripción original:
Título original
Tampón Bicarbonato _ CO2
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl tampón bicarbonato regula el pH en la sangre mediante la reacción reversible entre el ácido carbónico y el ión bicarbonato, que pueden ceder o aceptar protones para mantener el pH neutro. Este tampón está formado por el ácido carbónico, producido a partir de agua y dióxido de carbono por la anhidrasa carbónica, y su base conjugada, el ión bicarbonato, que puede unirse a un protón o disociarse en protón e ión bicarbonato.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
46 vistas1 páginaTampón Bicarbonato - CO2
Cargado por
Bynext HDEl tampón bicarbonato regula el pH en la sangre mediante la reacción reversible entre el ácido carbónico y el ión bicarbonato, que pueden ceder o aceptar protones para mantener el pH neutro. Este tampón está formado por el ácido carbónico, producido a partir de agua y dióxido de carbono por la anhidrasa carbónica, y su base conjugada, el ión bicarbonato, que puede unirse a un protón o disociarse en protón e ión bicarbonato.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
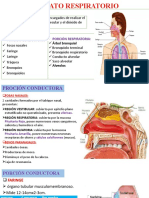
Tampón Bicarbonato / CO2
Un tampón o disolución reguladora es aquella que se encarga de estabilizar el pH
ante la variación de acidez o basicidad del medio y está formada por un ácido débil y
su base conjugada.
El tampón bicarbonato regula el pH en la sangre, lo que es importante ya que este
afecta a la actividad de enzimas y reacciones del metabolismo. Dependiendo del valor
del pH ceden o aceptan protones para mantenerlo neutro.
Esta disolución reguladora está constituida por el ácido carbónico (H CO ) y su base
conjugada, el ión bicarbonato (HCO ). Dicho ión se puede unir a un protón para
formar ácido carbónico y elevar el pH en la sangre por absorción de protones.
El H CO se forma a partir de agua (H O) y dióxido de carbono (CO ) por una
reacción enzimática en la que interviene la anhidrasa carbónica. Este ácido puede
disociarse en H e ion bicarbonato liberando protones y disminuyendo el pH
sanguíneo.
Debido a estas reacciones pueden producirse excesos de agua y dióxido de carbono,
donde el exceso de la primera se absorbe por el sistema, y el exceso de CO se elimina
de forma controlada por la respiración. En cambio, excesos de ión bicarbonato o de
protones no son tan sencillos de eliminar ya que se trata de mecanismos más lentos, y
ahí, radica la gran importancia biológica de los sistemas tampón y en concreto del
tampón bicarbonato.
Para entender más fácilmente las reacciones que tienen lugar y el funcionamiento del
tampón se puede seguir el siguiente esquema:
Adición básica
Acepta protones para pH
H HCO Adición ácida
3
CO
+
H H
2O
++
2CO3
2
Libera protones para pH
También podría gustarte
- Acidos VolátilesDocumento5 páginasAcidos VolátilesGabriel Vasquez100% (1)
- Práctica N°7: Separación de Proteínas en La Sangre PDFDocumento8 páginasPráctica N°7: Separación de Proteínas en La Sangre PDFSarahAún no hay calificaciones
- InformeS7 - Alcoholes USMPDocumento9 páginasInformeS7 - Alcoholes USMPOscar Orlando Fernandez CorreaAún no hay calificaciones
- Herencia Grupos Sanguineos y RHDocumento4 páginasHerencia Grupos Sanguineos y RHMonica Rodriguez GonzalezAún no hay calificaciones
- Principios Generales Tratamiento AntimicrobianoDocumento10 páginasPrincipios Generales Tratamiento AntimicrobianoDr. MSc. Byron Núñez FreileAún no hay calificaciones
- Generalidades Del Sodio y El PotasioDocumento19 páginasGeneralidades Del Sodio y El PotasioVanessa Cortes80% (5)
- Sem11 01 - Telencefalo Configuracion ExternaDocumento5 páginasSem11 01 - Telencefalo Configuracion Externaangeldeluz_morena1390Aún no hay calificaciones
- Anomalias PDFDocumento67 páginasAnomalias PDFHana SongAún no hay calificaciones
- 6histologia Del Tejido NerviosoDocumento64 páginas6histologia Del Tejido NerviosoMax Laban MartinezAún no hay calificaciones
- Equilibrio Acido Base en El Cuerpo HumanoDocumento6 páginasEquilibrio Acido Base en El Cuerpo HumanoRODOLFO MONREAL SANCHEZAún no hay calificaciones
- Seminario Hipertensión EndocraneanaDocumento28 páginasSeminario Hipertensión EndocraneanaClaudia CornejoAún no hay calificaciones
- Seminario 5 CompletoDocumento11 páginasSeminario 5 CompletoLeslie Gonzales ChipanaAún no hay calificaciones
- Riñon y UreterDocumento11 páginasRiñon y UreterJuanZambranoAún no hay calificaciones
- Parciales Cat 1 r1 2do Cuatri Catedra 1Documento29 páginasParciales Cat 1 r1 2do Cuatri Catedra 1aleffrichAún no hay calificaciones
- Intoxicación Por Alcohol EtílicoooooooooooooooooooooooooooooooooooDocumento13 páginasIntoxicación Por Alcohol EtílicoooooooooooooooooooooooooooooooooooAbigail NinaAún no hay calificaciones
- 4 Causas Fisiopatologicas Del Fallo Respiratorio AgudoDocumento9 páginas4 Causas Fisiopatologicas Del Fallo Respiratorio Agudoapi-3697492Aún no hay calificaciones
- Enfermedad Pulmonar RestrictivaDocumento26 páginasEnfermedad Pulmonar RestrictivaPerla Larissa BermúdezAún no hay calificaciones
- Monoxido de Carbono - ToxicologiaDocumento3 páginasMonoxido de Carbono - ToxicologiaNicolas Gabriel Gutierrez MedinaAún no hay calificaciones
- Neumoconiosis Actualizado 2018Documento7 páginasNeumoconiosis Actualizado 2018jancobinoAún no hay calificaciones
- Aparato Respiratorio 2019Documento12 páginasAparato Respiratorio 2019Ivan Rodriguez GarciaAún no hay calificaciones
- Insuficiencia AórticaDocumento34 páginasInsuficiencia AórticaJahaziel CordonAún no hay calificaciones
- CLASE 11. Acido - BaseDocumento73 páginasCLASE 11. Acido - BaseAnthony Klein Núñez AlarcónAún no hay calificaciones
- La Fisiopatología Como Base Fundamental Del Diagnóstico ClínicoDocumento3 páginasLa Fisiopatología Como Base Fundamental Del Diagnóstico ClínicoEnmanuel Guillen MartinezAún no hay calificaciones
- Glandulas Tiroides y ParatiroidesDocumento17 páginasGlandulas Tiroides y ParatiroidesClaudia MoncadaAún no hay calificaciones
- CAPITULO 30 - Regulacion Del Equilibrio Acido BasicoDocumento8 páginasCAPITULO 30 - Regulacion Del Equilibrio Acido BasicoMirianCamposAún no hay calificaciones
- Clase II - Agua PH y Amortiguadores FisiologicosDocumento32 páginasClase II - Agua PH y Amortiguadores FisiologicosgabrielallecllishAún no hay calificaciones
- J ctvtxw3sz 21Documento23 páginasJ ctvtxw3sz 21Oli QuiñonesAún no hay calificaciones
- Disoluciones AmortiguadorasDocumento31 páginasDisoluciones Amortiguadoraspaola sofia cordova huamani0% (1)
- Guia Hta 2022Documento21 páginasGuia Hta 2022Luis Fernando Bengoa VelardeAún no hay calificaciones
- Equilibrio Ácido BaseDocumento34 páginasEquilibrio Ácido BaseAngie ManningsAún no hay calificaciones
- Medicina en Las Civilizaciones AntiguaDocumento65 páginasMedicina en Las Civilizaciones AntiguaKatty Cat RodriAún no hay calificaciones
- Caso Clinco 1 GastoDocumento6 páginasCaso Clinco 1 Gastoscarleth jamileth vasquez alvarezAún no hay calificaciones
- Bioquimica TamponesDocumento13 páginasBioquimica TamponesrmdlcAún no hay calificaciones
- Leucopenias y Proliferaciones Reactivas de Los Leucocitos y Ganglios LinfaticosDocumento32 páginasLeucopenias y Proliferaciones Reactivas de Los Leucocitos y Ganglios LinfaticosJackelina OrtegaAún no hay calificaciones
- Tomografia Por Emision de PositronesDocumento37 páginasTomografia Por Emision de PositronesQlaudieth100% (1)
- Principales Síndromes Del Sistema DigestivoDocumento8 páginasPrincipales Síndromes Del Sistema DigestivoAnny Andreina Rengel RodriguezAún no hay calificaciones
- Anatomía - Práctica 3 PDFDocumento25 páginasAnatomía - Práctica 3 PDFOlortegui YudiAún no hay calificaciones
- Monografian Saturacion 1Documento11 páginasMonografian Saturacion 1Dani EsblAún no hay calificaciones
- Cuestionario 1 Micro 1Documento5 páginasCuestionario 1 Micro 1asdasdAún no hay calificaciones
- Propiedades Químicas Del KriptónDocumento2 páginasPropiedades Químicas Del KriptónJosafath Ventura33% (3)
- GUIA DE ESTUDIO PARA EL SEGUNDO PARCIAL DE ENFERMERIA. HOLAdocxDocumento17 páginasGUIA DE ESTUDIO PARA EL SEGUNDO PARCIAL DE ENFERMERIA. HOLAdocxchalchiAún no hay calificaciones
- Biofisica 2019 Clase 1 Silabo 2019 IDocumento11 páginasBiofisica 2019 Clase 1 Silabo 2019 IPercy Jando Muñoz Ramos100% (1)
- Solución Fisiopatología Altamar - Tema 11. Alteraciones de La Nutricion y El Metabolismo - EJERCICIOSDocumento4 páginasSolución Fisiopatología Altamar - Tema 11. Alteraciones de La Nutricion y El Metabolismo - EJERCICIOSmaria100% (1)
- Tabla Comparativa InmunologiaDocumento1 páginaTabla Comparativa InmunologiaCarlosivanramirezAún no hay calificaciones
- Bioseguridad en El Laboratorio de MicrobiologíaDocumento23 páginasBioseguridad en El Laboratorio de Microbiologíaaaraujoj8861Aún no hay calificaciones
- Receptores Del SNC FinalDocumento26 páginasReceptores Del SNC FinalMarilu PacaAún no hay calificaciones
- Fosforilación Oxidativa - ResumenDocumento10 páginasFosforilación Oxidativa - ResumenKevinDelaCruzAún no hay calificaciones
- Eponimos de MedicinaDocumento8 páginasEponimos de MedicinaAlan Alistair ATAún no hay calificaciones
- RegulaciÓn Del Equilibrio Ácido-Base de La OrinaDocumento24 páginasRegulaciÓn Del Equilibrio Ácido-Base de La OrinaYeyepalitos100% (1)
- Presentación Tomografía Por Emisión de Positrones PETDocumento10 páginasPresentación Tomografía Por Emisión de Positrones PETAlexandra VillarrealAún no hay calificaciones
- Reacciones Quimicas Universidad SurcolombianaDocumento11 páginasReacciones Quimicas Universidad Surcolombianacarl salanoAún no hay calificaciones
- Gasometria ArterialDocumento12 páginasGasometria ArterialAlexander MarinAún no hay calificaciones
- Biologia Guia UrpDocumento27 páginasBiologia Guia UrpLuisPerezAún no hay calificaciones
- Guía de InmunologíaDocumento37 páginasGuía de InmunologíaSamantha G. H.Aún no hay calificaciones
- Funciones de Las ProstaglandinasDocumento8 páginasFunciones de Las ProstaglandinasEliecer MaceaAún no hay calificaciones
- Banco de PreguntasDocumento10 páginasBanco de PreguntasOsorio Delgadillo PaulAún no hay calificaciones
- Actualizacic3b3n en Manejo y Tratamiento de TBC 2016 CamineroDocumento9 páginasActualizacic3b3n en Manejo y Tratamiento de TBC 2016 Caminerobbana1Aún no hay calificaciones
- Presencia de Lactato Deshidrogenasa. Citocromo Oxidasa y Succínico DeshidrogenasaDocumento26 páginasPresencia de Lactato Deshidrogenasa. Citocromo Oxidasa y Succínico DeshidrogenasaJorge Luis Tolentino Chavez100% (1)
- Regulación Acidobásica Del PH en El OrganismoDocumento58 páginasRegulación Acidobásica Del PH en El OrganismoOmar Alexei Monge de YtaAún no hay calificaciones
- Amortiguadores FisiologicosDocumento5 páginasAmortiguadores FisiologicosGisselleAún no hay calificaciones
- T9 Problemas ResueltosDocumento9 páginasT9 Problemas ResueltosBynext HDAún no hay calificaciones
- T11 Aminas ResumenDocumento3 páginasT11 Aminas ResumenBynext HDAún no hay calificaciones
- Dienos: Clasificación y Estabilidad RelativaDocumento5 páginasDienos: Clasificación y Estabilidad RelativaBynext HDAún no hay calificaciones
- Aminoácidos ProtéicosDocumento7 páginasAminoácidos ProtéicosBynext HDAún no hay calificaciones
- AromáticosDocumento6 páginasAromáticosBynext HDAún no hay calificaciones
- Organulos CelularesDocumento5 páginasOrganulos CelularesBynext HDAún no hay calificaciones
- Péptidos NaturalesDocumento3 páginasPéptidos NaturalesBynext HDAún no hay calificaciones