Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Experimento 3
Cargado por
Alexander MoralesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Experimento 3
Cargado por
Alexander MoralesCopyright:
Formatos disponibles
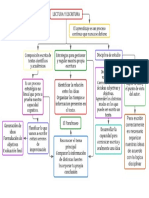
Resumen
En la presente practica de laboratorio se estudió las celdas electrolíticas mediante el uso
de soluciones electroquímicas y celdas voltaicas creadas a partir de elementos y
reactivos que actuaron como generadores de la fuerza electromotriz de la celda donde
cada electrodo con su solución forma una semi-celda que puede estar separada o unida
mediante un puente salino, mismo que permite la creación de electricidad en la celda
gracias a una reacción de óxido reducción o reacción Redox no espontánea.
Discusión de resultados
Experimento 1: Durante el desarrollo del experimento uno nos dimos cuenta que
algunas sustancias no reaccionaban debido al nivel de reactividad de los reactivos como
por el ejemplo el nitrato de plomo más cobre el cual no reacciono debido a que el plomo
es mas reactivo que el cobre, siguiendo este principio algunas sustancias no
reaccionaron pero eso nos permitió confirmar la reactividad de cada elemento.
Experimento 2: Al reaccionar ácido sulfúrico más zinc y cobre se estimaba obtener un
valor aproximado de 1,1 ya que el potencial de electrodo para el zinc era de 0.76 + 0.34
del cobre sin embargo el valor obtenido fue de 0,95 voltios, quizás hubo algún fallo al
usar ácido sulfúrico caliente por lo cual se recomienda usarlo en condiciones normales.
Experimento 3: Se formo una pila galvánica a partir de los electrodos el cobre y el zinc
unidos a través de un puente de nitrato de potasio, en esta reacción el cobre se oxido y el
zinc se redujo dándonos un potencial de 1.08 voltios cuyo valor es muy aproximado al
esperado de 1.1 voltios.
Cálculos.
Experimento 1
Nitrato de Cobre Cu(NO3)2 + Zn Cu + Zn(NO3)2
+ Zinc Cu2+ 2 e- → Cu0 (reducción)
Zn0 - 2 e- → Zn2 (oxidación)
Nitrato de Cobre Cu(NO3)2 + Pb Cu + Pb(NO3)2
+ Plomo Cu2 + 2 e- → Cu0 (reducción)
Pb0 - 2 e- → Pb2 (oxidación)
Nitrato de Plomo Pb(NO3)2 + Zn Pb + Zn(NO3)2
+ Zinc Pb2 + 2 e- → Pb0 (reducción)
Zn0 - 2 e- → Zn2 (oxidación)
Nitrato de Plomo Pb(NO3)2 + Cu El Pb es más reactivo que el cobre por lo
+ Cobre tanto no se puede dar una reacción.
Sulfato de Zinc + ZnSO₄ + Cu El Zn es más reactivo que el cobre por lo
cobre tanto no se puede dar una reacción.
Sulfato de Zinc + ZnSO₄ + Pb El Zn es más reactivo que el plomo por lo
Plomo tanto no se puede dar una reacción.
Nitrato de Plata + AgNO3 + Zn ZnNO3 + Ag
Zinc Zn0 - 2 e- → Zn2 (oxidación)
Ag1 + e- → Ag0 (reducción)
NV + e- → NIV (reducción)
Nitrato de Plata+ 2AgNO3 + Pb Pb(NO3)2 + 2 Ag
Plomo Pb0 - 2 e- → Pb2 (oxidación)
2 Ag1 + 2 e- → 2 Ag0 (reducción)
Experimento 2
Zn = Zn+2-2e Cu+2 +2e = Cu
E cátodo= 0.76 v E ánodo = 0.34
E cel = 0.76 v + 0.34 v = 1.1 Volt
Experimento 3
Zn = Zn+2-2e Cu+2 +2e = Cu
E cátodo= 0.76 v E ánodo = 0.34
E cel = 0.76 v + 0.34 v = 1.1 Volt
Conclusiones
Tal y como hemos podido comprobar las celdas electrolíticas se provocan la ruptura de
un compuesto químico en sus elementos constituyentes a través de un proceso de oxido-
reducción.
Luego de analizar los datos obtenidos podemos concluir que las reacciones dentro de las
celdas electrolíticas son reacciones no espontaneas ya que la variación de energía de
Gibbs correspondiente es positiva.
Referencias
Israel. (2021, July 21). ¿Qué es una celda electrolítica? YuBrain.
https://www.yubrain.com/ciencia/quimica/definicion-de-celda-electrolitica/
Spiegato. (2021, July 13). ¿Qué es un proceso electroquímico? Spiegato.
https://spiegato.com/es/que-es-un-proceso-electroquimico
También podría gustarte
- Electroquimica ClassDocumento40 páginasElectroquimica Classameli_cristelAún no hay calificaciones
- LABORATORIO Celdas Galvanicas y ElectriliticasDocumento6 páginasLABORATORIO Celdas Galvanicas y ElectriliticasFernandaAún no hay calificaciones
- Reacciones de Oxido ReduccionDocumento19 páginasReacciones de Oxido ReduccionJavier DroguettAún no hay calificaciones
- Practica de Quimica 5Documento4 páginasPractica de Quimica 5Francisco Perez ToribiosAún no hay calificaciones
- Potencial EstandarDocumento3 páginasPotencial EstandarGabriela GonzalezAún no hay calificaciones
- MerrillCrowe 2016Documento57 páginasMerrillCrowe 2016Core Cordova BaezAún no hay calificaciones
- A Construccion Del Electrodo de ReferenciaDocumento24 páginasA Construccion Del Electrodo de ReferenciaJUANCARLOS100% (1)
- 0 Presentación Reacciones RédoxDocumento17 páginas0 Presentación Reacciones RédoxPablo Vélez JumboAún no hay calificaciones
- Practica 1Documento5 páginasPractica 1Emiliano LozanoAún no hay calificaciones
- Electroquímica rápidaDocumento43 páginasElectroquímica rápidaGabriel Inostroza MedinaAún no hay calificaciones
- Practica1 Electroquímica QuímicaDocumento9 páginasPractica1 Electroquímica QuímicaYuqi LinAún no hay calificaciones
- Reacciones redox en tubos de ensayoDocumento10 páginasReacciones redox en tubos de ensayoJohan FelipeAún no hay calificaciones
- ELECTROQUIMICADocumento49 páginasELECTROQUIMICAfelipeoviedo43610812Aún no hay calificaciones
- S13 - Electroqu Mica 1 - CTDocumento15 páginasS13 - Electroqu Mica 1 - CTMoises Tordoya100% (1)
- 12 - Electroquimica 1Documento16 páginas12 - Electroquimica 1john cardenasAún no hay calificaciones
- Informe Oxido ReduccionDocumento8 páginasInforme Oxido ReduccionYeison Caicedo100% (1)
- Práctica de Escala ElectroquímicaDocumento5 páginasPráctica de Escala ElectroquímicaLuis Alfonso del Río CovarrubiasAún no hay calificaciones
- Redox 2021Documento17 páginasRedox 2021Debora GonzalezAún no hay calificaciones
- REEDOXXXDocumento14 páginasREEDOXXXMelchorita stephanie Nuñez CordovaAún no hay calificaciones
- Biblio - s18 - Quimica, R. Chang 10°ed.-Pages-168-171Documento4 páginasBiblio - s18 - Quimica, R. Chang 10°ed.-Pages-168-171William VasquezAún no hay calificaciones
- Reacciones redox virtuales: cambios de color y formación de precipitadosDocumento3 páginasReacciones redox virtuales: cambios de color y formación de precipitadosFabio VasquezAún no hay calificaciones
- AnaliticaDocumento68 páginasAnaliticaHenry Giampiere Reyna RamosAún no hay calificaciones
- Práctica 3Documento3 páginasPráctica 3Ángel Sanz AntoñanoAún no hay calificaciones
- Informe de Quimica 5Documento4 páginasInforme de Quimica 5Diego Ricardo CarriazoAún no hay calificaciones
- 0 - Presentación - Reacciones REDOXDocumento24 páginas0 - Presentación - Reacciones REDOXAaron raul gonzalezAún no hay calificaciones
- Laboratorio de Quimica. Cuaderno de practicas 2023Documento20 páginasLaboratorio de Quimica. Cuaderno de practicas 2023pinhoscpAún no hay calificaciones
- QU�MICA-901-902-903Documento3 páginasQU�MICA-901-902-903JOHN JAIRO TAMAYOAún no hay calificaciones
- Práctica 6Documento6 páginasPráctica 6Salomé JácomeAún no hay calificaciones
- ElectroquímicaDocumento44 páginasElectroquímicaJOHAN PERCY CHULLUNCUY YUPANQUIAún no hay calificaciones
- Ejercicios Resueltos de ElectroquimicaDocumento3 páginasEjercicios Resueltos de ElectroquimicaJose Demons Peña Carvajal100% (2)
- Guía 2 Reacciones de Óxidación y ReducciónDocumento2 páginasGuía 2 Reacciones de Óxidación y ReducciónLorena Isabel Arancibia CortesAún no hay calificaciones
- Clase Teórico 01.10.20Documento22 páginasClase Teórico 01.10.20Eze AusterlitzAún no hay calificaciones
- ElectroquimicaDocumento31 páginasElectroquimicaCar100% (1)
- Celdas electrolíticas y galvánicas: diferencias y aplicacionesDocumento119 páginasCeldas electrolíticas y galvánicas: diferencias y aplicacionesLimbert Pari CoelaAún no hay calificaciones
- Preparación para El Laboratorio 7Documento5 páginasPreparación para El Laboratorio 7Anonymous aeXyuqT2cq0% (1)
- Ejercicios RESUELTOS Del Tema 5 (Reacciones de Transferencia de Electrones)Documento7 páginasEjercicios RESUELTOS Del Tema 5 (Reacciones de Transferencia de Electrones)Rafa VilchezAún no hay calificaciones
- CAP V RXQ REDOX UNALMDocumento25 páginasCAP V RXQ REDOX UNALMCarol Luz Chavez ChambillaAún no hay calificaciones
- PTT ElectroquimicaDocumento35 páginasPTT ElectroquimicaFrancisco Roberto Villanueva CamposAún no hay calificaciones
- Recubr-Clase 02 (2014) PDFDocumento18 páginasRecubr-Clase 02 (2014) PDFSandro Fabrizzio Sanchez SanchezAún no hay calificaciones
- ElectrolisisDocumento21 páginasElectrolisisssdAún no hay calificaciones
- Electroquimica y ProblemasDocumento26 páginasElectroquimica y ProblemasAlberth0% (1)
- P1 Celdas Electroquímicas Aguirre, Guevara, TapiaDocumento10 páginasP1 Celdas Electroquímicas Aguirre, Guevara, TapiaDomenica GuevaraAún no hay calificaciones
- Diapositivas RedoxDocumento37 páginasDiapositivas RedoxLUIS CARLOS ROMERO ZAPATAAún no hay calificaciones
- ElectroquimicaDocumento36 páginasElectroquimicajuanrubio100% (12)
- Potenciales RedoxDocumento66 páginasPotenciales Redoxxlko0% (1)
- Clase 1 - Aspectos Fundamentales - Celdas Electroquimicas - Quimica Analitica IV PDFDocumento86 páginasClase 1 - Aspectos Fundamentales - Celdas Electroquimicas - Quimica Analitica IV PDFAngiie DilAún no hay calificaciones
- Unidad IIDocumento7 páginasUnidad IICarl AnidemAún no hay calificaciones
- Quimica Analiticaredox (2023.01.10)Documento38 páginasQuimica Analiticaredox (2023.01.10)Juan NogueraAún no hay calificaciones
- Electroquimica - Química GeneralDocumento39 páginasElectroquimica - Química Generalsandra stefanny rosales coilaAún no hay calificaciones
- 2q082las-Pilas Change MetaDocumento6 páginas2q082las-Pilas Change MetaAntonio José González ParejaAún no hay calificaciones
- Parte B QuimicaDocumento3 páginasParte B QuimicaJorge Ramses Soberanis SolisAún no hay calificaciones
- Tema 4 Reacciones de Transferencia de ElectronesDocumento64 páginasTema 4 Reacciones de Transferencia de Electroneslorena RojasAún no hay calificaciones
- Electroquímica del poder oxidante de los halógenosDocumento5 páginasElectroquímica del poder oxidante de los halógenosiWant PS PludAún no hay calificaciones
- Electroquimica Ejercicios 19Documento6 páginasElectroquimica Ejercicios 19Miguel Angel Calzada BialovoAún no hay calificaciones
- Reacciones de transferencia de electrones (RTEDocumento20 páginasReacciones de transferencia de electrones (RTEMARIA CRISTINA MARTINEZ GONZALEZAún no hay calificaciones
- TEMA 10 Electroquimica-1 2Documento38 páginasTEMA 10 Electroquimica-1 2frank valeriano ticonaAún no hay calificaciones
- Redox 2021Documento26 páginasRedox 2021Maria Celina MoyanoAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Materiales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoDe EverandMateriales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoCalificación: 5 de 5 estrellas5/5 (3)
- Ejemplos de Textos DescriptivosDocumento4 páginasEjemplos de Textos DescriptivosAlexander MoralesAún no hay calificaciones
- Integral Por PartesDocumento1 páginaIntegral Por PartesAlexander MoralesAún no hay calificaciones
- Ondas ElectromagnéticasDocumento46 páginasOndas ElectromagnéticasAlexander MoralesAún no hay calificaciones
- Mapa Mental m1Documento1 páginaMapa Mental m1Alexander MoralesAún no hay calificaciones
- Clase 1-Oir Leer y Escribir en La UniversidadDocumento29 páginasClase 1-Oir Leer y Escribir en La UniversidadAlexander MoralesAún no hay calificaciones
- Graficas Lab Fisica 3Documento8 páginasGraficas Lab Fisica 3Alexander MoralesAún no hay calificaciones
- ÓPTICADocumento34 páginasÓPTICAAlexander MoralesAún no hay calificaciones
- 319-Texto Del Artículo-877-1-10-20201110Documento4 páginas319-Texto Del Artículo-877-1-10-20201110Alexander MoralesAún no hay calificaciones
- Casos Clinicos TraumaDocumento3 páginasCasos Clinicos TraumaAlexander MoralesAún no hay calificaciones
- Propuesta Modelo de Gestión - Servicio de Atención de Salud Móvil (v2015!02!13)Documento124 páginasPropuesta Modelo de Gestión - Servicio de Atención de Salud Móvil (v2015!02!13)Oscar MIguel Chango SiguenzaAún no hay calificaciones
- Instructivo PUCE 2013 ABRILDocumento20 páginasInstructivo PUCE 2013 ABRILLiliana PacchaAún no hay calificaciones
- Norma Técnica Subsistema de Referencia y ContrareferenciaDocumento48 páginasNorma Técnica Subsistema de Referencia y ContrareferenciaDavid Campoverde100% (1)
- Vegas Modelos EstructuralesDocumento620 páginasVegas Modelos EstructuralesAlexander MoralesAún no hay calificaciones
- Madrid 2009 Septiembre. Con Criterios de CorrecciónDocumento4 páginasMadrid 2009 Septiembre. Con Criterios de CorrecciónAlexander MoralesAún no hay calificaciones
- Proyecto Unidad 2Documento17 páginasProyecto Unidad 2Alexander MoralesAún no hay calificaciones
- Ficha Informativa DirectivosDocumento1 páginaFicha Informativa DirectivosAlexander MoralesAún no hay calificaciones
- Eus MateDocumento16 páginasEus MateAlexander MoralesAún no hay calificaciones
- Revista Sin ResumenDocumento22 páginasRevista Sin ResumenAlexander MoralesAún no hay calificaciones
- Proyecto MatematicasDocumento3 páginasProyecto MatematicasAlexander MoralesAún no hay calificaciones
- Puce Eva CorrectoDocumento28 páginasPuce Eva CorrectoAlexander MoralesAún no hay calificaciones
- Rubrica de La Evaluación Grupo 8Documento7 páginasRubrica de La Evaluación Grupo 8Alexander MoralesAún no hay calificaciones
- Revista Sin ResumenDocumento22 páginasRevista Sin ResumenAlexander MoralesAún no hay calificaciones
- Rubrica de La Evaluación Grupo 8Documento7 páginasRubrica de La Evaluación Grupo 8Alexander MoralesAún no hay calificaciones
- Josue Estudio de CasoDocumento18 páginasJosue Estudio de CasoAlexander MoralesAún no hay calificaciones
- Proyecto MatematicasDocumento3 páginasProyecto MatematicasAlexander MoralesAún no hay calificaciones
- Correcciones Del Trabajo de Educacion FisicaDocumento15 páginasCorrecciones Del Trabajo de Educacion FisicaAlexander MoralesAún no hay calificaciones
- Proyecto Unidad 2Documento17 páginasProyecto Unidad 2Alexander MoralesAún no hay calificaciones
- Proyecto de Educacion Fisica Ya CorregidoDocumento4 páginasProyecto de Educacion Fisica Ya CorregidoAlexander MoralesAún no hay calificaciones
- Actividad 1 Proyecto de Educacion FisicaDocumento3 páginasActividad 1 Proyecto de Educacion FisicaAlexander MoralesAún no hay calificaciones
- S300 Es PDFDocumento4 páginasS300 Es PDFFlavio Nicolás RíosAún no hay calificaciones
- Examen Vega Flores YanellaoDocumento4 páginasExamen Vega Flores YanellaoYanella Vega FloresAún no hay calificaciones
- Ecuación de RichardsDocumento2 páginasEcuación de RichardsPedro Sánchez León100% (1)
- Bme U1 Ea MarzDocumento13 páginasBme U1 Ea MarzmarisolAún no hay calificaciones
- TREMCO Retail Supermercados Sector-MmrDocumento18 páginasTREMCO Retail Supermercados Sector-MmrGraceAún no hay calificaciones
- LABORATORIO 2. MicrobiologíaDocumento13 páginasLABORATORIO 2. MicrobiologíaLAURA SOFIA AVILA CANTORAún no hay calificaciones
- Máquinas Síncronas: Aplicaciones y Características en 39Documento10 páginasMáquinas Síncronas: Aplicaciones y Características en 39Jocelyn Cervantes GascaAún no hay calificaciones
- Manual de Operacion Taladro-Destornillador Portatil PDFDocumento16 páginasManual de Operacion Taladro-Destornillador Portatil PDFElkin MorenoAún no hay calificaciones
- Indicadores SostenibilidadDocumento7 páginasIndicadores Sostenibilidadnelson chaves100% (1)
- Estudio de Mercado NaOHDocumento4 páginasEstudio de Mercado NaOHMatias A100% (1)
- Explotación Del Yacimiento de Gas de AguaytiaDocumento60 páginasExplotación Del Yacimiento de Gas de Aguaytiayaku1618100% (1)
- Sintesis Extraccion y CCFDocumento6 páginasSintesis Extraccion y CCFJhonda Sequeda DominguezAún no hay calificaciones
- Pasta estuco hormigón reparacionesDocumento1 páginaPasta estuco hormigón reparacionesCarito Alvarez LabbéAún no hay calificaciones
- Fisiología y Metabolismo MicrobianoDocumento30 páginasFisiología y Metabolismo MicrobianoJhan Carlos Vergara VergaraAún no hay calificaciones
- Hoja de seguridad para Celesto Barita de Indumin GroupDocumento1 páginaHoja de seguridad para Celesto Barita de Indumin GroupMaldonado Pérez Diego AlejandroAún no hay calificaciones
- Nutricion de CafeDocumento54 páginasNutricion de CafeAide QuentaAún no hay calificaciones
- Ingenieria Quimica - Extraccion Liquido - LiquidoDocumento11 páginasIngenieria Quimica - Extraccion Liquido - LiquidoMej Hurt VeronicaAún no hay calificaciones
- Pama ToromochoDocumento8 páginasPama ToromochoorsiroAún no hay calificaciones
- Protocolo CompletoDocumento4 páginasProtocolo Completopier_89_9100% (1)
- Guia AlquenosDocumento11 páginasGuia Alquenosyolima vivasAún no hay calificaciones
- FARMACOCINETICADocumento52 páginasFARMACOCINETICAalberto nidomeAún no hay calificaciones
- Acabados Superficiales - MonografiasDocumento3 páginasAcabados Superficiales - MonografiasalainscAún no hay calificaciones
- Oxidacion de Acidos Grasos InsaturadosDocumento17 páginasOxidacion de Acidos Grasos InsaturadosMaria RosarioAún no hay calificaciones
- Golpe de ArieteDocumento5 páginasGolpe de ArieteAmilcarAún no hay calificaciones
- BudewevixaDocumento3 páginasBudewevixaAlfredo QuinteroAún no hay calificaciones
- 1ra Ley GasesDocumento6 páginas1ra Ley Gasessolymar estrellaAún no hay calificaciones
- Cisold - Api - 1104 - WPS-PQR-WPQDocumento44 páginasCisold - Api - 1104 - WPS-PQR-WPQDan Carrasco100% (2)
- Informe 7. Saponificación José CarrasquelDocumento7 páginasInforme 7. Saponificación José CarrasquelJose Rafael Carrasquel Pernalete0% (1)
- Metodologia Implementacion BIM (AP3D Piping)Documento24 páginasMetodologia Implementacion BIM (AP3D Piping)Raul Alejos100% (1)
- Calcular El Precio Del OroDocumento4 páginasCalcular El Precio Del OroKarol Morales ValenciaAún no hay calificaciones