Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Prac 01 PI217B-2021-2
Cargado por
DANIEL FFDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Prac 01 PI217B-2021-2
Cargado por
DANIEL FFCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL DE INGENIERIA
FACULTAD DE INGENIERIA QUIMICA Y MANUFACTURERA
DEPARTAMENTO ACADEMICO DE INGENIERIA QUIMICA
Termodinámica – II: PI-217/B 01/ 10 /21
Nombre del alumno: ……………………………………………………………………..
Código de estudiante: ……………………………………………………..
Duración de prueba: 01 hora
Primera Practica calificada
1. Responder brevemente: (01 pto c/u)
a) ¿Qué relación existe entre energía disponible y energía libre?
b) Según W. Gibbs, en el equilibrio ¿Cuáles son las variables independientes?
c) Para el caso de la temperatura de burbuja, ¿cuál es la función de convergencia?
d) ¿Qué representa “i” en la ley de Raoult corregida? Y en que caso se usa.
e) ¿Por qué es una ventaja utilizar la función de Gibbs cuando se estudia el equilibrio químico?
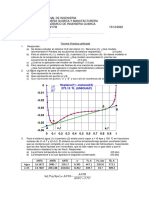
2. Para el sistema de n-pentano (1)/ metanol (2) a 397.7 K (Wilsak et al., 1987),
1600
4
1500
P/ kpa
1400
5
1300
3
1200
2
1100
1000
900
800
x1/y1
700
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
Responda las siguientes preguntas basadas en la figura.
a) El sistema presenta azeótropo, Justifique su respuesta39. (01 pto)
b) En los sistemas del 1 al 5, determinar la composición y estado de cada fase en equilibrio.
(02 pto)
c) La presión y composición del punto de rocío a z1=0.7. (02 pto)
d) La fracción vaporizada a 1200 kpa y z1=0.26. (03 pto)
3. Un tanque cerrado contiene 10 moles de propano (1), 16 moles de n-butano (2) y 8 moles de n-
pentano (3) a 320 K y 8 bar. Se desea saber,
a) ¿Cuántas fases hay dentro del tanque? (05 pto)
b) Plantear el procedimiento. (02 pto)
Duración de la prueba: 01 hora
Nota:
1. Poner su nombre en el cuadernillo
2. Responder en esta misma hoja
3. En hoja Word, ir a la columna “Archivo”, seleccionar la opción “exportar” y convertir la hoja de
Word a archivo PDF.
4. Si los cálculos se hicieron en Excel adjuntar archivo
5. Enviar el archivo PDF creado en (3) vía Moodle para su calificación en el tiempo establecido
También podría gustarte
- Cinetica Química PDFDocumento5 páginasCinetica Química PDFHector Tineo100% (1)
- Pi365 Rocagutierrez Deysiyeraldin PC1Documento3 páginasPi365 Rocagutierrez Deysiyeraldin PC1DANIEL FFAún no hay calificaciones
- Curso Operadores Bt-324 Com.05gDocumento21 páginasCurso Operadores Bt-324 Com.05gCocom Ivan83% (6)
- Cap 13 SolucionarioDocumento39 páginasCap 13 SolucionarioDIANA PAOLA PALEN GUTIERREZAún no hay calificaciones
- Cinetica Química AplicadaDocumento92 páginasCinetica Química AplicadaCarlos DoradoAún no hay calificaciones
- Estatica y Dinamica de Los FluidosDocumento20 páginasEstatica y Dinamica de Los FluidosKaty Guz50% (4)
- PI365 - PRÁCTICA CALFICADA 1 - 20-1 XDDocumento2 páginasPI365 - PRÁCTICA CALFICADA 1 - 20-1 XDDANIEL FFAún no hay calificaciones
- Capacidad Portante 1Documento531 páginasCapacidad Portante 1Martin Farfán100% (2)
- Compendio de Guias de Trabajo Termodinamica Fs-200Documento31 páginasCompendio de Guias de Trabajo Termodinamica Fs-200amaurimejiaAún no hay calificaciones
- 1ra PC - TermoDocumento4 páginas1ra PC - TermoRafaelAún no hay calificaciones
- Trabajo - 01 - P1217B - 2021 - 2Documento1 páginaTrabajo - 01 - P1217B - 2021 - 2DANIEL FFAún no hay calificaciones
- Ex - Final-PI217-2022-1 VirtualDocumento2 páginasEx - Final-PI217-2022-1 Virtualdaniel angel carhuatanta fuñoAún no hay calificaciones
- Examen Primera Conv 2018Documento3 páginasExamen Primera Conv 2018NoeliaAún no hay calificaciones
- Serie de Cromatografía de Gases y Líquidos 19-2Documento4 páginasSerie de Cromatografía de Gases y Líquidos 19-2danielAún no hay calificaciones
- ACFrOgCySjla V5h3u9RRCKLrIT5-sG5faGwbZlSqYQ0ipZcYzPNFXWnGrTgO HWI39wTY0xQVIyH4vyVVURNbPWDjkl3yW-BASrdZeydsReorIMUjeEiB3J4UFFiPgdM2X5mk6C5xM3aB6KFkHvDocumento3 páginasACFrOgCySjla V5h3u9RRCKLrIT5-sG5faGwbZlSqYQ0ipZcYzPNFXWnGrTgO HWI39wTY0xQVIyH4vyVVURNbPWDjkl3yW-BASrdZeydsReorIMUjeEiB3J4UFFiPgdM2X5mk6C5xM3aB6KFkHvMaximimilianoAún no hay calificaciones
- 01 Prac PI217B 2022-1Documento1 página01 Prac PI217B 2022-1daniel angel carhuatanta fuñoAún no hay calificaciones
- 2âºeso Fã Sica y Quã Mica Final TodoDocumento2 páginas2âºeso Fã Sica y Quã Mica Final TodoESCOBAR CARDONA SOFIAAún no hay calificaciones
- Informe 4Documento2 páginasInforme 4Catalina VicencioAún no hay calificaciones
- Quimica 3ra ParteDocumento44 páginasQuimica 3ra ParteRaul Leon EspinozaAún no hay calificaciones
- Prac 02 PI217B-2021-2Documento2 páginasPrac 02 PI217B-2021-2DANIEL FFAún no hay calificaciones
- 1ra Serie de ProblemasDocumento3 páginas1ra Serie de Problemasalejandro espinosaAún no hay calificaciones
- 10 FQ - Problemas Propuestos 2017B PDFDocumento3 páginas10 FQ - Problemas Propuestos 2017B PDFSergio Esteban Pantoja IbarraAún no hay calificaciones
- Tareas Todo El CursoDocumento21 páginasTareas Todo El CursoMirzan Alexandra Torres LaraAún no hay calificaciones
- 3 PC 2020-2Documento3 páginas3 PC 2020-2Nuñez Salvador ArianaAún no hay calificaciones
- 3 PC 2020-2Documento4 páginas3 PC 2020-2Marco Dueñas FloresAún no hay calificaciones
- AttachmentDocumento7 páginasAttachmentmiguel EncarnacionAún no hay calificaciones
- ACFrOgDcNjaU6Q8rej4Oz-Hp7X6pfJn5cR3tgc 2x VUuYhhBNNGJopErxk3sEXTwRXKr9SQGvaCMdUB4aFkfOCB6jMj0ar aESze BDNd1dssh6ZEW IpRJd-0W82DiwsCSJD5lwvpFwit6luv9Documento2 páginasACFrOgDcNjaU6Q8rej4Oz-Hp7X6pfJn5cR3tgc 2x VUuYhhBNNGJopErxk3sEXTwRXKr9SQGvaCMdUB4aFkfOCB6jMj0ar aESze BDNd1dssh6ZEW IpRJd-0W82DiwsCSJD5lwvpFwit6luv9CristhianPalaciosAún no hay calificaciones
- Ejercicios - QO I T5Documento6 páginasEjercicios - QO I T5dddddAún no hay calificaciones
- Prac 01 PI2179 2-2020-1Documento3 páginasPrac 01 PI2179 2-2020-1Edith Ingles MAún no hay calificaciones
- Resolucion Parte1 2ºllama Enero 22Documento6 páginasResolucion Parte1 2ºllama Enero 22Sophia El HarrakAún no hay calificaciones
- Guia Cromatografia Final 2018Documento18 páginasGuia Cromatografia Final 2018Milu Ycyry AlvarezAún no hay calificaciones
- Nueva Serie 5Documento3 páginasNueva Serie 5Sandra FanchiottiAún no hay calificaciones
- PEC 2 - Con SolucionesDocumento7 páginasPEC 2 - Con SolucionesbeichhhAún no hay calificaciones
- Q1 Pa3 2021-0 FinalDocumento3 páginasQ1 Pa3 2021-0 FinalLuis Angel Calderon CordovaAún no hay calificaciones
- QGeI-1 - 2022 - 1C - 1P - VFDocumento3 páginasQGeI-1 - 2022 - 1C - 1P - VFMauro GaitanAún no hay calificaciones
- Examen Final de Física Tema (A) 2022-IDocumento2 páginasExamen Final de Física Tema (A) 2022-IMarlon BardalesAún no hay calificaciones
- Taller 1Documento4 páginasTaller 1luisa niñoAún no hay calificaciones
- Repaso PC3Documento4 páginasRepaso PC3BC NandoAún no hay calificaciones
- Prac 03 PI217B 2022-2Documento2 páginasPrac 03 PI217B 2022-2DANIEL FFAún no hay calificaciones
- Serie 5 Corregida-1Documento5 páginasSerie 5 Corregida-1JuliAún no hay calificaciones
- Anexo 1 - Fase 2 - AireDocumento5 páginasAnexo 1 - Fase 2 - AireMafe PachecoAún no hay calificaciones
- Sem Nº2 - Cinética Química - Leyes de Velocidad 2021Documento9 páginasSem Nº2 - Cinética Química - Leyes de Velocidad 2021Abi YamiAún no hay calificaciones
- Prob. Cap.xDocumento4 páginasProb. Cap.xSonia GODODS DIEOAMAún no hay calificaciones
- Tarea Unidad III INGENIERIA DE REACCIONES IDocumento3 páginasTarea Unidad III INGENIERIA DE REACCIONES IKarenLissAún no hay calificaciones
- CF4E1B Final 2021-2Documento3 páginasCF4E1B Final 2021-2Sebastian M.Aún no hay calificaciones
- Repaso 1Documento6 páginasRepaso 1Leidy Torres MedranoAún no hay calificaciones
- Cinética Química A-A 2015Documento5 páginasCinética Química A-A 2015Johana Condo0% (1)
- Final Reactores 2010-2 PDFDocumento2 páginasFinal Reactores 2010-2 PDFYhonn HenryAún no hay calificaciones
- Ejercicios Cinética 2Documento3 páginasEjercicios Cinética 2Mayra MoralesAún no hay calificaciones
- Ejercicios Química Inorgánica de UTN FRA 2021Documento22 páginasEjercicios Química Inorgánica de UTN FRA 2021Deb iiAún no hay calificaciones
- Examen Final 2016 I Fiee UniDocumento2 páginasExamen Final 2016 I Fiee UniFernando de la Cruz100% (1)
- Ejemplos de ActividadesDocumento3 páginasEjemplos de ActividadesMac ArenaAún no hay calificaciones
- Repartido de Ejercicios de Estructura Atomica.2021Documento6 páginasRepartido de Ejercicios de Estructura Atomica.2021Juan MuscarelliAún no hay calificaciones
- Taller-Video-Cinetica.2020 Salomon Mendoza 1102Documento4 páginasTaller-Video-Cinetica.2020 Salomon Mendoza 1102THOMASAún no hay calificaciones
- PR 2 QG2 2022-I Solución 2Documento8 páginasPR 2 QG2 2022-I Solución 2Stiwart sadhot Mendoza mazaAún no hay calificaciones
- FisicoquímicaDocumento3 páginasFisicoquímicaLuis RodríguezAún no hay calificaciones
- Tarea 1Documento10 páginasTarea 1José YalibatAún no hay calificaciones
- Taller 1: Nivel 1: Verificación de Conceptos (Esto Se Evalúa en El Parcial)Documento4 páginasTaller 1: Nivel 1: Verificación de Conceptos (Esto Se Evalúa en El Parcial)Duban Bedoya valenciaAún no hay calificaciones
- Examen Olimpiada 2022 PDFDocumento5 páginasExamen Olimpiada 2022 PDFnayara kingsAún no hay calificaciones
- Examen Segundo Parcial-Reactores Ii-1-2020 PDFDocumento2 páginasExamen Segundo Parcial-Reactores Ii-1-2020 PDFJose LuisAún no hay calificaciones
- Examen Segundo Parcial-Reactores Ii-1-2020Documento2 páginasExamen Segundo Parcial-Reactores Ii-1-2020Marizabel Veramendi PolicarpioAún no hay calificaciones
- Termodinamica 11Documento6 páginasTermodinamica 11pablo carvajalAún no hay calificaciones
- Prob. Cap.x Tarea PDFDocumento7 páginasProb. Cap.x Tarea PDFStiven Deza QuispeAún no hay calificaciones
- I$ffil Ii:flt-: FfiomDocumento3 páginasI$ffil Ii:flt-: FfiomArT1110Aún no hay calificaciones
- Recu Parcial Ino 1Documento3 páginasRecu Parcial Ino 1Milena QuijadaAún no hay calificaciones
- EXAM SUST PA113C 2022-1 para Tomar 14-08-22Documento2 páginasEXAM SUST PA113C 2022-1 para Tomar 14-08-22DANIEL FFAún no hay calificaciones
- Practica 2 PI 140 AB 2020 1Documento3 páginasPractica 2 PI 140 AB 2020 1DANIEL FFAún no hay calificaciones
- Examen SustitutorioDocumento2 páginasExamen SustitutorioDANIEL FFAún no hay calificaciones
- Pi365 - Práctica Calficada 1 - 2020-2Documento3 páginasPi365 - Práctica Calficada 1 - 2020-2DANIEL FFAún no hay calificaciones
- Ex Susti PI216B 2022-1Documento2 páginasEx Susti PI216B 2022-1DANIEL FFAún no hay calificaciones
- Ep 22-2 TM SoluciónDocumento3 páginasEp 22-2 TM SoluciónDANIEL FFAún no hay calificaciones
- Quinta Practica PI-143A - 2022.2Documento3 páginasQuinta Practica PI-143A - 2022.2DANIEL FFAún no hay calificaciones
- 2 - Practica Transf Calor 2022 .2Documento2 páginas2 - Practica Transf Calor 2022 .2DANIEL FFAún no hay calificaciones
- PI521-03-Seminario 1 Perma ZymeDocumento1 páginaPI521-03-Seminario 1 Perma ZymeDANIEL FFAún no hay calificaciones
- Prac 04 PI217B 2022-2Documento2 páginasPrac 04 PI217B 2022-2DANIEL FFAún no hay calificaciones
- PC3 2022-1Documento1 páginaPC3 2022-1DANIEL FFAún no hay calificaciones
- 15) B. - Circuitos de MoliendaDocumento25 páginas15) B. - Circuitos de MoliendaDANIEL FFAún no hay calificaciones
- Pc4-Pa113b - 2022-2Documento3 páginasPc4-Pa113b - 2022-2DANIEL FFAún no hay calificaciones
- Prac 03 PI217B 2022-2Documento2 páginasPrac 03 PI217B 2022-2DANIEL FFAún no hay calificaciones
- Exam Sustitutorio Pa113c 2021-2Documento2 páginasExam Sustitutorio Pa113c 2021-2DANIEL FFAún no hay calificaciones
- 4 Solucionario Examen Final Pa113ab 2020 2 MejoradoDocumento4 páginas4 Solucionario Examen Final Pa113ab 2020 2 MejoradoDANIEL FFAún no hay calificaciones
- Examen Final Pa113ab 2021-2Documento3 páginasExamen Final Pa113ab 2021-2DANIEL FFAún no hay calificaciones
- 1) Silabus 2021-1 LabDocumento11 páginas1) Silabus 2021-1 LabDANIEL FFAún no hay calificaciones
- 3-Examen Final Pa113ab 2020-2Documento3 páginas3-Examen Final Pa113ab 2020-2DANIEL FFAún no hay calificaciones
- EXAM FIN PA113C 2021-2 para Tomar 26-12-21Documento1 páginaEXAM FIN PA113C 2021-2 para Tomar 26-12-21DANIEL FFAún no hay calificaciones
- 2-EF - Respuestas-ORCE - PA113AB-2020-1Documento3 páginas2-EF - Respuestas-ORCE - PA113AB-2020-1DANIEL FFAún no hay calificaciones
- Prac 03 PI217B 2021-2Documento2 páginasPrac 03 PI217B 2021-2DANIEL FFAún no hay calificaciones
- EXAM SUSTITUTORIO PA113C 2021-2 Tomar 9-1-21Documento2 páginasEXAM SUSTITUTORIO PA113C 2021-2 Tomar 9-1-21DANIEL FFAún no hay calificaciones
- Prac 02 PI217B-2021-2Documento2 páginasPrac 02 PI217B-2021-2DANIEL FFAún no hay calificaciones
- Practica Dirigida Ing Met I 2022-1Documento2 páginasPractica Dirigida Ing Met I 2022-1DANIEL FFAún no hay calificaciones
- Prac 03 PI217B 2022-1Documento1 páginaPrac 03 PI217B 2022-1DANIEL FFAún no hay calificaciones
- Prac 02 PI217B 2022-1Documento1 páginaPrac 02 PI217B 2022-1DANIEL FFAún no hay calificaciones
- Prac 04 PI217B 2021-2Documento1 páginaPrac 04 PI217B 2021-2DANIEL FFAún no hay calificaciones
- Pase Aereo PachacayoDocumento32 páginasPase Aereo PachacayoJoel FredyAún no hay calificaciones
- Simetría Rotacional y Traslacional en Problemas de Dos CuerposDocumento22 páginasSimetría Rotacional y Traslacional en Problemas de Dos CuerposJohan BautistaAún no hay calificaciones
- Hablar Sobre La Historia de Las Máquinas y Sus HerramientasDocumento27 páginasHablar Sobre La Historia de Las Máquinas y Sus HerramientasEdward Segura AlcantaraAún no hay calificaciones
- hd65 PDFDocumento1 páginahd65 PDFDelber Cornejo YanqeAún no hay calificaciones
- Laboratorio Mecanica de FluidosDocumento12 páginasLaboratorio Mecanica de FluidosFernando Alvarez GarcíaAún no hay calificaciones
- Glosario Terminos Resistencia de MaterialesDocumento28 páginasGlosario Terminos Resistencia de MaterialesLuis David Capacyachi100% (1)
- Wps OAW Nº1Documento1 páginaWps OAW Nº1Vicente CidAún no hay calificaciones
- Comprobaciones Sobre Las BujíasDocumento8 páginasComprobaciones Sobre Las BujíasPaul Bernal0% (1)
- CAP 5 - Generacion Termoeléctrica Con Ciclos CombinadosDocumento17 páginasCAP 5 - Generacion Termoeléctrica Con Ciclos CombinadosLea MartínAún no hay calificaciones
- Manual de Operacion y Mantenimiento Parte 1 PDFDocumento60 páginasManual de Operacion y Mantenimiento Parte 1 PDFJose Sostenes50% (2)
- Cuadro EngranajesDocumento1 páginaCuadro EngranajesAbner J. FierroAún no hay calificaciones
- Fi-Tec FT ESDocumento2 páginasFi-Tec FT ESJose Luis Tazzo OsorioAún no hay calificaciones
- Maquinas Simples y MotorizadasDocumento2 páginasMaquinas Simples y Motorizadasandres sousa0% (1)
- Cuaderno de FisicoDocumento127 páginasCuaderno de FisicoSTYVENAún no hay calificaciones
- Aplicacion de Bond-Graph A La HidraulicaDocumento19 páginasAplicacion de Bond-Graph A La HidraulicaRock SayboltAún no hay calificaciones
- Tema 4, 4.1, 4.2, 4.3Documento7 páginasTema 4, 4.1, 4.2, 4.3Conrado CortesAún no hay calificaciones
- Planificacion Semana 10 Fisica A-B PrimeroDocumento7 páginasPlanificacion Semana 10 Fisica A-B PrimeroPablo Gonzalez CisnerosAún no hay calificaciones
- Conceptos FundamentalesDocumento16 páginasConceptos FundamentalesYoseth Ferley chacon MuñozAún no hay calificaciones
- Problrmario TermodinamicaDocumento3 páginasProblrmario TermodinamicamendezAún no hay calificaciones
- Semana 3Documento14 páginasSemana 3Max DvhAún no hay calificaciones
- Mazda 6 Engine l8 LF l3 Repair ManualDocumento20 páginasMazda 6 Engine l8 LF l3 Repair Manualpatricia100% (38)
- 2º TransporteDocumento4 páginas2º TransporteHector MarzanaAún no hay calificaciones
- Presion de Vapor Labo de Fiki 1 3 1Documento15 páginasPresion de Vapor Labo de Fiki 1 3 1Carlos Daniel HQAún no hay calificaciones
- Manual Componentes Sistemas Admision Aire Escape Motores Caterpillar 150113203038 Conversion Gate01 PDFDocumento22 páginasManual Componentes Sistemas Admision Aire Escape Motores Caterpillar 150113203038 Conversion Gate01 PDFjoel100% (1)
- Concreto Armado - Secciones Tipo TDocumento49 páginasConcreto Armado - Secciones Tipo TDEIVIS JHOAN PANEZ RICALDIAún no hay calificaciones
- Ppto - Esc0046 - Ampliacion de Altura de Pasamanos y Barandas de Tolvas 6 y 7 Mina Estrella NV1467Documento10 páginasPpto - Esc0046 - Ampliacion de Altura de Pasamanos y Barandas de Tolvas 6 y 7 Mina Estrella NV1467Daniel Pesantes LeónAún no hay calificaciones