Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Unidad 7 Serie de Ejercicios
Cargado por
Arely HudsonDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Unidad 7 Serie de Ejercicios
Cargado por
Arely HudsonCopyright:
Formatos disponibles
Cinética Química (1603).
Facultad de Química. UNAM Unidad 7. Arrhenius y Eyring
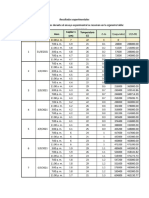
1. La hidrólisis de (CH2)6C(Cl)CH3 en 80% etanol sigue una cinética de primer orden. Los valores de
la constante de velocidad determinados a diferentes temperaturas son los siguientes:
T/ oC 0 25 35 45
k /s-1 1.06×10 -5
3.19×10 -4
9.86×10 -4
2.92×10-3
Determina la energía de activación y el factor pre-exponencial.
Respuesta: Ea = 90.0 kJ/mol y A= 1.77×1012 s-1
2. Considera las siguientes reacciones paralelas:
A → B
A → C
La energía de activación para la reacción de A → B es de 45.3 kJ mol-1 y para la reacción A→C es
de 69.8 kJ mol-1. Si a 320 K las constantes de velocidad k1 y k2 son iguales. ¿a qué temperatura se
encontrará que k1/k2 = 2. Respuesta: 298 K
3. La isomerización térmica de ciclopropano a propeno en fase gas tiene una constante de velocidad
de 5.95´10-4 s-1 a 500 oC. Calcula el ΔG°≠ para la reacción. Respuesta: ΔG°≠ = 2.43×105 Jmol-1
4. La vida media de la desnaturalización térmica de la hemoglobina, un proceso de primer orden, es
de 3460 s a 60 oC y de 530 s a 65 oC. Calcula la entalpía de activación y la entropía de activación a
60 oC, suponiendo que es aplicable la ecuación de Arrhenius. Respuesta: 348.6 kJmol-1 ; 730 Jmol-1
K-1
5. En un estudio de la hidrólisis alcalina del acetato de metilo se encontró que la constante de
velocidad variaba con la temperatura como sigue:
T/K 293 298 303 308
k /dm3mol-1s-1 0.135 0.186 0.259 0.358
Calcula la entalpía ΔH°≠ y entropía ΔS°≠ de activación para esta reacción. Respuesta: 46.6 kJmol-1;
-102.7 J K-1mol-1
Prof. Norma Angélica Macías Ruvalcaba 1
También podría gustarte
- Ejercicios Capitulos API 2,3 y 4Documento49 páginasEjercicios Capitulos API 2,3 y 4Sthfaa Clocks ColdAún no hay calificaciones
- ELL Pentane + N-Formylmorpholine Equipo 13Documento29 páginasELL Pentane + N-Formylmorpholine Equipo 13Gilberto MartínezAún no hay calificaciones
- Metodos de Estructura ElectronicaDocumento11 páginasMetodos de Estructura ElectronicaSandra SalazarAún no hay calificaciones
- Exposicion Equilibrio QuimicoDocumento18 páginasExposicion Equilibrio QuimicoRenso Ramos Lopez100% (1)
- Taller FisicoquimicaDocumento5 páginasTaller FisicoquimicadavidAún no hay calificaciones
- Trabajo CumenoDocumento11 páginasTrabajo CumenoAnonymous zhDyxFqeZAún no hay calificaciones
- Cinética IntrínsecaDocumento2 páginasCinética IntrínsecacaabernalraAún no hay calificaciones
- Problema 8-7Documento4 páginasProblema 8-7EduardodelAngelAún no hay calificaciones
- Ejercicios de DestilacionDocumento16 páginasEjercicios de DestilacionDiego Giraldo BoteroAún no hay calificaciones
- Ecuación de EyringDocumento7 páginasEcuación de EyringMizuki Carballo100% (1)
- Diagrama TernarioDocumento20 páginasDiagrama TernarioH Marquez R Graciela100% (1)
- Ejercicios Capitulo 1 y 2Documento4 páginasEjercicios Capitulo 1 y 2Julii TrochezAún no hay calificaciones
- Problema 9A-9 Fenómenos de Transporte BirdDocumento2 páginasProblema 9A-9 Fenómenos de Transporte BirdVeneno Alan JoqsanAún no hay calificaciones
- Conveccion ForzadaDocumento7 páginasConveccion ForzadaCärïïtö ÖtälväröAún no hay calificaciones
- Serie 3 CinéticaDocumento1 páginaSerie 3 CinéticaDoloresVergaraAún no hay calificaciones
- 4.4 PFR - Fogler - 4th - Ed.2008Documento8 páginas4.4 PFR - Fogler - 4th - Ed.2008Clarisabel RuizAún no hay calificaciones
- TEF Primer Examen Parcial Parte BDocumento6 páginasTEF Primer Examen Parcial Parte BEstefanía Angel ClavijoAún no hay calificaciones
- Examen 2do Parcial MNADocumento2 páginasExamen 2do Parcial MNAAlfredo AzcorraAún no hay calificaciones
- Lab 1, Determinacion de La Masa Molar Exacta de Un GasDocumento7 páginasLab 1, Determinacion de La Masa Molar Exacta de Un GasNicolas Riffo LepeAún no hay calificaciones
- 2 Procesos de TrasporteDocumento4 páginas2 Procesos de TrasporteIza AlegríaAún no hay calificaciones
- Informe 3 Calor IntegralDocumento12 páginasInforme 3 Calor IntegralJose LuisAún no hay calificaciones
- Sistemas Con Reacciones QuimicasDocumento6 páginasSistemas Con Reacciones QuimicasNatali CondeñaAún no hay calificaciones
- Ácido BenzoicoDocumento5 páginasÁcido BenzoicoanytcAún no hay calificaciones
- Universidad Nacional de IngenieríaDocumento9 páginasUniversidad Nacional de IngenieríaGabriel Caceres ArauzAún no hay calificaciones
- Taller 2 ..Documento4 páginasTaller 2 ..Luisa Marulanda100% (1)
- Tarea 5 SoluciónDocumento4 páginasTarea 5 SoluciónLuis Enrique Sanchez Mercado :DAún no hay calificaciones
- Relaciones TermodinamicasDocumento14 páginasRelaciones TermodinamicasKaren PerezAún no hay calificaciones
- Cinetica QuimicaDocumento45 páginasCinetica QuimicaarmynboliviaAún no hay calificaciones
- Ejercicios-Equilibrio Liquido - Vapor PDFDocumento2 páginasEjercicios-Equilibrio Liquido - Vapor PDFAleyda Fernández Lescano0% (2)
- Modelamiento de Primer OrdenDocumento10 páginasModelamiento de Primer OrdenLeonel YairAún no hay calificaciones
- Informe CSTRDocumento14 páginasInforme CSTRLauraAún no hay calificaciones
- ABSORCIÓN Y ADSORCIÓN Operaciones Unitarias IIDocumento54 páginasABSORCIÓN Y ADSORCIÓN Operaciones Unitarias IITanya Correa'Aún no hay calificaciones
- BalanceDocumento8 páginasBalanceAlex Pascual ToapantaAún no hay calificaciones
- Lab 33Documento13 páginasLab 33Gabriel Caceres ArauzAún no hay calificaciones
- Laboratorio Feno Aleta AgujaDocumento15 páginasLaboratorio Feno Aleta AgujaJerson Brian Valencia QuispeAún no hay calificaciones
- Metodo Grafico de WinkelmannDocumento4 páginasMetodo Grafico de WinkelmannCarmen HernandezAún no hay calificaciones
- Ponchon Savarit PDFDocumento41 páginasPonchon Savarit PDFMiguelAngelRodriguezTovarAún no hay calificaciones
- Universidad VeracruzanaDocumento18 páginasUniversidad VeracruzanaEnrique Hernandez LiraAún no hay calificaciones
- Cap Ii Movimiento de Fluidos PDFDocumento22 páginasCap Ii Movimiento de Fluidos PDFkatia andrade0% (1)
- Borrador Informe TCTBADocumento13 páginasBorrador Informe TCTBAAlejandro MartinezAún no hay calificaciones
- Actividad DE FISICOQUIMICADocumento6 páginasActividad DE FISICOQUIMICAAvelin CastillaAún no hay calificaciones
- Sol Eda D1 TMA (25 02 13) PDFDocumento2 páginasSol Eda D1 TMA (25 02 13) PDFLeonardo GranadosAún no hay calificaciones
- Guia de Problemas - Capitulo 2 PDFDocumento2 páginasGuia de Problemas - Capitulo 2 PDFJuan VasquezAún no hay calificaciones
- Transferencia de Calor Programa ComsolDocumento9 páginasTransferencia de Calor Programa ComsolTrajano Saúl Guevara MoralesAún no hay calificaciones
- Guia de Aprendizaje 2UI - CP1Documento6 páginasGuia de Aprendizaje 2UI - CP1javier gagoAún no hay calificaciones
- Diagrama Composicion Agua - EtanolDocumento3 páginasDiagrama Composicion Agua - EtanolRicardo Alcántara ReyesAún no hay calificaciones
- Equilibrio Sólido-Vapor Del Carbamato de AmónioDocumento9 páginasEquilibrio Sólido-Vapor Del Carbamato de Amónioleomirazu0% (1)
- 6 Carta PsicrometricaDocumento42 páginas6 Carta Psicrometricaluis0% (1)
- Calculo y Diseño de Un AbsorbedorDocumento5 páginasCalculo y Diseño de Un AbsorbedorSantajmnzAún no hay calificaciones
- EntalpíaDocumento4 páginasEntalpíaMae MaeAún no hay calificaciones
- David VeraDocumento8 páginasDavid VeraBeatriz mendozaAún no hay calificaciones
- Taller 3Documento1 páginaTaller 3hitayosara fernandezAún no hay calificaciones
- Tarea 7Documento17 páginasTarea 7CharliHernandezAún no hay calificaciones
- Aplicaciones DisolucionesDocumento13 páginasAplicaciones DisolucionesAdrián PilataxiAún no hay calificaciones
- Problemas Evaporación-Evaporadores v2Documento1 páginaProblemas Evaporación-Evaporadores v2Tomas Palazon MolinaAún no hay calificaciones
- Fenomenos de Transporte Cuestionario 0Documento6 páginasFenomenos de Transporte Cuestionario 0Veneno Alan JoqsanAún no hay calificaciones
- Problemas de Cinetica QuimicaDocumento9 páginasProblemas de Cinetica QuimicaAldo Jhared Ulloa ClaureAún no hay calificaciones
- Deber 1 Arrenius Ejercicios 15 Febr 2022Documento1 páginaDeber 1 Arrenius Ejercicios 15 Febr 2022Jose Gregorio Macias AvelinoAún no hay calificaciones
- Problemario 1aDocumento3 páginasProblemario 1aEDHER DAVID GUADALUPE ABREGOAún no hay calificaciones
- Taller de Arrenius Ejercicios Ag 2022Documento1 páginaTaller de Arrenius Ejercicios Ag 2022Wendy CedeñoAún no hay calificaciones
- Ejercicios Unidad 4Documento3 páginasEjercicios Unidad 4Arely HudsonAún no hay calificaciones
- Ejercicios Unidad 3Documento2 páginasEjercicios Unidad 3Arely HudsonAún no hay calificaciones
- Reporte 5. Ramirez Ordaz Arely SofiaDocumento5 páginasReporte 5. Ramirez Ordaz Arely SofiaArely HudsonAún no hay calificaciones
- Unidad 6 Series de EjerciciosDocumento5 páginasUnidad 6 Series de EjerciciosArely HudsonAún no hay calificaciones
- Ejercicios Unidad 1Documento1 páginaEjercicios Unidad 1Arely HudsonAún no hay calificaciones
- Propuesta Experimental Sales de DiazonioDocumento7 páginasPropuesta Experimental Sales de DiazonioArely HudsonAún no hay calificaciones
- Reporte 1.Documento8 páginasReporte 1.Arely HudsonAún no hay calificaciones
- Reporte Reacción SN1.Documento4 páginasReporte Reacción SN1.Arely HudsonAún no hay calificaciones
- Taller Técnicas de LaboratorioDocumento7 páginasTaller Técnicas de LaboratorioArely HudsonAún no hay calificaciones
- Previo 1. Reducción de Nitrocompuestos A AminasDocumento7 páginasPrevio 1. Reducción de Nitrocompuestos A AminasArely HudsonAún no hay calificaciones
- Previo 2.reaccion de Grignard.Documento4 páginasPrevio 2.reaccion de Grignard.Arely HudsonAún no hay calificaciones
- Deducción Expresiones Error Por IndicadorDocumento3 páginasDeducción Expresiones Error Por IndicadorArely HudsonAún no hay calificaciones
- QID 2020-1 Oxido - ReducciónDocumento48 páginasQID 2020-1 Oxido - ReducciónArely HudsonAún no hay calificaciones
- DinámicaDocumento1 páginaDinámicaArely HudsonAún no hay calificaciones
- Propiedades Coligativas PDFDocumento19 páginasPropiedades Coligativas PDFArely HudsonAún no hay calificaciones
- Tabla de PH y Fuerza Ácida PDFDocumento1 páginaTabla de PH y Fuerza Ácida PDFArely HudsonAún no hay calificaciones
- Ejer Qo 1 S3 2020-1Documento3 páginasEjer Qo 1 S3 2020-1Arely HudsonAún no hay calificaciones
- Propiedades Coligativas PDFDocumento19 páginasPropiedades Coligativas PDFArely HudsonAún no hay calificaciones
- Reglas de La IUPAC para AlcanosDocumento7 páginasReglas de La IUPAC para AlcanosArely HudsonAún no hay calificaciones