0% encontró este documento útil (0 votos)
120 vistas7 páginasPropiedades del Zinc
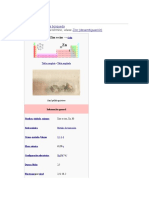
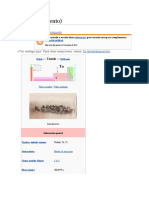
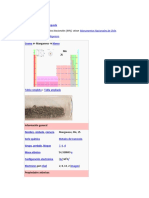
El zinc es un metal blanco azulado esencial para los seres vivos. Tiene numerosas aplicaciones industriales, siendo la principal el galvanizado del acero para protegerlo de la corrosión. Aunque se han usado aleaciones de zinc durante siglos, su naturaleza como metal no fue comprendida hasta el siglo XVIII. Actualmente, es el 23o elemento más abundante en la Tierra y se extrae principalmente de minerales como la calamina.
Cargado por
Andres Felipe HernandezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
120 vistas7 páginasPropiedades del Zinc
El zinc es un metal blanco azulado esencial para los seres vivos. Tiene numerosas aplicaciones industriales, siendo la principal el galvanizado del acero para protegerlo de la corrosión. Aunque se han usado aleaciones de zinc durante siglos, su naturaleza como metal no fue comprendida hasta el siglo XVIII. Actualmente, es el 23o elemento más abundante en la Tierra y se extrae principalmente de minerales como la calamina.
Cargado por
Andres Felipe HernandezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd