Documentos de Académico
Documentos de Profesional
Documentos de Cultura
IQA126 Taller 09 - Solución
Cargado por
RobertoTorreesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
IQA126 Taller 09 - Solución
Cargado por
RobertoTorreesCopyright:
Formatos disponibles
IQA126 Balance de Materia
Taller N° 09
Fecha: 11 de diciembre de 2020
En una planta química se opera un reactor batch a presión y temperatura constante, el cual inicialmente
es cargado a tope con una solución estequiométrica de anhídrido acético (𝐶𝐻3 𝐶𝑂)2 𝑂 que posee una
𝑘𝑚𝑜𝑙
concentración inicial de 0,49 , contenida en un volumen 50 𝑚3 . Reaccionando según:
𝑚3
(𝐶𝐻3 𝐶𝑂)2 𝑂(𝑙) + 𝐻2 𝑂(𝑙) → 2𝐶𝐻3 𝐶𝑂𝑂𝐻(𝑙) (1)
Tenga en cuenta la velocidad de desaparición para el anhídrido (A) viene dada por:
𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉 (2)
Donde 𝐶𝑖 representa la concentración molar del compuesto 𝑖, siendo el agua el reactivo (B).
A su vez, "𝑘" se postula como:
5867,1 𝑚3 (4)
𝑙𝑛(𝑘) = − + 17,828 (𝑇𝑒𝑛𝐾𝑦𝑘𝑒𝑛 )
𝑇 𝑘𝑚𝑜𝑙𝑚𝑖𝑛
Hint: Suponga el reactor opera con un mezclado perfecto.
1. Plantee todos los balances de materia del proceso. (25 puntos)
2. Desarrolle una ecuación algebraica que relacione la concentración del anhídrido en el tanque con
el tiempo y el producto obtenido. (25 puntos)
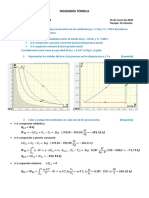
3. Asumiendo que la reacción ocurre a 20 °C. Calcule la concentración de producto a los 7 minutos.
(25puntos)
4. Si 𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 𝑛 ∙ 𝑉 , evalúe cómo varía la expresión obtenida en 2 considerando 𝑛 = 0. (25 puntos)
IQA126 – 2020-2 – Taller 09
Solución
1 - Plantee todos los balances de materia presentes en el proceso.
1
𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉 = 𝑟𝐵 = 𝑟𝐶
2
Balance para el reactivo anhídrido acético(A):
𝑑𝑀𝐴
= −𝑟𝐴
𝑑𝑡
𝑑𝑀𝐴
= −𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉
𝑑𝑡
Balance para el agua (B):
𝑑𝑀𝐵
= −𝑟𝐵
𝑑𝑡
𝑑𝑀𝐵
= −𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉
𝑑𝑡
Balance para el producto deseado ácido acético (C):
𝑑𝑀𝐶
= +𝑟𝐶
𝑑𝑡
𝑑𝑀𝐶
= 2 ∙ 𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉
𝑑𝑡
2 - Encuentre una ecuación algebraica que relacione la concentración del anhídrido en el tanque con
el tiempo.
A partir del balance para al anhídrido se tiene:
𝑑𝑀𝐴
= −𝑟𝐴
𝑑𝑡
𝑑𝑀𝐴
= −𝑘 ∙ 𝐶𝐴 ∙ 𝐶𝐵 ∙ 𝑉
𝑑𝑡
Por relación estequiométrica 𝐶𝐴 = 𝐶𝐵
Al suponer un mezclado perfecto, se postula: 𝐶𝐴𝑂𝑢𝑡 = 𝐶𝐴
Luego, el balance de masa viene dado por:
𝑑(𝑉 ∙ 𝐶𝐴 )
= −𝑘 ∙ 𝐶𝐴2 ∙ 𝑉
𝑑𝑡
𝑑(𝐶𝐴 )
= −𝑘 ∙ 𝐶𝐴2
𝑑𝑡
𝑑(𝐶𝐴 ) 5867,1
= −𝑒𝑥𝑝 (− + 17,828) ∙ 𝐶𝐴2
𝑑𝑡 𝑇
IQA126 – 2020-2 – Taller 09
La densidad es constante a lo largo del tiempo, dado que la temperatura y la presión no varían. De igual
manera, el volumen se mantiene constante al tratarse de liquidos.
𝐶𝐴 ′ 𝑡′
𝑑(𝐶𝐴 ) 5867,1
∫ 2 = −𝑒𝑥𝑝 (− 𝑇
+ 17,828) ∙ ∫ 𝑑𝑡
𝐶𝐴0 𝐶𝐴 0
1 1 5867,1
− ′+ = −𝑒𝑥𝑝 (− + 17,828) ∙ 𝑡 ′
𝐶𝐴 𝐶𝐴0 𝑇
−1
1 5867,1
𝐶𝐴 (𝑡) = ( + 𝑒𝑥𝑝 (− + 17,828) ∙ 𝑡 ′ )
𝐶𝐴0 𝑇
3- Asumiendo que la reacción ocurre a 20 °C. Calcule la concentración de producto a los 7 minutos.
La concentración del producto dependerá del avance de la reacción, de la siguiente forma:
(𝐶𝐻3 𝐶𝑂)2 𝑂(𝑙) + 𝐻2 𝑂(𝑙) → 2𝐶𝐻3 𝐶𝑂𝑂𝐻(𝑙)
Reemplazando en la ecuación anteriormente encontrada:
𝑇 = (20 + 273,15)𝐾
𝑡 ′ = 7𝑚𝑖𝑛
𝑘𝑚𝑜𝑙
𝐶𝐴0 [=]
𝑚3
𝑘𝑚𝑜𝑙
𝐶𝐴0 = 0,49
𝑚3
𝑘𝑚𝑜𝑙
Así, la concentración de 𝐶𝐴 va a ser 0,3537 𝑚3
Luego como está contenida en el mismo volumen por relación estequiométrica
𝑘𝑚𝑜𝑙
𝐶𝐶 = 2(𝐶𝐴0 − 𝐶𝐴 ) = 0,2726
𝑚3
4- Si 𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 𝑛 ∙ 𝑉 , evalúe cómo varían la expresión obtenida en 2 considerando un n=0.
Para 𝑛 = 0:
𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 0 ∙ 𝑉
𝑟𝐴 = 𝑘 ∙ 𝑉
Así, se tendrá que
IQA126 – 2020-2 – Taller 09
𝑑(𝑉 ∙ 𝐶𝐴 )
= −𝑘 ∙ 𝑉
𝑑𝑡
𝑑(𝐶𝐴 )
= −𝑘
𝑑𝑡
𝐶𝐴 ′ 𝑡′
5867,1
∫ 𝑑(𝐶𝐴 ) = −𝑒𝑥𝑝 (− + 17,828) ∙ ∫ 𝑑𝑡
𝐶𝐴0 𝑇 0
5867,1
𝐶𝐴′ − 𝐶𝐴0 = −𝑒𝑥𝑝 (− + 17,828) ∙ 𝑡 ′
𝑇
5867,1
𝐶𝐴 (𝑡) = −𝑒𝑥𝑝 (− + 17,828) ∙ 𝑡 + 𝐶𝐴0
𝑇
A medida que disminuye el valor de n, se incrementa la tasa de cambio de la concentración en el tiempo,
puesto que el valor de 𝐶𝐴 deberá ir disminuyendo a lo largo que transcurre la reacción, ya que el reactivo
se está consumiendo.
IQA126 – 2020-2 – Taller 09
Rubrica de evaluación
Pregunta No logrado Logro bajo Logro alto Logrado
Plantee todos los No logra Faltan dos Falta al menos Plantea
balances de materia plantear componentes en un componente correctamente
del proceso. correctamente los balances en los balances los balances para
ningún balance propuestos y/o propuestos y/o todos los
para los existe error en existe error en componentes del
componentes dos de los uno de los sistema.
del sistema. balances balances (25 puntos)
(0 puntos) (9 puntos) (18 puntos)
Desarrolle una No determina Determina una Determina una Determina
ecuación algebraica una expresión expresión que expresión que correctamente
que relacione la que relacione las relaciona las relaciona las una ecuación
concentración del variables del variables del variables del algebraica que
anhídrido en el proceso y/o lo proceso con 3 o proceso con 1 relacione
tanque con el tiempo hace con 4 o más menos inconsistencia. consistentemente
y el producto inconsistencias. inconsistencias. (18 puntos) las variables
obtenido (0 puntos) (9 puntos) involucradas en el
proceso
(25 puntos)
Asumiendo que la No determina la Determina la Determina la Determina
reacción ocurre a 20 concentración concentración a concentración a correctamente la
°C. Calcule la del producto a los 7 minutos sin los 7 minutos concentración a
concentración de los 7 minutos identificar la identificando los 7 minutos.
producto a los 7 (0 puntos) relación correctamente la (25 puntos)
minutos. estequiométrica. relación
(9 puntos) estequiométrica.
(18 puntos)
Si 𝑟𝐴 = 𝑘 ∙ 𝐶𝐴 𝑛 ∙ 𝑉 , No determina Determina una Determina una Determina
evalúe cómo varía la una expresión expresión que expresión que correctamente la
expresión obtenida que relacione las relaciona las relaciona las expresión que
en 2 considerando variables variables variables relaciona las
𝑛 = 0. involucradas y/o involucradas con involucradas con variables
presenta 4 o más 3 o menos una involucradas
inconsistencias inconsistencias inconsistencia en realizando un
en el proceso. en el proceso. el proceso y/o no pequeño análisis
(0 puntos) (9 puntos) realiza un análisis de las diferencias
respecto al con el resultado
resultado obtenido en 2).
obtenido en 2). (25 puntos)
(18 puntos)
IQA126 – 2020-2 – Taller 09
IQA126 – 2020-2 – Taller 09
También podría gustarte
- Proyecto ReaccionesDocumento5 páginasProyecto ReaccionesOscar ToroAún no hay calificaciones
- Reactor BatchDocumento12 páginasReactor BatchELIZABETHAún no hay calificaciones
- Tercer Parcial FQDocumento28 páginasTercer Parcial FQSOLAún no hay calificaciones
- Clase 1 FQ 3er Parcial PDFDocumento8 páginasClase 1 FQ 3er Parcial PDFRonald Cristhian Mamani CopaAún no hay calificaciones
- Clase 1 FQ 4to Parcial PDFDocumento8 páginasClase 1 FQ 4to Parcial PDFAstarot YolicarAún no hay calificaciones
- Examen Final ADocumento14 páginasExamen Final ADann NuñezAún no hay calificaciones
- Previo 9 Estado TransitorioDocumento4 páginasPrevio 9 Estado TransitorioAlejandro Garcia GarciaAún no hay calificaciones
- Clase 4 y 5 FQ 2do Parcial PDFDocumento19 páginasClase 4 y 5 FQ 2do Parcial PDFRonald Cristhian Mamani CopaAún no hay calificaciones
- Fisico Quimica Resolucion de Ejercicio AtkinsDocumento1 páginaFisico Quimica Resolucion de Ejercicio Atkinsgabriela davalosAún no hay calificaciones
- Clase 1 FQ 1er ParcialDocumento8 páginasClase 1 FQ 1er ParcialChatoSilvaLoayza100% (2)
- 1er P Aux PabloDocumento84 páginas1er P Aux Pablosergio alconAún no hay calificaciones
- Solucionario Practica de Equlibrio QuimicoDocumento12 páginasSolucionario Practica de Equlibrio QuimicoCarlos DelafuenteAún no hay calificaciones
- Tarea Unidad 5Documento10 páginasTarea Unidad 5Marcelo BenavidesAún no hay calificaciones
- EstáticaFluidos SolucionarioDocumento38 páginasEstáticaFluidos SolucionarioGabriel Gamarra LimayAún no hay calificaciones
- Guia de Ejercicios 3Documento6 páginasGuia de Ejercicios 3Jhoselyn Pijuan ViscarraAún no hay calificaciones
- Sustentacion Ejercicio Del ParcialDocumento4 páginasSustentacion Ejercicio Del ParcialAndres Eduardo Zarza HernandezAún no hay calificaciones
- Reactor para Producción de EtanolDocumento6 páginasReactor para Producción de EtanolHugo MárquezAún no hay calificaciones
- ReactorTubularDocumento8 páginasReactorTubularLeidy ToroAún no hay calificaciones
- Informe (3) - 3Documento8 páginasInforme (3) - 3Alejandro Daniel SonziniAún no hay calificaciones
- Taller 2 Termodinamica 2.0Documento10 páginasTaller 2 Termodinamica 2.0Ana Karolina Valeria PalenciaAún no hay calificaciones
- Primera Practica TermoDocumento19 páginasPrimera Practica TermoIsmael Escobar AlvaAún no hay calificaciones
- Martes 28 de Mayo Del 2019 10:30 H, Sem 2019-2Documento4 páginasMartes 28 de Mayo Del 2019 10:30 H, Sem 2019-2Alfonso PalaciosAún no hay calificaciones
- Problema de Balance de Masa ResueltoDocumento5 páginasProblema de Balance de Masa ResueltoJunior Mas Aguilar100% (1)
- Practica Del Ing Boris de FisicoquimicaDocumento6 páginasPractica Del Ing Boris de FisicoquimicaJose Gomez Alvarez50% (2)
- Previo 4Documento18 páginasPrevio 4Cristian UrielAún no hay calificaciones
- Guia 3er ParcialDocumento7 páginasGuia 3er ParcialRAQUEL CHACÓN JARRO0% (1)
- Taller Termodinamica 3Documento16 páginasTaller Termodinamica 3Katrine RocaAún no hay calificaciones
- Version Final Primer TallerDocumento10 páginasVersion Final Primer TallerJayder FontalvoAún no hay calificaciones
- Tarea3 TD GaelFernandoRodriguezLopez C2G2Documento4 páginasTarea3 TD GaelFernandoRodriguezLopez C2G2Rodríguez López Gael FernandoAún no hay calificaciones
- MONOGRAFÍA 1-PI225B-Grupo 3Documento31 páginasMONOGRAFÍA 1-PI225B-Grupo 3daniel angel carhuatanta fuñoAún no hay calificaciones
- Problemario 2PDocumento122 páginasProblemario 2PXimena OrtizAún no hay calificaciones
- Ejercicio 8.60: Primero Investigamos Las Ecuaciones Con Las Que Se Nos Indica TrabajarDocumento7 páginasEjercicio 8.60: Primero Investigamos Las Ecuaciones Con Las Que Se Nos Indica TrabajarLilia JimenezAún no hay calificaciones
- 2020-01-16 Problema 1 SOLUCION Rev01Documento2 páginas2020-01-16 Problema 1 SOLUCION Rev01Unai JimenezAún no hay calificaciones
- Clase 3 FQ 2do Parcial PDFDocumento10 páginasClase 3 FQ 2do Parcial PDFRonald Cristhian Mamani CopaAún no hay calificaciones
- Unidad 5. GasesDocumento8 páginasUnidad 5. GasesFernando PadillaAún no hay calificaciones
- Unidad 5. GasesDocumento8 páginasUnidad 5. Gasescarlosp7682Aún no hay calificaciones
- Hoja de Fórmulas PsicrometríaDocumento3 páginasHoja de Fórmulas Psicrometríamarco cruzAún no hay calificaciones
- Clase 20-06-2022Documento3 páginasClase 20-06-2022Eriica MendozaAún no hay calificaciones
- Descomposición de FosfinaDocumento3 páginasDescomposición de FosfinaDavid Ponce RochaAún no hay calificaciones
- Informe Reactor Batch AdiabaticoDocumento26 páginasInforme Reactor Batch AdiabaticoAntonio Eduardo Manchego ChamorroAún no hay calificaciones
- Pre5 - César Ramírez336145Documento7 páginasPre5 - César Ramírez336145Alvarez Mendez JoanaAún no hay calificaciones
- Problema 4. DestilaciónDocumento19 páginasProblema 4. DestilaciónCarlosm Mata DiazAún no hay calificaciones
- Simulacion WordDocumento13 páginasSimulacion WordVanne AmpaaranAún no hay calificaciones
- Calculo de Fugacidad para Mezclas en Fortran 95 Usando El Metodo de NewtonDocumento25 páginasCalculo de Fugacidad para Mezclas en Fortran 95 Usando El Metodo de NewtonRafael Loza Garcia100% (1)
- Ejercicios - Equilibrio Químico (Soluciones)Documento11 páginasEjercicios - Equilibrio Químico (Soluciones)Jefferson ConzaAún no hay calificaciones
- TermodinamicaDocumento21 páginasTermodinamicaEnrique EsquivelAún no hay calificaciones
- Preparaduría 9 - Termodinamica IIDocumento16 páginasPreparaduría 9 - Termodinamica IIJuan Diego LandaetaAún no hay calificaciones
- Tarea Reactores 1Documento7 páginasTarea Reactores 1Morelia MartínezAún no hay calificaciones
- Ejercicios de Aplicacion de Cinematica de Fluidos-Ynoñan (Autoguardado)Documento9 páginasEjercicios de Aplicacion de Cinematica de Fluidos-Ynoñan (Autoguardado)gianedgarAún no hay calificaciones
- Goche Per4ales Frank Paul - PC5 - PI355ADocumento9 páginasGoche Per4ales Frank Paul - PC5 - PI355AYEFERSON RAMIREZ OSCCOAún no hay calificaciones
- Corrección Parcial (2029)Documento14 páginasCorrección Parcial (2029)Emel Navarro MurgasAún no hay calificaciones
- Bce de Simple Efecto Evaporación - Problema - Amarillo - Jesus - Castillo - ValenteDocumento10 páginasBce de Simple Efecto Evaporación - Problema - Amarillo - Jesus - Castillo - ValenteJesús CastilloAún no hay calificaciones
- Fisica Examenes Virtuales ZeusDocumento14 páginasFisica Examenes Virtuales ZeusIsabel VargasAún no hay calificaciones
- Rodriguez Cuno Anthony HerbertDocumento17 páginasRodriguez Cuno Anthony HerbertVilma CarbajalAún no hay calificaciones
- Unidad 1 - EjerciciosDocumento9 páginasUnidad 1 - EjerciciosKevin Damián Morocho PorrasAún no hay calificaciones
- TermoDocumento16 páginasTermoChato Alarcon CharlaixAún no hay calificaciones
- Sobre Nilálgebras Conmutativas de Potencias AsociativasDe EverandSobre Nilálgebras Conmutativas de Potencias AsociativasAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Elemento N°3 Procedimiento de Identificacion de Peligro v2Documento19 páginasElemento N°3 Procedimiento de Identificacion de Peligro v2jfuenzalidagAún no hay calificaciones
- Mapa RyO I Cuatrim 2022Documento1024 páginasMapa RyO I Cuatrim 2022Steven RomeroAún no hay calificaciones
- Xasxsa PDFDocumento1 páginaXasxsa PDFRobertoTorreesAún no hay calificaciones
- Xasxsa PDFDocumento1 páginaXasxsa PDFRobertoTorreesAún no hay calificaciones
- Anexo 1.1. Matriz de Riesgos Consolidada de Procesos 2018-AjustadoDocumento340 páginasAnexo 1.1. Matriz de Riesgos Consolidada de Procesos 2018-Ajustadoheidy chavezAún no hay calificaciones
- VAN TIR Ej 2023 01Documento3 páginasVAN TIR Ej 2023 01RobertoTorreesAún no hay calificaciones
- Xasxsa PDFDocumento1 páginaXasxsa PDFRobertoTorreesAún no hay calificaciones
- Carolus Et Al 2018 - A Bottom-Up Approach To Environmental Cost-Benefit Analysis Es PDFDocumento26 páginasCarolus Et Al 2018 - A Bottom-Up Approach To Environmental Cost-Benefit Analysis Es PDFRobertoTorreesAún no hay calificaciones
- Pauta Certamen I FinalDocumento34 páginasPauta Certamen I FinalRobertoTorreesAún no hay calificaciones
- Experiencia 5 Lab 120 22020Documento3 páginasExperiencia 5 Lab 120 22020RobertoTorreesAún no hay calificaciones
- 2ºexp. Virtual - FIS1302021Documento3 páginas2ºexp. Virtual - FIS1302021RobertoTorreesAún no hay calificaciones
- Carolus Et Al 2018 - SiuDocumento14 páginasCarolus Et Al 2018 - SiuRobertoTorreesAún no hay calificaciones
- Experiencia 7 120 2S2020Documento2 páginasExperiencia 7 120 2S2020RobertoTorreesAún no hay calificaciones
- Manual Classroom PDFDocumento37 páginasManual Classroom PDFAnabel Elisa LoyraAún no hay calificaciones
- Guia Experiencia 2 IQA221Documento10 páginasGuia Experiencia 2 IQA221RobertoTorreesAún no hay calificaciones
- Guia Experiencia 2 IQA221Documento10 páginasGuia Experiencia 2 IQA221RobertoTorreesAún no hay calificaciones
- Flujo en Cañerías - Repaso y AplicaciónDocumento18 páginasFlujo en Cañerías - Repaso y AplicaciónCarlos RomeroAún no hay calificaciones
- 2ºexp. Virtual - FIS1302021Documento3 páginas2ºexp. Virtual - FIS1302021RobertoTorreesAún no hay calificaciones
- IQA126 Taller 10 - SoluciónDocumento6 páginasIQA126 Taller 10 - SoluciónRobertoTorreesAún no hay calificaciones
- Flujo en Cañerías - Repaso y AplicaciónDocumento18 páginasFlujo en Cañerías - Repaso y AplicaciónCarlos RomeroAún no hay calificaciones
- 3000 Palabras Mas Usadas en InglesDocumento20 páginas3000 Palabras Mas Usadas en Inglespcorvinos71% (21)
- Clase 08 Balances de Materia en Sistemas ReaccionantesDocumento18 páginasClase 08 Balances de Materia en Sistemas ReaccionantesRobertoTorreesAún no hay calificaciones
- IQA126 Taller 01Documento2 páginasIQA126 Taller 01RobertoTorreesAún no hay calificaciones
- BosquesDocumento3 páginasBosquesRobertoTorreesAún no hay calificaciones
- Documento 6Documento15 páginasDocumento 6RobertoTorreesAún no hay calificaciones
- BosquesDocumento3 páginasBosquesRobertoTorreesAún no hay calificaciones
- Rutina Lunes-ViernesDocumento2 páginasRutina Lunes-ViernesRobertoTorreesAún no hay calificaciones
- Guía de Ejercicios Mancuerna 10 KGDocumento3 páginasGuía de Ejercicios Mancuerna 10 KGRobertoTorreesAún no hay calificaciones
- Experimento 7 - K - Vi - 3-4Documento4 páginasExperimento 7 - K - Vi - 3-4RobertoTorreesAún no hay calificaciones
- Guia IAE 2018 - 1ra ParteDocumento2 páginasGuia IAE 2018 - 1ra ParteLucy KarsteinAún no hay calificaciones
- Informe de La Obra de SaneamientoDocumento11 páginasInforme de La Obra de SaneamientoPaolo PautratAún no hay calificaciones
- Calculo RelacionalDocumento22 páginasCalculo RelacionalDULCE ANDREA ESPINOSA PEREZAún no hay calificaciones
- Clase 1 Primavera Risk AnalysisDocumento70 páginasClase 1 Primavera Risk AnalysisMarcoReynaAún no hay calificaciones
- .archivetempNACE No. 2 SSPC SP 10 Near White - Copy - En.esDocumento6 páginas.archivetempNACE No. 2 SSPC SP 10 Near White - Copy - En.esKevin SaldañaAún no hay calificaciones
- MANUAL DE PRÁCTICAS DE LABORATORIOplc13Documento10 páginasMANUAL DE PRÁCTICAS DE LABORATORIOplc13Cesar Yucra AristaAún no hay calificaciones
- Carlos Gonzales Alanes, PresentacionDocumento25 páginasCarlos Gonzales Alanes, PresentacionRonald Borda SalinasAún no hay calificaciones
- Operador de TurismoDocumento5 páginasOperador de TurismoColegio Andres belloAún no hay calificaciones
- Rectificador de TracciónDocumento8 páginasRectificador de TracciónAndre AguilarAún no hay calificaciones
- Manual para Oficiales de Mesa FIBA ESPAÑOLDocumento104 páginasManual para Oficiales de Mesa FIBA ESPAÑOLcamilo prieto0% (1)
- Lista Sobre Definiciones de Criminología.Documento15 páginasLista Sobre Definiciones de Criminología.Anthony AlmanzarAún no hay calificaciones
- Clase N°2 Canon Minero, Regalias MinerasDocumento24 páginasClase N°2 Canon Minero, Regalias MinerasJoey AbarcaAún no hay calificaciones
- Presas de FabricaDocumento39 páginasPresas de FabricaChoque R. AlberthAún no hay calificaciones
- Revisión de Estructuras y Verificación de Las MismasDocumento5 páginasRevisión de Estructuras y Verificación de Las MismasJavier BanquezAún no hay calificaciones
- Chesterton, Gilbert K. - Hombrevida (O Hombre Vivo) (Español) PDFDocumento131 páginasChesterton, Gilbert K. - Hombrevida (O Hombre Vivo) (Español) PDFBrujita2010100% (5)
- Media KIT Revista Norte Minero 2014Documento5 páginasMedia KIT Revista Norte Minero 2014Lance EspinozaAún no hay calificaciones
- Funcion y Significado de La Historia de La ArquitecturaDocumento2 páginasFuncion y Significado de La Historia de La ArquitecturaAndrea Cervantes100% (1)
- Fuente Regulada 0 A 15V - 2A (Protección Contra Cortocircuitos)Documento2 páginasFuente Regulada 0 A 15V - 2A (Protección Contra Cortocircuitos)osmar rafael monsalve valenciaAún no hay calificaciones
- Pec2017 18Documento6 páginasPec2017 18Fran Sánchez IzquierdoAún no hay calificaciones
- Estructura de La Lengua 1Documento11 páginasEstructura de La Lengua 1El Tona100% (1)
- Introducción A La LógicaDocumento28 páginasIntroducción A La LógicaHesed S. CisnerosAún no hay calificaciones
- Prácticas Profesionalizantes ANTECEDENTES ASO ARG EMP 13Documento64 páginasPrácticas Profesionalizantes ANTECEDENTES ASO ARG EMP 13rafael ernestoAún no hay calificaciones
- CJ - Un Show Más Wiki - FANDOM Powered by WikiaDocumento7 páginasCJ - Un Show Más Wiki - FANDOM Powered by WikiaIntel_Pentium_IAún no hay calificaciones
- Sílabo 2019-I Planificacion y Control de Obras CivilesDocumento6 páginasSílabo 2019-I Planificacion y Control de Obras CivilesAlberth Maquera100% (1)
- CATALOGOMÁQUINASDocumento22 páginasCATALOGOMÁQUINASJose QuispeAún no hay calificaciones
- Anormalidades en Los Sistemas Electricos de PotenciaDocumento4 páginasAnormalidades en Los Sistemas Electricos de Potenciajuan kovanenAún no hay calificaciones
- Entrevista OVDocumento6 páginasEntrevista OVKarla CoronelAún no hay calificaciones
- Tecnologia de La Madera I PresentacionDocumento53 páginasTecnologia de La Madera I Presentacionmathewdj95Aún no hay calificaciones
- Tarea 2 Empresa 2Documento4 páginasTarea 2 Empresa 2ferdy nehemias fuentesAún no hay calificaciones
- Letra TDocumento8 páginasLetra TConsuelito M Muñoz MellaAún no hay calificaciones