Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica 2 Purificacion LDH
Cargado por
Miguel Angel Vázquez PérezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica 2 Purificacion LDH
Cargado por
Miguel Angel Vázquez PérezCopyright:
Formatos disponibles
Universidad Nacional Autónoma de México
Facultad de Química. Departamento de Bioquímica
Laboratorio de Bioquímica Experimental)
“Purificación de la enzima lactato deshidrogenasa de músculo esquelético de
pollo”
Equipo 5.Integrantes: Vázquez Pérez Miguel Ángel
RESUMEN: desarrolló un método experimental
No existe un procedimiento único para que va desde la obtención de la
la purificación de una enzima, esto enzima a partir de músculo
depende del uso final que se le dará a esquelético de pollo, hasta su
la proteína de interés y de las purificación y revisión de la actividad
propiedades que pueda tener para enzimatica que presenta para valorar
aprovecharlas en cada paso de qué tan eficaz fue nuestro proceso de
purificación. purificación.
Generalmente se procede a purificar Utilizando técnicas como precipitación
una enzima para poder precisar su por salado, cromatografía de
secuencia de aminoácidos, investigar intercambio iónico
su función bioquímica, para un uso
posterior en aplicaciones terapéuticas
o biotecnológicas o para establecer
relaciones evolutivas.
La enzima lactato deshidrogenasa
(LDH) es una proteína constituida por
cinco uso enzimas diferentes que
canalizan la interconversión de L-
lactato y piruvato. La LDH está
presente en el citoplasma de todos los
tejidos humanos con las
concentraciones más elevadas en el
hígado, el corazón y el músculo
esquelético, y más bajos en los
eritrocitos, el páncreas, riñón y INTRODUCCIÓN
estómago. En muchas aplicaciones
experimentales es necesario disponer
A partir de las diferentes propiedades de proteínas purificadas, incluyendo
físico-químicas que presenta la LDH, estudios estructurales y ensayos
como su peso molecular, punto bioquímicos in vitro. Las proteínas
isoeléctrico, solubilidad, estabilidad y pueden ser obtenidas de tejidos o, más
unión específica a ligandos se comúnmente, sobre expresándose en
algún organismo modelo como pueden objetivo incluyen la centrifugación
ser las bacterias, las levaduras o las diferencial y la centrifugación en
células de mamífero en cultivo. La gradiente de densidad, que separan
purificación de proteínas implica orgánulos y otras estructuras
aislarlas a partir de su fuente en base a subcelulares en base a diferencias en
diferencias en sus propiedades físico- tamaño y/o densidad, y la
químicas. El objetivo de un esquema de centrifugación en equilibrio de
purificación es retener la mayor densidad, es una técnica poderosa para
cantidad de proteína de interés activa separar orgánulos y macromoléculas en
con el menor número de base a las diferencias de densidad.
contaminantes. Otras técnicas biológicas que han sido
La consideración más importante en el muy útiles para aislar y purificar
desarrollo de un esquema para componentes subcelulares incluyen la
purificar una proteína son las cromatografía y la electroforesis.
aplicaciones que se pretenden dar a Cromatografía es un término general
esa proteína. Tanto la cantidad como que incluye una variedad de técnicas en
la calidad de la proteína deben ser las que se fracciona progresivamente
suficientes para el análisis una mezcla de moléculas mientras la
experimental. Además, se debe tener solución fluye a través de una fase
en cuenta información acerca del inmóvil y absorbente, contenida
comportamiento de la proteína, ya que generalmente en una columna. Las
se requiere del correcto plegamiento técnicas cromatográficas separan
de la proteína para poder estudiarla. moléculas en base al tamaño, la carga o
Durante la purificación, y subsiguiente la afinidad por moléculas o grupos
almacenamiento de la proteína, funcionales específicos.
pueden ocurrir muchos procesos que Por otro lado. la electroforesis hace
afecten su calidad: desnaturalización, referencia a diversas técnicas
agregación, degradación y pérdida de relacionadas que utilizan un campo
función. Un planeamiento cuidadoso eléctrico para separar moléculas en
que permita purificar la proteína tan base a su movilidad. El ritmo al que
rápido como sea posible y bajo las cualquier molécula se mueve durante la
condiciones que más promueven la electroforesis depende de su carga y de
estabilidad de la proteína maximizará su tamaño. El medio más común para la
las posibilidades de realizar una separación electroforética de proteínas y
purificación exitosa. ácidos nucleicos es un gel de agarosa o
La bioquímica dio un gran paso de poliacrilamida.
adelante con el desarrollo de la Los ensayos de actividad permiten
centrifugación como método para evaluar la pureza y el rendimiento de
separar y aislar estructuras una enzima, así como su actividad
subcelulares y macromoléculas en base cinética. Esta se determina midiendo la
a su tamaño, forma, y/o densidad, cantidad de sustrato que desaparece o
proceso denominado fraccionamiento bien de producto que se forma por
subcelular. Las técnicas de unidad de tiempo.
centrifugación usadas para este La LDH es una enzima que se clasifica
como óxido-reductasa por catalizar una sustrato. La concentración de producto
reacción redox. Participa en el no cambia con respecto al tiempo.
metabolismo anaerobio de la glucosa, la
reacción que cataliza es la conversión HIPÓTESIS
reversible de lactato a piruvato en las Se realizará la purificación de una
células cuando la tensión de oxígeno es enzima como la lactato
baja y la demanda de ATP es alta. deshidrogenasa que se obtendrá del
En la reacción se pierden dos electrones músculo esquelético de pollo por
del NADH, el cual funge como coenzima medio de métodos como la
de la reacción, oxidándose a NAD+, es precipitación por salado y
justo esta reacción en la cual se basa el cromatografía de intercambio iónico
ensayo de actividad de la LDH, pues se esperando tener una obtención de
detecta el cambio de absorción del concentraciones cuantificables
NADH y el NAD+. tomando en cuenta que el nivel de
El NADH es una molécula que absorbe pureza dependerá de la buena
a 340 nm mientras que el NAD+ no aplicación de los métodos .
absorbe a esa longitud. Por tanto la
actividad de la enzima se detecta como OBJETIVO GENERAL
una disminución en la absorción a 340
nm, pues el NADH va desapareciendo Basándonos en propiedades
debido a su conversión a la forma fisicoquímicas de la proteína Lactato
oxidada. Deshidrogenasa (LDH) de músculo de
Cuando se realizan ensayos temporales pollo como carga , punto isoeléctrico,y
se obtienen gráficos que presentan por afinidad, podemos relacionarlas y
lo general tres fases. La primera fase utilizar diferentes técnicas para
ocurre generalmente durante el primer purificar la proteína estudiada.
segundo, en esta fase denominada
transitoria suelen ocurrir las reacciones OBJETIVO
de formación del o los intermediarios de
vida corta, y se puede evaluar el número ● Obtener la mayor cantidad de
de pasos que limitan la velocidad de la proteína funcional con el menor
enzima, en la fase dos en la segunda número de contaminantes, en el
fase, la concentración de producto se menor número de pasos
incrementa linealmente conforme el posible, aprovechando sus
tiempo transcurre. La velocidad inicial de propiedades físico químicas.
una reacción ocurre en los primeros ● Determinar el peso molecular
minutos de la reacción, una relación de la proteína purificada.
lineal que se mantiene cuando el
consumo de sustrato no va más allá del METODOLOGÍA
5% de la concentración inicial, Se llevó a cabo la metodología
finalmente en la fase 3 se produce por descrita en : Sánchez Nieto, Dra.
cambios que generalmente se deben al Sobeida.“Manual de prácticas de
decremento en la concentración de Bioquímica experimental (0141)”
Facultad de Química. Departamento
de Bioquímica 2013. Editora: Dra. Homogeneizado F1 16.5
Nahieli Greaves Fernández.pp 9- Precipitación
F2 17.0
11,14-,17,19-21. 55% (NH4)2SO4
Precipitación
F3 2.2
RESULTADOS 75% (NH4)2SO4
Parte 1 . Extracción y precipitación Filtración en gel F4 0.1
por salado
Cromatografía Fracción
1.0
Se obtuvo la fracción 0 de afinidad A, B Y C
Se obtuvo la fracción 1
( Homogeneizado total) Tabla 2 Concentración de proteína calculada por la
absorbancia a 280nm
Precipitación con (NH4)2SO4
Tubo Abs. Conc.
FRACCIÓN 3 (mcg/mcL)
Parte 2 . Purificación por F1 0.385 0.583
cromatografía y de afinidad
F2 0.133 0.201
Desalado mediante cromatografía de
exclusión molecular (Fracción 4 ) F3 0.560 0.848
Purificación por cromatografía de a F4 0.069 0.104
afinidad .
FPA -0.194 -0.294
Se trabajó con la fracción f3 obtenida
FPB 0.007 0.010
de prácticas anteriores
Parte 3 . Determinación de la FPC 0.566 0.086
concentración de proteínas
Determinación por el método de
Tabla .3 Determinación de la concentración de proteína de
absorbancia a 280nm. las fracciones obtenidas durante los diferentes pasos de la
Tabla 1:Métodos de purificación y fracciones purificación de la LDH de músculo esquelético de pollo.
obtenidas para la enzima LDH
Métodos Fracciones Fracción Dilución Volúmen ensayo Branford Abs
(mcL)+ H2O(mcL) (mcL)
Rotura de membranas F0
F1 1:100 40+760 200 0.745
y posterior filtración
F2 1:50 40+760 200 0.811
Centrifugación F1
(Sobrenadante)
F3 1:100 10+790 200 0.476
Precipitación con 55% F2
(NH4)2SO4 F4 1:100 20+780 200 0.480
Precipitación con 75% F3 FPA SD 10+790 200 0.530
(NH4)2SO4
FPB SD 10+790 200 0.559
Cromatografía de F4
exclusión molecular FPC SD 10+790 200 0.479
Cromatografía de FP
afinidad Tabla .4 Contenido de proteína a 595nm
Tubo Vol .de Abs. Contenido
ensayo de proteína
Tabla 1.2 Volúmen de cada fracción obtenida.
(mcL) (mcg/mcL)
Fracción Volumen F1 40 0.745 19.03
Proceso
obtenida fracción (mL)
F2 40 0.811 10.36
Inicio F0 ---
F3 10 0.476 48.39
F4 20 0.480 24.40
FPA 10 0.530 0.5396
FPB 10 0.559 0.5695
FPC 10 0.479 0.4870
Tabla 3. Concentración de proteína en cada una de las
fracciones del proceso de purificación.
Fracción Proteína enl Volumen Concentración Rf =(Distancia que migra la proteína)/(Distancia que migr
la fracción total de la de cada Rf=(1.6 cm)/(4.4 cm )=0.36
(mg) fracción(m fracción
L) (mg/mL)
Para calcular el PM de nuestras fracciones :
F1 304.48 16.5 19.03 Log Rf= -1.1121x-1.8734
PM= antilog[-1.1121(0.36)+1.8734]
F2 176.12 17.0 10.36 PM= 29.71
para finalmente extrapolar conociendo el peso
F3 106.46 2.2 48.34
molecular de la LDH de nuestras fracciones.
F4 2.44 0.1 24.40 El resultado obtenido fue de 29.71 kDa
para nuestras fracciones purificadas..
FA 0.5396 1.0 0.5396
FB 0..5695 1.0 0.5694 𝐺𝑟𝑎𝑑𝑜 𝑝𝑢𝑟𝑒𝑧𝑎=( 𝐴𝑐𝑡𝑖𝑣𝑖𝑑𝑎𝑑 𝑒𝑛𝑧𝑖𝑚á𝑡𝑖𝑐𝑎 𝑒𝑠𝑝𝑒𝑐í𝑓𝑖𝑐𝑎
𝐹(𝑛))/( Actividad enzimática específica F1)
FC 0.4870 1.0 0.4870 Rendimiento=( 𝐴𝑐𝑡𝑖𝑣𝑖𝑑𝑎𝑑 𝑇𝑜𝑡𝑎𝑙 𝐹(𝑛))/( Actividad
Total F1)×100
SEPARACIÓN DE LAS PROTEÍNAS EN GEL DE Ejm. (F 1) 0.2543 mmol/min.ml /0.138
POLIACRILAM,INA -SDS
mmol⇒1.84mmol/min
Rendimiento.4.195mmol/min / 4.195 mmol/min
x100⇒100%
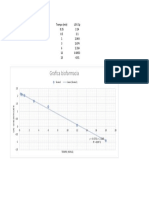
Gráfica 2
Figura 1. Se muestra el proceso de la
purificación de la LDH de músculo de pollo,
partiendo de la F1 hasta las fracciones
purificadas A,B, y C. Las muestras fueron
teñidas con azul de Coomassie.
Con nuestras proteínas separadas se
midieron las distancias que cada una
recorrido y mediante el peso molecular, se
graficó el log de los pesos moleculares de las
proteínas en función de los Rf utilizando la
ecuación de la recta para calcular el PM de
nuestras muestras Tabla 4. Regresión lineal con los datos
obtenidos.
Gráfica 1 Fracción Pendiente obtenida
F1 y = -0.6143x + 1.2674 centrifugación a 7000 RPM(basada en
R² = 0.9916
peso molecular de componentes que
F2 y = -0.1237x + 0.4741 se sedimentaran ) a 4`C durante 10
R² = 0.9998
minutos del homogeneizado con el fin
de clarificar la muestra (fracción 1)
F3 y = 0.0014x + 0.123
R² = 0.0088 Después se llevó a cabo la
F4 y = -0.222x + 1.0985
precipitación selectiva de proteínas
R² = 0.9845 por adición de sulfato de amonio, esta
FA y = -0.3065x + 0.4521 técnica se basa en modificar el
R² = 0.9776
ambiente que rodea la proteína
implicada para que de esta manera
FB y = -0.2953x + 0.5745
R² = 0.8986 precipite en el proceso llamado
“salting out” el cual lleva a cabo un
FC y = -0.2967x + 0.5727 mecanismo en donde la sal establece
R² = 0.9161
puentes de hidrógeno con el agua y al
TABLA 5. Actividad enzimática, total y
hacerlo sustrae el agua de la proteína
específica. ,modificando la conformación de esta
para que no haya exposición de los
Fracción Actividad Actividad Actividad residuos apolares con el
enzimática Total Específica
(mmol/min.m
solvente,formando nuevas
(mmol/min. (mmol/mi
mL) n) g) interacciones que dan lugar a la
formación de plegamientos que llevan
F1 0.2543 4.195 0.0138
a la precipitación y de igual forma a la
F2 0.02560 0.4352 0.00247 eliminación de contaminantes de una
F3 0.00225 0.00495 0.00004652
forma económica.
La precipitación de proteína depende
F4 0.1802 0.01802 0.00738 de sus características iónicas y del
FA 0.004927 0.004927 0.009131 contenido de residuos polares que
tenga.,para precipitar la proteína
FB 0.004747 0.004747 0.00833
Lactato Deshidrogenasa , se utilizó
FC 0.00477 0.0477 0.00979 una saturación del 55% de
( NH4)2SO4 (fracción 2) y en una
DISCUSIÓN segunda secuencia de precipitación se
utilizó una solución al 75%de
En la primera parte de Extracción y saturación de ( NH4)2SO4 con el fin
precipitación por salado , se llevó a de obtener la mayor cantidad de
cabo una homogeneización , que es proteína pura (fracción 3).
un proceso en donde las células o En la tabla 1 se indican los métodos
tejido se lisan en fragmentos de purificación y fracciones obtenidas
pequeños que dan lugar a una para la enzima LDH , en la tabla 1.2 se
suspensión uniforme y estable llamada indican los Volúmenes obtenidos de
homogeneizado , este procedimiento cada fracción .
se llevó hizo en una licuadora , Una vez obtenidas las fracciones se
posteriormente se llevó a cabo una retiró el agente precipitante , en este
caso la sal de sulfato de amonio .,esto utilizamos el método de Bradford, en
se hizo por medio de una el cual leímos las absorbancias a 595
cromatografía de exclusión molecular nm de todas las fracciones del
en donde se utilizó una columna de proceso de purificación. Se obtuvo la
Sephadex G-25 tamaño de poro curva patrón y con la ecuación de la
pequeño ,entonces la sal se queda en recta se obtuvo el contenido de
la columna y la proteína sale por proteína y la concentración de
gravedad ya que esta técnica de proteína. Los resultados de la curva
desalado se basa en la masa, también patrón se muestran en la gráfica 1.
se utilizó un amortiguador que Finalmente se llevó a cabo el método
contiene un buffer de TRIS/HCl pH 8.6 de separación de proteínas utilizando
(20 mM), el cual equilibra el pH en la gel de poliacrilamida-SDS, se
solución , B-mercaptoetanol (0.5mM) determinó que la reacción obtenida
el cual rompe puentes disulfuro de tiene un peso molecular de 29.71 kDa
proteínas ,inhibiendo la oxidación de para nuestras fracciones purificadas al
estas ,lo que es importante para comparar este resultado con el
obtener la proteína intacta. o de reportado en la literatura (35 kDa)
afinidad la cual está basada en el nos damos cuenta que el PM obtenido
peso molecular de la proteína y fue bajo ; esto puede deberse a que
PMSF(1 mM) que es un inhibidor de fue la primera vez que se trabajó con
proteasas, proteínas que interfieren en un gel de este tipo
la purificación de la deshidrogenasa
(fracción 4) CONCLUSIÓN
Posteriormente se llevó a cabo una La parte esencial para poder llevar a
cromatografía de afinidad ,esto con el cabo la purificación de la proteína son
fin de obtener una proteína pura o con las propiedades fisicoquímicas (la
la menor cantidad de contaminantes., solubilidad, la carga iónica, el tamaño
este método se basa en la afinidad molecular y la especificidad de unión a
que tiene la proteína por un ligando en otras biomoléculas) ya que
este caso el azul cibacron al tener una dependiendo de éstas se llevan a
estructura similar al NADH, la LDH se cabo la separación con los distintos
une (ligando-resina) ,en una unión métodos de purificación. Conociendo
Covalente, así cuando la muestra los fundamentos de cada método se
atraviesa la columna de afinidad la pueden optimizar los resultados
proteína se unirá al ligando, la fracción sabiendo que es lo que puede
no absorbida se desechó ya que no favorecer o no la purificación de una
contiene proteína y la LDH se proteína en particular.
despega de la columna con La actividad total de una enzima está
amortiguador de elución. (fracciones relacionada con el rendimiento del
A,B,C). proceso de purificación, conforme se
En la tabla 2 se muestra la avanza en el proceso, el rendimiento
concentración de proteínas basada en va disminuyendo, el cual se ve
el método absorbancia a 280nm. reflejado en una disminución de la
Para monitorear nuestra purificación actividad total de la enzima. De forma
simultánea, el grado de pureza está partir del NADH mediante la reducción
relacionada con la actividad del piruvato a lactato , reacción
específica, un alto grado de pureza se catalizada por la lactato
ve reflejado en una alta actividad deshidrogenasa .El lactato formado
enzimática. por los músculos activos en los
Los resultados obtenidos se vieron vertebrados se transporta por la
afectados debido a que las muestras sangre al hígado en donde se
deben mantenerse a 4°C para evitar la convierte en glucosa durante la
desnaturalización enzimática y nuestro recuperación después de la actividad
caso hubo ocasiones en donde esto física rigurosa.La purificación de la
no se llevó a cabo . enzima lactato deshidrogenasa se
llevó a cabo en cuatro partes. La
primera se llevó a cabo la purificación
de la enzima lactato deshidrogenasa
BIBL (LDH) la cual se extrajo a partir de
LEHNINGER.Albert L. “Principios de pechuga de pollo, mediante un
Bioquímica” Ediciones Omega S.A. 2a. edición
proceso de homogeneización y
1993. pp 400-416.
LOZANO.Teruel.J.A. “Bioquímica para ciencias posteriormente por una centrifugación
de la salud” Editorial: Interamericana Mc Graw diferencial. Para llevar a cabo la
Hill. ej 2 1998. PP.239-244. purificación se utilizaron métodos
Sánchez Nieto, Dra. Sobeida.“Manual de prácticas como precipitación por salado con
de Bioquímica experimental (0141)” Facultad de
sulfato de amonio al 75 %,
Química. Departamento de Bioquímica 2013.
Editora: Dra. Nahieli Greaves Fernández.pp 9- cromatografía de exclusión molecular,
11,14-,17,19-21. cromatografías de afinidad e
intercambio iónico (dependiendo el
Resumen equipo) y finalmente una electroforesis
Desde hace décadas se ha estudiado en gel. Se fueron determinando a lo
el metabolismo celular;como la largo del proceso la concentración de
energía química almacenada en la proteínas que se obtenían en las
glucosa y otras moléculas fracciones recolectadas utilizando el
combustibles se libera para realizar método colorimétrico de Bradford.
trabajo biológico en los organismos. Para esto lo primero que se necesitó
Uno de los procesos más estudiados fue conocer la estructura y
es la glucólisis en donde al degradarse propiedades fisicoquímicas de las
una molécula de glucosa en una serie proteínas ya que es fundamental para
de reacciones catalizadas aplicar las técnicas de purificación
enzimáticamente nos da formación a .Para la segunda parte se realizó un
Piruvato ( compuesto de alta desalado de la muestra mediante
energía ) . Cuando en los tejidos filtración en gel lo que posteriormente
animales no hay oxígeno suficiente nos llevó a una purificación mediante
para mantener la oxidación aeróbica una columna de intercambio iónico.
del piruvato y del 10 NADH(moléculas Continuando con la tercera parte se
con alta energía) producidos en la evaluó el rendimiento a partir de la
glucólisis , el NAD+ se regenera a determinación de la cantidad total de
proteína llevándonos , finalmente a la
cuarta parte en donde se determinó la
pureza al realizar la separación de las
muestras proteicas y su visualización
en un gel de poliacrilamida-SDS. En
esta práctica se realizó la
comprobación de la purificaciòn de la
proteína de interés, utilizando la
cuantificaciòn de la actividad
enzimática, este es uno de los
métodos más utilizados para identificar
una proteína, nos permite también
determinar los parámetros cinéticos
Palabras clave : Enzima LDH,
precipitación, centrifugación,
cromatografía, electroforesis,
purificación proteína cinetica
enzimatica, sustrato, actividad
También podría gustarte
- Curvas Temporal LDHDocumento5 páginasCurvas Temporal LDHKarla ArmendárizAún no hay calificaciones
- Evaluación de La Actividad Genotóxica de La Ciclofosfamida Utilizando La Técnica de Micronúcleos en Médula ÓseaDocumento11 páginasEvaluación de La Actividad Genotóxica de La Ciclofosfamida Utilizando La Técnica de Micronúcleos en Médula ÓseaAxelWarnerAún no hay calificaciones
- Reporte 2. LDHDocumento4 páginasReporte 2. LDHFrancisco Lozano GómezAún no hay calificaciones
- Práctica 2. TransformaciónDocumento1 páginaPráctica 2. TransformaciónYumari Martinez GalvanAún no hay calificaciones
- Actividad Enzimática. Parte Ii. Factores Que Modifican La Actividad de Las Enzimas: Efecto de La Concentración de Sustrato y de Un Inhibidor.Documento3 páginasActividad Enzimática. Parte Ii. Factores Que Modifican La Actividad de Las Enzimas: Efecto de La Concentración de Sustrato y de Un Inhibidor.Pedro SerranoAún no hay calificaciones
- Caso de Hechos 2 Monjaras Elias G40Documento4 páginasCaso de Hechos 2 Monjaras Elias G40FATIMA ITZEL MONJARAS ELIASAún no hay calificaciones
- Práctica 4. ToxicologíaDocumento4 páginasPráctica 4. ToxicologíaMiguel Angel Vázquez PérezAún no hay calificaciones
- Toxi Previo 5Documento2 páginasToxi Previo 5nick270150% (2)
- Practica No8 Reflejos en El Humano.-.Documento14 páginasPractica No8 Reflejos en El Humano.-.Leion UchihaAún no hay calificaciones
- PDF Apendice 1 Practica 1toxicologia CompressDocumento4 páginasPDF Apendice 1 Practica 1toxicologia CompressCarlos Romo MartinezAún no hay calificaciones
- Practica 4 Farmacologia Cardiovascular en Un Sistema SimuladoDocumento1 páginaPractica 4 Farmacologia Cardiovascular en Un Sistema Simuladojesus.checa.xoxotlaAún no hay calificaciones
- Reporte Cápsulas de IndometacinaDocumento6 páginasReporte Cápsulas de IndometacinaAxelWarnerAún no hay calificaciones
- Ápendice 1. Practica 1.toxicologíaDocumento7 páginasÁpendice 1. Practica 1.toxicologíaAkai Tsuki0% (1)
- Fracción S9 (Caracteristicas y Utilidad)Documento1 páginaFracción S9 (Caracteristicas y Utilidad)Andrés Arganis75% (4)
- Práctica 6 Excresión Renal de Ácido Acetilsalicílico en Voluntarios Equipo 5Documento15 páginasPráctica 6 Excresión Renal de Ácido Acetilsalicílico en Voluntarios Equipo 5sighynAún no hay calificaciones
- Conocimiento de Tecnicas Analiticas Parte 1 Fundamentos de EspectrofotometriaDocumento7 páginasConocimiento de Tecnicas Analiticas Parte 1 Fundamentos de EspectrofotometriaEstela RomeroAún no hay calificaciones
- Reporte Cinética Enzimática ACTUAL 2023-1Documento9 páginasReporte Cinética Enzimática ACTUAL 2023-1Alta Gracia ArguellesAún no hay calificaciones
- Práctica 1 Determinación Del Contenido de Humedad de Una Muestra ComercialDocumento5 páginasPráctica 1 Determinación Del Contenido de Humedad de Una Muestra ComercialCarlos Pérez DíazAún no hay calificaciones
- 01 - Practica 2 - Dosis Efectiva 50 en Un Sistema SimuladoDocumento1 página01 - Practica 2 - Dosis Efectiva 50 en Un Sistema Simuladokalu02Aún no hay calificaciones
- Práctica Conductimetría PDFDocumento2 páginasPráctica Conductimetría PDFWendy Núñez BedollaAún no hay calificaciones
- Informe Pseudo Sanger - NinhidrinaDocumento2 páginasInforme Pseudo Sanger - NinhidrinaDaniel OlmosAún no hay calificaciones
- Sintesis de IndolesDocumento2 páginasSintesis de IndolesJose GonzálezAún no hay calificaciones
- Cinetiza EnzimaticaDocumento8 páginasCinetiza EnzimaticaAndy Phy100% (1)
- Ames ClaseDocumento12 páginasAmes Claselester3leonel3Aún no hay calificaciones
- Práctica 8. Influencia de La Temperatura Sobre La Rapidez de La Reacción.Documento14 páginasPráctica 8. Influencia de La Temperatura Sobre La Rapidez de La Reacción.Sara VenturaAún no hay calificaciones
- Cuestionario Previo No 5 Electrolitos FuertesDocumento1 páginaCuestionario Previo No 5 Electrolitos Fuertesjoel100% (1)
- 1.análisis Cuantitativo de Analitos Previa Separación Por Precipitados de Una Muestra de AlCl3 Por El Método de CalcinaciónDocumento2 páginas1.análisis Cuantitativo de Analitos Previa Separación Por Precipitados de Una Muestra de AlCl3 Por El Método de CalcinaciónGerardo Rebollo PimentelAún no hay calificaciones
- Reporte de Pruebas Bioquimicas II Unam FescDocumento8 páginasReporte de Pruebas Bioquimicas II Unam FescJosh OrangeAún no hay calificaciones
- Humedad Exp 1Documento3 páginasHumedad Exp 1Leif_Erikson_Aún no hay calificaciones
- Normalizacion de Kmno4Documento15 páginasNormalizacion de Kmno4Ortega AlessandroAún no hay calificaciones
- Ápendice 1. Practica 1Documento7 páginasÁpendice 1. Practica 1Akai Tsuki0% (1)
- Previo 1Documento5 páginasPrevio 1Daniel ChavarriaAún no hay calificaciones
- Practica No5 Funcion Respiratoria PDFDocumento13 páginasPractica No5 Funcion Respiratoria PDFLeion UchihaAún no hay calificaciones
- Reporte. Acido AscorbicoDocumento9 páginasReporte. Acido AscorbicoCarlos CastilloAún no hay calificaciones
- Absorción de GlucosaDocumento8 páginasAbsorción de GlucosaMiguel AngelAún no hay calificaciones
- Analitica Experimental 1 Practica 2Documento3 páginasAnalitica Experimental 1 Practica 2Fer AlonsoAún no hay calificaciones
- Final GlassmanDocumento33 páginasFinal Glassmannallecitaj33% (3)
- Verificación de Calibración de Material VolumetricoDocumento2 páginasVerificación de Calibración de Material Volumetricorizhy128100% (3)
- DE50 Sedante en RatonesDocumento2 páginasDE50 Sedante en RatonesErick NeoAún no hay calificaciones
- Practica PolarografiaDocumento5 páginasPractica PolarografiaIsra Becerril ZaldivarAún no hay calificaciones
- Practica 6 Lab de FisicaDocumento4 páginasPractica 6 Lab de FisicaRicardo CruzAún no hay calificaciones
- OXIRANOSDocumento4 páginasOXIRANOSSandra OzAún no hay calificaciones
- Estimación de Capsaicina en Chiles Habaneros y Comparación Del Grado de Pungencia Usando La Técnica de Voltamperometría Linea1Documento8 páginasEstimación de Capsaicina en Chiles Habaneros y Comparación Del Grado de Pungencia Usando La Técnica de Voltamperometría Linea1Marianiux Wolff NurmiAún no hay calificaciones
- Manual de Analitica Experimental 2Documento19 páginasManual de Analitica Experimental 2MarcosEduardoMtzAún no hay calificaciones
- Reporte Práctica 9 FisiologíaDocumento13 páginasReporte Práctica 9 FisiologíaZyanya TapiaAún no hay calificaciones
- Determinación de La Ley Experimental de Rapidez.Documento6 páginasDeterminación de La Ley Experimental de Rapidez.thenightfly08160% (5)
- Curva de CalibraciónDocumento4 páginasCurva de CalibraciónALEJANDRO TECOZAUTLA APARICIOAún no hay calificaciones
- Pruebas BioquímicasDocumento6 páginasPruebas BioquímicasMelina ArteagaAún no hay calificaciones
- Farmacologia Practica 1Documento1 páginaFarmacologia Practica 1Nicholas's BarretoAún no hay calificaciones
- Análisis Cuantitativo de Analitos Con Base en Equilibrios RedoxDocumento7 páginasAnálisis Cuantitativo de Analitos Con Base en Equilibrios RedoxDiego Emilio MorettAún no hay calificaciones
- Reporte de Bioensayo de ToxicidadDocumento9 páginasReporte de Bioensayo de ToxicidadDavid Espinosa SuárezAún no hay calificaciones
- Practica 2 Obtención de CumarinaDocumento9 páginasPractica 2 Obtención de CumarinaMauricio Rodríguez100% (2)
- Práctica 01 SeguridadDocumento4 páginasPráctica 01 SeguridadAnn LeyvaAún no hay calificaciones
- Laboratorio 6 - HPLC PDFDocumento2 páginasLaboratorio 6 - HPLC PDFJe RivasAún no hay calificaciones
- Demostración Del Efecto Sinergista y Antagonista en Un Sistema SimuladoDocumento2 páginasDemostración Del Efecto Sinergista y Antagonista en Un Sistema SimuladoMitzi MorenoAún no hay calificaciones
- Practica 2 de Analitica ExperimentalDocumento2 páginasPractica 2 de Analitica ExperimentalHernandez DavidAún no hay calificaciones
- Previo 1. Fundamentos de SolubilidadDocumento5 páginasPrevio 1. Fundamentos de SolubilidadZurisadai Puente100% (1)
- Apuntes Tema 4 - Métodos y Técnicas para El Estudio de Las ProteínasDocumento13 páginasApuntes Tema 4 - Métodos y Técnicas para El Estudio de Las ProteínasChristian García TorresAún no hay calificaciones
- Seccic3b3n3 Curvas Temporales PDFDocumento7 páginasSeccic3b3n3 Curvas Temporales PDFFernando GutiérrezAún no hay calificaciones
- Criterios para El Aislamiento y Purificación de EnzimasDocumento4 páginasCriterios para El Aislamiento y Purificación de EnzimasMario Velasquez100% (1)
- C13 Estructura de InmunoglobulinasDocumento24 páginasC13 Estructura de InmunoglobulinasMiguel Angel Vázquez PérezAún no hay calificaciones
- AcetilcolinaDocumento15 páginasAcetilcolinaMiguel Angel Vázquez PérezAún no hay calificaciones
- La Farmacia en México A Finales Del Siglo XIX PDFDocumento29 páginasLa Farmacia en México A Finales Del Siglo XIX PDFcarlos landero marinAún no hay calificaciones
- Atención FarmacéuticaDocumento1 páginaAtención FarmacéuticaMiguel Angel Vázquez PérezAún no hay calificaciones
- ACh. Colinérgicos y AnticolinérgicosDocumento82 páginasACh. Colinérgicos y AnticolinérgicosMiguel Angel Vázquez PérezAún no hay calificaciones
- Cuestionario Capsulas Blandas TFI 2020-2Documento3 páginasCuestionario Capsulas Blandas TFI 2020-2Miguel Angel Vázquez PérezAún no hay calificaciones
- P2 Farma IIDocumento2 páginasP2 Farma IIMiguel Angel Vázquez PérezAún no hay calificaciones
- Sistema NerviosoDocumento48 páginasSistema NerviosoMiguel Angel Vázquez PérezAún no hay calificaciones
- Evaluación Semestre 2020-2 PDFDocumento1 páginaEvaluación Semestre 2020-2 PDFMiguel Angel Vázquez PérezAún no hay calificaciones
- Práctica 2 Orgánica IIIDocumento2 páginasPráctica 2 Orgánica IIIMiguel Angel Vázquez PérezAún no hay calificaciones
- HeterociclicaDocumento1 páginaHeterociclicaMiguel Angel Vázquez PérezAún no hay calificaciones
- Práctica 3 ORGÁNICA III QFBDocumento2 páginasPráctica 3 ORGÁNICA III QFBMiguel Angel Vázquez PérezAún no hay calificaciones
- Titulaciones PDFDocumento48 páginasTitulaciones PDFLaura GuarguatiAún no hay calificaciones
- SERIE 1 LAB 2020-2 Resuelta PDFDocumento4 páginasSERIE 1 LAB 2020-2 Resuelta PDFMiguel Angel Vázquez PérezAún no hay calificaciones
- Examen ResultadosDocumento2 páginasExamen ResultadosMiguel Angel Vázquez PérezAún no hay calificaciones
- Práctica 4. ToxicologíaDocumento4 páginasPráctica 4. ToxicologíaMiguel Angel Vázquez PérezAún no hay calificaciones
- Analisis Fisicoquimico de CC PDFDocumento25 páginasAnalisis Fisicoquimico de CC PDFDANIBATAAún no hay calificaciones
- Ejercicios Pincipales ResueltoDocumento4 páginasEjercicios Pincipales ResueltoLobito De la lunaAún no hay calificaciones
- Datos Problema E11Documento9 páginasDatos Problema E11Miguel Angel Vázquez PérezAún no hay calificaciones
- Toxicología 2021-1 Grupo 2Documento1 páginaToxicología 2021-1 Grupo 2Miguel Angel Vázquez PérezAún no hay calificaciones
- Viewersecurepdfnu 154 Ok 8 JMDB 0 GPHCC 1 SGK 71835 V 6 JP 2 Te 2160 Dtuodvq 0 GNT 4 Eei 5 RciDocumento4 páginasViewersecurepdfnu 154 Ok 8 JMDB 0 GPHCC 1 SGK 71835 V 6 JP 2 Te 2160 Dtuodvq 0 GNT 4 Eei 5 RciMiguel Angel Vázquez PérezAún no hay calificaciones
- Drug BankDocumento2 páginasDrug BankMiguel Angel Vázquez PérezAún no hay calificaciones
- 30 de Julio Que Signo Es - Buscar Con GoogleDocumento1 página30 de Julio Que Signo Es - Buscar Con GoogleMiguel Angel Vázquez PérezAún no hay calificaciones
- Tema 9 PDFDocumento7 páginasTema 9 PDFRICARDO ANDRES MORGADO PIZARROAún no hay calificaciones
- Grafica CPVSLNDocumento1 páginaGrafica CPVSLNMiguel Angel Vázquez PérezAún no hay calificaciones
- Cuestionario Sesión 3Documento1 páginaCuestionario Sesión 3Miguel Angel Vázquez PérezAún no hay calificaciones
- Libro (2) 2Documento1 páginaLibro (2) 2Miguel Angel Vázquez PérezAún no hay calificaciones
- Ejercicio de DisoluciónDocumento28 páginasEjercicio de DisoluciónMiguel Angel Vázquez PérezAún no hay calificaciones
- Libro (2) 2Documento1 páginaLibro (2) 2Miguel Angel Vázquez PérezAún no hay calificaciones
- TareaDocumento1 páginaTareaMiguel Angel Vázquez PérezAún no hay calificaciones
- Tablas TEMDocumento21 páginasTablas TEMArmando CabreraAún no hay calificaciones
- QB08 Taller IIIDocumento3 páginasQB08 Taller IIISary AtenciaAún no hay calificaciones
- Anexo 1 - Tarea 2Documento14 páginasAnexo 1 - Tarea 2TatisRamirezAún no hay calificaciones
- Lectura 4 CarbohidratosDocumento4 páginasLectura 4 CarbohidratosAngélica María Díaz ChanameAún no hay calificaciones
- Ficha Técnica Ultra 90Documento1 páginaFicha Técnica Ultra 90jose rodriguezAún no hay calificaciones
- TECNICAS INMUNOLÓGICAS - PPSXDocumento25 páginasTECNICAS INMUNOLÓGICAS - PPSXJosé Isaac Molina MoralesAún no hay calificaciones
- Interpretación Análisis SueloDocumento11 páginasInterpretación Análisis SueloKarla TelloAún no hay calificaciones
- Trabajo de Peso EspecificoDocumento27 páginasTrabajo de Peso Especificomilagros llanosAún no hay calificaciones
- Hoja de Seguridad Gel AntibacterialDocumento14 páginasHoja de Seguridad Gel AntibacterialJuan CastañoAún no hay calificaciones
- DrenajeDocumento58 páginasDrenajeLeonardo MirandaAún no hay calificaciones
- Grado Practicas 2 Q InorganicaDocumento82 páginasGrado Practicas 2 Q InorganicaCesarAún no hay calificaciones
- Definicion AireDocumento5 páginasDefinicion AirenorrusAún no hay calificaciones
- La Slocion Pos Pa La Que No La Tiene de QuimicaDocumento8 páginasLa Slocion Pos Pa La Que No La Tiene de QuimicaJuanjoocordoba100% (1)
- 03 Solucionario Campo MagneticoDocumento40 páginas03 Solucionario Campo MagneticoZaburi WsAún no hay calificaciones
- DilataciónDocumento3 páginasDilataciónBarbara AlejandraAún no hay calificaciones
- 14 Principio de ArquímedesDocumento7 páginas14 Principio de ArquímedesJohan RodriguezAún no hay calificaciones
- S07 S14 LAB3 C Soluciones Actividad Laboratorio ReporteDocumento7 páginasS07 S14 LAB3 C Soluciones Actividad Laboratorio ReporteShaen Aliaga0% (1)
- Ensayo de JominyDocumento24 páginasEnsayo de JominyCésar Cruz RuizAún no hay calificaciones
- Pilas GalvanicasDocumento9 páginasPilas GalvanicasJuly Nym NeylaAún no hay calificaciones
- 3.1 AnodizadoDocumento10 páginas3.1 AnodizadoGustavo BecerrilAún no hay calificaciones
- Amercoat 450H E PDFDocumento3 páginasAmercoat 450H E PDFMAR MUAún no hay calificaciones
- Metalurgia 1 Tarea ProblemasDocumento16 páginasMetalurgia 1 Tarea ProblemasKatherine Rojas FernandezAún no hay calificaciones
- Informe Mecanica Fluidos Lab - 5 2 PDFDocumento5 páginasInforme Mecanica Fluidos Lab - 5 2 PDFEilithAún no hay calificaciones
- Matriz - Riesgos Maria DelgadoDocumento9 páginasMatriz - Riesgos Maria DelgadoLucianna Arevalo FunluaAún no hay calificaciones
- Diagrama de Flujo-GlucosaDocumento1 páginaDiagrama de Flujo-GlucosaLivier Alejandra Torres Rueda100% (2)
- E200 Abril 20Documento2 páginasE200 Abril 20jorgeAún no hay calificaciones
- Examen Final Fisicoquimica 18110Documento7 páginasExamen Final Fisicoquimica 18110Maria Teresa Illanes LopezAún no hay calificaciones
- LAB 4 - Grupo C3 - 2Documento9 páginasLAB 4 - Grupo C3 - 2transportesrosa2020Aún no hay calificaciones
- Challenger Noticia LecturónDocumento2 páginasChallenger Noticia Lecturóngrisgando0% (1)
- Practica 4 Identif Aminoacidos Con CuestionarioDocumento8 páginasPractica 4 Identif Aminoacidos Con CuestionarioOsmara Cabello RoldanAún no hay calificaciones