Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe 7-Preparación de Soluciones
Informe 7-Preparación de Soluciones
Cargado por
Yinoska LemusTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe 7-Preparación de Soluciones
Informe 7-Preparación de Soluciones
Cargado por
Yinoska LemusCopyright:
Formatos disponibles
PREPARACIÓN DE SOLUCIONES
Yinoska Lemus barros, Luz Stela Blanco, Roberto Reales, Anderson Arrieta Poveda
Facultad de Ingeniería, Universidad Tecnológica de Bolívar.
Cartagena, Colombia.
lemusyinoska@gmail.com, Luzduranospino@gmail.com , rrealesa2002@hotmail.com , anderson.jhair12332017@gmail.com
En este laboratorio se llevaron a cabo distintos procedimientos en base a los obtenidos mediante el uso de materiales
del laboratorio, de esta manera podríamos hallar incógnitas, por medio de ecuaciones y leyes químicas establecidas.
Se realizaron procedimientos en los cuales se mantenía los moles y gramos de soluto disueltos en agua (H2O), Etc.
Todo esto con el fin de comprender la manera en que las ecuaciones químicas se forman de acuerdo con los demás
compuestos.
Palabras claves: Mezclas, Peso, Solución, Soluto y Solvente.
1. Introducción
Las soluciones en química son mezclas homogéneas de sustancias en semejantes o diferentes etapas de
agregación. La concentración de una solución compone una de sus primordiales características.[ CITATION
jor \l 9226 ] Muchas propiedades de las soluciones dependen únicamente de la concentración. Algunos
ejemplos de soluciones son: agua salada, oxígeno y nitrógeno del aire, el gas carbónico en los refrescos y
todas las propiedades: color, sabor, densidad, punto de fusión y ebullición dependen de las cantidades que
pongamos de las diferentes sustancias. La composición de una solución se debe calcular en términos de
volumen y masa, por ende, es indispensable saber la cantidad de soluto diluido por unidad de volumen o
masa de disolvente, es decir su concentración.[ CITATION ken \l 9226 ]
2. Objetivos
Saber como se prepara una solución y conocer su composición.
Preparar soluciones de diversas concentraciones.
Preparar soluciones por dilución.[ CITATION UTB \l 9226 ]
3. Procedimiento experimental
PRIMERA PARTE
Inicialmente se pesaron 10g de sal (NaCl) en un Beaker de 100mL. Mas tarde se agregó 30 mL de H20 para
que la sal se disolviera. Luego de que la sal se disolviera completamente se pasó a un matraz de 100mL con
ayuda de un embudo y se llenó el resto con agua, para así preparar una solución de sal al 10% en P/V.
SEGUNDA PARTE
Se pesó en un Beaker dicha masa de NaCl para preparar 250mL de una solución de 1M. Luego se agregó 30
mL de agua para poder disolver la sal. Mas tarde se pasó a un matraz volumétrico de 250 mL completándolo
con agua hasta llenar el matraz.
TERCERA PARTE
Finalizando la experiencia, se calculó el volumen que tiene que tomar para una solución de 1M, es decir la
solución anteriormente hecha, para preparar 100mL de la solución 0.3M. Inmediatamente, se utilizó una
pipeta para pasar 30 mL al matraz volumétrico de 100mL para así completarlo con agua.
4. Resultados y Discusión
En la última práctica de laboratorio del 22 de mayo debíamos preparar cierta cantidad de mililitros de
solución de NaCl, a medida que transcurría la clase observamos que la concentración de una solución
expresa la cantidad de un soluto presente en una cantidad determinada de solución o solvente.
En este caso debíamos pesar 10 gramos de NaCl en un Beaker en el cual agregamos 30 mL de agua para
disolver, luego éste lo agregamos a un matraz de 100 mL en el cual completamos la solución a su tope
máximo.
A raíz de esto obtuvimos unos pesos los cuales eran necesarios para la fulminación del experimento, en los
cuales debíamos restar el peso del matraz con la solución y el peso inicial del matraz (vacío).
Luego hicimos una solución de 1 molar, vemos que una solución molar es aquella que tiene la concentración
de un mol de soluto por litro de solución o mezcla; aquí debíamos seguir el mismo procedimiento anterior
Pero esta vez pesamos 11,9g de cloruro de sodio (NaCl) en el cual agregamos 50 mililitros de agua para
disolver y completamos hasta 250 mL en el matraz después de esto se obtuvo la cantidad de solución que se
tenía agregada.
MATERIALES:
Matraz volumétrico
Beaker
Embudo
Frasco lavador
Pipeta
Agitador de vidrio
H2SO4 concentrado
NaCl (sólido)
CALCULOS:
o Preparación de una solución de NaCl al 10% en P/V.
%m/v = 10g de soluto (NaCl)
Peso Beaker vacío = 45.8g.
Peso Beaker con 10g de NaCl = 56.77g.
Peso del matraz vacío = 52,70g
Densidad del agua = 1
90g de solvente + 10g de soluto = 100g de solución.
o Preparación de 250mL de solución 1M de NaCl.
1M= moles de soluto/ 0.25l
= 11.7g de NaCl.
Peso Beaker vacío = 45.8g
Peso Beaker con NaCl = 56.86g.
Peso matraz vacio = 97.25g.
Peso matraz con la solución = 352.85g
325.85g-97.25g= 255,6g (resta del peso del matraz vacío con peso del matraz con la solución).
255.6g – 11.7g= m del solvente
Masa solvente= 243.9g
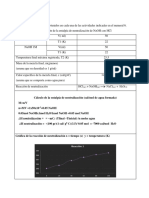
o Preparación de 100mL de una solución 0.3M de NaCl.
C1V1=C2V2
V2= 30mL.
Peso matraz con la solución= 79.76g
Peso matraz vacío= 52.70g
Completando hasta 100 con agua= 153,30g-52,70(peso matraz) =100,6g
Conclusiones
A través de estos experimentos se pudo comprender y a como determinar la concentración de sustancias por
medio de fórmulas, estos valores los obtuvimos por medio de la utilización de distintos instrumentos que se
encuentran en el laboratorio.
También se pudo percibir la importancia que representa el manejo de soluciones, ya que las cantidades de
estas puede ser muy variado, y si al instante de producirlas no se presta atención a la concentración y
densidad de los compuestos y no reaccionaran adecuadamente.
Bibliografía
[1] j. marconi, «Monografías,» [En línea]. Available:
https://www.monografias.com/trabajos97/soluciones-quimicas/soluciones-quimicas.shtml.
[2] k. I. Tellez, «quimica11alianza,» [En línea]. Available:
https://sites.google.com/site/quimica11alianza/temas-de-clase/solucione-quimicas.
[3] UTB, «PREPARACIÓN DE SOLUCIONES».
También podría gustarte
- Informe de Laboratorio - Cinetica QuimicaDocumento5 páginasInforme de Laboratorio - Cinetica QuimicaEliana Duette100% (1)
- Informe Fisica. Experiencia 3.Documento7 páginasInforme Fisica. Experiencia 3.Yinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Practica de Laboratorio No.3 - Titulaciones Potenciometricas de NeutralizaciónDocumento4 páginasPractica de Laboratorio No.3 - Titulaciones Potenciometricas de Neutralizaciónnewton50% (2)
- Identificacion de Aminoacidos Por Cromatografia en PapelDocumento11 páginasIdentificacion de Aminoacidos Por Cromatografia en PapelIvan A Juarez Turriza100% (1)
- Informe Practica 1. Gravimetría Por VolatilizaciónDocumento6 páginasInforme Practica 1. Gravimetría Por VolatilizacióndanielAún no hay calificaciones
- Reconocimiento de Material y Equipos Empleados en Estudios EcológicosDocumento10 páginasReconocimiento de Material y Equipos Empleados en Estudios EcológicosAndersson Paredes ÁlvarezAún no hay calificaciones
- Análisis Elemental de Compuestos OrgánicosDocumento12 páginasAnálisis Elemental de Compuestos OrgánicosValery Velasquez Ruiz50% (4)
- Humedad en El EucaliptoDocumento4 páginasHumedad en El EucaliptoDeyvis Ubaldo YaurivilcaAún no hay calificaciones
- Informe 3 Soluciones AcuosasDocumento7 páginasInforme 3 Soluciones Acuosasingrita456100% (1)
- Trabajo de EstequiometriaDocumento17 páginasTrabajo de EstequiometriaFausto Champi ChecyaAún no hay calificaciones
- Práctica N°6 Volumetria de Neutralizacion Determinacion de Acido Acetico en Un Vinagre Ccial PDFDocumento6 páginasPráctica N°6 Volumetria de Neutralizacion Determinacion de Acido Acetico en Un Vinagre Ccial PDFRonaldo Guao BolañoAún no hay calificaciones
- Informe de Práctica 4 MacromoléculasDocumento22 páginasInforme de Práctica 4 MacromoléculasJavier Augusto Rodríguez BravoAún no hay calificaciones
- Practica #13 IIDocumento12 páginasPractica #13 IImaria100% (1)
- Estequiometria Discusion Conclusion...Documento1 páginaEstequiometria Discusion Conclusion...LUIS JAIME RAMOS POMPA100% (1)
- Marco Teorico - Reacciones RedoxDocumento13 páginasMarco Teorico - Reacciones RedoxLivia Prtl FlrsAún no hay calificaciones
- Guia 6 - Química Analítica - PREPARACIÓN DE SOLUCIONES BUFFERDocumento8 páginasGuia 6 - Química Analítica - PREPARACIÓN DE SOLUCIONES BUFFERLaura CarvajalAún no hay calificaciones
- Practica #7 PH Soluciones Amortiguadoras Análisis FarmacéuticoDocumento3 páginasPractica #7 PH Soluciones Amortiguadoras Análisis Farmacéuticojuan layque layasaAún no hay calificaciones
- Cuestionario Practica 9Documento2 páginasCuestionario Practica 9DANNERI LEZAMA GALLEGOSAún no hay calificaciones
- Práctica de Laboratorio #04 - Polisacáridos - Almidón y CelulosaDocumento17 páginasPráctica de Laboratorio #04 - Polisacáridos - Almidón y CelulosaPeter Poma Arias100% (1)
- INFORME-11 de Quimica GeneralDocumento11 páginasINFORME-11 de Quimica GeneralRaul Llanos100% (1)
- Analisis GravimetricoDocumento8 páginasAnalisis GravimetricoFranz LandaAún no hay calificaciones
- Prueba de Identificacion de AminoacidosDocumento15 páginasPrueba de Identificacion de AminoacidosMónica Janampa MenesesAún no hay calificaciones
- Monografia ExcipientesDocumento4 páginasMonografia ExcipientesDeysi QispeAún no hay calificaciones
- Solibilidad AnilinaDocumento1 páginaSolibilidad AnilinaKaterin RinconAún no hay calificaciones
- Reacciones Importantes de Aldehidos Cetonas y Ac CarboxilicosDocumento7 páginasReacciones Importantes de Aldehidos Cetonas y Ac CarboxilicosMaycol Bustamante100% (1)
- Informe 4 - Soluciones ValoradasDocumento5 páginasInforme 4 - Soluciones ValoradasJorge Andres EspinozaAún no hay calificaciones
- Umss Derecho InformeDocumento19 páginasUmss Derecho InformeJEANNE CALLE CALLEJASAún no hay calificaciones
- Informe Ciclo de Krebs Bioquimica MonoDocumento3 páginasInforme Ciclo de Krebs Bioquimica MonosebastianAún no hay calificaciones
- 2do Informe - SAPONIFICACIÓN - Obser..recomen..dibujo..Documento3 páginas2do Informe - SAPONIFICACIÓN - Obser..recomen..dibujo..Cristian Muñoz SolisAún no hay calificaciones
- BIOQUIMICA - Informe de Reacciones Generales de Los CarbohidratosDocumento17 páginasBIOQUIMICA - Informe de Reacciones Generales de Los CarbohidratosHUGOAún no hay calificaciones
- Sesión Aseguramiento de Los Resultados 2022-IIDocumento28 páginasSesión Aseguramiento de Los Resultados 2022-IIAnais Briggit Jacinto ChavezAún no hay calificaciones
- Práctica #1 Separación de Cationes Por Cromatografía de PapelDocumento5 páginasPráctica #1 Separación de Cationes Por Cromatografía de PapelArlés GómezAún no hay calificaciones
- Informe 2. Hidrolisis Del AlmidonDocumento7 páginasInforme 2. Hidrolisis Del AlmidonCarlos Aguirre100% (1)
- Temas Exposicion - Bioquimica y Nutricion PDFDocumento3 páginasTemas Exposicion - Bioquimica y Nutricion PDFLuis Remolina100% (1)
- Ensayo Por Vía SecaDocumento16 páginasEnsayo Por Vía Secafrank100% (1)
- Informe de Calibracion de Material de Vidrio en Lab de AnaliticaDocumento10 páginasInforme de Calibracion de Material de Vidrio en Lab de Analiticaemma streep100% (1)
- Laboratorio # 6. Alcalinidad en Una Muestra de AguaDocumento3 páginasLaboratorio # 6. Alcalinidad en Una Muestra de AguaEreck Rodriguez Claro100% (1)
- PRACTICA 2.calibracion de Material VolumetricoDocumento17 páginasPRACTICA 2.calibracion de Material VolumetricoEmely Suhuchery Alfonso DiazAún no hay calificaciones
- Informe Carbohidratos, 100% CalidadDocumento14 páginasInforme Carbohidratos, 100% CalidadJorge Gustavo Santiago Soto100% (1)
- RecomendacionesDocumento1 páginaRecomendacionesCristian MartinAún no hay calificaciones
- Disolucion de Alcoholes en VolumenDocumento5 páginasDisolucion de Alcoholes en VolumenJer RodriguezAún no hay calificaciones
- Informe 10 Identificacion de CarbohidratosDocumento6 páginasInforme 10 Identificacion de CarbohidratosJéssica Baños FalconesAún no hay calificaciones
- Aplicación Del Coeficiente de Partición en La Extracción de P.ADocumento17 páginasAplicación Del Coeficiente de Partición en La Extracción de P.ALeila Liz Reyna ReynaAún no hay calificaciones
- Estequiometria Informe de LaboratorioDocumento3 páginasEstequiometria Informe de LaboratorioVicente EstradaAún no hay calificaciones
- INFORME N 006 ActualDocumento10 páginasINFORME N 006 ActualAnonymous RaF65xNAún no hay calificaciones
- Trabajo Previo 09Documento6 páginasTrabajo Previo 09ALEXANDRA IRENE DEL AGUILA MENDOZAAún no hay calificaciones
- INFORME 01 - Sintesis de Cloruro de Terc-ButiloDocumento14 páginasINFORME 01 - Sintesis de Cloruro de Terc-ButiloBryan SanchezAún no hay calificaciones
- Informe 9-Cinetica QuímicaDocumento6 páginasInforme 9-Cinetica QuímicaMari NarvaezAún no hay calificaciones
- Soluciones en LaboratorioDocumento6 páginasSoluciones en LaboratorioSteffany Alvarado GarayAún no hay calificaciones
- Práctica Preparación de Solución y Titulación Ácido-BaseDocumento5 páginasPráctica Preparación de Solución y Titulación Ácido-BaseAnaiisa Vizcarra50% (2)
- Solubilidad y SolucionesDocumento5 páginasSolubilidad y SolucionesEdgar RomeroAún no hay calificaciones
- Informe 3Documento31 páginasInforme 3Kvins RouAún no hay calificaciones
- Informe - Preparación y Evaluación de Una Solución Amortiguadora de AcetatosDocumento7 páginasInforme - Preparación y Evaluación de Una Solución Amortiguadora de AcetatosIraiz Styles HoranAún no hay calificaciones
- Informe Constante de Producto de Solubilidad, Kps y Efecto Ion Común (Química General) - UNALMDocumento15 páginasInforme Constante de Producto de Solubilidad, Kps y Efecto Ion Común (Química General) - UNALMAndres Atilio Durand CrucesAún no hay calificaciones
- Lab 3. Soluciones y Expresiones de La ConcentracionDocumento11 páginasLab 3. Soluciones y Expresiones de La Concentraciondilmerarias100% (2)
- Aminoacidos y ProteinasDocumento6 páginasAminoacidos y Proteinasfrancisco gomezAún no hay calificaciones
- Practica 4Documento5 páginasPractica 4Milka Rafaela Acero VargasAún no hay calificaciones
- Tipos de Reacciones QuímicasDocumento7 páginasTipos de Reacciones QuímicasJosueGuayuscaSoriaGalvarroAún no hay calificaciones
- Determinación de La Dureza Del AguaDocumento9 páginasDeterminación de La Dureza Del AguaFranz Aleman SanchezAún no hay calificaciones
- INFORME-7Documento7 páginasINFORME-7AnaisBriggitJacintoChavezAún no hay calificaciones
- Practica 2 Identificación de Aldehídos y CetonasDocumento5 páginasPractica 2 Identificación de Aldehídos y CetonasMario Edwin Martinez CoronaAún no hay calificaciones
- Informe 3Documento8 páginasInforme 3Marisol Realpe DiazAún no hay calificaciones
- Informe #08Documento7 páginasInforme #08Yinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Informe 5. Calor Especifico de Los SólidosDocumento7 páginasInforme 5. Calor Especifico de Los SólidosYinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Evidencias de Ocurrencia de Una Reacción QuímicaDocumento4 páginasEvidencias de Ocurrencia de Una Reacción QuímicaYinoska Del Carmen Lemus BarrosAún no hay calificaciones
- INFORME#04Documento4 páginasINFORME#04Yinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Guía Experiencia 2 PDFDocumento3 páginasGuía Experiencia 2 PDFYinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Pre Informe 2 22Documento3 páginasPre Informe 2 22Yinoska Del Carmen Lemus BarrosAún no hay calificaciones
- Null 14Documento14 páginasNull 14ahsimAún no hay calificaciones
- Alejandro Sulbaran V22251703 Maracaibo Termo IiDocumento30 páginasAlejandro Sulbaran V22251703 Maracaibo Termo IiAlejandro SulbaranAún no hay calificaciones
- Practica # 1 ValoraciónDocumento3 páginasPractica # 1 ValoraciónQuimica GonzalezAún no hay calificaciones
- Tabla Comparativa: Diferencia Entre Reacción Y Ecuación QuímicaDocumento2 páginasTabla Comparativa: Diferencia Entre Reacción Y Ecuación QuímicaEvelyn Yazaret Moncayo OlmosAún no hay calificaciones
- Tema 3. Reacciones de Los Mono y OligosacaridosDocumento17 páginasTema 3. Reacciones de Los Mono y OligosacaridoslauraAún no hay calificaciones
- Seminario Redox 2018Documento3 páginasSeminario Redox 2018gaAún no hay calificaciones
- Gestión Del PlásticoDocumento8 páginasGestión Del PlásticoLIDA MORENOAún no hay calificaciones
- Zprobl TMaDocumento53 páginasZprobl TMaMichael Cebral LópezAún no hay calificaciones
- Dioxido de CloroDocumento14 páginasDioxido de Clororosa perezAún no hay calificaciones
- TEEMDocumento6 páginasTEEMSudden DeathAún no hay calificaciones
- Clase 5 Tecnologia Del Hormigon 2021 VMDocumento32 páginasClase 5 Tecnologia Del Hormigon 2021 VMManuel CarpAún no hay calificaciones
- Examende Broma Pero Si Quieres No Es Broma. JPGDocumento4 páginasExamende Broma Pero Si Quieres No Es Broma. JPGDarwin Ruiz SaavedraAún no hay calificaciones
- P1 M1 Propiedadesdelosfluidos Forero Rodrguez Grandas TovarDocumento19 páginasP1 M1 Propiedadesdelosfluidos Forero Rodrguez Grandas TovarKaren GrandasAún no hay calificaciones
- ManueltecnicopegamentoDocumento10 páginasManueltecnicopegamentoRicardoAún no hay calificaciones
- Práctica Laboratorio #1 de Fluidos de PerforaciónDocumento15 páginasPráctica Laboratorio #1 de Fluidos de PerforaciónJosé ManuelAún no hay calificaciones
- El AguaDocumento2 páginasEl AguaYessenia Ocsa Serrano100% (1)
- Taller de Soluciones QFII 2017cintiaDocumento3 páginasTaller de Soluciones QFII 2017cintiaAny de jesus chima oliveroAún no hay calificaciones
- Lab CementacDocumento8 páginasLab CementacLuis Alberto Rondon GutierrezAún no hay calificaciones
- Tarea de QuimicaDocumento4 páginasTarea de QuimicaPrii AcostaAún no hay calificaciones
- Examen Final Tercer Periodo 8 RespuestasDocumento2 páginasExamen Final Tercer Periodo 8 RespuestasRafael SolisAún no hay calificaciones
- Inorganica Practica N 02Documento2 páginasInorganica Practica N 02richard diego0% (1)
- Capacitacion en Explosivos y Sistemas de Iniciacion 2Documento34 páginasCapacitacion en Explosivos y Sistemas de Iniciacion 2kenin hiro justo damasAún no hay calificaciones
- Experimento 3 de Quimica (Punto de Funsion)Documento7 páginasExperimento 3 de Quimica (Punto de Funsion)Yurem Adjamir RojasAún no hay calificaciones
- S5 - HT - Función Hidruro y Ácidos - TeoríaDocumento6 páginasS5 - HT - Función Hidruro y Ácidos - TeoríaLenin JimenezAún no hay calificaciones
- Portafolio de EvidenciasDocumento2 páginasPortafolio de EvidenciasPAUL JHERSON CARCAHUSTO TUMBILLOAún no hay calificaciones
- Cuestionario DE OPTICADocumento6 páginasCuestionario DE OPTICAVictor Tello MarcaAún no hay calificaciones
- Mes Febrero Año Sede Laboratorio Clinico Diagnostico Genetico Y Molecular KeraltyDocumento6 páginasMes Febrero Año Sede Laboratorio Clinico Diagnostico Genetico Y Molecular KeraltyALEJANDRO NINO MAYORGAAún no hay calificaciones
- Ejercicios PolimerosDocumento3 páginasEjercicios PolimerosNazarena RosalesAún no hay calificaciones
- Definición de Los Gases-Ideales y Características de Los GasesDocumento6 páginasDefinición de Los Gases-Ideales y Características de Los GasesCESAR AUGUSTO ARIAS RUEDAAún no hay calificaciones