Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Introduccion Materiales
Cargado por
Sam Arle0 calificaciones0% encontró este documento útil (0 votos)
323 vistas5 páginasTítulo original
Introduccion materiales
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
323 vistas5 páginasIntroduccion Materiales
Cargado por
Sam ArleCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Introduccion:
En este trabajo se demostrara la elaboración de cristales usando utensilios que se
pueden conseguir fácilmente (azúcar, sal y alubre) mezclados con agua, cada uno
con un procedimiento un algo distinto. Se pensó en la elaboración de este
experimento para poder observar el procedimiento que se lleva el lograr obtener
cristales y comprender mejor el efecto de las condiciones más de cerca sobre los
materiales, además de que también se buscaba el reflexionar acerca de los
factores que influyen en sus formas y propiedades.
Estructuras cristalinas
La estructura cristalina es uno de los estados sólidos que pueden adoptar en la
naturaleza los átomos, iones o moléculas, el cual se caracteriza por poseer un alto
ordenamiento espacial. En otras palabras, esta es una evidencia de la
“arquitectura corpuscular” que define muchos cuerpos con apariencias vítreas y
brillantes.
Estructura
En la imagen superior se ilustran unas gemas de esmeraldas.
Así como estas, muchos otros minerales, sales, metales,
aleaciones y diamantes exhiben una estructura cristalina.
Si a un cristal, cuyas partículas pudieran ser observadas a
simple vista, se le aplica operaciones de simetría (invertirlo,
rotarlo a distintos ángulos, reflejarlo en un plano, etc.), entonces
se encontrará que permanece intacto en todas las dimensiones
del espacio.
Lo contrario ocurre para un sólido amorfo, a partir del que se
obtienen diferentes ordenamientos al someterlo a una operación
de simetría. Además, este carece de patrones de repetición
estructural, lo que demuestra la aleatoriedad en la distribución
de sus partículas.
En la imagen superior el sólido cristalino es simétrico en el
espacio, mientras que el amorfo no lo es.
Si se dibujaran unos cuadrados que encerrasen unas esferas
naranjas y se les aplicara las operaciones de simetría, se encontraría que generan
otras partes del cristal.
Lo anterior se repite con cuadrados más y más pequeños, hasta dar con aquel que
sea asimétrico; el que le antecede en tamaño es, por definición, la celda unitaria.
Celda unitaria
La celda unitaria es la mínima expresión estructural que
permite la reproducción completa del sólido cristalino. A
partir de esta es posible armar el cristal, trasladándola en
todas las direcciones del espacio.
Puede considerarse como un cajón pequeño donde las
partículas, representadas por esferas, se colocan
siguiendo un patrón de llenado. Las dimensiones y
geometrías de este cajón dependen de las longitudes de
sus ejes (a, b y c), así como de los ángulos entre estos
(α, β y γ).
La más simple de todas las celdas unitarias es la de la
estructura cúbica simple (imagen superior (1)). En esta el
centro de las esferas ocupa las esquinas del cubo,
ubicándose cuatro en su base y cuatro en el techo.
En este arreglo, las esferas apenas ocupan el 52 % del volumen total del cubo, y
dado que la naturaleza aborrece el vacío, no son muchos los compuestos o
elementos que adoptan esta estructura.
Sin embargo, si al mismo cubo se le disponen las esferas de tal manera que una
ocupe el centro (cúbica centrada en el cuerpo, bcc), entonces se tendrá un
empaquetamiento más compacto y eficiente (2). Ahora las esferas ocupan el 68 %
del volumen total.
Por otra parte, en (3) ninguna esfera ocupa el centro del cubo, pero sí el centro de
sus caras, y todas ocupan hasta el 74 % del volumen total (cúbica centrada en las
caras, ccp).
Así, puede apreciarse que para el mismo cubo pueden obtenerse otros arreglos,
variando el modo de cómo se empaquetan las esferas (iones, moléculas, átomos,
etc.).
Tipos
Las estructuras cristalinas pueden clasificarse en función de sus sistemas
cristalinos o de la naturaleza química de sus partículas.
Por ejemplo, el sistema cúbico es el más común de todos y muchos sólidos
cristalinos se rigen a partir de este; sin embargo, este mismo sistema aplica tanto
para cristales iónicos como para cristales metálicos.
Según su sistema cristalino
En la imagen anterior se representan los siete sistemas cristalinos principales.
Puede notarse que en realidad hay catorce de estos, los cuales son producto de
otras formas de empaquetamientos para los mismos sistemas y conforman las
redes de Bravais.
De (1) a (3) son los cristales con sistemas cristalinos cúbicos. En (2) se observa
(por las franjas azules) que la esfera del centro y la de las esquinas interactúan
con ocho vecinos, por lo que las esferas tienen un número de coordinación de 8. Y
en (3) el número de coordinación es 12 (para verlo es necesario duplicar el cubo
en cualquier dirección).
Los elementos (4) y (5) corresponden a los sistemas tetragonales simple y
centrado en las caras. A diferencia del cúbico, su eje c es más largo que los ejes a
y b.
De (6) a (9) son los sistemas ortorrómbicos: desde el simple y el centrado en las
bases (7), hasta los centrados en el cuerpo y en las caras. En estos α, β y γ son
de 90º, pero todos los lados son de diferentes longitudes.
Las figuras (10) y (11) son los cristales monoclínicos y la (12) es el triclínico,
presentando las últimas desigualdades en todos sus ángulos y ejes.
El elemento (13) es el sistema rombohedral, análogo al cúbico pero con un ángulo
γ distinto a 90º. Finalmente están los cristales hexagonales
Los desplazamientos de los elementos (14) originan el prisma hexagonal trazados
por las líneas punteadas de verde.
Según su naturaleza química
– Si los cristales están formados por iones, entonces son cristales iónicos
presentes en las sales (NaCl, CaSO4, CuCl2, KBr, etc.)
– Las moléculas como la glucosa forman (siempre que puedan) cristales
moleculares; en este caso, los famosos cristales de azúcar.
– Los átomos cuyos enlaces son esencialmente covalentes forman cristales
covalentes. Tales son los casos del diamante o del carburo de silicio.
– Asimismo, los metales como el oro forman estructuras cúbicas compactas, las
cuales constituyen los cristales metálicos.
Ejemplos.
K2Cr2O7 (sistema triclínico) NaCl (sistema cúbico)
ZnS (wurtzita, sistema hexagonal) CuO (sistema monoclínico)
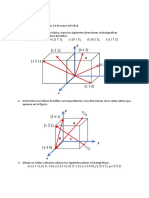
Índices de Miller.
Para conocer a los planos cristalinos en una red cristalina se utiliza el sistema
Miller, que se conoce como el recíproco de las fracciones de intersección (con
fracciones simplificadas) que el plano presenta en los átomos de las tres aristas no
paralelas a la celda unitaria.
PROCEDIMIENTOS PARA DETERMINAR LOS ÍNDICES:
1. Se elige un plano que no pase por el origen de las coordenadas (0,0,0).
2. Se determinan las intersecciones del plano de la función de los ejes
cristalográficos para un cubo unidad. Estas intersecciones pueden ser
fraccionarias.
3. Se obtiene el recíproco de las intersecciones.
4. Se simplifican las fracciones y se determina el conjunto más pequeño de
números enteros que existen en las mismas proporciones que las intersecciones.
La notación (h,k,l) se utiliza para indicar los índices de Miller en un sentido
general.
PROCEDIMIENTOS PARA DETERMINAR LA DIRECCIÓN:
1. Determinar las coordenadas inicial y final.
2. Restar final menos inicial.
3. Reducir a enteros mínimos.
4. Representar los resultados entre [ ] y usando un guion sobre aquel número que
resulte negativo.
También podría gustarte
- Romero Rojas Jairo Alberto - Potabilizacion Del AguaDocumento306 páginasRomero Rojas Jairo Alberto - Potabilizacion Del Aguamansocalula100% (45)
- Producción de Un Ensayo Académico Sobre Su Área deDocumento6 páginasProducción de Un Ensayo Académico Sobre Su Área deRomany Esparza50% (2)
- Ecuaciones diferenciales en ingeniería mecánicaDocumento6 páginasEcuaciones diferenciales en ingeniería mecánicaEddy SgtrAún no hay calificaciones
- Transmision 31ht Chrysler Dodge JeepDocumento102 páginasTransmision 31ht Chrysler Dodge JeepDaniel Caminati100% (2)
- Materiales no metálicos en la industriaDocumento15 páginasMateriales no metálicos en la industriaLuis UbaldoAún no hay calificaciones
- Equilibrio de Una Particula en Tres DimensionesDocumento6 páginasEquilibrio de Una Particula en Tres DimensionesJhon Alex Villanueva Sanchez78% (9)
- 02 Libro Ciencia Materiales I Defectos Cristalinos 2017Documento69 páginas02 Libro Ciencia Materiales I Defectos Cristalinos 2017Oliver Leonardo Daniel Hernandez ReyesAún no hay calificaciones
- Mecánica de Materiales 1Documento19 páginasMecánica de Materiales 1Candido Alberto Almeida Herrera67% (3)
- Estructuras Cristalinas de Materiales No MetalicosDocumento9 páginasEstructuras Cristalinas de Materiales No MetalicosEduardo Romo100% (1)
- Practica 3. Defectos Cristalinos en Los Materiales.Documento21 páginasPractica 3. Defectos Cristalinos en Los Materiales.Miguel Abraham Hernández Villa100% (1)
- Ensayo Estructuras CristalinasDocumento6 páginasEnsayo Estructuras CristalinasEmmanuel Osorio Fuentes0% (1)
- Reacciones Invariantes - Materiales IIDocumento1 páginaReacciones Invariantes - Materiales IIIsrael Castillo Altamirano0% (1)
- La mejora continua y el control de calidad en las organizacionesDocumento13 páginasLa mejora continua y el control de calidad en las organizacionesGabriel ParedesAún no hay calificaciones
- Examen Tipo TM 1d 190219Documento1 páginaExamen Tipo TM 1d 190219carlos gonzalezAún no hay calificaciones
- Tarea 1 FM G2 P58Documento5 páginasTarea 1 FM G2 P58Donald TitoAún no hay calificaciones
- Descomposición LUDocumento37 páginasDescomposición LUbenedicto maximo requez sanchez0% (1)
- ProblemasDocumento4 páginasProblemasLuis LiraAún no hay calificaciones
- Prueba de La ChispaDocumento10 páginasPrueba de La ChispaAlvin David Ochoa Sandoval0% (1)
- Diagrama Fe-C tratamientosDocumento2 páginasDiagrama Fe-C tratamientosGustavo Yampara LoveraAún no hay calificaciones
- Capitulo v. Cinetica de Una Partícula. Trabajo - EnergiaDocumento57 páginasCapitulo v. Cinetica de Una Partícula. Trabajo - EnergiaPariapaza Cuarite DarwinAún no hay calificaciones
- Propiedades Físicas Presentadas Por Los Materiales No MetálicosDocumento6 páginasPropiedades Físicas Presentadas Por Los Materiales No MetálicosLuis UbaldoAún no hay calificaciones
- 1.2 Defectos LinealesDocumento4 páginas1.2 Defectos LinealesluisfredAún no hay calificaciones
- Algoritmo VacacionesDocumento3 páginasAlgoritmo VacacionesLeugue AviAún no hay calificaciones
- Ensayo 1.3 Categoría de Los Procesos de FabricaciónDocumento8 páginasEnsayo 1.3 Categoría de Los Procesos de FabricaciónENRIQUE SANCHEZAún no hay calificaciones
- Práctica 1 Ensayo de ChispaDocumento5 páginasPráctica 1 Ensayo de ChispaCarlos BuenAún no hay calificaciones
- Estructura Cristalina FCCDocumento3 páginasEstructura Cristalina FCCdigrian david romero rojasAún no hay calificaciones
- Propiedades Mecánicas: Primera Parte: CapítuloDocumento47 páginasPropiedades Mecánicas: Primera Parte: Capítuloyeferson tamayoAún no hay calificaciones
- Diagramas de cuerpo libre y determinación de reaccionesDocumento8 páginasDiagramas de cuerpo libre y determinación de reaccionesBenjaminAún no hay calificaciones
- Guía de TorsiónDocumento4 páginasGuía de TorsiónTorres SamuelAún no hay calificaciones
- Tarea 3 Estática - 1Documento1 páginaTarea 3 Estática - 1Btriz M TulcanAún no hay calificaciones
- Enlaces SecundariosDocumento2 páginasEnlaces SecundariosEduardo Zavala50% (2)
- Aplicaciones de Los Métodos NuméricosDocumento2 páginasAplicaciones de Los Métodos Numéricosluis gerardo ulin hernandezAún no hay calificaciones
- Celda Hexagonal CompactaDocumento2 páginasCelda Hexagonal CompactaEdwin RamírezAún no hay calificaciones
- Historia de la fabricaciónDocumento7 páginasHistoria de la fabricaciónArturo Castillo100% (1)
- Materiales Ceramicos y CompuestosDocumento40 páginasMateriales Ceramicos y Compuestoscarlos_camb67% (3)
- CONCLUSIONES MecanicaDocumento1 páginaCONCLUSIONES Mecanicajulian5431088Aún no hay calificaciones
- Conclusión de Fundición de Hierro GrisDocumento1 páginaConclusión de Fundición de Hierro GrisLaura Sofia Zuñiga BolañosAún no hay calificaciones
- Taller 8 Ejer - 45,46,47,48Documento5 páginasTaller 8 Ejer - 45,46,47,48Jordy QuishpeAún no hay calificaciones
- Apuntes de Fundamentos de Mec de MatDocumento23 páginasApuntes de Fundamentos de Mec de MatJeysson AvilaAún no hay calificaciones
- Practica 1 Seguridad en Laboratorio de ElectromagnetismoDocumento10 páginasPractica 1 Seguridad en Laboratorio de ElectromagnetismoAnne HarperAún no hay calificaciones
- Deber No. 2 sobre direcciones y planos cristalográficosDocumento3 páginasDeber No. 2 sobre direcciones y planos cristalográficosByron VasconezAún no hay calificaciones
- La austenita, forma de ordenamiento de átomos de hierro y carbonoDocumento2 páginasLa austenita, forma de ordenamiento de átomos de hierro y carbonoSaul RomeroAún no hay calificaciones
- Fuerzas en El EspacioDocumento7 páginasFuerzas en El EspacioBrianVegaAún no hay calificaciones
- Endurecimiento por deformación y tratamientos térmicosDocumento4 páginasEndurecimiento por deformación y tratamientos térmicosAmairaniAún no hay calificaciones
- Evaluación técnica de fallas mediante END y EDTDocumento29 páginasEvaluación técnica de fallas mediante END y EDTfreddy jaramillo100% (2)
- Vector de Deslizamiento o Vector de BurgersDocumento2 páginasVector de Deslizamiento o Vector de BurgersOscar ToroAún no hay calificaciones
- Ensayo de tracción bronceDocumento18 páginasEnsayo de tracción bronceGandhi Livia Cordova RamosAún no hay calificaciones
- Practica 1Documento13 páginasPractica 1Eduardo NietoAún no hay calificaciones
- Capitulo 3 ADocumento37 páginasCapitulo 3 ANaomi VegagAún no hay calificaciones
- Introducción Diagrama de FaceDocumento12 páginasIntroducción Diagrama de FaceObed AguilarAún no hay calificaciones
- EnsayoDocumento2 páginasEnsayoALEJANDRO PEREZ HERNANDEZAún no hay calificaciones
- Imperfecciones cristalinas y defectos estructuralesDocumento13 páginasImperfecciones cristalinas y defectos estructuralesChristianJavier50% (2)
- Aceros HSLADocumento4 páginasAceros HSLAFernando GamboaAún no hay calificaciones
- Orden atómico en materiales: corto vs largo alcanceDocumento3 páginasOrden atómico en materiales: corto vs largo alcanceKarenEscárragaAún no hay calificaciones
- Reporte de la práctica de tensión: Módulo de elasticidad, resistencia y ductilidadDocumento7 páginasReporte de la práctica de tensión: Módulo de elasticidad, resistencia y ductilidadvicenteAún no hay calificaciones
- Arreglos Atómicos, Ciencia de MaterialesDocumento6 páginasArreglos Atómicos, Ciencia de MaterialesDavid Martinez100% (1)
- Investigación Topología de MecanismosDocumento6 páginasInvestigación Topología de MecanismosFabián LaraAún no hay calificaciones
- Coordenadas Cilíndricas PDFDocumento3 páginasCoordenadas Cilíndricas PDFTathie BolañoAún no hay calificaciones
- Ejercicios TTQ PDFDocumento12 páginasEjercicios TTQ PDFalejandroruiz020697Aún no hay calificaciones
- Procesos para fabricar aceros y sus aleacionesDocumento24 páginasProcesos para fabricar aceros y sus aleacionesARACELI VALERIA CALVO RAMIREZAún no hay calificaciones
- Clase 3. Eslabones, Juntas y DiagramasDocumento29 páginasClase 3. Eslabones, Juntas y DiagramasRodneyAún no hay calificaciones
- EstructuraDocumento6 páginasEstructuraMarieladelAún no hay calificaciones
- Quimica ADocumento59 páginasQuimica Aevert german mamani mermaAún no hay calificaciones
- Problema Resuelto de Volumen de Control en El ESS: Mecánica, Mecánica Eléctrica y MecatrónicaDocumento8 páginasProblema Resuelto de Volumen de Control en El ESS: Mecánica, Mecánica Eléctrica y MecatrónicaThe BatonAún no hay calificaciones
- 1T Alumno 2°Documento45 páginas1T Alumno 2°ChristianLazosAún no hay calificaciones
- Informe Geotecnico Miraflores BoyacaDocumento73 páginasInforme Geotecnico Miraflores BoyacaNelson BohorquezAún no hay calificaciones
- Trabajo y energía prácticaDocumento2 páginasTrabajo y energía prácticaAlvinDiazAún no hay calificaciones
- Diseño de red de distribución de agua potable para vivienda unifamiliarDocumento7 páginasDiseño de red de distribución de agua potable para vivienda unifamiliarEliezer RojasAún no hay calificaciones
- Informe 3Documento3 páginasInforme 3Jorge CotrinaAún no hay calificaciones
- Recuento Bibliográfico Sobre Extracción Líquido-Líquido.Documento9 páginasRecuento Bibliográfico Sobre Extracción Líquido-Líquido.Angel DuarteAún no hay calificaciones
- Código CIEN Código de Instalaciones Eléctricas en NicaraguaDocumento707 páginasCódigo CIEN Código de Instalaciones Eléctricas en NicaraguaAntonioAcevedoAún no hay calificaciones
- Copia de Manual Del Alumno.Documento40 páginasCopia de Manual Del Alumno.LUIS ADRIAN RAMOS GARCIAAún no hay calificaciones
- Reporte desgaste bomba aguaDocumento14 páginasReporte desgaste bomba aguaDany Rivera Rubio0% (1)
- Taller de Movimiento Armonico SimpleDocumento4 páginasTaller de Movimiento Armonico SimpleSebastian Ruiz romeroAún no hay calificaciones
- Densidad sustancias sólidas líquidasDocumento1 páginaDensidad sustancias sólidas líquidasOscar Ariel GerAún no hay calificaciones
- 7 Cambiadores de Calor en Serie 1Documento9 páginas7 Cambiadores de Calor en Serie 1Eduardo Solis100% (1)
- Presentacion Edificio Mirador Del Santuario REV DJLDocumento27 páginasPresentacion Edificio Mirador Del Santuario REV DJLFrancisco Orellana FernándezAún no hay calificaciones
- SIG-PR-QA-006 - Inspeccion Visual de SoldaduraDocumento10 páginasSIG-PR-QA-006 - Inspeccion Visual de SoldaduraHector Aldair Valle RiveraAún no hay calificaciones
- Corrección TP1 Lubricantes y BombasDocumento13 páginasCorrección TP1 Lubricantes y BombasDamián GonzálezAún no hay calificaciones
- Entregable 01Documento8 páginasEntregable 01Jhojan RodriguezAún no hay calificaciones
- Segunda UnidadDocumento29 páginasSegunda UnidadMARCIAL ALMIRON PANTIAún no hay calificaciones
- Tipos de AcuiferosDocumento20 páginasTipos de AcuiferosrobertoAún no hay calificaciones
- TRABAJO COLABORATIVO Movimiento Armonico SimpleDocumento19 páginasTRABAJO COLABORATIVO Movimiento Armonico Simpleyeison alfonso paez ramirezAún no hay calificaciones
- Regeneración resinas intercambio iónico laboratorios Ryan ColombiaDocumento2 páginasRegeneración resinas intercambio iónico laboratorios Ryan ColombiaAntonio Carlos Gutiérrez MirandaAún no hay calificaciones
- Presentación BEEQ21Documento26 páginasPresentación BEEQ21Leandro Alberto Villanueva MancillaAún no hay calificaciones
- Instalaciones Hidráulicas, Gas y VentilaciónDocumento83 páginasInstalaciones Hidráulicas, Gas y VentilaciónVicente Navarro AguilarAún no hay calificaciones
- Memoria Descriptiva de Muro de ContenciónDocumento10 páginasMemoria Descriptiva de Muro de ContenciónCarlos Valverde PortillaAún no hay calificaciones
- 10 - Simbología SoldaduraDocumento165 páginas10 - Simbología SoldaduraJulito ParraAún no hay calificaciones
- Glosario de términos de geotecnia y cimentacionesDocumento10 páginasGlosario de términos de geotecnia y cimentacionesLiz Morán LeónAún no hay calificaciones
- Taller de BiotecnologíaDocumento11 páginasTaller de BiotecnologíaCARLOS ARTURO PEREZ GONZALEZ ESTUDIANTE ACTIVOAún no hay calificaciones