Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Construcción de diagramas de fases mediante análisis térmico
Cargado por
Javier Andres Urrea0 calificaciones0% encontró este documento útil (0 votos)
43 vistas1 páginaLos datos necesarios para la construcción de los diagramas de equilibrio o de fases se determinan experimentalmente por medio de una gran variedad de procedimientos
Título original
construcción de los diagramas de equilibrio o de fases
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoLos datos necesarios para la construcción de los diagramas de equilibrio o de fases se determinan experimentalmente por medio de una gran variedad de procedimientos
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
43 vistas1 páginaConstrucción de diagramas de fases mediante análisis térmico
Cargado por
Javier Andres UrreaLos datos necesarios para la construcción de los diagramas de equilibrio o de fases se determinan experimentalmente por medio de una gran variedad de procedimientos
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
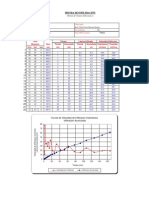
Los datos necesarios para la construcción de los diagramas de equilibrio o de fases se
determinan experimentalmente por medio de una gran variedad de procedimientos, entre
los cuales los más comunes son: el análisis térmico, procedimientos metalográficos y rayos
X. El análisis térmico es el más utilizado; si representamos gráficamente las temperaturas
en función del tiempo, a composición constante, obtenemos una curva de enfriamiento cuya
pendiente cambia al presentarse un cambio de fase, debido al calor liberado en la
transformación. Este procedimiento es el más adecuado para conocer la temperatura inicial
y final de solidificación; esto fue el objetivo principal de este experimento el cual logro
alcanzarse ya que a partir de los datos obtenidos pudo construirse las curvas de
enfriamiento respectivas y el diagrama del sistema binario naftaleno-benzofenona (figura
5.3), las curvas aquí presentadas corresponden a las composiciones 100% naftaleno (figura
5.1) y 50% naftaleno/ 50%benzfenona (figura 5.2).
Para el primer caso correspondiente a la composición 100% naftaleno, se observa a los 80C
el plato, este el cual inicia aproximadamente a las 4 minutos ½ de haber iniciado a tomar
las temperaturas, este indica el cambio de fase al estado sólido, instante a partir del cual la
temperatura permanece constante mientras termina de solidificar el compuesto –esto ocurre
porq----- Cuando un líquido puro es enfriado en forma controlada, su temperatura
disminuye continuamente y en forma proporcional a su calor específico hasta llegar a lo
antes descrito como el plato, cuando todo el líquido ha solidificado y persiste el
enfriamiento, la temperatura continua descendiendo, esta vez proporcionalmente al calor
específico del compuesto en fase sólida, esto es lo que se observa posterior al minuto 8, en
el que todo el naftaleno solidifico.
La ley de Rauld dice que si a una sustancia pura se le adiciona otra soluble en ella en estado
líquido e insoluble en estado sólido, su punto de solidificación disminuirá en una cantidad
proporcional al peso molecular del soluto, este principio sirve de base para explicar la
pruebas de las mezclas naftaleno-benzofenona a partir de las cuales se elaboró el diagrama.
Cuando se le adiciona a A(naftaleno) una pequeña cantidad de B(bensofenona), el punto de
solidificación de la mezcla disminuye y si ésta cantidad aumenta el punto de solidificación
lo hará aun más , la línea que une estos puntos de comienzo de la solidificación presentará
un mínimo tal como se ve en el diagrama; a éste punto se le denomina punto eutéctico, a la
temperatura correspondiente a éste punto temperatura eutéctica y a su composición,
composición eutéctica. En este punto se encuentran en equilibrio cristales de naftaleno y
benzofenona, y se denomina eutéctico del griego "de fusión fácil", porque corresponde a la
mínima temperatura de fusión a la cual una mezcla puede fundir.
Especificando en cuanto a la mezlca 50% naftaleno/ 50% benzofenona, se observó un
sobreenfriamiento porque esta solución no solidifico completamente, hasta que al momento
de intentar extraer la mezcla del tubo de ensayo y extenderla por las paredes del mismo,
una parte de dicha mezcla solidifico y se pudo registrar una temperatura minima de 16 |C,
de haberse tratado de un proceso normal, la solificacion hubiese ocurrido en la temperatura
a la que se registró el primer cristal, un sobreenfriamiento es un proceso en el que se
alcanza la fusión antes de alcanzar el punto de fusión correspondiente, consecuencia de
factores externos. El hecho de que una curva de enfriamiento presente discontinuidades
supone la existencia de alguna irregularidad en el cuerpo que se enfría, lo que debe
interpretarse como la realización de un proceso físicoquímico que se produce con
desprendimiento de calor, lo que retrasa el enfriamiento, reflejándose en la gráfica por una
disminución de su pendiente.
También podría gustarte
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Prueba de InfiltracionDocumento6 páginasPrueba de InfiltracionBenjamin C. Laura100% (11)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Mezcla EutecticaDocumento16 páginasMezcla Eutecticamonkyarc50% (2)
- Equilibrio Vapor LiquidoDocumento13 páginasEquilibrio Vapor LiquidoERCI100% (1)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Silabus 244Documento11 páginasSilabus 244Alcides Emerson Cerda GomezAún no hay calificaciones
- Concepto de PosiciónDocumento8 páginasConcepto de PosiciónJuan Martinez Jerez33% (3)
- Sandler 10Documento5 páginasSandler 10Omar SoteloAún no hay calificaciones
- Reacción 6lk5bvolátilDocumento34 páginasReacción 6lk5bvolátilXimena GutierrezAún no hay calificaciones
- Laboratorio 3 de FisicoquímicaDocumento14 páginasLaboratorio 3 de FisicoquímicaUlrich MogrovejoAún no hay calificaciones
- Mezcla Eutéctica GuiaDocumento6 páginasMezcla Eutéctica GuiaUluri JoelAún no hay calificaciones
- Destilacion FraccionadaDocumento26 páginasDestilacion FraccionadaLuis Antonio VazquezAún no hay calificaciones
- Resumen de Artículo Científico Equilibrio Líquido-VaporDocumento3 páginasResumen de Artículo Científico Equilibrio Líquido-VaporSebastian Camacho CerraAún no hay calificaciones
- Sistema Binario Sólido-Liquido Laboratorio-FisicoquimicaDocumento5 páginasSistema Binario Sólido-Liquido Laboratorio-Fisicoquimicamarcelina60% (1)
- Propiedades Fisicas, Punto de Fusion y EbullicionDocumento6 páginasPropiedades Fisicas, Punto de Fusion y EbullicionLorena JaramilloAún no hay calificaciones
- Practica 11 - Equipo 3Documento7 páginasPractica 11 - Equipo 3ReginaAún no hay calificaciones
- Informe 10 (Regla de Fases)Documento13 páginasInforme 10 (Regla de Fases)Jean AlvAún no hay calificaciones
- Mezcla Eutect HDocumento19 páginasMezcla Eutect HDavid QuispeAún no hay calificaciones
- Fases de Transformaciones de Los MetalesDocumento8 páginasFases de Transformaciones de Los MetalesbryanAún no hay calificaciones
- Cuestionario Diagrma de FasesDocumento5 páginasCuestionario Diagrma de FasesAndrés Gallardo AlbercaAún no hay calificaciones
- Determinacion Punto de Ebullicion PDFDocumento7 páginasDeterminacion Punto de Ebullicion PDFPedrin El Katalan SambranoAún no hay calificaciones
- Mezcla EutecticaDocumento24 páginasMezcla EutecticaStefani S RojasAún no hay calificaciones
- Determinacion Punto de Fusion Compuestos OrganicosDocumento6 páginasDeterminacion Punto de Fusion Compuestos OrganicosSara Saavedra Gonzalez100% (4)
- Equilibrio Solido-LiquidoDocumento9 páginasEquilibrio Solido-LiquidoCristian FigueroaAún no hay calificaciones
- INFORME-IVDocumento2 páginasINFORME-IVsilviaAún no hay calificaciones
- 10 Equilibrio Solido LiquidoDocumento10 páginas10 Equilibrio Solido LiquidoEduar Moreno LondoñoAún no hay calificaciones
- Equilibrio Liquido Vapor - InformeDocumento36 páginasEquilibrio Liquido Vapor - InformeCristhianPalaciosAún no hay calificaciones
- Benceno Vs ToluenoDocumento11 páginasBenceno Vs ToluenoNicole Orellana PintoAún no hay calificaciones
- Solido LiquidoDocumento17 páginasSolido LiquidoRaque PcAún no hay calificaciones
- Destilacion BencenoDocumento13 páginasDestilacion BencenoDejaee Bk D'alexkanitho100% (1)
- Inf-Diagrama de FasesDocumento26 páginasInf-Diagrama de FasesEddy RolanAún no hay calificaciones
- Guia de CalibracionDocumento7 páginasGuia de CalibracionlorenaAún no hay calificaciones
- Informe Liquido VaporDocumento11 páginasInforme Liquido Vaporgonzalex179100% (1)
- Informe Equilibrio SólidoDocumento8 páginasInforme Equilibrio SólidoLigia IzaguirreAún no hay calificaciones
- Destilación continua de vinos para obtener alcohol etílicoDocumento26 páginasDestilación continua de vinos para obtener alcohol etílicolucerocaAún no hay calificaciones
- Fenol Naftaleno Practica 2Documento9 páginasFenol Naftaleno Practica 2Enrique Herrera100% (1)
- Mezcla EutecticaDocumento25 páginasMezcla EutecticaTania Mireya VillarroelAún no hay calificaciones
- Fisico QuimicaDocumento17 páginasFisico QuimicaGianfranco Yucra RojasAún no hay calificaciones
- Destilacion Ing 3Documento14 páginasDestilacion Ing 3winnyAún no hay calificaciones
- Diagrama de Fases de Un Sistema BinarioDocumento3 páginasDiagrama de Fases de Un Sistema BinarioAbraham Falcon GrandeAún no hay calificaciones
- DESTILACIÓNDocumento16 páginasDESTILACIÓNJuan Julio BadaracoAún no hay calificaciones
- Conceptos generales de la destilación y sus aplicaciones en la separación de mezclasDocumento50 páginasConceptos generales de la destilación y sus aplicaciones en la separación de mezclaskomodiemoAún no hay calificaciones
- Tema 5 Separaciones Tc3a9rmicasDocumento80 páginasTema 5 Separaciones Tc3a9rmicasquimmaseda1144Aún no hay calificaciones
- Informe de Lab 2Documento6 páginasInforme de Lab 2unk93100% (1)
- Lab. 9 Fisica 2Documento10 páginasLab. 9 Fisica 2Rolando Silva UriarteAún no hay calificaciones
- Destilacion - TeoriaDocumento32 páginasDestilacion - TeoriaGracielaProiettiAún no hay calificaciones
- Destilacion Flash 2010. A. VALIENTE PDFDocumento75 páginasDestilacion Flash 2010. A. VALIENTE PDFJhonatan Mamani Cañasaca100% (1)
- 7-Tipos de DestilaciónDocumento11 páginas7-Tipos de DestilaciónesmeraldaAún no hay calificaciones
- Sistema fenol-agua: determinación de la temperatura y composición críticaDocumento5 páginasSistema fenol-agua: determinación de la temperatura y composición críticaCaleb Juárez Reyes100% (1)
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Esterificación de FischerDocumento1 páginaEsterificación de FischerJavier Andres UrreaAún no hay calificaciones
- Genesisrock IGDocumento2 páginasGenesisrock IGJavier Andres UrreaAún no hay calificaciones
- EstereoquimicaDocumento1 páginaEstereoquimicaJavier Andres UrreaAún no hay calificaciones
- Reseña y Acontecimientos Históricos de Las Vaguadas Ocurridas en El Estado VargasDocumento7 páginasReseña y Acontecimientos Históricos de Las Vaguadas Ocurridas en El Estado VargasJavier Andres UrreaAún no hay calificaciones
- La Energía SuperficialDocumento3 páginasLa Energía SuperficialJavier Andres UrreaAún no hay calificaciones
- El Fluir de La Conciencia HistoriografíaDocumento4 páginasEl Fluir de La Conciencia HistoriografíaJavier Andres UrreaAún no hay calificaciones
- ProcesosDocumento1 páginaProcesosJavier Andres UrreaAún no hay calificaciones
- Funciones de EstadoDocumento1 páginaFunciones de EstadoJavier Andres UrreaAún no hay calificaciones
- La Estereoquímica Es El Estudio de La Estructura TridimensionalDocumento1 páginaLa Estereoquímica Es El Estudio de La Estructura TridimensionalJavier Andres UrreaAún no hay calificaciones
- CalorimetríaDocumento1 páginaCalorimetríaJavier Andres UrreaAún no hay calificaciones
- Propiedad de Las Minas VnzlaDocumento4 páginasPropiedad de Las Minas VnzlaJavier Andres UrreaAún no hay calificaciones
- La Estereoquímica Es El Estudio de La Estructura TridimensionalDocumento1 páginaLa Estereoquímica Es El Estudio de La Estructura TridimensionalJavier Andres UrreaAún no hay calificaciones
- Compuestos MezclasDocumento1 páginaCompuestos MezclasJavier Andres UrreaAún no hay calificaciones
- La Energía SuperficialDocumento3 páginasLa Energía SuperficialJavier Andres UrreaAún no hay calificaciones
- Desarrollo de La Tabla PeriódicaDocumento1 páginaDesarrollo de La Tabla PeriódicaJavier Andres UrreaAún no hay calificaciones
- Equilibrio químico: Reacción del ion tetraclorocobaltato(II) con aguaDocumento1 páginaEquilibrio químico: Reacción del ion tetraclorocobaltato(II) con aguaJavier Andres UrreaAún no hay calificaciones
- La Energía SuperficialDocumento3 páginasLa Energía SuperficialJavier Andres UrreaAún no hay calificaciones
- Por Qué Estudiar QuímicaDocumento1 páginaPor Qué Estudiar QuímicaJavier Andres UrreaAún no hay calificaciones
- 2.1 La Teoría Atómica de La Materia: - (Sección 1.1)Documento1 página2.1 La Teoría Atómica de La Materia: - (Sección 1.1)Aby MartinezAún no hay calificaciones
- Quimica EstudiarDocumento2 páginasQuimica EstudiarJavier Andres UrreaAún no hay calificaciones
- La Energía SuperficialDocumento3 páginasLa Energía SuperficialJavier Andres UrreaAún no hay calificaciones
- Termodinamica Calor de Reaccion EntropiaDocumento2 páginasTermodinamica Calor de Reaccion EntropiaJavier Andres UrreaAún no hay calificaciones
- Funciones de EstadoDocumento1 páginaFunciones de EstadoJavier Andres UrreaAún no hay calificaciones
- El Proceso de DisoluciónDocumento1 páginaEl Proceso de DisoluciónJavier Andres UrreaAún no hay calificaciones
- Antes de Viajar A Una Ciudad DesconocidaDocumento1 páginaAntes de Viajar A Una Ciudad DesconocidaJavier Andres UrreaAún no hay calificaciones
- Por Qué Estudiar QuímicaDocumento1 páginaPor Qué Estudiar QuímicaJavier Andres UrreaAún no hay calificaciones
- El Potencial QuímicoDocumento3 páginasEl Potencial QuímicoJavier Andres UrreaAún no hay calificaciones
- El Proceso de DisoluciónDocumento3 páginasEl Proceso de DisoluciónJavier Andres UrreaAún no hay calificaciones
- El Proceso de DisoluciónDocumento1 páginaEl Proceso de DisoluciónJavier Andres UrreaAún no hay calificaciones
- Recipientes A PresionDocumento44 páginasRecipientes A PresionRous Pastor Abanto0% (1)
- Introducción a la Física Universitaria: Análisis de Situaciones y EjerciciosDocumento2 páginasIntroducción a la Física Universitaria: Análisis de Situaciones y EjerciciosJimmy RebitAún no hay calificaciones
- Momento angular cuánticoDocumento7 páginasMomento angular cuánticoGerardo NavarreteAún no hay calificaciones
- Coordenadas Esféricas y CilindricasDocumento8 páginasCoordenadas Esféricas y CilindricasDavid RubioAún no hay calificaciones
- Laboratorio 8 de FísicaDocumento12 páginasLaboratorio 8 de FísicaLaura ViafaraAún no hay calificaciones
- Trabajo Grupo 4 InductanciaDocumento16 páginasTrabajo Grupo 4 InductanciaDionel100% (1)
- Practica CalorimetriaDocumento24 páginasPractica CalorimetriaAreli AltamiranoAún no hay calificaciones
- Semana 2b-2016-1 Tito Cinematica de La ParticulaDocumento34 páginasSemana 2b-2016-1 Tito Cinematica de La ParticulaJose Luis Cuenca CuencaAún no hay calificaciones
- Modelo EstándarDocumento7 páginasModelo EstándarjordivibeAún no hay calificaciones
- 980H Wheel Loader KZL00001-UP (MACHINE) POWERED BY C15 Engine (SEBP5737 - 46) - Sistemas y ComponentesDocumento7 páginas980H Wheel Loader KZL00001-UP (MACHINE) POWERED BY C15 Engine (SEBP5737 - 46) - Sistemas y ComponentesEmma OjedaAún no hay calificaciones
- PrincipioFuncionamiento MicrostripDocumento3 páginasPrincipioFuncionamiento MicrostripLuis Miguel MorilloAún no hay calificaciones
- Simulación de lazo cerrado de un motor DC en SimulinkDocumento12 páginasSimulación de lazo cerrado de un motor DC en SimulinkStela RamirezAún no hay calificaciones
- Electricidad PDFDocumento35 páginasElectricidad PDFLuis David100% (1)
- Convertidor de Torque.Documento43 páginasConvertidor de Torque.GILMAR NIETOAún no hay calificaciones
- 5a ESFUERZO EN UNA MAZA DE SUELODocumento16 páginas5a ESFUERZO EN UNA MAZA DE SUELOSarita Sanchez Apolitano100% (1)
- Revisión de La Investigación de Flujo de EscombrosDocumento19 páginasRevisión de La Investigación de Flujo de EscombrosKate Ochoa CárdenasAún no hay calificaciones
- S09 s1+-+HT+Descomposición+de+VectoresDocumento3 páginasS09 s1+-+HT+Descomposición+de+VectoresCamisnzAún no hay calificaciones
- Ingenieria Industrial Conceptos BasicosDocumento13 páginasIngenieria Industrial Conceptos BasicososmeiderAún no hay calificaciones
- Informe Lab Fisica Mec 9Documento10 páginasInforme Lab Fisica Mec 9Angie Arrieta MendozaAún no hay calificaciones
- Dimensionamiento de estribo de puenteDocumento36 páginasDimensionamiento de estribo de puenteCristian Mondragon BecerraAún no hay calificaciones
- Modelado de Un PénduloDocumento5 páginasModelado de Un PénduloReNé ShunAún no hay calificaciones
- t.5 Trayectorias PolaresDocumento6 páginast.5 Trayectorias PolaresFERNANDO ALONSO SANUDO OSORIO0% (1)
- Análisis dinámico estructura pórtico FHEDocumento27 páginasAnálisis dinámico estructura pórtico FHEJuan J GalánAún no hay calificaciones
- Practica N - 6 (Número de Reynolds)Documento5 páginasPractica N - 6 (Número de Reynolds)mary solAún no hay calificaciones
- Preinforme RodaduraDocumento3 páginasPreinforme RodaduraEdinson Garcia DiazAún no hay calificaciones
- Taller de FlexiónDocumento4 páginasTaller de FlexiónJorge Andres Montoya QuirozAún no hay calificaciones
- Taller de AcústicaDocumento1 páginaTaller de AcústicaDanny Marin0% (1)