Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Problemas Propuestos para El Segundo Examen
Cargado por
Victor V IeDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Problemas Propuestos para El Segundo Examen
Cargado por
Victor V IeCopyright:
Formatos disponibles
UNMSM EAPIM
Fisicoquimica II semestre 2007
PROBLEMAS PROPUESTOS PARA EL SEGUNDO EXAMEN
1.Cual ser la entropa en la fusin y en la vaporizacin de una mol de
etanol a la presin atmosfrica normal, el etanol funde a 156 K con un f
igual a 1150 cal/mol en el punto de ebullicin de 351 K y su v es de 9390
cal/mol.
2.- La entropa del oxigeno gaseoso a 298K y una atmsfera de presin es
49 cal/mol grado. Halla su entropa a 373K y una atmsfera Si su capacidad
calorfica a P = cte viene dada por la siguiente ecuacin:
cp = 6,5 + 0,001 T cal/mol K
3.- Calcular el cambio total de entropa del agua cuando 1 mol de agua liquida
a la temperatura de -10C se transforma en hielo a -10C.
H2O(L, -10C,Patm)
--------
H2O(s, -10C,Patm)
4.- Calcular el cambio total de entropa en la expansin reversible de un gas
desde un volumen inicial de 1 litro hasta un volumen final de 10 litros si el
proceso ocurre a una temperatura constante de 27C y a una presin de 10
atmsferas.
5.- Calcular el todas las funciones termodinmicas: E, H, S, G, Q y W.
Cuando un mol de gas ideal a 127C y a una presin de 1 atmsfera, se
expande isotermicamente y de manera reversible hasta que su presin es de
0,010 atmsferas.
6.- Calcular el cambio total de entropa en el proceso que le ocurre a una mol
de vapor sobresaturado de agua a 110C y una atmsfera de presin que
condensndose y luego sobre enfrindose el agua liquida, forma hielo a
-10C.
Calor especifico del agua:
H2O(s) = 0,49 cal/gC
H2O(L) = 1,0 cal/gC
H2O(v) = 0,48 cal/gC
v = 540 cal/g
f = 79,78 cal/g
7.- Calcular el cambio total de entalpa en el proceso que ocurre cuando se
saca un bloque de hielo de 1 Kg de un congelador a -10C se coloca en un
recipiente y se deja fundir, luego se calienta hasta ebullicin para
Profesora del curso: Ingeniera Qumica Godelia Canchari Silverio
UNMSM EAPIM
Fisicoquimica II semestre 2007
convertirlo en vapor sobrecalentado hasta una temperatura de 110C y una
atmsfera de presin. Cual ser el Calor total absorbido?
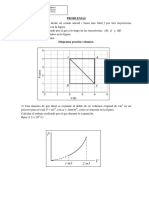
8.- En el siguiente ciclo de Carnot en el que opera una maquina trmica ideal,
entre una T1 = 273 y T2; ha producido un trabajo de 1000 cal por ciclo;
Calcular: Q1 ; Q2 y T2.
TK
T2
273
40
80
S cal/grado
9.- Calcular el trabajo que se gasta en una maquina refrigeradora que
funciona siguiendo un ciclo reversible entre 0C y 25C, para congelar 1 Kg
de agua a 0C, sabiendo que el calor latente de solidificacin del agua es de
79,78 cal/g
10.- Una fabrica de hielo utiliza el agua a 0C y desprende el calor a 27C.
Si producen 150 Kg de hielo por hora y se desprenden 25000 Kcal.
Calcular la eficiencia de la instalacin; es decir la relacin entre la
cantidad de Wrev necesario para congelar el agua y la cantidad de trabajo
gastado.
11.-
La
reaccin
de
sntesis
del
acetileno,
2 C (grafito) + H2(g) = C2H2(g)
C2H2,
es:
Calcular su variacin de entalpa a partir de sus entalpas de formacin
a) 2 C2H2(g) + 5 O2(g) = 4 CO2(g) + 2 H2O(l) ; Ha=-2598,8 kJ
Profesora del curso: Ingeniera Qumica Godelia Canchari Silverio
UNMSM EAPIM
Fisicoquimica II semestre 2007
b) C (grafito) + O2(g) = CO2(g) ; Hb= -393,5 kJ
c) H2(g) + 1/2 O2(g) = H2O(l) ; Hc=-285,8 kJ
12.- A partir de las siguientes ecuaciones termoqumicas:
(1) Pb (s) + O2 (g).. PbO2 (s)
H1 = -276,3 kJ
(2) 6 PbO (s) + O2 (g) 2 Pb3O4 (s)
H2 = -153,8 kJ
(3) Pb3O4 (s) + O2 (g) .. 3 PbO2 (s)
H3 = -94,9 kJ
Calcular la entalpa estndar de formacin del xido de plomo (II).
13.- Para la reaccin
C(grafito) + H2O (g)
CO(g) + H2(g)
DHo298 = 31,38 kcal/mol. Los valores de la capacidad calorfica molar en el
estado de referencia expresadas como cal.grad -1.mol-1 son: grafito: 2,066;
H2O(g):8,025; CO(g):6,965 y H2(g):6,892. Calcular el valor de Ho a 125C.
14.- Se comprime reversible y adiabticamente una muestra de 1,00 mol de
un gas diatmico a 200 K hasta que su temperatura alcanza los 250 K.
Sabiendo que la capacidad calorfica molar a volumen constante vale 27,5
J.K-1. mol-1, calcular q, w, E, H, S.
15.- 1,00 mol de un gas ideal monoatmico ( C v,m = 1,5 R) efecta un ciclo de
Carnot. En el estado inicial ocupa 4,92 L a 10 atm y 600 K. Despus de
expandirse isotrmicamente, el volumen es 49,2 L a la presin de 1,00 atm
(etapa 1). Posteriormente de forma adiabtica el gas pasa a 139,2 L a 0,176
atm y 300 K (etapa 2). Esta expansin es seguida por una compresin
isotrmica hasta el volumen 13,9 L y presin 1,76 atm (etapa 3) y
posteriormente una compresin adiabtica (etapa 4) que lo lleva de nuevo al
estado inicial. Determinar los valores de S para cada etapa del ciclo y para
el ciclo completo.
16.- La capacidad calorfica molar a presin constante para un cierto gas
ideal, vara con la temperatura de acuerdo con la ecuacin: C p,m/(J.K-1.mol-1) =
12,47 + 0,1111 T/K Calcular q, w, E, H y S se aumenta la temperatura de
1 mol del gas desde 283 K hasta 1273 K a la presin constante de 2 atm.
17.- Un mol de un gas ideal (Cm,v = 5/2 R) inicialmente a 20C y 5 atm, se
expansiona adiabticamente hasta una presin de 1 atm, despus se calienta
isobricamente hasta que su temperatura vuelve a ser de 20C y por ltimo
se comprime isotrmicamente hasta volver a la presin de 5 atm.
Profesora del curso: Ingeniera Qumica Godelia Canchari Silverio
UNMSM EAPIM
Fisicoquimica II semestre 2007
Determinar el volumen en cada etapa y dibujar el ciclo en un diagrama PV.
Calcular: q, w, ,H para cada etapa y para el ciclo.
18.- Calcular S para convertir 1 mol de hielo a 0C y 1 atm a vapor de agua
a 100C y 0,5 atm. Los calores latentes de fusin y de vaporizacin son 1435
y 9360 cal.mol-1 respectivamente. Cm,p (lquido) = 18 cal.mol-1.K-1.
19.- Un mol de un gas ideal con C v,m = 3R/2 se expande reversiblemente
desde 24,6 litros y 300 K a 49,2 litros. Calcular la temperatura y presin
finales si la expansin es: a) isotrmica, b) adiabtica. Dibujar los dos
procesos en el mismo diagrama P-V y calcular q, w, , H para ambos
procesos.
20.- Calcular S para convertir un mol de hielo a -10C y 760 torr a 1 mol de
vapor de agua a 100C y 380 torr. Suponer comportamiento ideal. Hacer un
esquema de las distintas etapas. Calores latentes de fusin y de
vaporizacin 1435 y 9360 cal/mol respectivamente. Cp(slido) =
0,5+0,03T(cal/K) y Cp (lquido) = 18 cal/K.
21.- 2 moles de un gas ideal (CV,m = cal.K-1 mol-1) realizan un ciclo formado por
las siguientes etapas: Desde un estado inicial (1) de 30 litros y 1,5
atmsferas pasa isocricamente a un estado (2), luego se expansiona
adiabticamente a un estado (3) duplicando su volumen, y finalmente vuelve
isobricamente al estado inicial. Dibujar el proceso en un diagrama PV y
calcular: q, w, , H, S para cada etapa y para el ciclo.
22.- Para un gas ideal se ha observado que C p / (J.K-1.mol-1) = 14,73 + 0,1272
(T/K). Calcular q, w, y H para 1,00 mol cuando se incrementa la
temperatura desde 25 C hasta 200 C a presin constante de 1 atm.
23.- Para un gas ideal se ha observado que Cm,p / (J.K-1.mol-1) = 14,73 +
0,1272 (T/K). Calcular S cuando 2,00 moles se calientan desde 27 C hasta
127 C a presin constante de 1 atm.
24.- Para cierto gas perfecto, Cm,v =2,5R a todas las temperaturas. Calcular
q,w,,H cuando un mol de este gas experimenta cada uno de los
siguientes procesos: a) una expansin reversible isobrica desde 1 atm y 20
dm3 hasta 40 dm3; b) un cambio de estado reversible e isocrico desde 1
atm y 40 dm3 hasta 0,5 atm; c) una compresin reversible isotrmica desde
0,5 atm y 40 dm3 hasta 1 atm y 20 dm 3. Representar cada proceso en el
mismo diagrama P-V
Profesora del curso: Ingeniera Qumica Godelia Canchari Silverio
UNMSM EAPIM
Fisicoquimica II semestre 2007
25.- Un mol de un gas ideal inicialmente a 2,44 atm, 25C y 10 litros duplica
su volumen por expansin adiabtica reversible. Calcular: a) la presin final y
b) q, w, , H, S en caloras. Repetir los clculos de los apartados a) y b)
si la expansin fuese isotrmica reversible ( = 1,67; Cm,V = 3/2 R).
26.- 1 mol de un gas ideal monoatmico (Cv,m = 1,5 R) ocupa un volumen de
22,4 L a 1 atm y sufre un proceso cclico en el que la primera etapa es una
expansin isotrmica hasta un volumen doble del inicial. En una segunda
etapa se comprime a presin constante hasta reducir el volumen a la mitad
y, en la tercera etapa se le vara la presin a volumen constante de modo
que se llega al estado inicial. Calcular q, w, y S para cada etapa del ciclo.
27.- Un mol de gas ideal diatmico ( = 1,4) inicialmente a V1 = 5 litros, P1 = 3
atm y T1 experimenta un proceso cclico reversible formado por las
siguientes etapas:
a) Calentamiento a volumen constante hasta un estado (2).
b) Compresin isotrmica a 273 K hasta un estado (3).
c) Expansin adiabtica hasta el estado inicial (1).
Dibujar los procesos en un diagrama P-V y calcular q, w, E, H para cada
etapa y para el ciclo.
28.- Para un gas ideal se ha observado que C P,m / (J.K-1.mol-1) = 14,73 +
0,1272 (T/K). Calcular q, w, y H para 1,00 mol cuando se incrementa la
temperatura desde 25 C hasta 200 C a presin constante de 1 atm.
29.- Un ciclo de Carnot emplea 1,00 mol de un gas ideal monoatmico (C V,m =
1,5 R) como sustancia de trabajo que en el estado inicial se encuentra a 10
atm y 600 K. El gas se expande isotrmicamente hasta una presin de 1,00
atm (etapa 1) y posteriormente de forma adiabtica hasta una temperatura
de 300 K (etapa 2).
Esta expansin es seguida de una compresin isotrmica (etapa 3) y
posteriormente una compresin adiabtica (etapa 4) que lo lleva de nuevo al
estado inicial. Determinar los valores de q, w, , H y S para cada etapa
del ciclo y para el ciclo completo. Calcular el rendimiento de la mquina
trmica.
Profesora del curso: Ingeniera Qumica Godelia Canchari Silverio
También podría gustarte
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Guía Ejercicios TDDocumento6 páginasGuía Ejercicios TDKatheryn MondragónAún no hay calificaciones
- TALLER No.2 ESTEQUIOMETRIADocumento5 páginasTALLER No.2 ESTEQUIOMETRIADANIELA PEREA GIRALDOAún no hay calificaciones
- Op Sec FisQui T 17 Entropia Segundo Principio TermodinamicaDocumento18 páginasOp Sec FisQui T 17 Entropia Segundo Principio TermodinamicaHector Triana100% (1)
- Ejercicios Capítulo 3Documento4 páginasEjercicios Capítulo 3Brian ArroyoAún no hay calificaciones
- Propuestos Segundo ExamenDocumento3 páginasPropuestos Segundo ExamenAldo Alvarez SalvadorAún no hay calificaciones
- Ecuaciones de EstadoDocumento12 páginasEcuaciones de EstadoDavid IsraelAún no hay calificaciones
- ENTROPIADocumento11 páginasENTROPIAKike RodriguezAún no hay calificaciones
- Tutorial de TeXmacsDocumento81 páginasTutorial de TeXmacsCarlos Andrés Pérez100% (1)
- ENTROPIADocumento9 páginasENTROPIANevsaint MartinezAún no hay calificaciones
- Cálculo de Un Reactor Catalítico de Lecho FluidizadoDocumento39 páginasCálculo de Un Reactor Catalítico de Lecho FluidizadoRomina RussianAún no hay calificaciones
- Termodinamica de Reacciones QuimicasDocumento31 páginasTermodinamica de Reacciones QuimicasVictor Alberto Solano GaviñoAún no hay calificaciones
- Mecánica de FluidosDocumento2 páginasMecánica de Fluidosluna olivaresAún no hay calificaciones
- Variación de EntropíaDocumento8 páginasVariación de EntropíaCuasar PulsarAún no hay calificaciones
- Análisis Gráfico de DatosDocumento11 páginasAnálisis Gráfico de DatosNelcy MiramagAún no hay calificaciones
- Practica 7 Brigada #4Documento6 páginasPractica 7 Brigada #4Cuevas Alvarado DavidAún no hay calificaciones
- Ejercicios Resueltos Uso Carta Psicrometrica Nivel II Junio 2020Documento15 páginasEjercicios Resueltos Uso Carta Psicrometrica Nivel II Junio 2020Rico Lopez Esperanza100% (1)
- Potenciometrica de HalurosDocumento5 páginasPotenciometrica de HalurosFlor Matias100% (1)
- Guía de Prácticos de Física II - Práctica v. 1.00 (Final)Documento14 páginasGuía de Prácticos de Física II - Práctica v. 1.00 (Final)Valeria Laura Vera Escobar100% (1)
- Síntesis de Una PerovskitaDocumento6 páginasSíntesis de Una PerovskitaDiana LopezAún no hay calificaciones
- Ecuacion de ClapeyronDocumento11 páginasEcuacion de ClapeyronEnrique Castillo Sanchezz100% (1)
- Regla de FasesDocumento26 páginasRegla de FasesPamela Vidal SalazarAún no hay calificaciones
- Problemas 3. Classroom 2019 IDocumento4 páginasProblemas 3. Classroom 2019 IAlain Llanqui ChocataAún no hay calificaciones
- Calor Parte2 Clase8Documento11 páginasCalor Parte2 Clase8Rudecindo Araya TerceroAún no hay calificaciones
- Laboratorio GasesDocumento2 páginasLaboratorio GasesYandery YanaAún no hay calificaciones
- Apuntes para El CursoDocumento82 páginasApuntes para El CursoNestor LendizabalAún no hay calificaciones
- Efecto JouleDocumento11 páginasEfecto JouleWilliam Junior Guthrié RíosAún no hay calificaciones
- Cálculo de Las Propiedades Termodinámicas Modelos MatemáticosDocumento11 páginasCálculo de Las Propiedades Termodinámicas Modelos MatemáticosMijhael Anatholi Romero MamaniAún no hay calificaciones
- CALORIMETRÍADocumento25 páginasCALORIMETRÍAMartin Eduardo Marchena TiradoAún no hay calificaciones
- TERMODINÁMICADocumento46 páginasTERMODINÁMICARosember Romero AcuñaAún no hay calificaciones
- FisicoquimicaDocumento26 páginasFisicoquimicaJairArmandoGomezPerezAún no hay calificaciones
- Practica de Quimica Gases Ideales y HumedosDocumento5 páginasPractica de Quimica Gases Ideales y HumedosRamiroUluriMamaniAún no hay calificaciones
- Segundo Trabajo de TermodinamicaDocumento18 páginasSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaAún no hay calificaciones
- 2do INFORME FISICOQUIMICADocumento37 páginas2do INFORME FISICOQUIMICACarlos Quispe C0% (1)
- Tercer Principio de La TermodinámicaDocumento39 páginasTercer Principio de La TermodinámicaCarlos HuachoAún no hay calificaciones
- Problemario #2 GVDMDocumento9 páginasProblemario #2 GVDMMonse González ValenciaAún no hay calificaciones
- Diagrama TernarioDocumento20 páginasDiagrama TernarioH Marquez R Graciela100% (1)
- Ciclo TermodinámicoDocumento11 páginasCiclo Termodinámicofranco di gregorioAún no hay calificaciones
- Hoja 7Documento3 páginasHoja 7AlexThunderAún no hay calificaciones
- Reposición III Parcial UHDocumento4 páginasReposición III Parcial UHJeff VillaplanaAún no hay calificaciones
- Labo de Electronica 2Documento16 páginasLabo de Electronica 2Dan Li DiAún no hay calificaciones
- Guia 1Documento8 páginasGuia 1Junior Benjamin Castro FloresAún no hay calificaciones
- Conexión Entre La Física Estadística y La TermodinámicaDocumento46 páginasConexión Entre La Física Estadística y La TermodinámicaAmIn20122Aún no hay calificaciones
- ManualDocumento45 páginasManualFernando MendozaAún no hay calificaciones
- Números AdimensionalesDocumento5 páginasNúmeros AdimensionalesTebyBritoAún no hay calificaciones
- Cinética ExposiciónDocumento106 páginasCinética ExposiciónYanella Smith Arevalo GonzalesAún no hay calificaciones
- Determinación Del Índice AdiabáticoDocumento4 páginasDeterminación Del Índice Adiabáticoc_s_blackAún no hay calificaciones
- Ley de Boyle Universidad Tecnologica de PanamáDocumento9 páginasLey de Boyle Universidad Tecnologica de Panamálily100% (2)
- Cuestionario Previo 8. Ley de CharlesDocumento2 páginasCuestionario Previo 8. Ley de CharlesDiego CárdenasAún no hay calificaciones
- Equilibrio SimultaneoDocumento10 páginasEquilibrio SimultaneoOctavio AmtzAún no hay calificaciones
- MemoriaDocumento13 páginasMemorialucia de lucasAún no hay calificaciones
- Ley RaoultDocumento3 páginasLey RaoultEnrique ZarateAún no hay calificaciones
- Tarea 1 de Quimica Aplicada UpiicsaDocumento1 páginaTarea 1 de Quimica Aplicada UpiicsaDaniel VegaAún no hay calificaciones
- Problemario Fisicoquímica I Segunda ParteDocumento3 páginasProblemario Fisicoquímica I Segunda ParteLuisJorgeMaldonadoRincónAún no hay calificaciones
- DISEÑO DE TORRES TerminadoDocumento36 páginasDISEÑO DE TORRES TerminadoLuis Carlos Calderon100% (2)
- Taller de Operaciones Solido Fluido Avanzadas Daniel Alejandro Calisaya AzpilcuetaDocumento20 páginasTaller de Operaciones Solido Fluido Avanzadas Daniel Alejandro Calisaya AzpilcuetaDaniel Calisaya AzpilcuetaAún no hay calificaciones
- Reemplazamiento de EquiposDocumento25 páginasReemplazamiento de EquiposVictor V IeAún no hay calificaciones
- El Reemplazo de Equipos MinerosDocumento16 páginasEl Reemplazo de Equipos MinerosVictor V IeAún no hay calificaciones
- Angulo de ReposoDocumento7 páginasAngulo de ReposoVictor V IeAún no hay calificaciones
- Regla de Fases - Sulfato de CuDocumento31 páginasRegla de Fases - Sulfato de CuVictor V IeAún no hay calificaciones
- Estados FinancierosDocumento21 páginasEstados FinancierosVictor V Ie100% (1)
- Laboratorio 3Documento14 páginasLaboratorio 3Victor V IeAún no hay calificaciones
- GLOSARIODocumento4 páginasGLOSARIOAlvi-pba SantiagoAún no hay calificaciones
- Mapa Conceptual Actividad 2 Evidencia 3Documento4 páginasMapa Conceptual Actividad 2 Evidencia 3Eva Contreras80% (5)
- Estudio Hidrologico e Hidraulico CorisDocumento40 páginasEstudio Hidrologico e Hidraulico Corisalfonso luis mendoza de la cruzAún no hay calificaciones
- Sentido Numérico y Pensamiento AlgebraicoDocumento8 páginasSentido Numérico y Pensamiento AlgebraicoMariano MatamorosAún no hay calificaciones
- Ruleta Digital Con PIC18F4550Documento3 páginasRuleta Digital Con PIC18F4550Javier Mendoza100% (1)
- Leemos Un Texto Narrativo de Las 3rDocumento6 páginasLeemos Un Texto Narrativo de Las 3rMaricel Gamarra Reynoso100% (1)
- Actividad 9 para Los Alumnos de Estadistica Aplicada 10 A Probabilidad, Permutaciones y CombinacionesDocumento2 páginasActividad 9 para Los Alumnos de Estadistica Aplicada 10 A Probabilidad, Permutaciones y Combinacionesmarco_valle_30Aún no hay calificaciones
- Desarrollo Integral y Sustentable de Lagunas Costeras MexicanasDocumento25 páginasDesarrollo Integral y Sustentable de Lagunas Costeras MexicanasDennis QuispeAún no hay calificaciones
- Articulo EducativoDocumento6 páginasArticulo EducativoAda Yris ValenzuelaAún no hay calificaciones
- Mineros S. A: Inspección A Lancha N.º 3 Informe N.º 21 - 003J12 - IG01Documento11 páginasMineros S. A: Inspección A Lancha N.º 3 Informe N.º 21 - 003J12 - IG01Carlos Eugenio Lovera VelasquezAún no hay calificaciones
- Iper Ilo 1Documento39 páginasIper Ilo 1Wendy GarciaAún no hay calificaciones
- Trabajo Final de Pruebas Psicp 2Documento9 páginasTrabajo Final de Pruebas Psicp 2Yosmeidy Rosariopena100% (1)
- Teoria BásicaDocumento3 páginasTeoria BásicaDavid MorenoAún no hay calificaciones
- Proyecto IVDocumento19 páginasProyecto IVjose NogueraAún no hay calificaciones
- Tesis InsightDocumento5 páginasTesis InsightMonica GallegosAún no hay calificaciones
- Rubrica, Unidad 2, Administracion GlobalDocumento3 páginasRubrica, Unidad 2, Administracion GlobalKeun TaeyangAún no hay calificaciones
- Realidad Aumentada en MovilesDocumento90 páginasRealidad Aumentada en MovilesCesar UndaAún no hay calificaciones
- AntropometriaDocumento4 páginasAntropometriajose maria loango chamorroAún no hay calificaciones
- Adminunife,+6 +Plan+de+EstimulacionDocumento3 páginasAdminunife,+6 +Plan+de+EstimulacionEcia MoraperedaAún no hay calificaciones
- Software Centro de Salud JavaDocumento9 páginasSoftware Centro de Salud JavaAplcacionCentroDeSalud100% (1)
- Boquillas AlbuzDocumento40 páginasBoquillas AlbuzLeoFrancoAún no hay calificaciones
- Bitacora 1Documento11 páginasBitacora 1Franco Armando Salgado BazanAún no hay calificaciones
- SVCS de Inf AeronáuticaDocumento11 páginasSVCS de Inf AeronáuticacontroladoraereoAún no hay calificaciones
- Grupo Quimera, Curso de Lectura Comprensiva, Edicions de La Universitat de Lleida 1995 PDFDocumento187 páginasGrupo Quimera, Curso de Lectura Comprensiva, Edicions de La Universitat de Lleida 1995 PDFhector hernandez100% (2)
- Trabajo Semana 6 - Preguntas de InvestigaciónDocumento3 páginasTrabajo Semana 6 - Preguntas de InvestigaciónFEsquiviasHuamanAún no hay calificaciones
- Control Banding DGSSTDocumento3 páginasControl Banding DGSSTRoberto CastroAún no hay calificaciones
- Actividad 1Documento4 páginasActividad 1Fernanda RomeroAún no hay calificaciones
- Ubicación SocialDocumento2 páginasUbicación SocialCarolina Cornejo Farías100% (2)
- Tesis Sus Característica y RequisitosDocumento2 páginasTesis Sus Característica y RequisitosFelipon9367% (6)