Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ácido Clorhídrico
Cargado por
Cesar Yerba ApazaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ácido Clorhídrico
Cargado por
Cesar Yerba ApazaCopyright:
Formatos disponibles
cido clorhdrico
El cido clorhdrico, cido muritico, espritu de sal, cido marino, cido de sal o todava ocasionalmente llamado, cido hidroclrico (por su extraccin a partir de sal marina en Amrica), agua fuerte o salfumn (en Espaa), es una disolucin acuosa del gas cloruro de hidrgeno (HCl). Es muy corrosivo y cido. Se emplea comnmente como reactivo qumico y se trata de un cido fuerte que se disocia completamente en disolucin acuosa. Una disolucin concentrada de cido clorhdrico tiene un pH inferior a 1; una disolucin de HCl 0,1 M da un pH de 1 (Con 40 mL es suficiente para matar a un ser humano, en un litro de agua. Al disminuir el pH provoca la muerte de toda la microbiota gastrointestinal, adems de la destruccin de los tejidos gastrointestinales). A temperatura ambiente, el cloruro de hidrgeno es un gas ligeramente amarillo, corrosivo, no inflamable, ms pesado que el aire, de olor fuertemente irritante. Cuando se expone al aire, el cloruro de hidrgeno forma vapores corrosivos densos de color blanco. El cloruro de hidrgeno puede ser liberado por volcanes. El cloruro de hidrgeno tiene numerosos usos. Se usa, por ejemplo, para limpiar, tratar y galvanizar metales, curtir cueros, y en la refinacin y manufactura de una amplia variedad de productos. El cloruro de hidrgeno puede formarse durante la quema de muchos plsticos. Cuando entra en contacto con el agua, forma cido clorhdrico. Tanto el cloruro de hidrgeno como el cido clorhdrico son corrosivos. El cido clorhdrico o todava ocasionalmente llamado, cido muritico, es una disolucin acuosa del gas cloruro de hidrgeno (HCl). Es muy corrosivo y cido. Se emplea comnmente como reactivo qumico y se trata de un cido fuerte que se disocia completamente en disolucin acuosa. Una disolucin concentrada de cido clorhdrico tiene un pH de menos de 1; una disolucin de HCl 1 M da un pH de 0.
cido clorhdrico
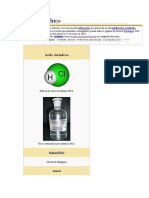
Molcula de cido clorhdrico (HCl).
Frasco conteniendo cido clorhdrico (HCl).
Qumica[editar]
Reaccin de cido clorhdrico con amonaco, liberando vapores blancos de cloruro de amonio. El cloruro de hidrgeno es un cido monoprtico, lo que significa que slo puede liberar un ion H+ (un protn). En soluciones acuosas, este electrn se une a una molcula de agua para dar un ion oxonio, H3O+: HCl + H2O H3O+ + Cl El otro ion formado es Cl, el ion cloruro. El cido clorhdrico puede entonces ser usado para preparar sales llamadas cloruros, como el cloruro de sodio. El cido clorhdrico es un cido fuerte, ya que se disocia completamente en agua. Los cidos monoprticos tienen una constante de disociacin cida, Ka, que indica el nivel de disociacin en agua. Para cidos fuertes como el HCl, el valor de Ka es alto. Al agregar cloruros, como el NaCl, a una solucin acuosa de HCl, el valor de pH prcticamente no cambia, lo que indica que el ion Cl es una base conjugada
notablemente dbil, y que HCl est casi completamente disociado en soluciones acuosas. Por lo tanto, para soluciones de cido clorhdrico de concentracin relativamente altas, se puede asumir que la concentracin de H+ es igual a la de HCl. De los siete cidos fuertes comunes en la qumica, todos ellos inorgnicos, el cido clorhdrico es el cido monoprtico con menor tendencia a provocar reacciones redox que puedan interferir con otras reacciones. Es uno de los cidos fuertes menos peligrosos de manipular; y a pesar de su acidez, produce el relativamente poco reactivo y no txico ion cloruro. Sus soluciones de concentraciones intermedias son bastante estables (hasta 6 M), manteniendo sus concentraciones con el paso del tiempo. Estos atributos, sumados al hecho de que se encuentra disponible como un reactivo puro, lo hacen un excelente reactivo acidificante, y valorante cido (para determinar la cantidad de base en una volumetra). Es comnmente utilizado en el anlisis qumico y para digerir muestras para anlisis. Soluciones concentradas de este cido pueden utilizarse para disolver algunos metales (metales activos), formando cloruros metlicos oxidados e hidrgeno gas.
Propiedades fsicas[editar]
Las propiedades fsicas del cido clorhdrico, tales como puntos de fusin y ebullicin, densidad, y pH dependen de la concentracin o molaridad de HCl en la solucin cida. Calor Presi Conc. Conc. Punto Punt Viscosid especfi n (m/m) (m/v) Densid Molarid de o de p ad co de c: c: ad ad ebullici fusi : s: H vapor kg HCl/ kg HCl/ : kg/l M n n mPas kJ/(kg PHCl : 3 kg m b.p. m.p. K) Pa 10% 104,80 1,048 2,87 M 0,5 1,16 3,47 0,527 103 C 18 C 59 C 52 C 43 C 36 C 30
20%
219,60
1,098
6,02 M
0,8
1,37
2,99
27,3
108 C
30%
344,70
1,149
9,45 M
1,0
1,70
2,60
1.410
90 C
32%
370,88
1,159
10,17 M 1,0
1,80
2,55
3.130
84 C
34% 36%
397,46 424,44
1,169 1,179
10,90 M 1,0 11,64 M 1,1
1,90 1,99
2,50 2,46
6.733 14.10 0
71 C 61 C
C 38% 451,82 1,189 12,39 M 1,1 2,10 2,43 28.00 0 48 C 26 C
La temperatura y presin de referencia para la tabla anterior son respectivamente 20 C y 1 atmsfera (101 kPa).
Valoracin cida. El cido clorhdrico (HCl) se obtiene en el laboratorio por adicin de cido sulfrico (H2SO4) a sal (NaCl): En la industria qumica se forman grandes cantidades de cido clorhdrico en las reacciones orgnicas de cloracin de las sustancias orgnicas con cloro elemental: Otro mtodo de produccin a gran escala es el utilizado por la industria cloro-alcali, en la cual se electroliza una disolucin de sal comn (NaCl), produciendo cloro, hidrxido de sodio e hidrgeno. El gas cloro as obtenido puede ser combinado con el gas hidrgeno, formando gas HCl qumicamente puro. Ya que la reaccin es exotrmica, las instalaciones en las que se realiza son conocidas como horno de HCl.
En agua se disuelven hasta 38 g/100 mL aunque a baja temperatura se pueden formar cristales de HClH2O con un contenido del 68% de HCl. La disolucin forma un azetropo con un contenido del 20,2% de HCl en masa y un punto de ebullicin de 108,6 C. El cido clorhdrico que se encuentra en el mercado suele tener una concentracin del 38% o del 25%. Las disoluciones de una concentracin de algo ms del 40% son qumicamente posibles, pero la tasa de evaporacin en ellas es tan alta que se tienen que tomar medidas de almacenamiento y manipulacin extras. En el mercado es posible
adquirir soluciones para uso domstico de una concentracin de entre 10% y 12%, utilizadas principalmente para la limpieza.
Aplicaciones[editar]
El cido clorhdrico se utiliza sobre todo como cido barato, fuerte y voltil. El uso ms conocido es el de desincrustante para eliminar residuos de caliza (carbonato clcico: CaCO3)3 . En esta aplicacin se transforma el carbonato clcico en cloruro clcico ms soluble y se liberan dixido de carbono (CO2) y agua: CaCO3 + 2 HCl CaCl2 + CO2 + H2O En qumica orgnica se aprovecha el cido clorhdrico a veces en la sntesis de cloruros orgnicos - bien por sustitucin de un grupo hidroxilo de un alcohol o por adicin del cido clorhdrico a un alqueno aunque a menudo estas reacciones no transcurren de una manera muy selectiva. Otra importante aplicacin del cido clorhdrico de alta calidad es en la regeneracin de resinas de intercambio inico. El intercambio catinico suele utilizarse para eliminar cationes como Na+ y Ca2+ de disoluciones acuosas, produciendo agua demineralizada. Na+ es reemplazado por H3O+ Ca2+ es reemplazado por 2 H3O+ En la industria alimentaria se utiliza por ejemplo en la produccin de la gelatina disolviendo con ella la parte mineral de los huesos. En metalrgia a veces se utiliza para disolver la capa de xido que recubre un metal, previo a procesos como galvanizado, extrusin, u otras tcnicas. Tambin es un producto de partida en la sntesis de policloruro de aluminio o de cloruro frrico (FeCl3): Fe2O3 + 6 HCl 2 FeCl3 + 3 H2O
También podría gustarte
- DAKOTA 97 A 04-Manual de Taller (Español)Documento2121 páginasDAKOTA 97 A 04-Manual de Taller (Español)Seoane GustavoAún no hay calificaciones
- El Guardar El Sábado y La IdolatríaDocumento10 páginasEl Guardar El Sábado y La IdolatríaRoberth TorresAún no hay calificaciones
- QuizDocumento8 páginasQuizjulian_g_27100% (4)
- Ácido ClohídricoDocumento9 páginasÁcido ClohídricoDiegoAún no hay calificaciones
- Caso de Estudio Hospital Santa MaríaDocumento8 páginasCaso de Estudio Hospital Santa MaríaGerman VerdezotoAún no hay calificaciones
- Ácido ClorhídricoDocumento6 páginasÁcido ClorhídricoLuis José MavarezAún no hay calificaciones
- Hipoclorito de sodio: desinfectante y blanqueadorDocumento2 páginasHipoclorito de sodio: desinfectante y blanqueadorJavier TabaraAún no hay calificaciones
- Introducción Acido ChorhidricoDocumento14 páginasIntroducción Acido ChorhidricoJesus BedoyaAún no hay calificaciones
- Zapatas Norma E.060Documento4 páginasZapatas Norma E.060Cesar Yerba ApazaAún no hay calificaciones
- SESIÓN DE APRENDIZAJE de HidrocarburosDocumento2 páginasSESIÓN DE APRENDIZAJE de HidrocarburosLuis Gustavo Mendoza Garcia67% (3)
- Tabla de Rendimientos de Mano de ObraDocumento8 páginasTabla de Rendimientos de Mano de ObraRosa Angela Perez MartinezAún no hay calificaciones
- Tabla de Rendimientos de Mano de ObraDocumento8 páginasTabla de Rendimientos de Mano de ObraRosa Angela Perez MartinezAún no hay calificaciones
- S15.s1 - Instalaciones Sanitarias - MetradosDocumento17 páginasS15.s1 - Instalaciones Sanitarias - MetradosMarcos EspinoAún no hay calificaciones
- Ácido clorhídrico: propiedades, usos y efectosDocumento21 páginasÁcido clorhídrico: propiedades, usos y efectosCarlos Ccq100% (1)
- Acido MuriáticoDocumento14 páginasAcido MuriáticoAlex AlvaradoAún no hay calificaciones
- Acido MuriaticoDocumento9 páginasAcido MuriaticoJONATHAN BONIFAZAún no hay calificaciones
- Ácido ClorhídricoDocumento10 páginasÁcido ClorhídricoGerald CrespinAún no hay calificaciones
- Ácido ClorhídricoDocumento9 páginasÁcido ClorhídricoEdgar A. GeroldAún no hay calificaciones
- ACIDO CLORHIDRICO: PROPIEDADES, OBTENCIÓN Y APLICACIONESDocumento9 páginasACIDO CLORHIDRICO: PROPIEDADES, OBTENCIÓN Y APLICACIONESrogeralexhuacotoAún no hay calificaciones
- Ácido ClorhídricoDocumento13 páginasÁcido ClorhídricoDar TorresAún no hay calificaciones
- Acido ClorhidricoDocumento16 páginasAcido ClorhidricoLaura Flores Basto0% (1)
- Acido Clorhídrico Técnico HCLDocumento5 páginasAcido Clorhídrico Técnico HCLJuve Crespo PadillaAún no hay calificaciones
- Ácido ClorhídricoDocumento4 páginasÁcido ClorhídricoIlse GomezAún no hay calificaciones
- Ácido clorhídrico guíaDocumento20 páginasÁcido clorhídrico guíaAlejandro Castillo VélezAún no hay calificaciones
- Ácido Muriático E Hipoclorito de SodioDocumento15 páginasÁcido Muriático E Hipoclorito de SodioDavid Hurtado CertucheAún no hay calificaciones
- Ácido ClorhídricoDocumento11 páginasÁcido ClorhídricoJorge Alberto Estrada TorresAún no hay calificaciones
- Ácido ClorhídricoDocumento7 páginasÁcido ClorhídricoRenato MezaAún no hay calificaciones
- Hipoclorito de SodioDocumento15 páginasHipoclorito de SodioAntony ChávezAún no hay calificaciones
- Produccion de HCLDocumento24 páginasProduccion de HCLtitoAún no hay calificaciones
- Ácido Hipocloroso (HClO) - Estructura, Propiedades, Usos, SíntesisDocumento9 páginasÁcido Hipocloroso (HClO) - Estructura, Propiedades, Usos, SíntesisGregorio ValeroAún no hay calificaciones
- Trabajo Práctico Sobre Ácido Clorhídrico. Industrial SuperiorDocumento16 páginasTrabajo Práctico Sobre Ácido Clorhídrico. Industrial SuperiorBianca PistolsAún no hay calificaciones
- Acido ClorhídricoDocumento15 páginasAcido Clorhídricoroel007Aún no hay calificaciones
- PiaDocumento3 páginasPiaMarbel Martínez LongoriaAún no hay calificaciones
- CorregidoDocumento10 páginasCorregidoNicole QuintoAún no hay calificaciones
- REACTIVOS Informe de Ley de ConservacionDocumento2 páginasREACTIVOS Informe de Ley de Conservacionkaterine TorradoAún no hay calificaciones
- Hipoclorito de Calsio 3Documento5 páginasHipoclorito de Calsio 3Miguel AngelAún no hay calificaciones
- Ácido Clorhídrico (Trabajo de Exposicion) Ppt-1Documento36 páginasÁcido Clorhídrico (Trabajo de Exposicion) Ppt-1Luis Enrique Gómez Clavijo0% (1)
- Principios de La Cloración Del AguaDocumento17 páginasPrincipios de La Cloración Del AgualuisAún no hay calificaciones
- Historia y propiedades del HClDocumento25 páginasHistoria y propiedades del HClmariagil5550% (2)
- TP HalogenosDocumento4 páginasTP HalogenosPriscila CaneloAún no hay calificaciones
- Preguntas de HCL y NaOHDocumento9 páginasPreguntas de HCL y NaOHSantiago NuñezAún no hay calificaciones
- Densidades QMC 255Documento14 páginasDensidades QMC 255Maria IsabelAún no hay calificaciones
- HCL Ácido ClorhídricoDocumento3 páginasHCL Ácido Clorhídricojuan gonzalesAún no hay calificaciones
- Cloración y La Dosis de CloroDocumento4 páginasCloración y La Dosis de CloroFranklin Quispe huayllaAún no hay calificaciones
- Obtencion Del CloroDocumento5 páginasObtencion Del CloroFernanda MartinezAún no hay calificaciones
- Blanqueadores A Base de CloroDocumento2 páginasBlanqueadores A Base de CloroJimmy MendezAún no hay calificaciones
- INFORME 1 INDUSTRIALxxxDocumento17 páginasINFORME 1 INDUSTRIALxxxGeraLd RomeroAún no hay calificaciones
- HidrolisisDocumento9 páginasHidrolisisEduardo CariapazaAún no hay calificaciones
- Soluciones BufferDocumento23 páginasSoluciones BufferStefany XiomAra B SAún no hay calificaciones
- Ácido clorhídrico: propiedades, obtención y usosDocumento36 páginasÁcido clorhídrico: propiedades, obtención y usosVioleta Peña ColqueAún no hay calificaciones
- Practica Detecciuon de Azucares y OzasonasDocumento7 páginasPractica Detecciuon de Azucares y OzasonasMichelle Fortis ValeraAún no hay calificaciones
- Agua Tratada Por CloroDocumento5 páginasAgua Tratada Por CloroLuis Alberto Rivera LeguiaAún no hay calificaciones
- Reacciones de Los AlcoholesDocumento15 páginasReacciones de Los Alcoholesbernardo antonio barralAún no hay calificaciones
- Ácido Clorhídrico - Wikipedia, La Enciclopedia LibreDocumento7 páginasÁcido Clorhídrico - Wikipedia, La Enciclopedia LibreHéctor ConteAún no hay calificaciones
- Acido Clorhidrico en FormatoDocumento6 páginasAcido Clorhidrico en FormatoMario Ramiro Humerez DiazAún no hay calificaciones
- El Ácido ClorhídricoDocumento2 páginasEl Ácido ClorhídricoSERVILAB ALIMENTOS SEGUROSAún no hay calificaciones
- Hidroxido de PotasioDocumento5 páginasHidroxido de PotasioFrank Jhoel ICAún no hay calificaciones
- Definición de Ácido ClorhídricoDocumento4 páginasDefinición de Ácido ClorhídricoJose Angel Hernandez GrajalesAún no hay calificaciones
- Titulación ácido-base y determinación de acidez en vinagreDocumento16 páginasTitulación ácido-base y determinación de acidez en vinagreBiblio ScribAún no hay calificaciones
- Oxidación ciclohexanol ciclohexanonaDocumento8 páginasOxidación ciclohexanol ciclohexanonaElizabethBelloAún no hay calificaciones
- Alcohol EsDocumento15 páginasAlcohol EsBastian Muñoz RobledoAún no hay calificaciones
- Acido Clorhidrico 2012Documento32 páginasAcido Clorhidrico 2012lizmendieta100% (1)
- Ácidos carboxílicos y derivadosDocumento22 páginasÁcidos carboxílicos y derivadosedsonAún no hay calificaciones
- Sintesis Final ImprimirDocumento61 páginasSintesis Final ImprimirivanAún no hay calificaciones
- CLORHIDRICODocumento9 páginasCLORHIDRICOMARIO LINO CABRERAAún no hay calificaciones
- HCLDocumento11 páginasHCLYanella Smith Arevalo GonzalesAún no hay calificaciones
- Hipoclorito de SodioDocumento7 páginasHipoclorito de SodioAnonymous nIKQnZ7Aún no hay calificaciones
- Se Estima Que La Base de La Plataforma PatagDocumento1 páginaSe Estima Que La Base de La Plataforma PatagCesar Yerba ApazaAún no hay calificaciones
- El Punto de Origen de Un Terremoto Se DenominaDocumento1 páginaEl Punto de Origen de Un Terremoto Se DenominaCesar Yerba ApazaAún no hay calificaciones
- Ejemplo 003Documento3 páginasEjemplo 003Cesar Yerba ApazaAún no hay calificaciones
- La ArquitecturaDocumento2 páginasLa ArquitecturaCesar Yerba ApazaAún no hay calificaciones
- Consideraciones Sobre Dinamica EstructuralDocumento1 páginaConsideraciones Sobre Dinamica EstructuralCesar Yerba ApazaAún no hay calificaciones
- Resume NDocumento5 páginasResume NCesar Yerba ApazaAún no hay calificaciones
- Fluido - Wikipedia, La Enciclopedia LibreDocumento4 páginasFluido - Wikipedia, La Enciclopedia LibreCesar Yerba ApazaAún no hay calificaciones
- Riesgo SismicoDocumento1 páginaRiesgo SismicoCesar Yerba ApazaAún no hay calificaciones
- Predimensionamiento y Metrado de Cargas © EscalerasDocumento4 páginasPredimensionamiento y Metrado de Cargas © EscalerasCesar Yerba ApazaAún no hay calificaciones
- VibracionesDocumento1 páginaVibracionesCesar Yerba ApazaAún no hay calificaciones
- La Sismología IncluyeDocumento1 páginaLa Sismología IncluyeCesar Yerba ApazaAún no hay calificaciones
- La Ingeniería Sísmica Es El Estudio Del Comportamiento de Los Edificios y Las Estructuras Sujetas A - Es El Conjunto de La yDocumento1 páginaLa Ingeniería Sísmica Es El Estudio Del Comportamiento de Los Edificios y Las Estructuras Sujetas A - Es El Conjunto de La yCesar Yerba ApazaAún no hay calificaciones
- Escuela LibertadoresDocumento1 páginaEscuela LibertadoresCesar Yerba ApazaAún no hay calificaciones
- Ingeniería Mecánica Ingeniería Estructural Ingeniería Industrial Sólidos DeformablesDocumento1 páginaIngeniería Mecánica Ingeniería Estructural Ingeniería Industrial Sólidos DeformablesCesar Yerba ApazaAún no hay calificaciones
- 10 F1 UsoPoblacDocumento11 páginas10 F1 UsoPoblacCesar Yerba ApazaAún no hay calificaciones
- AceroDocumento1 páginaAceroCesar Yerba ApazaAún no hay calificaciones
- Computadoras y EstructurasDocumento1 páginaComputadoras y EstructurasCesar Yerba ApazaAún no hay calificaciones
- Diseño AceroDocumento346 páginasDiseño AceroCesar Yerba ApazaAún no hay calificaciones
- AceroDocumento1 páginaAceroCesar Yerba ApazaAún no hay calificaciones
- El Acero SuaveDocumento1 páginaEl Acero SuaveCesar Yerba ApazaAún no hay calificaciones
- Corporación Aceros ArequipaDocumento2 páginasCorporación Aceros ArequipaCesar Yerba ApazaAún no hay calificaciones
- Predimensionamiento y Metrado de Cargas © EscalerasDocumento4 páginasPredimensionamiento y Metrado de Cargas © EscalerasCesar Yerba ApazaAún no hay calificaciones
- 104-09 - InO - Liquidaci N Obra y OtrosDocumento9 páginas104-09 - InO - Liquidaci N Obra y OtrosCesar MartinezAún no hay calificaciones
- TransitoDocumento1 páginaTransitoCesar Yerba ApazaAún no hay calificaciones
- SelectionDocumento1 páginaSelectionCesar Yerba ApazaAún no hay calificaciones
- El Sap2000Documento1 páginaEl Sap2000Cesar Yerba ApazaAún no hay calificaciones
- Acero InoxidableDocumento1 páginaAcero InoxidableCesar Yerba ApazaAún no hay calificaciones
- Guia de Office 365Documento15 páginasGuia de Office 365Hillary Rentería CarrilloAún no hay calificaciones
- Fichas de Información Técnica: Ácido Retinoico TransDocumento4 páginasFichas de Información Técnica: Ácido Retinoico TransWilliam OchoaAún no hay calificaciones
- GUABIRADocumento69 páginasGUABIRADarAún no hay calificaciones
- MSDS Koraza PDFDocumento5 páginasMSDS Koraza PDFSebastián CuartasAún no hay calificaciones
- Proyecto A.D.A.N. Genesis - Hugo CarotttiDocumento79 páginasProyecto A.D.A.N. Genesis - Hugo CarotttiMARTÍN DE LA CRUZAún no hay calificaciones
- Cristalización Del Sulfato de Cobre 2Documento22 páginasCristalización Del Sulfato de Cobre 2Eymi Gianella Layza EscobarAún no hay calificaciones
- Migración y Educación InterculturalDocumento6 páginasMigración y Educación InterculturalKathyVillarAún no hay calificaciones
- PrincipioPascal-LeyfísicaigualdadpresiónfluidosDocumento2 páginasPrincipioPascal-LeyfísicaigualdadpresiónfluidosAldo Jiménez RegisAún no hay calificaciones
- Cap 5 Circuitos ElectrónicosDocumento13 páginasCap 5 Circuitos Electrónicoskenneth cruzAún no hay calificaciones
- Costos de producción en ExcelDocumento4 páginasCostos de producción en ExcelMariela Becerra CarrascoAún no hay calificaciones
- Cifrado Asimétrico Con MochilasDocumento17 páginasCifrado Asimétrico Con MochilasFranklin Caceres0% (1)
- Marco TeóricoDocumento22 páginasMarco TeóricoCarlosMedinaAún no hay calificaciones
- BAUTISMODocumento1 páginaBAUTISMOCopeticona Quinteros Juan ManuelAún no hay calificaciones
- Ficha Técnica Revestimiento Hunter Douglas PDFDocumento2 páginasFicha Técnica Revestimiento Hunter Douglas PDFlpillacaa936Aún no hay calificaciones
- Holistico IntegradorDocumento3 páginasHolistico IntegradorYULY MARCELA RODRIGUEZ OVIEDOAún no hay calificaciones
- Procedimiento Contencioso Electoral El Recurso Contencioso Electoral, Es Un Procedimiento Administrativo Que DaDocumento2 páginasProcedimiento Contencioso Electoral El Recurso Contencioso Electoral, Es Un Procedimiento Administrativo Que DaYadira UrbinaAún no hay calificaciones
- Texto Dialogado - ArchivoDocumento6 páginasTexto Dialogado - ArchivoFernando HernandezAún no hay calificaciones
- Semanario Horizontes - 2016-05-22Documento13 páginasSemanario Horizontes - 2016-05-22Patricia FariaAún no hay calificaciones
- Diablada de PíllaroDocumento4 páginasDiablada de Píllarodaniela.teanga642Aún no hay calificaciones
- Al-For-05 Matriz Iper CelosiaDocumento1 páginaAl-For-05 Matriz Iper CelosiaJimmyCarrilloFernándezAún no hay calificaciones
- Libro de Códigos de Dispositivos de Montaje SuperficialDocumento3 páginasLibro de Códigos de Dispositivos de Montaje SuperficialLuis Eduardo Cardenas RodriguezAún no hay calificaciones
- Ejercitario 4 - FISICA - VII - FPUNA - 2019Documento3 páginasEjercitario 4 - FISICA - VII - FPUNA - 2019Santiago Figueredo SanzAún no hay calificaciones
- Manual en Espanol Del HI9814Documento2 páginasManual en Espanol Del HI9814Carlos VegaAún no hay calificaciones
- Declaración de Bochica Acj-YmcaDocumento4 páginasDeclaración de Bochica Acj-YmcaACJTolimaVoluntarioAún no hay calificaciones