Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Refractometria
Cargado por
Sol AngelTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Refractometria
Cargado por
Sol AngelCopyright:
Formatos disponibles
Laboratorio de Fisicoqumica 1: Refractometra
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS
(DECANA DE AMERICA)
FACULTAD DE QUIMICA E INGENIERIA QUIMICA E. A. P. DE INGENIERIA QUIMICA Laboratorio de Fsico-Qumica I
Profesor: Anbal Figueroa Tauquino Integrantes: - Aranguri Baca Sara - Rodrguez Carrillo Sol ngel - Yale Urcos Jos I. 08070143 08070093 08070041
Fecha de realizacin de la prctica: 02/12/09 Fecha de entrega: 09/12/09 Grupo: C-D Turno: Mircoles 8-11 a.m.
LIMA-PER
Refractometra
1
Laboratorio de Fisicoqumica 1: Refractometra INDICE
1. Introduccin...........................................................................................3 2. Resumen ..............................................................................................4 3. Principios tericos ...............................................................................5 4. Detalles experimentales .......................................................................8 5. Tabulacin de datos y resultados experimentales................................9 6. Ejemplo de clculos ............................................................................12 7. Anlisis y discusin de resultados ......................................................16 8. Conclusiones y recomendaciones ......................................................17 9. Apndice..............................................................................................18 10. Cuestionario..............................................................................19
Bibliografa22
Laboratorio de Fisicoqumica 1: Refractometra INTRODUCCIN
El fenmeno de la refraccin est basado en el cambio de velocidad que experimenta la radiacin electromagntica al pasar de un medio a otro, como consecuencia de su interaccin con los tomos y molculas del otro medio. Dicho cambio de velocidad se manifiesta en una variacin en la direccin de propagacin. La medida relativa de la variacin entre dos medios tomando uno fijo como referencia se le conoce como ndice de refraccin n y en general est expresado con respecto al aire. El instrumento para medir n, es bsicamente un sistema ptico que busca medir el ngulo que se ha desviado la radiacin, utilizando para ello dos prismas: uno fijo de iluminacin sobre el cual se deposita la muestra y uno mvil de refraccin. Los prismas estn rodeados de una corriente de agua termostatizada, ya que la temperatura es una de las variables que afecta a la medida. La refractometra es usada en la industria principalmente para hacer anlisis qumicos, determinacin de relaciones de mezcla, controles de calidad y calidad en las siguientes industrias: Industria de la celulosa y del papel Industria qumica Industria de las bebidas Industria de los productos alimenticios Industria del azcar y los edulcorantes Industria textil
Tenemos tambin que la refractometra que es un mtodo indirecto que determina la concentracin de azcar de un mosto mediante la medida del ndice de refraccin (n) El ndice de refraccin puede ser un parmetro de un anlisis cualitativo, como por ejemplo, la determinacin de tipos de aceites de mesa, tambin se puede emplear en el anlisis cuantitativo para la determinacin exacta de la concentracin de una solucin de azcar de 0,01%.En la actualidad la determinacin directa para anlisis, ha sido superada por la informacin obtenida por otras tcnicas, no obstante es ampliamente utilizada como herramienta de los detectores de muchos aparatos modernos como cromatgrafos, etc.
Laboratorio de Fisicoqumica 1: Refractometra RESUMEN
La presente prctica experimental de refractometra tuvo como finalidad determinar el ndice de refraccin de sustancias puras como acetona y 1-propanol, as como de mezcla a distintos porcentajes de volumen de acetona, adems se determino el ndice de refraccin de la sacarosa disuelta en agua en distintos porcentajes en peso. Para cumplir con el objetivo se emple el Refractmetro ABBE, bajo condiciones de laboratorio de 21C de temperatura, 756 mmHg y 99% de humedad relativa. A partir de los ndices de refraccin obtenidos se pudo realizar varias operaciones, tales como: la determinacin del porcentaje en peso de la acetona en la mezcla con 1-propanol y el porcentaje en peso de la sacarosa en agua. Finalmente se calcul la refraccin molar de las mezclas, demostrndose que es una propiedad aditiva. En conclusin la medida del ndice de refraccin depende de la concentracin del componente ms voltil, es una funcin de la concentracin (fraccin molar) de la sustancia ms voltil. Es importante porque permite identificar la pureza y composicin de una sustancia. En la grafica, demostramos que es una funcin lineal de la forma: = -0.0229X + 1.3834 Donde la pendiente sera -0.0229, esto indica que a mayor concentracin de una sustancia voltil, el ndice de refraccin baja. Debemos tener en cuenta que los valores de x estn entre 0 y 1 por tratarse de ser una fraccin molar. Los errores obtenidos en la prctica se deben a la volatilidad de los componentes como la acetona en la mezcla; y a posibles errores en las mediciones al momento de preparar las mezclas.
Laboratorio de Fisicoqumica 1: Refractometra
PRINCIPIOS TERICOS
Refraccin La refraccin es el cambio de direccin que experimenta una onda al pasar de un medio a otro. Slo se produce si la onda incide oblicuamente sobre la superficie de separacin de los dos medios y si stos tienen ndices de refraccin distintos. La refraccin se origina en el cambio de velocidad que experimenta la onda. El ndice de refraccin es precisamente la relacin entre la velocidad de la onda en un medio de referencia (el vaco para las ondas electromagnticas) y su velocidad en el medio de que se trate. Un ejemplo de este fenmeno se ve cuando se sumerge un lpiz en un vaso con agua: el lpiz parece quebrado. Tambin se produce cuando la luz atraviesa capas de aire a distinta temperatura, de la que depende el ndice de refraccin. Los espejismos son producidos un caso extremo de refraccin, denominado reflexin total. Refraccin de la luz
Se produce cuando la luz pasa de un medio de propagacin a otro con una densidad ptica diferente, sufriendo un cambio de velocidad y un cambio de direccin si no incide perpendicularmente en la superficie. Esta desviacin en la direccin de propagacin se explica por medio de la ley de Snell. Esta ley, as como la refraccin en medios no homogneos, son consecuencia del principio de Fermat, que indica que la luz se propaga entre dos puntos siguiendo la trayectoria de recorrido ptico de menor tiempo. La propagacin de la luz en un medio distinto del vaco est en relacin con la longitud de la onda y, cuando un haz de luz blanca pasa de un medio a otro, cada color sufre una ligera desviacin. Este fenmeno es conocido como dispersin de la luz. Por ejemplo, al llegar a un medio ms denso, las ondas ms cortas pierden velocidad sobre las largas (ej: cuando la luz blanca atraviesa un prisma). Las longitudes de onda corta son hasta 4 veces ms dispersadas que las largas lo cual explica que el cielo se vea azulado, ya que para esa gama de colores el ndice de refraccin es mayor y se dispersa ms.
Laboratorio de Fisicoqumica 1: Refractometra
Ley de refraccin (Ley de Snell) La relacin entre el seno del ngulo de incidencia y el seno del ngulo de refraccin es igual a la razn entre la velocidad de la onda en el primer medio y la velocidad de la onda en el segundo medio. No relaciona los ngulos de los rayos luminosos con la perpendicular a la superficie de refraccin, sino los senos de esos ngulos. En smbolos matemticos se expresa as: sen (i) / sen (r') = constante = n Esto es, el cociente de los senos de los ngulos de incidencia i y de refraccin r' toma el mismo valor para todos los valores posibles de estos ngulos. Para un rayo luminoso con un ngulo de incidencia 1 sobre el primer medio, ngulo entre la normal a la superficie y la direccin de propagacin del rayo, tendremos que el rayo se propaga en el segundo medio con un ngulo de refraccin 2 cuyo valor se obtiene por medio de la ley de Snell.
Obsrvese que para el caso de 1 = 0 (rayos incidentes de forma perpendicular a la superficie) los rayos refractados emergen con un ngulo 2 = 0 para cualquier n1 y n2. Es decir los rayos que inciden perpendicularmente a un medio no se refractan. ndice de refraccin absoluto y relativo La velocidad de la luz depende del medio en el cual se propaga y de su longitud de onda. Solo en el vaco la velocidad de propagacin es la misma para cualquier longitud de onda. El concepto que nos da una medida cuantitativa de la velocidad de propagacin de la luz en un medio material es el ndice de refraccin. ndice de refraccin absoluto de un medio es la razn entre la velocidad de la luz en el vaco y la velocidad en dicho medio. Si llamamos n al ndice absoluto de refraccin, c a la velocidad de la luz en el vaco y v a su velocidad en el medio considerado se tiene: N=c/v ndice de refraccin relativo de dos medio materiales cualesquiera es la razn entre sus relativos ndices de refraccin absoluto. Si lo designamos igualmente por n resulta: N= n1 / n2
Laboratorio de Fisicoqumica 1: Refractometra
Pero: n 1 = c / v1 y n 2 = c / v2 Luego: N = v2 / v1 Esto ltimo indica que ndice de refraccin relativo de dos medios es igual a la razn inversa de la velocidad de la luz en dichos medios. El ndice de refraccin del vaco, por definicin es igual a la unidad. El del aire es 1,0002926, a 0 C y 760 mm Hg. En la prctica se lo considera igual a 1. Los lquidos para ndice de refraccin estn formulados para un ndice de refraccin especfico, a una longitud de onda especfica y generalmente tienen una viscosidad menor que los aceites de inmersin, puesto que stos se usan para el montaje real de muestras. As, mientras que en algunos aspectos existen similitudes, al mismo tiempo, la manera en que se utilizan los dos grupos de fluidos es sustancialmente diferente. Todos los aceites de inmersin son formulados para tener "baja" fluorescencia, pero los aceites formulados especficamente para utilizarse en fluorescencia, tienen mucho menor, o ninguna fluorescencia. No se debiera tratar de ahorrar dinero usando aceites estndar, cuando se lleven a cabo estudios de fluorescencia.
Laboratorio de Fisicoqumica 1: Refractometra DETALLES EXPERIMENTALES
MATERIALES Y REACTIVOS: - Refractmetro de Abbe. Pipetas graduadas de 1, 2 y 5 mL, tubos con tapn de corcho, algodn. - Muestras de Acetona, 1-Propanol y sacarosa. PROCEDIMIENTO: A. MEDIDA DEL INDICE DE REFRACCION DE SOLUCIONES DE ACETONA Y PROPANOL a) Prepare 3mL de soluciones que contengan 0, 20, 40, 60, 80 y 100% en volumen de A en B. Mida la temperatura de los componentes puros. b) Mida el ndice de refraccin de cada una de las mezclas preparadas. B. MEDIDA DEL NDICE DE REFRACCIN DE SOLUCIONES DE SACAROSA EN AGUA: a) Prepare 10mL de solucin al 10 y 20% en peso. b) Mida los ndices de refraccin y los porcentajes de sacarosa en las soluciones preparadas. c) Mida la temperatura de las soluciones.
Laboratorio de Fisicoqumica 1: Refractometra TABULACIN DE DATOS Y RESULTADOS
TABLA 1: Condiciones experimentales PRESION (mmHg) 756 TEMPERATURA(C) 21 H. R. (%) 99
TABLA 2: Datos obtenidos de ndices de refraccin TABLA 2.1: Datos obtenidos en la mezcla de acetona y 1-propanol %V Acetona %V 1-Propanol 0 100 20 80 40 60 60 40 80 20 100 0 TPROPANOL = 21oC T ACETONA=21C 1.3834 1.3794 1.3740 1.3694 1.3644 1.3610
TABLA 2.2: Datos obtenidos en las soluciones de sacarosa y agua Mezcla Sacarosa en agua al 10%W Sacarosa en agua al 20%W 1.3445 1.3676 Correccin de %W sacarosa 8.1% 22.3%
TABLA 3: Porcentaje en peso de la acetona en la mezcla Mezcla Acetona al %V=20% Acetona al %V=40% Acetona al %V=60% Acetona al %V=80% %W acetona(terico) 19.73 39.6 59.6 79.73 %W acetona (experimental) 16.71 42.2 63.19 86.51
TABLA 4: Densidades de las mezclas %V de acetona 20 40 60 80 Densidad (g/cm3) 0.8007 0.7980 0.7954 0.7927
TABLA 5: Fraccin molar de la acetona en cada mezcla 9
Laboratorio de Fisicoqumica 1: Refractometra
%VACETONA 20 40 60 80 Xi 0.203 0.404 0.604 0.803
TABLA 6: Datos para la grafica: ndice de refraccin de la mezcla versus fraccin molar de la acetona EJE X X 0.203 0.404 0.604 0.803 Pendiente = -0.0229 EJE Y 1.3794 1.3740 1.3694 1.3644 0 = 1.3834
TABLA 7 : Refraccin experimental y terico de las mezclas de propanol y agua %VACETONA 20 40 60 80 REXP 17.216 16.939 16.694 16.436 Radd 17.149 16.880 16.612 16.346
TABLA 8: Propiedades de los compuestos utilizados Densidad de la acetona (25C) Densidad del 1-propanol (25C) de la acetona pura del 1-propanol puro del agua Densidad del agua 21C TABLA 9: Porcentaje de errores TABLA 9.1: Errores en as refracciones molares de las mezclas %V acetona 20 40 60 80 R.M. terico 17.149 16.880 16.612 16.346 R.M. experimental 17.216 16.939 16.694 16.436 %Error 0.39 (exceso) 0.35 (exceso) 0.49 (exceso) 0.55 (exceso) 0.79 g/cm3 0.8034 g/cm3 1.357 (25C) 1.383 (25C) 1.33290 (21C) 0.998 g/cm3
10
Laboratorio de Fisicoqumica 1: Refractometra
TABLA 9.2: Errores en los porcentajes en peso %V acetona 20 40 60 80 % Peso terico 19.73 39.6 59.6 79.73 %Peso experimental 16.71 42.20 63.19 86.51 %Error 3.02 (defecto) 2.6 (exceso) 3.59 (exceso) 6.78 (exceso)
TABLA 9.3: Errores en los porcentajes en peso de la sacarosa en las mezclas %W sacarosa Al 10% Al 20% % W Terico 10 20 %W Experimental 8.1 22.3 %Error 1.9 (defecto) 2.3 (exceso)
CLCULOS Y EJEMPLOS DE CLCULOS
a) Clculo de los % en peso tericos de la acetona
%W Acetona = WAcetona * 100 WTotal
Para una mezcla con acetona al 20% en volumen WAcetona=0.79g/mLx2mL=1.58g WTotal=0.79g/mLx2mL + 0.8034g/mLx8mL=8.0072g %WAcetona=(1.58g/8.0072g)x100%=19.73% Para una mezcla con acetona al 40% en volumen %WAcetona=39.6% Para una mezcla con acetona al 60% en volumen %WAcetona=59.6% Para una mezcla con acetona al 80% en volumen %WAcetona=79.73% b) Clculo de la fraccin molar Xacetona = (nacetona)/( nacetona+n1-propanol) Xacetona = (Wacetona/Macetona)/( Wacetona/Macetona + W1-propanol/M1-propanol) Para una mezcla con acetona al 20% en volumen Wacetona=0.79g/mLx2mL=1.58g Macetona=58g/mol 11
Laboratorio de Fisicoqumica 1: Refractometra
W1-propanol=0.8034g/mLx8mL=6.4272g M1-propanol=60g/mol Xacetona=(1.58g/58g/mol)/(1.58g/58g/mol +6.4272g/60g/mol)=0.203 Para una mezcla con acetona al 40% en volumen Xacetona =0.404 Para una mezcla con acetona al 60% en volumen Xacetona=0.604 Para una mezcla con acetona al 80% en volumen Xacetona=0.803
c) Clculo del % en peso experimental de la acetona
100(n 0 1) P1 (n 1 1) (100 P1 )(n 2 1) = + d0 d1 d2
Utilizamos la siguiente ecuacin:
Despejando P1, porcentaje en peso de la acetona P1 = 100x((no-1)/do - (n2-1)/d2)/((n1-1)/d1 - (n2-1)/d2) Para una mezcla con acetona al 20% en volumen. P1 = 100x((1.3794-1)/0.8007 (1.3834-1)/0.8034)/((1.3610-1)/0.79(1.38341)/0.8034) P1 = 16.71% Para una mezcla con acetona al 40% en volumen. P1 = 42.20% Para una mezcla con acetona al 60% en volumen. P1 = 63.19% Para una mezcla con acetona al 80% en volumen. P1 = 86.51% ***Obtenemos las densidades de las mezclas: Densidad de la Mezcla = WTOTAL/VTOTAL Para una mezcla con acetona al 20% en volumen WTOTAL = 2mLx0.79g/mL + 8mLx0.8034 = 8.0072g 12
Laboratorio de Fisicoqumica 1: Refractometra
VTOTAL = 10mL Densidad de la mezcla = 8.007g/10mL =0.8007g/mL Para una mezcla con acetona al 40% en volumen Densidad de la mezcla =0.7980g/mL Para una mezcla con acetona al 60% en volumen Densidad de la mezcla =0.7954g/mL Para una mezcla con acetona al 80% en volumen Densidad de la mezcla =0.7927g/mL
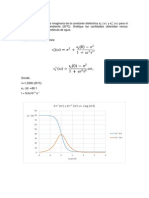
d) Determine las refracciones molares experimentales de las mezclas usando la siguiente ecuacin:
Rexp
n 1 X 1 M 1 + (1 - X 1 )M 2 = 02 * d0 n0 + 2
donde: no = ndice de refraccin de la mezcla do = densidad de la mezcla X1 = fraccin molar de la Acetona M1 = peso molecular de la Acetona = 58 g/mol M2 = peso molecular del 1-propanol = 60 g/mol Para una mezcla con acetona al 20% en volumen Rexp= ((1.37942-1)/(1.37942+2))x(0.203x58 + (1-0.203)x60)/0.8007 Rexp=17.216 Para una mezcla con acetona al 40% en volumen Rexp=16.939 Para una mezcla con acetona al 60% en volumen Rexp=16.694 Para una mezcla con acetona al 80% en volumen Rexp=16.436 e) Calcule las refracciones molares tericas de las mezclas usando la siguiente ecuacin: 13
Laboratorio de Fisicoqumica 1: Refractometra
A 2 1 M A B 2 1 M B Radd = X A 2 + 2 + (1 X A ) 2 + 2 A A B B
donde: nA,B = ndice de refraccin de la acetona y 1-propanol A ,B = densidad de la acetona y 1-propanol XA,B = fraccin molar de la acetona y el 1-propanol MA = peso molecular de la Acetona = 58 g/mol MB = peso molecular del 1-propanol = 60 g/mol Para una mezcla con acetona al 20% en volumen Radd =0.203((1.36102-1)/(1.36102+2))x(58/0.79)+(1-0.203)((1.3832+1)/(1.3832+2))x(60/0.8034) Radd=17.149
Para una mezcla con acetona al 40% en volumen Radd=16.880 Para una mezcla con acetona al 60% en volumen Radd=16.612 Para una mezcla con acetona al 80% en volumen Radd=16.346 f) Clculo de los errores de los datos de Refraccin molar %Error = ((Valor terico Valor experimental)/(Valor terico))x100% Para una mezcla con acetona al 20% en volumen. *Valor terico = 17.149 *Valor experimental = 17.216 %Error = ((17.149 17.216)/17.149)x100% = -0.39% 0,39% por exceso Para una mezcla con acetona al 40% en volumen. %Error = -0.35% 0.35% por exceso Para una mezcla con acetona al 60% en volumen. %Error = -0.49% 0.49% por exceso Para una mezcla con acetona al 80% en volumen. %Error = -0.55% 0.55% en exceso 14
Laboratorio de Fisicoqumica 1: Refractometra
DISCUSIN DE RESULTADOS
Durante la medicin del ndice de refraccin de las sustancias puras q usamos, como la acetona y el 1-propanol, utilizamos el refractmetro de Abbe, obteniendo datos muy cercanos a los valores tericos; el error tal vez se deba a q los compuestos son muy voltiles a temperatura ambiente. En la prctica para la medicin del ndice de refraccin de mezclas entre acetona y 1-propanol, obtuvimos que los valores estn entre los datos obtenidos de las sustancias puras. Para determinar el ndice de refraccin de las mezclas de sacarosa, utilizamos tambin el refractmetro de Abbe, que para este caso adems de darnos el ndice de refraccin de las mezclas, tambin nos daba el porcentaje en peso de sacarosa en las diferentes muestras. Con ello notamos que habamos tenido errores al momento de pesar la sacarosa cuando hicimos las mezclas.
15
Laboratorio de Fisicoqumica 1: Refractometra
Al momento de graficar los datos de ndice de refraccin como funcin de la fraccin molar, obtuvimos que el comportamiento es lineal, o sea obtuvimos la ecuacin de una recta.
CONCLUSIONES Y RECOMENDACIONES
Con los datos obtenidos del trabajo con las mezclas de acetona y 1-propanol, podemos deducir que los ndices de refraccin de las mezclas siempre van a estar entre los valores de los ndices de refraccin de las sustancias puras, variando segn la concentracin del elemento ms voltil; para nuestro caso fue la acetona. Una vez que graficamos los ndices de refraccin obtenidos con concentracin de la acetona (elemento ms voltil), es decir la fraccin molar; obtuvimos una recta, lo que indica que el ndice de refraccin vara linealmente con la concentracin del elemento ms voltil. Demostramos que la refraccin molar es una propiedad aditiva de las mezclas, es decir todos los elementos presentes contribuyen a obtener un nuevo valor de refraccin molar dependiendo de la concentracin en la que se encuentran (utilizando la fraccin molar). Demostramos que es posible determinar la concentracin de sacarosa en una solucin, utilizando para ello el ndice de refraccin, y concluimos que esta propiedad puede ser utilizada para determinar valores de pureza de las 16
Laboratorio de Fisicoqumica 1: Refractometra
sustancias, en nuestro caso el refractmetro Abbe era preciso al momento de determinar la concentracin en peso de la sacarosa en la solucin. Al momento de realizar la prctica con la sacarosa y el 1-propanol, procurar que sea rpido, ya que la acetona se evapora con gran rapdez a temperatura ambiente. Se recomienda ser muy cuidadoso al momento de prepara las mezclas, ya que de ello depende que tengoamos errores grandes o pequeos.
17
Laboratorio de Fisicoqumica 1: Refractometra
CUESTIONARIO
1. Cules son los tipos de refractmetros? Describa en forma breve el refractmetro ABBE (partes esenciales, escalas, tipo de luz, etc.) Los ndices de refraccin pueden ser medidos por dos tipos de instrumentos: los refractmetros y los interfermetros. Refractmetros: se basan en la refraccin del ngulo critico o en la determinacin del desplazamiento de una imagen. Existen dos tipos de refractmetros que son: el de Abbe y el de Inmersin.
Refractmetro de Abbe: el instrumento lee directamente, el ndice de refraccin es durable, requiere solo una gota de la muestra y da una buena aproximacin del valor de la diferencia de ndice de refraccin entre la lnea azul y la roja del hidrgeno que constituye una medida de la dispersin.
18
Laboratorio de Fisicoqumica 1: Refractometra
Refractmetro de Inmersin: da una precisin mayor en sus lecturas que cualquier otro tipo, excepto el refractometro de interferencia. Como el ndice de refraccin cambia con la temperatura, debe escogerse una temperatura patrn. Mide concentraciones con ms precisin y facilidad, de soluciones acuosas y alcohlicas.
Interfermetros: utilizan el fenmeno de la interferencia para obtener ndices de refraccin diferenciales con precisin muy alta. La medicin ms exacta se basa en la interferencia de luz.
Refractmetro de Abbe Este refractmetro est basado en el principio de ngulo lmite, esta ideado para realizar la operacin con comodidad y rapidez. Requiere solo cantidades muy pequeas de la muestra y da una precisin de + 2 x 10-4. La escala esta graduada directamente en ndices de refraccin para las lneas D a 20 C. En su forma usual se puede usar con luz de sodio o con luz blanca. Los modelos de alta precisin se limitan en general al uso de la luz de sodio, aunque los fabricantes suministran tablas de correccin para las lneas C y F. La escala curva s, graduada en unidades de ndice de refraccin, esta insertada en el anteojo. Los prismas P y P estn sujetos a una varilla B, que puede girar en rededor de un eje perpendicular al plano de dibujo. La varilla lleva un fiel, cuya posicin en la escala indica el ndice de refraccin de la muestra cuando se hace coincidir la lnea divisoria entre las posiciones oscura e iluminada del campo con la interseccin del retculo en el plano focal del anteojo. Los prismas de Amici, A1 y A2 estn ideados de tal modo que no desvan la luz d del sodio, mientras que las longitudes de onda ms largas se desvan hacia un lado y las ms cortas hacia el otro.
19
Laboratorio de Fisicoqumica 1: Refractometra
2. Cul es el efecto de la variacin de la temperatura y de la presin en la refraccin especfica y en la refraccin molar de los lquidos? El ndice de refraccin es sensible a los cambios de temperatura y vara con la longitud de onda de la luz, deben especificarse ambas variables al expresar el ndice de refraccin de una sustancia. Si el medio 1 es el aire, para el cual abs = 1.000277 (a 760 mmHg, 0o C. Longitud de onda 5893 A), entonces 2abs = 1.000277 (sen i/sen r). Como el ndice de refraccin del aire vara muy poco con los cambios ordinarios de humedad, composicin, temperatura y presin del aire en el laboratorio, son suficientes los valores del ndice de refraccin referidos al aire. Sin embargo en determinaciones de mxima precisin ha de corregir el valor del ndice de refraccin para las condiciones normales (PTN) o usar abs en caso necesario. 3. Importancia del uso del refractmetro en la industria alimenticia
Refractmetro para contenido de sal PCE-028
Aparato para determinar el contenido de sal en alimentos y medios acuosos o pastosos Con este aparato puede determinar el contenido de sal de un modo rpido y preciso, as como obtener el peso especfico. El refractmetro puede ser usado para medir el contenido de sal en alimentos y en todo tipo de soluciones con concentracin de sal. Esto es importante por ejemplo en el sector de la industria de la alimentacin. En lugar de emplear el refractmetro para medir el contenido de sal del agua o de soluciones acuosas, puede determinarlo con la ayuda de los medidores de conductibilidad digitales
Refractmetro para contenido de alcohol PCE-ALK
refractmetro para determinar el contenido de alcohol en porcentaje del volumen Con este refractmetro puede determinar el contenido de alcohol de un modo rpido y preciso. El refractmetro puede ser usado para medir el contenido de alcohol en soluciones alcohlicas o en alcoholes de todo tipo. Para una correcta medicin, este refractmetro debe ser utilizado en soluciones sin ningn tipo de pigmentacin ni contenido en azcares. Con otro refractmetro puede medir el alcohol probable del mosto.
Refractmetro para viticultores PCE-Oe
refractmetro con tres escalas para Oechsle, sacarosa / brix y KMN / babo Con el refractmetro para viticultura podr determinar el contenido de azcar en el mosto y con ello el contenido potencial de alcohol en el vino. En Alemania, la unidad de medida ms importante para el refractmetro es el Oechsle (Oe). En otros pases son comunes KMW, babo, KMN, baum y brix. El refractmetro para viticultura presenta escalas de lectura en Oe, sacarosa / brix y KMN / babo. Todas estas unidades miden siguiendo el mismo principio, segn el cual 16,5 g de azcar producen un 1 % de alcohol. En Alemania el peso del mosto es un criterio determinante de calidad y se usa para la clasificacin del vino. El mecnico alemn Ferdinand Oechsle, natural de Pforzheim invent a principios del siglo XIX la balanza que lleva su nombre y que determina el peso especfico del mosto. 1 Oechsle en la escala del refractmetro para viticultura corresponde a un peso especfico que se encuentra 1 g / kg por encima del del agua, lo que quiere decir 1,001. En Austria August von Babo desarroll la balanza de mosto Klosterneuburg. Dicha balanza proporciona el contenido de azcar en el mosto de la uva en porcentajes de peso. La conversin a grados
20
Laboratorio de Fisicoqumica 1: Refractometra
Oechsle ms precisa se realiza por medio de la frmula "1 KMW = 5 Oe". El viticultor ser la persona encargada de realizar esta comprobacin.
Refractmetro para viticultores PCE-Oe
refractmetro con tres escalas para Oechsle, sacarosa / brix y KMN / babo Con el refractmetro para viticultura podr determinar el contenido de azcar en el mosto y con ello el contenido potencial de alcohol en el vino. En Alemania, la unidad de medida ms importante para el refractmetro es el Oechsle (Oe). En otros pases son comunes KMW, babo, KMN, baum y brix. El refractmetro para viticultura presenta escalas de lectura en Oe, sacarosa / brix y KMN / babo. Todas estas unidades miden siguiendo el mismo principio, segn el cual 16,5 g de azcar producen un 1 % de alcohol. En Alemania el peso del mosto es un criterio determinante de calidad y se usa para la clasificacin del vino. El mecnico alemn Ferdinand Oechsle, natural de Pforzheim invent a principios del siglo XIX la balanza que lleva su nombre y que determina el peso especfico del mosto. 1 Oechsle en la escala del refractmetro para viticultura corresponde a un peso especfico que se encuentra 1 g / kg por encima del del agua, lo que quiere decir 1,001. En Austria August von Babo desarroll la balanza de mosto Klosterneuburg. Dicha balanza proporciona el contenido de azcar en el mosto de la uva en porcentajes de peso. La conversin a grados Oechsle ms precisa se realiza por medio de la frmula "1 KMW = 5 Oe". El viticultor ser la persona encargada de realizar esta comprobacin.
BIBLIOGRAFA
http://es.wikipedia.org/wiki/Refracci%C3%B3n http://www.pce-iberica.es/medidor-detalles-tecnicos/instrumento-deoptico/refractometro-sal-alimentos.htm David R. Lide, Handbook of Chemistry, 84va ed., CRC, 2003-2004 Castellan, Fisico-Qumica Pons Muzzo, Gastn, Fisico-qumica
21
También podría gustarte
- Laboratorio de Fisicoquimica II ElectroquimicaDocumento23 páginasLaboratorio de Fisicoquimica II Electroquimicapamela182212Aún no hay calificaciones
- Descomposicion Catalitica Del H2o2Documento21 páginasDescomposicion Catalitica Del H2o2Alan J. López DíazAún no hay calificaciones
- Informe de Melde - FISICA II - UNMSMDocumento20 páginasInforme de Melde - FISICA II - UNMSMDiana Chávez Gómez100% (1)
- PRACTICA No 09 Carga y Descarga Del CapacitorDocumento10 páginasPRACTICA No 09 Carga y Descarga Del CapacitorOscarHernándezGonzálezAún no hay calificaciones
- Final Fisica 2Documento15 páginasFinal Fisica 2BRAYAN SALAZAR MEZAAún no hay calificaciones
- Informe Nº2 Refractometría - Fisicoquímica IDocumento6 páginasInforme Nº2 Refractometría - Fisicoquímica IGianmarco AraujoAún no hay calificaciones
- Laboratorio Fisica 2 - Unmsm - Ciclo 2017-1 - Informe 4Documento19 páginasLaboratorio Fisica 2 - Unmsm - Ciclo 2017-1 - Informe 4Axel 76Aún no hay calificaciones
- P3 Pendulo SimpleDocumento8 páginasP3 Pendulo SimpleSofia TorresAún no hay calificaciones
- Reporte 5Documento16 páginasReporte 5Angel MarellaAún no hay calificaciones
- Experimento de MeldeDocumento6 páginasExperimento de MeldeAnonymous JAGp5folAún no hay calificaciones
- Informe de Refractometría de Líquidos PDFDocumento6 páginasInforme de Refractometría de Líquidos PDFGian TorranceAún no hay calificaciones
- Informe Fisicoquimica 1-Presion de VaporDocumento21 páginasInforme Fisicoquimica 1-Presion de VaporedsonAún no hay calificaciones
- Informe de Laboratorio 4Documento11 páginasInforme de Laboratorio 4Roberto Ortiz LazarteAún no hay calificaciones
- Informe Diagrama de Solubilidad TerminadoDocumento18 páginasInforme Diagrama de Solubilidad TerminadoFRANCO VALENCIA CHINARROAún no hay calificaciones
- Laboratorio 1 Fisico QuimicoDocumento24 páginasLaboratorio 1 Fisico QuimicoRosaAún no hay calificaciones
- Informe 13N ConductividadDocumento17 páginasInforme 13N ConductividadNICK MARALLANOAún no hay calificaciones
- Conductividad de Soluciones ElectrolíticasDocumento17 páginasConductividad de Soluciones ElectrolíticasElMaharajaAún no hay calificaciones
- Inf. 8 de FisicoquimicaDocumento8 páginasInf. 8 de FisicoquimicaLucía Molina RamírezAún no hay calificaciones
- Estequiometria y Volumen MolarDocumento15 páginasEstequiometria y Volumen MolarJose Alarcon100% (1)
- Reflexión y RefracciónDocumento4 páginasReflexión y RefracciónJair Gomez GomezAún no hay calificaciones
- Informe de Tension Superficial Laboratorio de Fisica 2 UnmsmDocumento19 páginasInforme de Tension Superficial Laboratorio de Fisica 2 UnmsmCristian Richard Saico CcopeAún no hay calificaciones
- Experiencia de MeldeDocumento10 páginasExperiencia de MeldearnoldAún no hay calificaciones
- Refractometria Final 1.0Documento22 páginasRefractometria Final 1.0Kevin VizcarraAún no hay calificaciones
- Informe Laboratorio #3 (Grupon° 2)Documento28 páginasInforme Laboratorio #3 (Grupon° 2)LUIS DELGADO FLORESAún no hay calificaciones
- Cuadernillo de Física I (Incluye ISBN)Documento107 páginasCuadernillo de Física I (Incluye ISBN)itzamara100% (1)
- Informe de Termoquimica UnmsmDocumento17 páginasInforme de Termoquimica UnmsmPier NavarroAún no hay calificaciones
- Labo 4 FiquiDocumento6 páginasLabo 4 FiquiFranco Airo Rey CordovaAún no hay calificaciones
- Informe Laboratorio Fiqui Medidas Potenciometricas de PHDocumento26 páginasInforme Laboratorio Fiqui Medidas Potenciometricas de PHElMaharaja0% (1)
- Interferometro de MichelsonDocumento4 páginasInterferometro de MichelsonFrancisco Tovar CecereAún no hay calificaciones
- Informe Velocidad Del SonidoDocumento4 páginasInforme Velocidad Del SonidoDANIEL FELIPE HENAO FLORAún no hay calificaciones
- Informe 9 Calor EspecíficoDocumento13 páginasInforme 9 Calor EspecíficoAlex GironAún no hay calificaciones
- Informe de Laboratorio de Fisica II OSCILACIONESDocumento17 páginasInforme de Laboratorio de Fisica II OSCILACIONESSteven ZMAún no hay calificaciones
- Exp. 5 Tension SuperficialDocumento6 páginasExp. 5 Tension SuperficialDenis PAAún no hay calificaciones
- Informe de CromatografíaDocumento18 páginasInforme de CromatografíaKevinMegoAún no hay calificaciones
- Informe 3 Coeficiente AdiabaticoDocumento19 páginasInforme 3 Coeficiente AdiabaticoLuz AndiaAún no hay calificaciones
- Informe 7 Del Laboratorio de Química InorgánicaDocumento18 páginasInforme 7 Del Laboratorio de Química InorgánicaisaacAún no hay calificaciones
- Informe Del 1° Lab QIDocumento16 páginasInforme Del 1° Lab QIMARTHA NICOLE FUMAGALLI CAJAHUANCAAún no hay calificaciones
- Informe 2 Interferencia y DifraccionDocumento7 páginasInforme 2 Interferencia y DifraccionDeivis J' GutierrezAún no hay calificaciones
- Práctica 2. Calor Diferencial de Disolución.Documento4 páginasPráctica 2. Calor Diferencial de Disolución.Karen CarrilloAún no hay calificaciones
- GUIAS DE LABORATORIO DE FISICOQUIMICA 2020 - II - PD PDFDocumento67 páginasGUIAS DE LABORATORIO DE FISICOQUIMICA 2020 - II - PD PDFPablo BerrocalAún no hay calificaciones
- Ejercicios 38.70Documento1 páginaEjercicios 38.70Carlos CabraAún no hay calificaciones
- FQ 06 ElectroquimicaDocumento19 páginasFQ 06 ElectroquimicaMegy Silva100% (2)
- Conductividad InformeDocumento21 páginasConductividad InformeJoselyn Matias BrañezAún no hay calificaciones
- Informe PotenciometríaDocumento7 páginasInforme PotenciometríaRosliana GonzálezAún no hay calificaciones
- Trabajo de Laboratorio Cinetica QuimicaDocumento57 páginasTrabajo de Laboratorio Cinetica QuimicaMarianellaTellezLazaro100% (5)
- Manual de Laboratorio de FisicoquimicaDocumento66 páginasManual de Laboratorio de FisicoquimicaLuiis FloresAún no hay calificaciones
- Cambio Fase de La Naftalina N 9 Fisica IIDocumento7 páginasCambio Fase de La Naftalina N 9 Fisica IICesar Guerini100% (1)
- Mediciones Potenciométricas de PHDocumento14 páginasMediciones Potenciométricas de PHMariel Bazán PananaAún no hay calificaciones
- ALEXANDRA IRENE DEL AGUILA MENDOZA - Informe Nro 01 - Densidad y Difusión de GasesDocumento13 páginasALEXANDRA IRENE DEL AGUILA MENDOZA - Informe Nro 01 - Densidad y Difusión de GasesALEXANDRA IRENE DEL AGUILA MENDOZAAún no hay calificaciones
- Informe 8 Calor Absorbido Disipado ConveccionDocumento19 páginasInforme 8 Calor Absorbido Disipado ConveccionAbel Isaac Huaytalla CotrinaAún no hay calificaciones
- Solución Examen 1 de Circuitos Eléctricos.Documento6 páginasSolución Examen 1 de Circuitos Eléctricos.Joel Daniel Pajuelo LucianoAún no hay calificaciones
- Informe de Efecto FotoeléctricoDocumento6 páginasInforme de Efecto FotoeléctricoJannia DevozAún no hay calificaciones
- Calor Absorbido Disipado Disipado y ConveccionDocumento21 páginasCalor Absorbido Disipado Disipado y ConveccionAngel VelasquezAún no hay calificaciones
- Solucionario de Tarea Fisica IiDocumento2 páginasSolucionario de Tarea Fisica IikevinAún no hay calificaciones
- Práctica 3 Laboratorio de Equilibrio y CineticaDocumento4 páginasPráctica 3 Laboratorio de Equilibrio y CineticaDany PandaAún no hay calificaciones
- Refractometria Informe de LaboratorioDocumento22 páginasRefractometria Informe de Laboratoriorompecaminos0275% (4)
- Informe de RefractometriaDocumento25 páginasInforme de RefractometriaAnonymous 56juHu100% (1)
- Guia de Determiancionde Indice de Refraccion de SueroDocumento9 páginasGuia de Determiancionde Indice de Refraccion de SueroRoyer PilcoAún no hay calificaciones
- Laboratorio Refra - PolariDocumento16 páginasLaboratorio Refra - PolariAraceli CabezasAún no hay calificaciones
- Post PaginaDocumento2 páginasPost PaginaSol AngelAún no hay calificaciones
- Trabajo de Campo 4342416561Documento1 páginaTrabajo de Campo 4342416561Sol AngelAún no hay calificaciones
- Línea de Extrusión DobleDocumento1 páginaLínea de Extrusión DobleMary GaleanoAún no hay calificaciones
- Proceso LiofilizacionDocumento6 páginasProceso LiofilizacionCarlos Javier Romero MurilloAún no hay calificaciones
- VMHL 40ezDocumento2 páginasVMHL 40ezSol AngelAún no hay calificaciones
- Presentación 1465Documento4 páginasPresentación 1465Sol AngelAún no hay calificaciones
- Brochure 23º PAE GPROD 2023 OnlineDocumento8 páginasBrochure 23º PAE GPROD 2023 OnlineSol AngelAún no hay calificaciones
- Pan de La Casa S/ 14 Precios en Soles (S/) Incluido Los Impuestos de LeyDocumento8 páginasPan de La Casa S/ 14 Precios en Soles (S/) Incluido Los Impuestos de LeySol AngelAún no hay calificaciones
- Parámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasDocumento13 páginasParámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasSol AngelAún no hay calificaciones
- Parámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasDocumento13 páginasParámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasSol AngelAún no hay calificaciones
- Grupo N PDFDocumento6 páginasGrupo N PDFSol Angel0% (1)
- Parámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasDocumento13 páginasParámetros Fisicoquímicos Y Sensoriales de Cerveza Artesanal Ale Con Almidón de Papa Y EspeciasSol AngelAún no hay calificaciones
- Actividad 1Documento1 páginaActividad 1Sol AngelAún no hay calificaciones
- Ejercicios - SR UPNDocumento3 páginasEjercicios - SR UPNSol AngelAún no hay calificaciones
- EDADDocumento4 páginasEDADSol AngelAún no hay calificaciones
- Alimento Con Historia CervezaDocumento11 páginasAlimento Con Historia CervezaJesus Gutierrez CuevasAún no hay calificaciones
- Los AmarillitosDocumento2 páginasLos AmarillitosSol AngelAún no hay calificaciones
- Membra NaDocumento2 páginasMembra NaSol AngelAún no hay calificaciones
- 2760 6746 1 PBDocumento10 páginas2760 6746 1 PBSol AngelAún no hay calificaciones
- Análisis Comportamiento MGC-1 Utilizando SBSDocumento50 páginasAnálisis Comportamiento MGC-1 Utilizando SBSSol AngelAún no hay calificaciones
- U1 S8 T03 FormulacionyEvaluacionFinanciera IndDocumento7 páginasU1 S8 T03 FormulacionyEvaluacionFinanciera IndSol AngelAún no hay calificaciones
- Boletin Informativo para Elección Del Sistema PensionarioDocumento6 páginasBoletin Informativo para Elección Del Sistema PensionarioCarlosFFernandezAún no hay calificaciones
- 567 836 1 PB PDFDocumento17 páginas567 836 1 PB PDFSol AngelAún no hay calificaciones
- Lineamientos Trabajo Aplicativo IIDocumento3 páginasLineamientos Trabajo Aplicativo IISol AngelAún no hay calificaciones
- Icm602 3Documento16 páginasIcm602 3Sol AngelAún no hay calificaciones
- Problema 15Documento3 páginasProblema 15Sol AngelAún no hay calificaciones
- Pruebas ReologicasDocumento29 páginasPruebas Reologicascarlosmax5_550% (1)
- Problemas de Diseño de Reactores - S1Documento1 páginaProblemas de Diseño de Reactores - S1Sol AngelAún no hay calificaciones
- Titanio y Aleaciones PDFDocumento15 páginasTitanio y Aleaciones PDFSol Angel100% (1)
- 1ra Hoja de Trabajos PracticosDocumento8 páginas1ra Hoja de Trabajos PracticosSol AngelAún no hay calificaciones
- Integracion NumericaDocumento11 páginasIntegracion NumericaVictor AgredaAún no hay calificaciones
- Chavez Arnaldo Edificio Multifamiliar Ocho Pisos SotanoDocumento107 páginasChavez Arnaldo Edificio Multifamiliar Ocho Pisos SotanoyugoingAún no hay calificaciones
- Informe Del Laboratorio 1Documento4 páginasInforme Del Laboratorio 1David Damian GutierrezAún no hay calificaciones
- Diamante de FuegoDocumento9 páginasDiamante de FuegoGUILLERMOPPDAún no hay calificaciones
- Trabajo CienciasDocumento3 páginasTrabajo CienciasEsteban Jimenez ZapataAún no hay calificaciones
- Nom 026 STPS 1998Documento20 páginasNom 026 STPS 1998Otoniel Pecina HernandezAún no hay calificaciones
- Calor Latente de Fusión Del HieloDocumento1 páginaCalor Latente de Fusión Del HieloDayana HernandezAún no hay calificaciones
- Algebra Lineal Resumen FriedbergDocumento18 páginasAlgebra Lineal Resumen FriedbergEmmanuel AguayoAún no hay calificaciones
- Bombas CentrifugasDocumento24 páginasBombas CentrifugasAlexander EncisoAún no hay calificaciones
- Sustancias Puras y Mezclas 7° BásicoDocumento5 páginasSustancias Puras y Mezclas 7° BásicoPia GuiñezAún no hay calificaciones
- Hidraulica EspañolDocumento70 páginasHidraulica EspañolLuis David Concha CastilloAún no hay calificaciones
- Seductiva MenteDocumento19 páginasSeductiva MenteYngrid Joanna Riera Rodriguez100% (1)
- Gomez 45 PreguntasDocumento14 páginasGomez 45 Preguntasayminformatica67% (3)
- Método de La Regla FalsaDocumento2 páginasMétodo de La Regla FalsaJavier Salvador Martinez SalasAún no hay calificaciones
- Ecuacione ParametricasDocumento11 páginasEcuacione ParametricassolplayingAún no hay calificaciones
- Informe Medicion Caudal Rio ChaupiurangaDocumento17 páginasInforme Medicion Caudal Rio ChaupiurangaAbimael Sinche RamosAún no hay calificaciones
- Ejercitario UCSA Fisica Electricidad Cap1-2Documento4 páginasEjercitario UCSA Fisica Electricidad Cap1-2Christian EscurraAún no hay calificaciones
- Sistema de ProduccionDocumento13 páginasSistema de ProduccionLuis ColdplayAún no hay calificaciones
- Diseño de Una Celda de Electrocoagulación para El Tratamiento de Aguas Residuales de La Industria LácteaDocumento10 páginasDiseño de Una Celda de Electrocoagulación para El Tratamiento de Aguas Residuales de La Industria LácteacristinaAún no hay calificaciones
- Mlopez - Andamio Magnitudes y Sistemas de Unidades - U1 - Act2Documento4 páginasMlopez - Andamio Magnitudes y Sistemas de Unidades - U1 - Act2Miguel López MorenoAún no hay calificaciones
- Gran Libro Gordo de GeologiaDocumento85 páginasGran Libro Gordo de GeologiaMartin ScavoneAún no hay calificaciones
- AfirmacionesDocumento2 páginasAfirmacionesJesús MéridaAún no hay calificaciones
- Manual GeotecnicoDocumento27 páginasManual GeotecnicoJuvenal Huamani FloresAún no hay calificaciones
- Cuadro ComparativoDocumento3 páginasCuadro ComparativoAlfredo Santos RamirezAún no hay calificaciones
- 4.2 Ejercicios de Variables Aleatorias ContinuasDocumento7 páginas4.2 Ejercicios de Variables Aleatorias ContinuasProf. Claudio JaraAún no hay calificaciones
- Electricidad 1Documento4 páginasElectricidad 1Anonymous leiXIfq100% (1)
- La Cerámica en La ConstrucciónDocumento7 páginasLa Cerámica en La ConstrucciónEse Deivid LopezAún no hay calificaciones
- Importancia de La Densidad en AlimentosDocumento10 páginasImportancia de La Densidad en AlimentosElizabeth Clorinda Huaman EleraAún no hay calificaciones
- 11.0. El TeodolitoDocumento42 páginas11.0. El TeodolitoDiceth Chacon RojasAún no hay calificaciones