Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teoria Orbitales Moleculares
Teoria Orbitales Moleculares
Cargado por
Leticia LopezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teoria Orbitales Moleculares
Teoria Orbitales Moleculares
Cargado por
Leticia LopezCopyright:
Formatos disponibles
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Teora de Orbitales Moleculares
Profesor Ctedra: Sr. Ricardo Letelier Profesor Auxiliar: Magn Torres
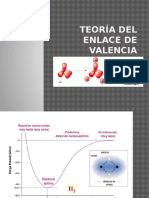
Los orbitales moleculares se forman por una combinacin lineal de orbitales atmicos. Como los orbitales atmicos estaban definidos por una funcin de onda, las combinaciones entre ellos se tomarn como interferencias constructivas o destructivas. sto define tipos de orbitales moleculares enlazantes y antienlazantes. O.M. Enlazante Energa menor que el orbital de partida Interferencia constructiva Genera Enlace Qumico O.M. Antienlazante Energa mayor que el orbital de partida Interferencia destructiva Orbital Antienlazante (densidad electrnica baja entre ncleos)
La combinacin de ciertos orbitales atmicos dar origen a diferentes tipos de orbitales moleculares. Orbitales tipo s Se generan a partir de una combinacin lineal de dos orbitales atmicos tipo s.
* antienlazante 1s enlazante
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Orbitales tipo p,p Se generan a partir de una combinacin lineal de dos orbitales atmicos tipo npx, y npy.
antienlazante antienlazante 2p enlazante enlazante
*Nota importante: Despus del Nitrgeno (Z=7) el orden entre orbitales enlazantes se invierte (primero viene el sigma y despus el pi). _________________________________________________________________________ Tipos de Molculas Diatmicas: Homonucleares: Poseen los mismos ncleos (H2, Li2, O2, N2) Heteronucleares: Poseen ncleos distintos (HLi,CN,NO,CO,BN,LiH,HHe) Paramagnticas: Poseen electrones desapareados, se ven afectadas por campos magnticos. m = n(n + 2) Diamagnticas: Poseen todos sus electrones apareados y no se ven afectadas por campos magnticos (m=0). Polares: Su vector momento dipolar es distinto de cero, son afectadas por campos elctricos (Molculas heteronucleares). Apolares: Su vector momento dipolar es igual a cero, no se ven afectadas por campos elctricos (Molculas homonucleares). _________________________________________________________________________ Vector momento dipolar: Vector cuya magnitud est determinada por la diferencia de electronegatividades entre tomos, cuya direccin est definida por el ngulo definido por la geometra de la molcula y cuyo sentido est definido desde el tomo menos electronegativo hacia el tomo ms electronegativo.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Orden de enlace: El orden de enlace determina el nmero de enlaces que tiene la molcula. En caso de ser cero, sta no existe. Se calcula con la siguiente frmula: _ _ 1 OE = (n e enlazantes n e antienlazantes ) 2 Molculas Diatmicas Homonucleares H2 He2
1s
1s
OE=1 diamagntica =0
OE=0 (no existe) diamagntica =0
* Noten que las reglas para llenar los orbitales moleculares son las mismas de las de orbitales atmicos: Principio de mnima energa, principio de exclusin de Pauli, Regla de Hund. Li2 Be2
2s
2s
OE: 1 diamagntica =0
OE: 0 (no existe) diamagntica =0
QI21A Qumica Moderna
Teora de Orbitales Moleculares
B2
N2
2p
2p
OE: 1 paramagntica =0 F2
OE: 3 diamagntica =0 NO
2p
OE: 0.5 paramagntica =0 Ambos Flor Otorgan 9 electrones
OE: 1.5 paramagntica <> <>0 En total se aportan (7+8) electrones, 7 del Nitrgeno y 8 del Oxgeno.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
En general, la regla para llenar las molculas es la siguiente...
2p* * 2p 2p 2 2s 2
1 1s 1 Ms ejemplos... HF (cido Fluorhdrico): El Flor otorga 9 electrones y el Hidrgeno 1. Debemos llenar los OM con 10 electrones.
2p
2s
1s
OE: 0.5 (6-4)=1, Diamagntica y Momento dipolar distinto de cero.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Para molculas con carga positiva, recuerden que se resta un electrn... Para molculas con carga negativa, se agrega un electrn... O2 + O2 -
2p
OE: 2.5 OE: 1.5 paramagntica paramagntica _________________________________________________________________________
(P3 Examen 2004/1) El Potencial de Ionizacin del Oxgeno atmico es mayor que el PI del Oxgeno diatmico. A su vez el PI del Nitrgeno atmico es menor que el PI del Nitrgeno diatmico. Explique. Solucin: Hacemos el diagrama energtico... E=0 PIN 2p Nitrgeno PIN2
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Recordemos que los orbitales enlazantes poseen MENOR energa que los orbitales de partida. Ahora para el Oxgeno... E=0 PIO 2p Oxgeno PIO2
Ac recordemos que los orbitales antienlazantes poseen MAYOR energa que los orbitales de partida. Otros conceptos: El orden de enlace aparte de determinar el tipo de enlace que posee la molcula y saber si sta existe o no. Tambin nos entrega la longitud del tipo de enlace. A medida que el orden de enlace aumenta, la longitud de enlace disminuye. O sea un enlace triple es ms corto que un enlace simple. La propiedad de paramagnetismo se puede aplicar a tomos... Por ejemplo, la configuracin electrnica del Nitrgeno: 1s 2 2s 2 2p1 2p1 2p1 posee electrones x y z desapareados, por lo tanto el Nitrgeno atmico es paramagntico. Suponga que el oxgeno diatmico puede ganar o perder 2 o ms electrones. Con sto, ordene las molculas de mayor a menor longitud de enlace. * O 2 = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (* px ) 2 (* py ) 2 OE = 1 2 2 2 2 * O = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (* px ) 2 (* py )1OE = 1.5 2 2 2 2 * O 2 = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (* px )1(* py )1OE = 2 2 2 2 * O + = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (* px )1OE = 2.5 2 2 2 * O + 2 = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 OE = 3 2 2 O+ 2 < O+ < O2 < O < O2 2 2 2 2 _________________________________________________________________________
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Cientficos han descubierto un meteorito compuesto por elementos X,Y,M. Los datos que poseen los cientficos son los siguientes... M se ve afectado por campos magnticos y su nmero de protones vara entre 18 y 20. El nmero de protones de X e Y varan entre 6 y 8. X2 es diamagntica y X2- es menos estable que su forma neutra. XY es isoelectrnica con X2+. Para M Ar(Z=18) es diamagntico K(Z=19) es paramagntico (sirve) Ca(Z=20) es diamagntico. M=K (Potasio). X e Y pueden ser C, N u O. C2 es diamagntica N2 es diamagntica O2 es paramagntica (no sirve) C2- no puebla orbitales antienlazantes (estable) N2- puebla orbitales antienlazantes (inestable)
* N = (1s ) 2 (1s ) 2 ( 2s ) 2 (* s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (* px )1 2 2 2
X=N (Nitrgeno) N2+ posee 13 electrones en su configuracin... NO posee 15 electrones CN posee 13 electrones Y=C (Carbono)
También podría gustarte
- Orbitales Moleculares CiclobutadienoDocumento7 páginasOrbitales Moleculares CiclobutadienoMaria MartinezAún no hay calificaciones
- Práctica DE Laboratorio: Construcción de Un Mesocosmos CerradoDocumento11 páginasPráctica DE Laboratorio: Construcción de Un Mesocosmos CerradoAngel Goyes100% (1)
- 3 OrbitalesMolecularesDocumento30 páginas3 OrbitalesMolecularesMartin GonzalezAún no hay calificaciones
- Orbitales SDocumento3 páginasOrbitales SDianita LozaAún no hay calificaciones
- Colegio Químicos Asturias - FormulacionDocumento30 páginasColegio Químicos Asturias - FormulacionvengapijoAún no hay calificaciones
- La nanotecnología: El mundo de las máquinas a escala nanométricaDe EverandLa nanotecnología: El mundo de las máquinas a escala nanométricaAún no hay calificaciones
- Teoria Atomica Moderna OrbitalesDocumento32 páginasTeoria Atomica Moderna OrbitalesLeibniz FourierAún no hay calificaciones
- Orbitales AtómicosDocumento15 páginasOrbitales AtómicosRicardo MancillaAún no hay calificaciones
- Perturbaciones OrbitalesDocumento6 páginasPerturbaciones OrbitalesXime Coral0% (1)
- MolesDocumento2 páginasMolesAngelo Alexander LimaAún no hay calificaciones
- Variaciones OrbitalesDocumento2 páginasVariaciones OrbitalesCarlos CEAún no hay calificaciones
- Cinetica Química (Chang)Documento49 páginasCinetica Química (Chang)Cristina Durand RubioAún no hay calificaciones
- Teoria de Orbitales MolecularesDocumento26 páginasTeoria de Orbitales MolecularesBrian Jeef Blancas SotoAún no hay calificaciones
- Química Orgánica ApuntesDocumento13 páginasQuímica Orgánica ApuntesDivulgación de archivosAún no hay calificaciones
- PRÁCTICA (Neutralización de Soluciones)Documento10 páginasPRÁCTICA (Neutralización de Soluciones)alfredoabad19Aún no hay calificaciones
- Informe 4 ORBITALES MOLECULARESDocumento2 páginasInforme 4 ORBITALES MOLECULARESjennyfer castrillonAún no hay calificaciones
- Cuadernillo OrganicaDocumento84 páginasCuadernillo OrganicaBruno PenoffAún no hay calificaciones
- Examen Grupos FuncionalesDocumento2 páginasExamen Grupos FuncionalesDaniela SPAún no hay calificaciones
- Calculos EstequiometricosDocumento11 páginasCalculos EstequiometricosNoemi BarrosAún no hay calificaciones
- Clase 2-Cadenas TroficasDocumento31 páginasClase 2-Cadenas TroficasAnonymous 2HShWKOIAún no hay calificaciones
- Quimica Inorganica Industrial - Modulo VF02.pdf217669243 PDFDocumento286 páginasQuimica Inorganica Industrial - Modulo VF02.pdf217669243 PDFJose J Saito CasanovaAún no hay calificaciones
- P HDocumento119 páginasP Hbanda_faygoAún no hay calificaciones
- Guia de Cinetica QuimicaDocumento5 páginasGuia de Cinetica QuimicaElkin G. MendezAún no hay calificaciones
- Alcohol EsDocumento3 páginasAlcohol EsAlessandro TorresAún no hay calificaciones
- SEMANA 11 y 12 Reacciones Quimicas 1Documento23 páginasSEMANA 11 y 12 Reacciones Quimicas 1anon_455104866Aún no hay calificaciones
- Equilibrio Quimico en Medio AmortiguadoDocumento98 páginasEquilibrio Quimico en Medio AmortiguadoFrancisco Monroy PerezAún no hay calificaciones
- Analisis Cualitativo Compuestos OrganicosDocumento19 páginasAnalisis Cualitativo Compuestos OrganicosAbel de Jesús RiveraAún no hay calificaciones
- Manual Laboratorio Quimica II Interciclo 2022Documento40 páginasManual Laboratorio Quimica II Interciclo 2022holahola edededeAún no hay calificaciones
- Práctica 3 - ButanonaDocumento7 páginasPráctica 3 - ButanonaJosé Luis ValenciaAún no hay calificaciones
- Hibridación de Orbitales AtómicosDocumento30 páginasHibridación de Orbitales AtómicosMonica BortAún no hay calificaciones
- Equilibrio Quimico EjerciciosDocumento2 páginasEquilibrio Quimico EjerciciosMarco Antonio Escobedo AguilarAún no hay calificaciones
- Clase 2 Números Cuánticos y Configuración Electrónica 2017Documento33 páginasClase 2 Números Cuánticos y Configuración Electrónica 2017magalopezAún no hay calificaciones
- Quimica EderDocumento432 páginasQuimica Ederotonashieder100% (1)
- Integración ArealDocumento8 páginasIntegración ArealSilvina Natalia CamporaAún no hay calificaciones
- AlgebraDocumento8 páginasAlgebraDany E GuzmánAún no hay calificaciones
- Guia de EcologiaDocumento21 páginasGuia de EcologiaKikeRiveraAún no hay calificaciones
- Cinetica QuimicaDocumento64 páginasCinetica QuimicaNelson ChiribogaAún no hay calificaciones
- EQUILIBRIO IONICO Ácidos Fuertes y Débiles 2020Documento34 páginasEQUILIBRIO IONICO Ácidos Fuertes y Débiles 2020johan peña alencarAún no hay calificaciones
- Módulo de QuímicaDocumento24 páginasMódulo de QuímicaCarmelino Almestar VillegasAún no hay calificaciones
- Cinetica Quimica Aplicando Principios QVDocumento114 páginasCinetica Quimica Aplicando Principios QVGiovanniAún no hay calificaciones
- Integrada VentusDocumento4 páginasIntegrada VentusEncarniAún no hay calificaciones
- Fisicoquímica GeneralDocumento29 páginasFisicoquímica GeneralFernando Camilo Joaquín RodríguezAún no hay calificaciones
- Quimica General Guia 2017Documento74 páginasQuimica General Guia 2017Luz ArandaAún no hay calificaciones
- Quimica2 1Documento90 páginasQuimica2 1Alba LuciaAún no hay calificaciones
- Laboratorio QuimicaDocumento122 páginasLaboratorio QuimicaTHAYLOR DAVITHSON MEZA BORJA100% (1)
- Proyecto SteamDocumento13 páginasProyecto Steamjavier0% (1)
- Cobac Química IIDocumento244 páginasCobac Química IILuz María Hernández JuárezAún no hay calificaciones
- Estructura Atómica - DiapositivasDocumento34 páginasEstructura Atómica - DiapositivasAugusto Muñoz VillarrealAún no hay calificaciones
- Enlaces CovalentesDocumento101 páginasEnlaces CovalentesRobert Velázquez LucianoAún no hay calificaciones
- Trabajo Práctico #1 QuimicaDocumento11 páginasTrabajo Práctico #1 QuimicaFederico FretesAún no hay calificaciones
- Reconocimiento de Materiales,-1Documento6 páginasReconocimiento de Materiales,-1Denis MaxiAún no hay calificaciones
- QMC 302 Tema I Mecanismos de EliminaciónDocumento46 páginasQMC 302 Tema I Mecanismos de EliminaciónAnonymous yEGP9hnAún no hay calificaciones
- S1 - El Atomo de CarbonoDocumento30 páginasS1 - El Atomo de CarbonoGamerS14 XDAún no hay calificaciones
- Que Pasa Cunado Chocan Los Atomos ActividadDocumento6 páginasQue Pasa Cunado Chocan Los Atomos ActividadHumberto CortezAún no hay calificaciones
- Cuadernillo de Actividades de QUIMICA para 1º Año POLIMODAL o 3º de La E. E. S. Año 2011Documento15 páginasCuadernillo de Actividades de QUIMICA para 1º Año POLIMODAL o 3º de La E. E. S. Año 2011Ale BrittoAún no hay calificaciones
- Brown Quimi AtomoDocumento21 páginasBrown Quimi AtomoEmily AlejandraAún no hay calificaciones
- XIX Olimpiada Estatal de BiologiaDocumento4 páginasXIX Olimpiada Estatal de BiologiaK Rn J. ZalgadoAún no hay calificaciones
- Presentacion Enlace QuimicoDocumento33 páginasPresentacion Enlace QuimicoTio InataAún no hay calificaciones
- Nuevas Metáforas en Gestión de Organizaciones y Estructura Organizacional - Luis RagnoDocumento47 páginasNuevas Metáforas en Gestión de Organizaciones y Estructura Organizacional - Luis RagnoMaria RestonAún no hay calificaciones
- Act Tabla PeriódicaDocumento2 páginasAct Tabla Periódicalautaro luqueAún no hay calificaciones
- (Química 2º Bachillerato) Ejercicios + Soluciones: Estructura de La Materia. Modelos AtómicosDocumento8 páginas(Química 2º Bachillerato) Ejercicios + Soluciones: Estructura de La Materia. Modelos AtómicosÁlvaro S.83% (6)
- ANEXOSDocumento14 páginasANEXOSANA SOTOAún no hay calificaciones
- 02configuracionelectronica 110816115841 Phpapp01 PDFDocumento19 páginas02configuracionelectronica 110816115841 Phpapp01 PDFovidioAún no hay calificaciones
- Mapa Conceptual de Fisica ModernaDocumento1 páginaMapa Conceptual de Fisica ModernaDan SalgadoAún no hay calificaciones
- Temario Química InorgánicaDocumento4 páginasTemario Química InorgánicaLiliana BarcenasAún no hay calificaciones
- Actividad 2Documento6 páginasActividad 2ANGEL ESLI NAJERA LOPEZAún no hay calificaciones
- ¿Qué Es La Matriz DivinaDocumento5 páginas¿Qué Es La Matriz DivinaPablo Carrión ARGAún no hay calificaciones
- Diagrama de FeynmanDocumento12 páginasDiagrama de FeynmanJJAún no hay calificaciones
- Clase 5 - Configuración ElectrónicaDocumento14 páginasClase 5 - Configuración ElectrónicaGabriel Zúñiga MartinezAún no hay calificaciones
- INFORME FLUORESCENCIA LabDocumento8 páginasINFORME FLUORESCENCIA Labjaycalderon777Aún no hay calificaciones
- Cuestionario de Quimica Organica IDocumento3 páginasCuestionario de Quimica Organica Iestefania_ramos_4Aún no hay calificaciones
- BioelementosDocumento5 páginasBioelementospmlalanguiAún no hay calificaciones
- Secuencia N°2 FÍSICO QUÍMICA 3°AÑO 1° CuatrDocumento12 páginasSecuencia N°2 FÍSICO QUÍMICA 3°AÑO 1° CuatrMeliAún no hay calificaciones
- Guia de Aprendizaje Prefisica 1er Periodo Grado 9° 2021Documento8 páginasGuia de Aprendizaje Prefisica 1er Periodo Grado 9° 2021davaesAún no hay calificaciones
- Química Cuántica 2Documento2 páginasQuímica Cuántica 2Gloria SuazoAún no hay calificaciones
- Espectroscopia de Emision AUGER RXDocumento7 páginasEspectroscopia de Emision AUGER RXismenia alanizAún no hay calificaciones
- Distribución de Elementos de La Tabla PeriódicaDocumento2 páginasDistribución de Elementos de La Tabla PeriódicaBryan BorjaAún no hay calificaciones
- Carga ElectricaDocumento3 páginasCarga ElectricaAsuncion NtAún no hay calificaciones
- Dualidad Onda CorpúsculoDocumento35 páginasDualidad Onda CorpúsculoJaime Giovanni Ballesteros MuñozAún no hay calificaciones
- Silabo - Fisica IV 2015Documento2 páginasSilabo - Fisica IV 2015Miguel04_1995Aún no hay calificaciones
- El AtomoDocumento22 páginasEl Atomojosefina diazAún no hay calificaciones
- Química 1Documento51 páginasQuímica 1Luciano Matias Garrido SosaAún no hay calificaciones
- BiologíaDocumento10 páginasBiologíaNetprint PalenciaAún no hay calificaciones
- Progreso de QuimicaDocumento1 páginaProgreso de QuimicaMDFK ULISES:vAún no hay calificaciones
- Tabla PeriodicaDocumento14 páginasTabla Periodicagoth_sycoticAún no hay calificaciones
- Joseph John ThomsonDocumento2 páginasJoseph John ThomsonEmanuel SalvadorAún no hay calificaciones
- Responda Las Preguntas 5 y 6 de Acuerdo Con La Siguiente InformaciónDocumento5 páginasResponda Las Preguntas 5 y 6 de Acuerdo Con La Siguiente InformaciónHeidy RölleAún no hay calificaciones
- Elementos de Física Cuántica PDFDocumento29 páginasElementos de Física Cuántica PDFDoloresAún no hay calificaciones