Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Resumen Enlace Químico
Cargado por
Marisol Celestina Sulca Lovera0 calificaciones0% encontró este documento útil (0 votos)
6 vistas1 páginaTítulo original
Resumen enlace químico
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas1 páginaResumen Enlace Químico
Cargado por
Marisol Celestina Sulca LoveraCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
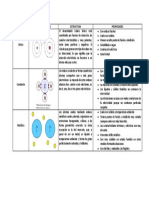
Enlace químico
Según la electronegatividad de los átomos que se enlazan:
Los átomos metálicos al tener baja energía de ionización
ceden sus electrones de valencia entre muchos átomos polar y no polar
formando cationes. Estos electrones se encuentran Según el número de electrones compartidos: simple, doble y
deslocalizados y pueden desplazarse libremente formando triple
una especie de mar de electrones. Enlace covalente apolar (E.C.A):
Propiedades de los metales: EN de diferencia hasta 0,4 (∆𝑬𝑵 ≤ 0,4)
Son sólidos a temperatura ambiente con elevadas Ejemplo: H2, Cl2, O2, N2 y F2.
temperaturas de fusión y ebullición. Excepto por el
mercurio que es líquido a temperatura ambiente. Enlace covalente polar (E.C.P):
Son buenos conductores de la electricidad y del calor EN de diferencia mayor que 0,4 (∆𝑬𝑵 > 0,4)
por la facilidad de movimiento del mar de electrones y
la vibración de los cationes. Ejemplo: HF, HCl y H2O
Son dúctiles (facilidad de formar hilos) y maleables
Polaridad de las moléculas: (simetría)
(facilidad de formar láminas) al aplicar presión.
Son duros en general (resistentes al rayado). Moléculas apolares (SIMÉTRICAS)
La mayoría se oxida con facilidad a excepción de los
F2, N2, CO2, CXHX (hidrocarburos)
metales nobles como el oro y el platino, que deben su
mayor valor monetario a esta cualidad. No pares libres en el átomo central
Átomos restantes tienen que ser iguales
Propiedades:
Propiedades de los compuestos iónicos: Son gases, líquidos o sólidos (con puntos de fusión
bajos, por lo general <300 ºC) pero tienden a ser
Son sólidos cristalinos con puntos de fusión altos (>
400 ºC). menores que los polares de semejante masa molar.
Tienden a ser solubles en solventes polares como el La mayoría son solubles en solventes apolares como
agua. los aceites e hidrocarburos. No son solubles en agua.
Son insolubles en solventes no polares (como aceites, Son malos conductores de la electricidad (buenos
hidrocarburos, etc.) aislantes).
Los compuestos fundidos (líquidos) y las soluciones
Moléculas polares (ASIMÉTRICAS)
acuosas conducen bien la
electricidad porque contienen iones móviles. HCl, HF, H2O, CH3COCH3, C12H22O11
Son aislantes térmicos y eléctricos en estado sólido
Propiedades:
Son gases, líquidos o sólidos (con puntos de
fusión bajos a moderados, por lo general <300
ºC) pero tienden a ser mayores que los apolares
de semejante masa molar.
Las moléculas polares son solubles en solventes
polares como alcoholes o éteres e incluso en
agua.
Puros, son malos conductores de la electricidad
(buenos aislantes) y en solución solo conducen
la corriente eléctrica los que pueden ionizarse.
También podría gustarte
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Enlace QuimicoDocumento28 páginasEnlace QuimicoRenzo Carrera SalasAún no hay calificaciones
- Elementos y Compuestos QuímicosDocumento2 páginasElementos y Compuestos QuímicosCynthia VasquezAún no hay calificaciones
- Cuadro de Enlaces QuimicosDocumento4 páginasCuadro de Enlaces QuimicosChino LoqiyoAún no hay calificaciones
- CTM Clase 12Documento36 páginasCTM Clase 12Julio GiraldoAún no hay calificaciones
- Vasconez - GR8 - 2022 - Resumen SolidosDocumento2 páginasVasconez - GR8 - 2022 - Resumen SolidosNicolas Vasconez TorresAún no hay calificaciones
- Enlace Químico y Lenguaje de La QuímicaDocumento47 páginasEnlace Químico y Lenguaje de La Químicasu1611Aún no hay calificaciones
- Enlace QuímicoDocumento24 páginasEnlace QuímicoMaria Cristina Sanchez ArellanoAún no hay calificaciones
- Andino Hugo 1600 Cuadro ComparativoDocumento3 páginasAndino Hugo 1600 Cuadro ComparativoHAAM SPRINTPINKAún no hay calificaciones
- Estado Sólido - Tabla ResumenDocumento1 páginaEstado Sólido - Tabla ResumenivezuAún no hay calificaciones
- Enlaces QuimicosDocumento4 páginasEnlaces QuimicosLeonel HernándezAún no hay calificaciones
- 5 Ficha 5 (T) SolidosDocumento4 páginas5 Ficha 5 (T) SolidosHappinessAún no hay calificaciones
- Parcial QuimicaDocumento2 páginasParcial Quimicakarla newtonAún no hay calificaciones
- Enlace QuímicoDocumento35 páginasEnlace QuímicoLuz Anel SarayaAún no hay calificaciones
- Mapa Mental LabotorioDocumento2 páginasMapa Mental LabotorioRomina GarduñoAún no hay calificaciones
- Estado Sólido Resumen (Jonathan Ismael Pungacho Enriquez)Documento2 páginasEstado Sólido Resumen (Jonathan Ismael Pungacho Enriquez)Ismael Pungacho100% (1)
- Fuerzas Interm + SólidosDocumento17 páginasFuerzas Interm + SólidosjorgeAún no hay calificaciones
- Propiedades PeriódicasDocumento31 páginasPropiedades Periódicascienciaspdg23Aún no hay calificaciones
- Propiedades de Los SolidosDocumento4 páginasPropiedades de Los SolidosGeremias OrtizAún no hay calificaciones
- (Cristales Covalentes) :: Compuestos Covalentes AtómicosDocumento2 páginas(Cristales Covalentes) :: Compuestos Covalentes AtómicosLuicitho Anderson Gibson Vargas ArevaloAún no hay calificaciones
- Naturaleza de Los Electrolitos (Cuestionario)Documento2 páginasNaturaleza de Los Electrolitos (Cuestionario)adriftt2009Aún no hay calificaciones
- Año de La Unidad, La Paz Y El DesarrolloDocumento7 páginasAño de La Unidad, La Paz Y El DesarrolloDiego Alonso GómezAún no hay calificaciones
- 5.uniones Entre TomosDocumento2 páginas5.uniones Entre TomospepepotamoAún no hay calificaciones
- Enlace Quimico: M. Sc. Elsa Huamán PDocumento39 páginasEnlace Quimico: M. Sc. Elsa Huamán PDeysi Sayuri Chavez CutipaAún no hay calificaciones
- Enlaces QuimicosDocumento2 páginasEnlaces QuimicosMafer LaupaAún no hay calificaciones
- 6.1 Naturaleza de Las Interacciones IntermolecularesDocumento3 páginas6.1 Naturaleza de Las Interacciones IntermolecularesKika ShisAún no hay calificaciones
- Tabla de SolidosDocumento1 páginaTabla de Solidosjavi1611Aún no hay calificaciones
- Unidad Educativa "Ambato" Proyecto Interdiciplinar Promoviendo La Diversidad Natural Y CulturalDocumento7 páginasUnidad Educativa "Ambato" Proyecto Interdiciplinar Promoviendo La Diversidad Natural Y CulturalFranklin TigasiAún no hay calificaciones
- Lo Semejante Disuelve Lo SemejanteDocumento3 páginasLo Semejante Disuelve Lo SemejanteMarlon Rene Reyes JacoAún no hay calificaciones
- Enlace Quimico TicsDocumento23 páginasEnlace Quimico Ticsvickyf23Aún no hay calificaciones
- Cuarto Capitulo Fuerzas IntermolecularesDocumento18 páginasCuarto Capitulo Fuerzas IntermolecularesNorela RodriguezAún no hay calificaciones
- Propiedades de Las Sustancias IónicasDocumento10 páginasPropiedades de Las Sustancias IónicasMireya Ng100% (1)
- Tema 3 Sólidos, Líquidos y GasesDocumento50 páginasTema 3 Sólidos, Líquidos y GasesanaAún no hay calificaciones
- Los CompuestosDocumento2 páginasLos CompuestosAlexis Manuel Carreño CruzAún no hay calificaciones
- CE83 S03 S09 PPT03 Enlace y LenguajeDocumento36 páginasCE83 S03 S09 PPT03 Enlace y LenguajeMichelle AlejandraAún no hay calificaciones
- Conductividad ElectricaDocumento3 páginasConductividad ElectricaDavid Hernandez LopezAún no hay calificaciones
- Estructura CristalinaDocumento38 páginasEstructura CristalinaArturo MelenaAún no hay calificaciones
- CE83 - S03 - S09 - PPT03 - Enlace y LenguajeDocumento36 páginasCE83 - S03 - S09 - PPT03 - Enlace y LenguajeFreddy Gabriel Huayna AndradeAún no hay calificaciones
- Cuestionario Quimica N5Documento4 páginasCuestionario Quimica N5Josue AquispeAún no hay calificaciones
- MA465 - S03 - S07 - CT03 - Enlace y Fuerzas IntermolecularesDocumento20 páginasMA465 - S03 - S07 - CT03 - Enlace y Fuerzas IntermolecularesPiero GonzagaAún no hay calificaciones
- 03 - Enlace y Fuerzas IntermolecularesDocumento20 páginas03 - Enlace y Fuerzas Intermolecularesalvaro santosAún no hay calificaciones
- Apuntes Quimica UP2020 (Parte 2)Documento10 páginasApuntes Quimica UP2020 (Parte 2)José Alberto Rosendo RicoAún no hay calificaciones
- Tema 3. Enlace QuímicoDocumento22 páginasTema 3. Enlace Químicor494y99bdkAún no hay calificaciones
- Propiedades Eléctricas de Los LíquidosDocumento7 páginasPropiedades Eléctricas de Los Líquidosalbaropernalete19_80Aún no hay calificaciones
- SESIÓN 2.1 - ENLACE QUÍMICO - ApuntesDocumento31 páginasSESIÓN 2.1 - ENLACE QUÍMICO - ApuntesFelipe VidalAún no hay calificaciones
- Inform 03 Enlace QuimicoDocumento11 páginasInform 03 Enlace QuimicoErnesto GálvezAún no hay calificaciones
- 3tresenlaces QuimicosDocumento22 páginas3tresenlaces QuimicosYatzil AlatorreAún no hay calificaciones
- Semana 9 - Enlace QuímicoDocumento16 páginasSemana 9 - Enlace QuímicoClases virtuales con Miss KarinaAún no hay calificaciones
- Pregunta Numero Dos Del CuestionarioDocumento3 páginasPregunta Numero Dos Del CuestionarioJese Machuca OrcoAún no hay calificaciones
- Actividad 12Documento11 páginasActividad 12Alexa Torruella BremerAún no hay calificaciones
- Cuadro Comparativo de QuimicaDocumento1 páginaCuadro Comparativo de QuimicaFernanda RomeroAún no hay calificaciones
- Práctica No - ViiDocumento4 páginasPráctica No - ViiLourensAún no hay calificaciones
- Practica 5 IpDocumento21 páginasPractica 5 IpVALERIA GOMEZ ROMEROAún no hay calificaciones
- Enlaces QuimicosDocumento5 páginasEnlaces QuimicosperlaAún no hay calificaciones
- Quimica Organica InvestigacionDocumento16 páginasQuimica Organica InvestigacionNicolás MéndezAún no hay calificaciones
- Clase 6 Soluciones SólidaDocumento17 páginasClase 6 Soluciones SólidaMackenzie Aguilar SanzAún no hay calificaciones
- CONSULTA Acido y BasesDocumento7 páginasCONSULTA Acido y BasesDaniela AlejandroAún no hay calificaciones
- Presentacion Sobre Los Tipos de Enlaces Quimicos.Documento10 páginasPresentacion Sobre Los Tipos de Enlaces Quimicos.Alessandro Llorente OjedaAún no hay calificaciones
- Estructura MolecularDocumento36 páginasEstructura MolecularleasturbaAún no hay calificaciones
- Formulario de Teoria de ColasDocumento1 páginaFormulario de Teoria de ColasMarisol Celestina Sulca LoveraAún no hay calificaciones
- Apuntes Semana 11Documento2 páginasApuntes Semana 11Marisol Celestina Sulca LoveraAún no hay calificaciones
- Apuntes Clase 3.2Documento1 páginaApuntes Clase 3.2Marisol Celestina Sulca LoveraAún no hay calificaciones
- Apuntes SingerDocumento2 páginasApuntes SingerMarisol Celestina Sulca LoveraAún no hay calificaciones
- Apuntes Semana 9Documento6 páginasApuntes Semana 9Marisol Celestina Sulca LoveraAún no hay calificaciones
- Ajustes - Dibujo Asistido Por El ComputadorDocumento9 páginasAjustes - Dibujo Asistido Por El ComputadorMarisol Celestina Sulca LoveraAún no hay calificaciones
- Resumen Lenguaje de La QuímicaDocumento1 páginaResumen Lenguaje de La QuímicaMarisol Celestina Sulca LoveraAún no hay calificaciones
- Tratamientos TermicosDocumento49 páginasTratamientos TermicosbrandunAún no hay calificaciones
- Guía de Laboratorio Ley de LavoisierDocumento2 páginasGuía de Laboratorio Ley de LavoisierMatias Manuel Viscarra ChavezAún no hay calificaciones
- Composiscion de La Vida Molecualas InorganicasDocumento5 páginasComposiscion de La Vida Molecualas InorganicasNancy Marilyn Quezada AmayaAún no hay calificaciones
- Fisica Quimica Nodos - SMDocumento200 páginasFisica Quimica Nodos - SMsofia beltroccoAún no hay calificaciones
- Tarea 2Documento7 páginasTarea 2naupariperezAún no hay calificaciones
- Los Materiales Cerámicos MA 39Documento10 páginasLos Materiales Cerámicos MA 39Shibe DoggoAún no hay calificaciones
- Recetas de Champús y Acondicionadores ProfesionalesDocumento59 páginasRecetas de Champús y Acondicionadores ProfesionalesAna VeliaAún no hay calificaciones
- Lista de Los Cationes y Los Aniones Mas FrecuentesDocumento5 páginasLista de Los Cationes y Los Aniones Mas Frecuenteslilafirpo07Aún no hay calificaciones
- QUÍMICA 5TO - PDC. 2024 - Gentiliza Editorial ActiDocumento24 páginasQUÍMICA 5TO - PDC. 2024 - Gentiliza Editorial ActiDarling Nineth Flores SabyAún no hay calificaciones
- S20 ManualDocumento23 páginasS20 ManualJimmyHansAún no hay calificaciones
- Quimica Jhon..Documento3 páginasQuimica Jhon..Kelly johana Pedroza bonillaAún no hay calificaciones
- Masterseal M 790Documento10 páginasMasterseal M 790Comercial ConpisosAún no hay calificaciones
- Practica de Examen 3er. Trimestre Ciencias 3 QuimicaDocumento1 páginaPractica de Examen 3er. Trimestre Ciencias 3 Quimica5k8hscbtbsAún no hay calificaciones
- CromatografíaDocumento13 páginasCromatografíaCasimiro MartinezAún no hay calificaciones
- Reporte Semana 3Documento8 páginasReporte Semana 3jorgeluiscaseres2005Aún no hay calificaciones
- 4 0-Training Burners Esp Rev2Documento38 páginas4 0-Training Burners Esp Rev2roger romeroAún no hay calificaciones
- Guiaquimica 23242049Documento29 páginasGuiaquimica 23242049Sofia ZannoniAún no hay calificaciones
- Quimica Aduni School 4° MuestraDocumento40 páginasQuimica Aduni School 4° MuestraAbner MostaceroAún no hay calificaciones
- Anisol y AcetofenonaDocumento13 páginasAnisol y AcetofenonaCYNTHIA AZUCENA LIMA RUIZAún no hay calificaciones
- ZINCDocumento5 páginasZINCmmartinezbalderramaAún no hay calificaciones
- BioPhene Ficha TécnicaDocumento1 páginaBioPhene Ficha TécnicaSamuel Alfonso Sanchez MonzonAún no hay calificaciones
- Ejercicios de SolubilidadDocumento7 páginasEjercicios de SolubilidadMedaly GuzmanAún no hay calificaciones
- Sec. Los Materiales y Sus TransformacionesDocumento11 páginasSec. Los Materiales y Sus TransformacionesSofia AriasAún no hay calificaciones
- Problemario ElectroquimicaDocumento8 páginasProblemario ElectroquimicaKaren RomanAún no hay calificaciones
- Modulo 20 Cuest A y 5 ContestadoDocumento16 páginasModulo 20 Cuest A y 5 Contestadoroselvimendez90Aún no hay calificaciones
- ESTRUCTURA DE LEWIS y Tipos de EnlacesDocumento2 páginasESTRUCTURA DE LEWIS y Tipos de Enlacesmarcosnoriega400Aún no hay calificaciones
- Alga 95Documento2 páginasAlga 95Hector Gpe Rangel RodriguezAún no hay calificaciones
- Práctica Númerio 3 - Números Cuánticos, Configuraciones Electrónicas y Tabla Periódica - OficialDocumento7 páginasPráctica Númerio 3 - Números Cuánticos, Configuraciones Electrónicas y Tabla Periódica - OficialEVELYN NICOLE CUTIPA CALCINAAún no hay calificaciones
- Gmbii 2024Documento111 páginasGmbii 2024xksrtdypqwAún no hay calificaciones
- 4° Cuadernillo Tumejormaestro Sem 29 23-24Documento17 páginas4° Cuadernillo Tumejormaestro Sem 29 23-24Laura RodriguezAún no hay calificaciones