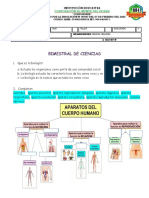
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tabla Periodica 6to Grado
Cargado por
jorge ortizDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tabla Periodica 6to Grado
Cargado por
jorge ortizCopyright:
Formatos disponibles
NOMBRE Y GRADO: FECHA:
APELLIDOS 6 to grado
DOCENTE: JORGE ORTIZ RICO QUÍMICA
TEORÍA
HISTORIA DE LA TABLA PERIÓDICA
En 1869, el químico ruso Dmitri Mendeleev publicó su primera tabla Grupo 2 (IIA). Los metales alcalinotérreos: berilio (Be), magnesio
periódica de los elementos organizada en orden creciente de masa (Mg), calcio (Ca), estroncio (Sr), bario (Ba), radio (Ra).
atómica. Al mismo tiempo, Lothar Meyer, químico alemán, publicó su
tabla propia periódica con los elementos ordenados de menor a Grupo 3 (IIIB). La familia del escandio (Sc), que incluye al Itrio (Y) y
a las tierras raras: lantano (La), cerio (Ce), praseodimio (Pr), neodimio
mayor masa atómica. Mendeleev organizó su tabla en filas
(Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd),
horizontales dejando espacios vacíos donde debían incorporar
terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), iterbio
algunos elementos que aún no habían sido descubiertos. En esa (Yt), lutecio (Lu). También se incluyen a los actínidos: actinio (Ac),
organización Mendeleev visualizó un patrón aparente: elementos con torio (Th), protactinio (Pa), uranio (U), neptunio (Np), plutonio (Pu),
propiedades químicas similares aparecen en intervalos regulares (o americio (Am), curio (Cm), berkelio (Bk), californio (Cf), einstenio (Es),
periódicos) en las columnas verticales de la tabla. El respaldo a las fermio (Fm), mendelevio (Md), nobelio (No) y lawrencio (Lr).
predicciones de Mendeleev se produce tras el descubrimiento de
galio (Ga), escandio (Sc) y germanio (Ge) entre 1874 y 1885 Grupo 4 (IVB). La familia del titanio (Ti), que incluye el circonio (Zr),
localizándolos en aquellos espacios vacíos, lo que dio aún más valor el hafnio (Hf) y el rutherfordio (Rf), este último sintético y radiactivo.
y aceptación de su Tabla Periódica en la comunidad científica.
Grupo 5 (VB). La familia del vanadio (V): niobio (Nb), tántalo (Ta) y
En 1913, un químico inglés, Henry Moseley, mediante estudios de dubnio (Db), este último es sintético.
rayos X, determinó la carga nuclear (número atómico) de los Grupo 6 (VIB). La familia del cromo (Cr): molibdeno (Mb), wolframio
elementos, reagrupándolos en orden creciente de número atómico, (W) y seaborgio (Sg), este último es sintético.
tal como la conocemos hoy.
Grupo 7 (VIIB). La familia del manganeso (Mn): renio (Re), tecnecio
(Tc) y bohrio (Bh), estos dos últimos son sintéticos.
Grupo 8 (VIIIB). La familia del hierro (Fe): rutenio (Ru), osmio (Os) y
hassio (Hs), este último sintético.
Grupo 9 (VIIIB). La familia del cobalto (Co): rodio (Rh), iridio (Ir) y el
sintético meitneiro (Mt).
Grupo 10 (VIIIB). La familia del níquel (Ni): paladio (Pd), platino (Pt)
y el sintético darmstadtio (Ds).
Grupo 11 (IB). La familia del cobre (Cu): plata (Ag), oro (Au) y el
sintético roentgenio (Rg).
Grupo 12 (IIB). La familia del zinc (Zn): cadmio (Cd), mercurio (Hg) y
el sintético copernicio (Cn).
Grupo 13 (IIIA). Los térreos: boro (Br), aluminio (Al), galio (Ga),
indio (In), talio (Tl) y el sintético nihonio (Nh).
Grupo 14 (IVA). Los carbonoideos: carbono (C), silicio (Si), germanio
(Ge), estaño (Sn), plomo (Pb) y el sintético flevorio (Fl).
Grupo 15 (VA). Los nitrogenoideos: nitrógeno (N), fósforo (P),
arsénico (As), antimonio (Sb), bismuto (Bi) y el sintético moscovio
¿QUÉ ES LA TABLA PERIÓDICA?
(Mc).
La Tabla Periódica de los elementos es un registro de todos Grupo 16 (VIA). Los calcógenos o anfígenos: oxígeno (O), azufre (S),
los elementos químicos conocidos por la humanidad. Los elementos selenio (Se), teluro (Te), polonio (Po) y el sintético livermorio (Lv).
están ordenados en forma de tabla según su número
atómico (número de protones), su configuración electrónica y sus Grupo 17 (VIIA). Los halógenos: flúor (F), cloro (Cl), bromo (Br),
propiedades químicas. yodo (I), astato (At) y el sintético teneso (Ts).
En esta tabla los elementos están organizados en filas y Grupo 18 (VIIIA). Los gases nobles: helio (He), neón (Ne), argón
columnas que muestran cierta periodicidad: los elementos que (Ar), kriptón (Kr), xenón (Xe), radón (Rn) y el sintético oganesón
pertenecen a una misma columna tienen propiedades similares. En (Og).
principio, toda la materia conocida del universo está compuesta por
diversas combinaciones de los 118 elementos, registrados en la Tabla Las 7 filas que conforman la tabla periódica son los periodos que
Periódica. vienen dados por las 7 capas o niveles de energía K, L, M, N, O, P,
Se han establecido símbolos, llamados símbolos químicos, para Q. El periodo que ocupa un elemento coincide con su última capa
representar a cada elemento de la Tabla Periódica, que además están electrónica. Los elementos situados en un mismo periodo tienen
identificados según sus estados de agregación (sólido, líquido o gas) propiedades diferentes, pero masas atómicas parecidas. En la tabla
a una temperatura de 0 °C y a una presión de 1atm. periódica podemos distinguir 4 bloques generados de acuerdo al
La Tabla Periódica es una herramienta fundamental para la química, orbital que están ocupando los electrones más externos; los orbitales
la biología y otras ciencias naturales, que se actualiza con el pasar son s, p, d y f que permite respectivamente hasta 2, 6, 10 y 14
de los años, conforme aprendemos más sobre las propiedades de la electrones. Al bloque s pertenecen los elementos alcalinos y los
materia y las relaciones entre los elementos. alcalino térreos; el bloque p está formado por los grupos que van del
13 al 18; el grupo f comprende las familias que van de la 3 a la 12 y
¿CÓMO ESTÁ ORGANIZADA LA TABLA PERIÓDICA? contiene a los metales de transición; finalmente el bloque f que se
posiciona en la parte inferior de los grupos, contiene a las tierras
La tabla periódica actual está estructurada en siete filas (horizontales) raras. La tabla periódica nos da diferente información sobre cada
denominadas períodos y en 18 columnas (verticales) elemento químico como su símbolo, radio atómico (distancia entre el
llamadas grupos o familias. Los elementos químicos están ordenados núcleo y la capa de valencia más externa), Energía de ionización
en orden creciente de sus números atómicos, es decir, el número (energía para separar al electrón más externo de un átomo en estado
atómico aumenta de izquierda a derecha en el período y de arriba gaseoso), Afinidad electrónica (energía liberada cuando un átomo en
hacia abajo en el grupo. Los dieciocho grupos conocidos son: estado gaseoso capta un electrón), Electronegatividad (medida en
que un átomo atrae electrones cuando forma parte de un enlace
Grupo 1 (IA). Los metales alcalinos: litio (Li), sodio (Na), potasio (K), químico), número atómico (número de protones que tiene el átomo
del elemento), masa atómica (la suma de las masas de todos los
rubidio (Rb), cesio (Cs), francio (Fr). Además, en este grupo se
protones y neutrones del átomo, entre otras.
encuentra el hidrógeno (H), que es un gas.
También podría gustarte
- La tabla periódica de los elementos químicosDe EverandLa tabla periódica de los elementos químicosCalificación: 1 de 5 estrellas1/5 (1)
- Matriz de Riesgo de MantenimientoDocumento4 páginasMatriz de Riesgo de MantenimientoYileFernandezFrancoAún no hay calificaciones
- La IbericaDocumento3 páginasLa Ibericaalekatherine123Aún no hay calificaciones
- Para Aplicarlo TestDocumento10 páginasPara Aplicarlo TestCarlos Omar Gonzalez ChavezAún no hay calificaciones
- Terapia de Esquemas - EN PROCESODocumento26 páginasTerapia de Esquemas - EN PROCESOAnthony LarreaAún no hay calificaciones
- 01 Atomo Tabla Periodica-2Documento9 páginas01 Atomo Tabla Periodica-2Rossana ZacariasAún no hay calificaciones
- Metales y No Metales Ejercicios Fabian Sebastian Monroy BaezaDocumento6 páginasMetales y No Metales Ejercicios Fabian Sebastian Monroy Baezafabian vazquez santana100% (3)
- Juegos para Estimular La Sana Convivencia en NiñosDocumento7 páginasJuegos para Estimular La Sana Convivencia en NiñosTiffany AmayaAún no hay calificaciones
- Triptico de La Tabla PeriodicaDocumento2 páginasTriptico de La Tabla PeriodicaStephano Estacio Duran100% (1)
- Tabla PeriodicaDocumento2 páginasTabla PeriodicaYOSMARI MILLANAún no hay calificaciones
- Investigacion Tabla PeriodicaDocumento4 páginasInvestigacion Tabla PeriodicaDerick PeñalozaAún no hay calificaciones
- Qué Es La Tabla PeriódicaDocumento3 páginasQué Es La Tabla PeriódicaSandy Yazuri Archibold SmithAún no hay calificaciones
- ¿Qué Es La Tabla Periódica?Documento12 páginas¿Qué Es La Tabla Periódica?ALEXISAún no hay calificaciones
- Tabla PeriódicaDocumento3 páginasTabla PeriódicaCristofer RodriguezAún no hay calificaciones
- Como Se Organizan Los Elementos QuímicosDocumento5 páginasComo Se Organizan Los Elementos Químicosmaria moyaAún no hay calificaciones
- Tabla PeriódicaDocumento4 páginasTabla PeriódicaNick BitarAún no hay calificaciones
- Historia de La Tabla PeriódicaDocumento4 páginasHistoria de La Tabla PeriódicaBRYANAún no hay calificaciones
- Actividad 3. Tabla Periódica 1Documento6 páginasActividad 3. Tabla Periódica 1Samuel Jesus Rodriguez SilvaAún no hay calificaciones
- Ciencia y TecnologiaDocumento2 páginasCiencia y TecnologiaReina HernandezAún no hay calificaciones
- Clase Tabla PeriódicaDocumento16 páginasClase Tabla PeriódicaEdwin Morales JuárezAún no hay calificaciones
- Anotaciones Quimica 10Documento4 páginasAnotaciones Quimica 10Malú PantojaAún no hay calificaciones
- Modelos Atómicos y Tabla Periódica Grado NovenoDocumento4 páginasModelos Atómicos y Tabla Periódica Grado Novenofredy merchanAún no hay calificaciones
- Tabla PeriódicaDocumento5 páginasTabla PeriódicaDannyCielAún no hay calificaciones
- Elementos QuimicosDocumento6 páginasElementos QuimicosAnayanci Rondon GarciaAún no hay calificaciones
- Tarea Tabla PeriodicaDocumento4 páginasTarea Tabla PeriodicaCristian Flores SaicoAún no hay calificaciones
- MENDELEIEVDocumento4 páginasMENDELEIEVJennifer BeltranAún no hay calificaciones
- Tabla PeriódicaDocumento16 páginasTabla Periódicajuan pablo el proAún no hay calificaciones
- XdtablaDocumento5 páginasXdtablaLuis MontaneéèAún no hay calificaciones
- Dmitri Ivánovich Mendeléiev QuimicaDocumento6 páginasDmitri Ivánovich Mendeléiev QuimicaLisbeth ColladoAún no hay calificaciones
- La Tabla Periódica 1Documento3 páginasLa Tabla Periódica 1Danna SimaluisaAún no hay calificaciones
- 1 - Proyecto Final. Tabla Periódica InteractivaDocumento4 páginas1 - Proyecto Final. Tabla Periódica InteractivaMaylin Grace Cáceres SolísAún no hay calificaciones
- Tabla Periodica Grado 7 Agosto 19Documento9 páginasTabla Periodica Grado 7 Agosto 19Romero YariethAún no hay calificaciones
- T3 Elementos Químicos, Sistema PeriódicoDocumento11 páginasT3 Elementos Químicos, Sistema Periódicoxameise666Aún no hay calificaciones
- Qué Es La Tabla PeriódicaDocumento5 páginasQué Es La Tabla PeriódicaElero JoseAún no hay calificaciones
- Qué Es La Tabla PeriódicaDocumento3 páginasQué Es La Tabla PeriódicaisrafajardoAún no hay calificaciones
- La Tabla PeriódicaDocumento17 páginasLa Tabla PeriódicaMonika FonsecaAún no hay calificaciones
- Tabla Periódica de Los ElementosDocumento5 páginasTabla Periódica de Los ElementosFrancely MarielAún no hay calificaciones
- La Tabla Periódica ActualDocumento3 páginasLa Tabla Periódica ActualMilagros Kemberly Loza CarrilloAún no hay calificaciones
- Historia de La Tabla PeriodicaDocumento4 páginasHistoria de La Tabla PeriodicaRocio Rivas GonzalezAún no hay calificaciones
- Quimica Organica MayoDocumento37 páginasQuimica Organica MayoShereAún no hay calificaciones
- Tabla PeriódicaDocumento14 páginasTabla PeriódicaAlbis SalinasAún no hay calificaciones
- Trabajo Tabla PeriodicaDocumento8 páginasTrabajo Tabla PeriodicaKarla Marcela Tang VelaAún no hay calificaciones
- Conceptos de La Tabla de QuímicaDocumento2 páginasConceptos de La Tabla de QuímicaSilvia FunesAún no hay calificaciones
- Actividad 10 Grupos de La Tabla PeriódicaI 2023Documento3 páginasActividad 10 Grupos de La Tabla PeriódicaI 2023marcareynaluispaoloAún no hay calificaciones
- Autonoma de Honduras: DocenteDocumento14 páginasAutonoma de Honduras: DocenteAndrea MaltaAún no hay calificaciones
- Perioricidad QuimicaDocumento13 páginasPerioricidad QuimicaCoquitoMazelAún no hay calificaciones
- TABLA PERIÓDICA. Estrada Ron AndrésDocumento9 páginasTABLA PERIÓDICA. Estrada Ron AndrésAndrés EstradaAún no hay calificaciones
- Tabla Periodica y Su DivisionesDocumento3 páginasTabla Periodica y Su DivisionesLuis Moreira ParragaAún no hay calificaciones
- Historia de La Tabla Periódica Eje 1Documento19 páginasHistoria de La Tabla Periódica Eje 1Wil OlaveAún no hay calificaciones
- La Tabla Periódica y Sus Elementos QuímicosDocumento2 páginasLa Tabla Periódica y Sus Elementos QuímicosbeathrizAún no hay calificaciones
- Guía Aprendizaje Tabla PeriódicaDocumento3 páginasGuía Aprendizaje Tabla Periódicakelly perozaAún no hay calificaciones
- Descripción de La Tabla PeriódicaDocumento1 páginaDescripción de La Tabla Periódicaᴀʀɪᴀɴᴀ ᴇꜱᴘɪɴᴀʟAún no hay calificaciones
- Reseña Historica y Propiedades de La Tabla PeriodicaDocumento2 páginasReseña Historica y Propiedades de La Tabla PeriodicaIsrael Sanchez RodriguezAún no hay calificaciones
- Tabla Periodica y Su DivisionesDocumento3 páginasTabla Periodica y Su DivisionesLuis Fernando Moreira ParragaAún no hay calificaciones
- Practica #1 Estudio de La Tabla PeriodicaDocumento14 páginasPractica #1 Estudio de La Tabla PeriodicaDey CalcinaAún no hay calificaciones
- La Tabla PeriodicaDocumento9 páginasLa Tabla PeriodicaealejandronsAún no hay calificaciones
- Taller Tabla Periodica 2019Documento9 páginasTaller Tabla Periodica 2019rocio blancoAún no hay calificaciones
- Clasificación Tabla PeriódicaDocumento5 páginasClasificación Tabla PeriódicaFernando Alcivar JuradoAún no hay calificaciones
- Práctica N 1Documento13 páginasPráctica N 1Gunnar Leonardo Gutiérrez QuisbertAún no hay calificaciones
- Ficha de Tabla Periodica de Los Elementos QuimicosDocumento1 páginaFicha de Tabla Periodica de Los Elementos Quimicoscesar ulisesAún no hay calificaciones
- Tabla PeriodicaDocumento9 páginasTabla PeriodicaKarol Valeria Tarazona MendozaAún no hay calificaciones
- Practica 3 Tabla Periodica Quimica TecDocumento12 páginasPractica 3 Tabla Periodica Quimica TecErvin Molina PerezAún no hay calificaciones
- Santiago Rebolledo 9D Quimica GUIA 5Documento11 páginasSantiago Rebolledo 9D Quimica GUIA 5santiago rebolledoAún no hay calificaciones
- Grupos de La Tabla PeriodicaDocumento3 páginasGrupos de La Tabla PeriodicaJoselee Ramos TitoAún no hay calificaciones
- Tarea Quimica Semana 5Documento4 páginasTarea Quimica Semana 5xXenelFchatXxAún no hay calificaciones
- Los Cinco Reinos Grado 9 y 10Documento2 páginasLos Cinco Reinos Grado 9 y 10jorge ortizAún no hay calificaciones
- Historia de La Tabla PeriodicaDocumento3 páginasHistoria de La Tabla Periodicajorge ortizAún no hay calificaciones
- Sistema Nervioso Guia NuevaDocumento2 páginasSistema Nervioso Guia Nuevajorge ortizAún no hay calificaciones
- Bimestral Ciencias Ciclo Iii y IvDocumento3 páginasBimestral Ciencias Ciclo Iii y Ivjorge ortizAún no hay calificaciones
- Fisica de Noveno MRUDocumento2 páginasFisica de Noveno MRUjorge ortizAún no hay calificaciones
- Sistema Digestivo en Los AnimalesDocumento3 páginasSistema Digestivo en Los Animalesjorge ortizAún no hay calificaciones
- Tritico de Instruccion PremilitarDocumento4 páginasTritico de Instruccion Premilitarjorge ortizAún no hay calificaciones
- Energia Fisica de 6 ToDocumento1 páginaEnergia Fisica de 6 Tojorge ortizAún no hay calificaciones
- Movimiento de Caida Libre 10 MoDocumento1 páginaMovimiento de Caida Libre 10 Mojorge ortizAún no hay calificaciones
- Evaluacion de Fisica 6to y SeptimoDocumento1 páginaEvaluacion de Fisica 6to y Septimojorge ortizAún no hay calificaciones
- Sistema Oseo de 6to GradoDocumento3 páginasSistema Oseo de 6to Gradojorge ortizAún no hay calificaciones
- Principios de TermodinamicaDocumento2 páginasPrincipios de Termodinamicajorge ortizAún no hay calificaciones
- Guia de Los Cambios de La MateriaDocumento6 páginasGuia de Los Cambios de La Materiajorge ortizAún no hay calificaciones
- Estadistica II CorregidoDocumento2 páginasEstadistica II Corregidojorge ortizAún no hay calificaciones
- Taller de BiologiaDocumento2 páginasTaller de Biologiajorge ortizAún no hay calificaciones
- Evaluacion de QuimicaDocumento2 páginasEvaluacion de Quimicajorge ortizAún no hay calificaciones
- Taller Seman1 Servicios GastronomicosDocumento4 páginasTaller Seman1 Servicios Gastronomicosjorge ortizAún no hay calificaciones
- Taller Semana 3 Servicios GastronómicosDocumento10 páginasTaller Semana 3 Servicios Gastronómicosjorge ortizAún no hay calificaciones
- Taller de La Semana 2 Servicios GastronómicosDocumento7 páginasTaller de La Semana 2 Servicios Gastronómicosjorge ortizAún no hay calificaciones
- Ciclo V y Vi Unidad 6 Quimica MezclasDocumento6 páginasCiclo V y Vi Unidad 6 Quimica Mezclasjorge ortizAún no hay calificaciones
- Trabajo de Orientacion RealizadoDocumento5 páginasTrabajo de Orientacion Realizadojorge ortizAún no hay calificaciones
- Analis Del Poema 19Documento7 páginasAnalis Del Poema 19jorge ortizAún no hay calificaciones
- Manuel Mauricio Faillace Delgado: Procesos de La Administración Educativa Y Funcionarios EncargadosDocumento1 páginaManuel Mauricio Faillace Delgado: Procesos de La Administración Educativa Y Funcionarios Encargadosjorge ortizAún no hay calificaciones
- Cuadro Comparativo Del RealismoDocumento2 páginasCuadro Comparativo Del Realismojorge ortizAún no hay calificaciones
- Crucigrama de QuimicaDocumento1 páginaCrucigrama de Quimicajorge ortizAún no hay calificaciones
- Unidad 4 Disoluciones y Las Diferentes Medidas de Su Concentración. JorjhanaDocumento29 páginasUnidad 4 Disoluciones y Las Diferentes Medidas de Su Concentración. Jorjhanajorge ortizAún no hay calificaciones
- Taller de Ley de La Gravitacion Universal Fisica Ciclo VDocumento4 páginasTaller de Ley de La Gravitacion Universal Fisica Ciclo Vjorge ortizAún no hay calificaciones
- Evidencia de Foro Tematico Gestion DocumentalDocumento2 páginasEvidencia de Foro Tematico Gestion Documentaljorge ortizAún no hay calificaciones
- Taller Reflexivo de Herramientas VirtualesDocumento5 páginasTaller Reflexivo de Herramientas Virtualesjorge ortizAún no hay calificaciones
- Foro Tematico de Servicios Gastronomicos Semana 3Documento1 páginaForo Tematico de Servicios Gastronomicos Semana 3jorge ortizAún no hay calificaciones
- SANKY TripticoDocumento2 páginasSANKY TripticoGina Perez50% (4)
- Protocolo Abordaje Fonoaudiológico en Pandemia - Mayo2020 OKDocumento32 páginasProtocolo Abordaje Fonoaudiológico en Pandemia - Mayo2020 OKFlor MartinAún no hay calificaciones
- Maravillas de La NaturalezaDocumento41 páginasMaravillas de La NaturalezaJosé María Escudero100% (1)
- Sexo y Sexualidad La Identidad Sexual PDFDocumento12 páginasSexo y Sexualidad La Identidad Sexual PDFMayerlis AlvarezAún no hay calificaciones
- Practicas FHDocumento44 páginasPracticas FHAlejandra Ceja Vallejo100% (1)
- NutricionDocumento38 páginasNutricionMarina AlbertiAún no hay calificaciones
- Taller 3 BacteriologiaDocumento7 páginasTaller 3 BacteriologiaSebastian SaldañaAún no hay calificaciones
- Cámara de Niebla Cuba 2019 - Antología Gabriel Chávez CasazolaDocumento76 páginasCámara de Niebla Cuba 2019 - Antología Gabriel Chávez CasazolaSofía VeraAún no hay calificaciones
- Riego en Frutales PDFDocumento34 páginasRiego en Frutales PDFAriel Garcia100% (1)
- Unidad 3 La Ley Moral y Los Principios Basicos de La Moral CristianaDocumento12 páginasUnidad 3 La Ley Moral y Los Principios Basicos de La Moral CristianaManuel Armando67% (3)
- Pacífico Cotizador VIAPDocumento3 páginasPacífico Cotizador VIAPJose Miguel Vera VasquezAún no hay calificaciones
- Comparacion Codigos y Normas PDFDocumento27 páginasComparacion Codigos y Normas PDFyefer_123100% (1)
- 1000 CS SpanishDocumento2 páginas1000 CS SpanishAlxAscAún no hay calificaciones
- La PornografiaDocumento6 páginasLa PornografiaTatiana AlvarezAún no hay calificaciones
- Tarea Química SenaDocumento4 páginasTarea Química SenaESTEBAN VASQUEZAún no hay calificaciones
- Acta CopasoDocumento7 páginasActa CopasoEdgarRuizAún no hay calificaciones
- Trabajo Mecanica de SueloDocumento14 páginasTrabajo Mecanica de SueloEdgardito GutierrezAún no hay calificaciones
- Silabo de GastroenterologiaDocumento8 páginasSilabo de Gastroenterologiajanin_182Aún no hay calificaciones
- Obtencion de Lubricantes MedianteDocumento19 páginasObtencion de Lubricantes MedianteGonzalo Gamez PintoAún no hay calificaciones
- Santas en CadenaDocumento8 páginasSantas en CadenaHavva VeveAún no hay calificaciones
- Sobre Dos Formas de Comprender Del Coordinador GrupalDocumento9 páginasSobre Dos Formas de Comprender Del Coordinador GrupalzirpoAún no hay calificaciones
- Taller Excrecion en Animales InvertebradosDocumento2 páginasTaller Excrecion en Animales InvertebradosAntonio Andrés Lugo NiñoAún no hay calificaciones
- Control de Calidad en El Proceso de ProducciónDocumento2 páginasControl de Calidad en El Proceso de ProducciónMarcial Campos GutierrezAún no hay calificaciones
- Informe InspeccionDocumento4 páginasInforme InspeccionPalacios MixelAún no hay calificaciones