Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicios Termoquimica Con Solucion.11.10.2021
Cargado por
diani perez perez0 calificaciones0% encontró este documento útil (0 votos)
13 vistas2 páginasimportante para el estudio
Título original
Ejercicios termoquimica con solucion.11.10.2021
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOC, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoimportante para el estudio
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOC, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas2 páginasEjercicios Termoquimica Con Solucion.11.10.2021
Cargado por
diani perez perezimportante para el estudio
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOC, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
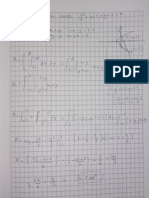
Ejercicios de termoquímica con solución
Energía de reacción y Ley de Hess
1) Calcular la ΔH0 de la reacción: C(s) + CO2(g) 2 CO(g)
Sabiendo que:
CO(g) + 1/2 O2 → CO2 ΔH0 = -283.0 kJ
C(s) + O2(g) → CO2 ΔH0= -393.5 kJ Resultado: ΔH0 =
+172.5 kJ
2) Las entalpías estándar de formación del CO2(g) y del H2O(l) son respectivamente –
393 kJ/mol y –286 kJ/mol y la entalpía estándar de combustión del etanal C2H4O(l) es –
1164 kJ/mol. Calcular:
a) La entalpía de formación del etanal. Resultado: ΔH0 =-194kJ/mol. b) La energía
que se libera al quemar 10 gramos de etanal.
Resultado: E= 264,5 J
3) La entalpía estándar de formación del dióxido de carbono (g) es -393,5 kJ/mol,
la del agua líquida -285,8 kJ/mol y la del metano (g) -748,0 kJ/mol.
Calcular la variación de entalpía estándar de la reacción de combustión del gas metano.
Resultado: ΔH0 =-217,1kJ/mol
4) Escribe la reacción de formación del SH2(g) y calcula su entalpía estándar de
formación a partir de los siguientes datos:
ΔHf0 SO2(g): -296.4 kJ/mol ΔHf0 H2O (liq): -285.9 kJ/mol
SH2(g) + 3/2 O2 (g) → SO2 (g) + H2O (liq) ΔH0= -561.8 kJ/mol
Resultado: ΔHf0 SH2(g): -20.5 kJ/mol
5) El tolueno (C7H8) es un hidrocarburo líquido muy importante en la industria orgánica,
utilizándose como disolvente, y también en la fabricación de tintes, colorantes,
medicamentos y explosivos como el TNT.
Si cuando se quema un gramo de tolueno (C7H8) se desprenden 42, 5 kilojulios.
a) ¿Cuál será el valor de su entalpía de combustión?
b) Calcula la entalpía estándar de formación del tolueno, utilizando la ley de Hess.
(Resultado: ΔHf0= +10.2 kJ/mol)
Datos: masa atómica. (C) = 12; masa. atómica. (H) = 1
Entalpía estándar de formación del CO2(g): -393, 8KJ/mol
Entalpía estándar de formación del H2O (liq): –285,8 KJ/mol.
6) Calcular el calor de formación del acetileno (etino, C2H2), conocidos los calores de
formación del H2O(l) y del CO2(g). (Resultado: ΔHf0= +272 kJ/mol)
Datos:H0 f H2O(g): -241,8 kJ/mol ;H0f CO2(g): -393,13 kJ/mol;
H0 combustión C2H2 (g): -1300 kJ/mol
Energía libre de Gibbs
21) Calcula la variación de entropía que se produce en la combustión del metanol.
Datos:
S0 CH3OH (l) = 126.8 J/mol K S0 CO2 (g) = 213.4 J/mol K
S0 O2 (g) = 204.8 J/mol K S0 H2O(g) = 188.7 J/mol K
Resultado: ΔSº = +156.8 J/K
22) Calcula la variación de entropía para la reacción de síntesis del amoníaco:
N2 + 3H2 --> 2NH3
Datos:
S0 N2 (g) = 191.5 J/mol K S0 H2 (g) = 130.7 J/mol K
S0 NH3 (g) = 192.3 J/mol K Resultado: ΔSº = -199 J/K
23) Determina si es espontánea la formación del CO2 a partir de sus elementos a 25°C
Datos:
∆Hf0 CO2 (g) = -393.5 kJ/mol S0 CO2 (g) = 213.4 J/mol K
0
S O2 (g) = 204.8 J/mol K S0 C (s) = 5.7 J/mol K
Resultado: ∆Gº = -394.4 kJ, será espontánea
24) Predecir la espontaneidad de la siguiente reacción:
Ag2O (s) 2Ag(s) + 1/2 O2(g)
Datos de la reacción: ∆H= 30,6 kJ ∆Sº = 60,2 J/K
0
Resultado: ∆Hf Ag2O(s)= -30.6 kJ/mol ∆Gº = -48.54 kJ
25) Para una determinada reacción, a 25 ºC, los valores de ∆Hº y ∆Sº son,
respectivamente, 10,5 kJ y 30,0 J/K.
a) Justificar numéricamente si la reacción será espontánea o
no. b) ¿Es una reacción exotérmica? ¿Por qué?
c) Supuestas constantes ambas funciones de estado, calcular la temperatura a la que
el sistema está en equilibrio.
Resultado: a) ∆Gº= 1560 J, no espontánea b) Endotérmica c) Tequilibrio =350 K
26) Calcular la variación de la energía libre de Gibbs para la combustión del metano a
298 K.
Datos:
∆Hf0 CH4 (g) = -74.8 kJ/mol S0 CH4 (g) = 186.3 J/mol K
∆Hf0 CO2 (g) = -393.5 kJ/mol S0 CO2 (g) = 213.4 J/mol K
∆Hf0 H2O (g) = -241.6 kJ/mol S0 H2O (g) = 188.7 J/mol K
S0 O2 (g) = 49.0 J/mol K
Resultado: ∆Gº= -893.2 kJ, espontánea
27) Calcular la variación de la energía libre de Gibbs y la temperatura de equilibrio,
supuestas constantes ∆H y ∆S, para la oxidación del SO2 a SO3: SO2 + ½O2
SO3. Datos:
∆Hf0 SO3 (g) = -395.7 kJ/mol S0 SO3 (g) = 255.9 J/mol K
0
∆Hf SO2 (g) = -296.4 kJ/mol S0 SO2 (g) = 248.3 J/mol K
S0 O2 (g) = 204.8 J/mol K
Resultado: ∆H = -99.3 kJ/mol ∆S = -94.8 J/mol K Teq= 1047 K
28) Discutir el efecto de un cambio de espontaneidad de las siguientes reacciones a 1
atm, suponiendo constantes ∆H y ∆S, cuando cambia la temperatura:
∆H0 (kJ) ∆S0 (J/K)
a) 2PbO(s) + 2 SO2 (g) 2 PbS (s) + 3 O2 (g) + 830.8 +168
b) 2 As(s) + 3 F2 (g) 2 AsF3 (l) -1643 -0.316
c) CO(g) C(s) + 1/2 O2 (g) +110.5 -89.4
Resultado: a) Siempre espontánea b) Espontánea a T baja c) Nunca espontánea
29) La "peste del estaño" consiste en un cambio de sistema de cristalización por el que
estaño blanco se transforma en estaño gris. Calcular a qué temperatura se produce este
cambio.
Estaño Blanco ∆Hf0 = 0.0 kJ /mol S0 = 51.55 J/mol K
Estaño gris ∆Hf0 = - 2.09 kJ/mol S0 = 44.14 J/mol K
Resultado= 282 K = 9°C
También podría gustarte
- Ejercicios Termoquimica Con SolucionDocumento2 páginasEjercicios Termoquimica Con Solucionisidora090% (1)
- Ejercicios Termoquimica Con SolucionDocumento4 páginasEjercicios Termoquimica Con SolucionAlejandro Garcia MateoAún no hay calificaciones
- Ejercicios Repaso TermoDocumento2 páginasEjercicios Repaso TermonachoAún no hay calificaciones
- Termoquimica EjerciciosDocumento3 páginasTermoquimica EjerciciosAgustin PerezAún no hay calificaciones
- Tarea para Enviar III SEMESTREDocumento6 páginasTarea para Enviar III SEMESTRECarlos Bruno TolenAún no hay calificaciones
- Tarea para Enviar III SEMESTREDocumento6 páginasTarea para Enviar III SEMESTRECarlos Odilio Bruno TolentinoAún no hay calificaciones
- Ejer Entropia y Energia LibreDocumento1 páginaEjer Entropia y Energia Librespaceman800Aún no hay calificaciones
- Taller 7. Entropía de Una Reacción Química-2Documento3 páginasTaller 7. Entropía de Una Reacción Química-2Adolf ReinhardtAún no hay calificaciones
- TRabajo FebreroDocumento5 páginasTRabajo FebreroSilvano Salvador ondo ndongAún no hay calificaciones
- Energía Libre de Gibbs EjerciciosDocumento2 páginasEnergía Libre de Gibbs EjerciciosClaudio PezoAún no hay calificaciones
- Practica Tema IVDocumento4 páginasPractica Tema IVSilvano Salvador ondo ndongAún no hay calificaciones
- Ejercicios EspontaneidadDocumento1 páginaEjercicios EspontaneidadDaniel Sierra0% (1)
- Capitulo 10 - Termodinamica y CinéticaDocumento12 páginasCapitulo 10 - Termodinamica y CinéticaMaria Monneret de VillarsAún no hay calificaciones
- Guia Ejercicios Entalpía 3° y 4° Diferenciado 2016Documento5 páginasGuia Ejercicios Entalpía 3° y 4° Diferenciado 2016acyutaAún no hay calificaciones
- Guia Ejercicios eDocumento6 páginasGuia Ejercicios ebarlosAún no hay calificaciones
- Taller No. 2 TermoquímicaDocumento4 páginasTaller No. 2 TermoquímicaMaria Fernanda AyalaAún no hay calificaciones
- Termoquimica 1303210110 PDFDocumento3 páginasTermoquimica 1303210110 PDFAna Paula CascoAún no hay calificaciones
- Recuperación de Exámenes de LaboratorioDocumento10 páginasRecuperación de Exámenes de LaboratorioJose Dario Salcedo ChumoqueAún no hay calificaciones
- Guia Ejercicios Entalpía 3° y 4° Diferenciado 2018Documento6 páginasGuia Ejercicios Entalpía 3° y 4° Diferenciado 2018barlosAún no hay calificaciones
- MIcro Taller 3 PDFDocumento10 páginasMIcro Taller 3 PDFDora SoriaAún no hay calificaciones
- Guia TermodinamicaDocumento3 páginasGuia TermodinamicaMarlie OlivaresAún no hay calificaciones
- Guia Ejercicios Entalpía 3° y 4° DiferenciadoDocumento5 páginasGuia Ejercicios Entalpía 3° y 4° DiferenciadoNatalia Arias FigueroaAún no hay calificaciones
- Problemas Tema4 QDocumento5 páginasProblemas Tema4 Qignaciolangarica68Aún no hay calificaciones
- Energía de las reacciones químicas: problemas resueltosDocumento4 páginasEnergía de las reacciones químicas: problemas resueltosdari0% (2)
- Guia de TermoquimicaDocumento5 páginasGuia de TermoquimicanixiaAún no hay calificaciones
- Guia Ejercicios Entalpía 3° y 4° Diferenciado 2016Documento5 páginasGuia Ejercicios Entalpía 3° y 4° Diferenciado 2016Ana María Millán InzunzaAún no hay calificaciones
- Problemas Tema 12-Termodinámica QuimicaDocumento7 páginasProblemas Tema 12-Termodinámica Quimicavictor lebronAún no hay calificaciones
- Guà - A Nâº5 Termoquà - MicaDocumento3 páginasGuà - A Nâº5 Termoquà - MicaConi SchnohrAún no hay calificaciones
- Guia Ejercicios Entalpía 3° y 4° Diferenciado 2016Documento5 páginasGuia Ejercicios Entalpía 3° y 4° Diferenciado 2016Luciano TooperAún no hay calificaciones
- Taller No. 1 Fundamentos Qca. 2Documento2 páginasTaller No. 1 Fundamentos Qca. 2Cristian RozoAún no hay calificaciones
- Taller 6Documento11 páginasTaller 6Luis Angel Mamani HuahuacondoriAún no hay calificaciones
- 11-Ejercicios de Termodinamica Con SolucionDocumento9 páginas11-Ejercicios de Termodinamica Con SolucionShey LagladAún no hay calificaciones
- EJERTERMODocumento2 páginasEJERTERMOClara AlvarezAún no hay calificaciones
- 2TERMOQUIMICADocumento4 páginas2TERMOQUIMICAAlison Melo TorresAún no hay calificaciones
- Ejercicios de Termodinamica (1154)Documento2 páginasEjercicios de Termodinamica (1154)Caro GodoyAún no hay calificaciones
- Semana 8guía de Problemas para La Práctica 3Documento7 páginasSemana 8guía de Problemas para La Práctica 3JUNIORAún no hay calificaciones
- q1 Termoquimica SolucionesDocumento3 páginasq1 Termoquimica SolucionesSnnopy SnnopyAún no hay calificaciones
- Taller de Repaso para La Practica Calificada 3Documento11 páginasTaller de Repaso para La Practica Calificada 3abigail.cruzAún no hay calificaciones
- Termoquimica 2014Documento5 páginasTermoquimica 2014Luis Vaca50% (2)
- Tema 4 TermoquímicaDocumento10 páginasTema 4 TermoquímicaPedro A. MartínezAún no hay calificaciones
- EJERCICIOS y CUESTIONES TERMODINÁMICA QUÍMICADocumento3 páginasEJERCICIOS y CUESTIONES TERMODINÁMICA QUÍMICAiconpokemonabuelitamiedoAún no hay calificaciones
- Ejercicios de Termodinámica I: Física y Química 1º BachilleratoDocumento2 páginasEjercicios de Termodinámica I: Física y Química 1º BachilleratoCesarHernandezAún no hay calificaciones
- Efrain Asencio CruzDocumento8 páginasEfrain Asencio Cruzmarco antonioAún no hay calificaciones
- Taller - 5-Semana 9Documento13 páginasTaller - 5-Semana 9Elizabeth MolloAún no hay calificaciones
- Guia de TermoquimicaDocumento5 páginasGuia de TermoquimicaRosa MariaAún no hay calificaciones
- Guía de ejercicios de termoquímica UNAH-FQFDocumento4 páginasGuía de ejercicios de termoquímica UNAH-FQFMichell ReyesAún no hay calificaciones
- Termoquímica II EjerciciosDocumento2 páginasTermoquímica II EjerciciosJuan Pablo IngrassiaAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Gasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleDe EverandGasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Materiales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoDe EverandMateriales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoCalificación: 5 de 5 estrellas5/5 (3)
- Avance 9 Perdidas MenoresDocumento4 páginasAvance 9 Perdidas Menoresdiani perez perezAún no hay calificaciones
- Wa0000Documento6 páginasWa0000diani perez perezAún no hay calificaciones
- EnsayoDocumento4 páginasEnsayodiani perez perezAún no hay calificaciones
- Energía de Enlace de Reformado Catalítico para ProducciónDocumento7 páginasEnergía de Enlace de Reformado Catalítico para Produccióndiani perez perezAún no hay calificaciones
- Ciclo de Otto y Ciclo de Diesel - Diani PerezDocumento4 páginasCiclo de Otto y Ciclo de Diesel - Diani Perezdiani perez perezAún no hay calificaciones
- Primer Corte - Taller-2024-01PDocumento3 páginasPrimer Corte - Taller-2024-01Pdiani perez perezAún no hay calificaciones
- Punto 3Documento2 páginasPunto 3diani perez perezAún no hay calificaciones
- Presion OsmoticaDocumento1 páginaPresion Osmoticadiani perez perezAún no hay calificaciones
- Taller de Procesamiento Numerico - RaicesDocumento8 páginasTaller de Procesamiento Numerico - Raicesdiani perez perezAún no hay calificaciones
- Proyecto GeoinformaciónDocumento12 páginasProyecto Geoinformacióndiani perez perezAún no hay calificaciones
- Taller 1. EvolucionDocumento2 páginasTaller 1. Evoluciondiani perez perezAún no hay calificaciones
- Tarea Adicional #2Documento1 páginaTarea Adicional #2diani perez perezAún no hay calificaciones
- Ejercicios Fenomenos de TransporteDocumento17 páginasEjercicios Fenomenos de Transportediani perez perezAún no hay calificaciones
- Guia de Filosofia Del Terver PeriodoDocumento10 páginasGuia de Filosofia Del Terver Periododiani perez perezAún no hay calificaciones
- Actividad Complementaria - EXP 8Documento1 páginaActividad Complementaria - EXP 8diani perez perezAún no hay calificaciones
- EntregaDocumento2 páginasEntregadiani perez perezAún no hay calificaciones
- ACTIVIDADDocumento3 páginasACTIVIDADdiani perez perezAún no hay calificaciones
- Universidad Tecnológica de Bolívar integrantes determinación masa equivalente calorímetroDocumento1 páginaUniversidad Tecnológica de Bolívar integrantes determinación masa equivalente calorímetrodiani perez perezAún no hay calificaciones
- ImagenDocumento3 páginasImagendiani perez perezAún no hay calificaciones
- Quiz de Estadística InferencialDocumento4 páginasQuiz de Estadística Inferencialdiani perez perezAún no hay calificaciones
- 127 Guía 9Documento1 página127 Guía 9diani perez perezAún no hay calificaciones
- Ejercicio 112Documento1 páginaEjercicio 112diani perez perezAún no hay calificaciones
- Ejercicio 111Documento1 páginaEjercicio 111diani perez perezAún no hay calificaciones
- Ejercicio 120Documento1 páginaEjercicio 120diani perez perezAún no hay calificaciones
- Ejercicio 123Documento1 páginaEjercicio 123diani perez perezAún no hay calificaciones
- Actividad N°2 - Estadística InferencialDocumento4 páginasActividad N°2 - Estadística Inferencialdiani perez perezAún no hay calificaciones
- ImagenDocumento5 páginasImagendiani perez perezAún no hay calificaciones
- Actividad N°1 - Estadística InferencialDocumento3 páginasActividad N°1 - Estadística Inferencialdiani perez perezAún no hay calificaciones
- Infografia - BiologiaDocumento1 páginaInfografia - Biologiadiani perez perezAún no hay calificaciones
- Acido Citrico Monohidratado PDFDocumento4 páginasAcido Citrico Monohidratado PDFHector Isacc Palechor EspitiaAún no hay calificaciones
- Supercito 3.2 - HDSDocumento23 páginasSupercito 3.2 - HDSKevin Portocarrero MoriAún no hay calificaciones
- La Energía de La BiomasaDocumento18 páginasLa Energía de La Biomasacarlosp7682Aún no hay calificaciones
- Los 10 Problemas Ambientales Que Enfrenta El Planeta Al 2012 Expo de FedericaDocumento12 páginasLos 10 Problemas Ambientales Que Enfrenta El Planeta Al 2012 Expo de FedericaTita SusanaAún no hay calificaciones
- Estequiometria ProblemasDocumento4 páginasEstequiometria ProblemasDario DorkoAún no hay calificaciones
- Plantilla IEEE-Fase 3 - 215080 - 18 Desarrollo Proyecto - Fase 4Documento6 páginasPlantilla IEEE-Fase 3 - 215080 - 18 Desarrollo Proyecto - Fase 4mayeli montañez perezAún no hay calificaciones
- Alcohol 70Documento14 páginasAlcohol 70Justino maytaAún no hay calificaciones
- Meropa FDSDocumento7 páginasMeropa FDSMaye ValenciaAún no hay calificaciones
- HS-604 Jet Pox 2000 CatalizadorDocumento6 páginasHS-604 Jet Pox 2000 CatalizadorAntony ZaaAún no hay calificaciones
- AIRBOLDocumento22 páginasAIRBOLCarlos ConradoAún no hay calificaciones
- Diseño conceptual de un fotobiorreactor para la producción de biocombustible a partir de microalgasDocumento64 páginasDiseño conceptual de un fotobiorreactor para la producción de biocombustible a partir de microalgasLaura Alejandra MontañoAún no hay calificaciones
- Reciclaje Resíduos Sólidos UrbanosDocumento114 páginasReciclaje Resíduos Sólidos Urbanosluquitas_10Aún no hay calificaciones
- (Tesis) .DDocumento162 páginas(Tesis) .DArturo Gabancho Valderrama100% (1)
- Especificaciones Tecnicas Cerro Azul OkDocumento68 páginasEspecificaciones Tecnicas Cerro Azul OkFritz Del Río AltamiranoAún no hay calificaciones
- Introduccion de QuimicaDocumento16 páginasIntroduccion de Quimicaalexander huamanAún no hay calificaciones
- Tesis Del Plan de EmergenciaDocumento99 páginasTesis Del Plan de EmergenciaJulissahumb Penafer88% (8)
- FDS Alcohol AntisépticoDocumento9 páginasFDS Alcohol AntisépticoRafael Alvarez100% (1)
- MSDS - K - 2001 Pasta CeraDocumento6 páginasMSDS - K - 2001 Pasta CeraFredy Moises Gomez AguilarAún no hay calificaciones
- Como Hacerlo Con HierbasDocumento126 páginasComo Hacerlo Con HierbasMarco Vazquez100% (2)
- Módulo 4 6° Básico FotosíntesisDocumento23 páginasMódulo 4 6° Básico Fotosíntesiscarla oliva100% (1)
- Química Del CO2Documento7 páginasQuímica Del CO2Fernando MéndezAún no hay calificaciones
- Medidas para Prevenir El Desastre EcológicoDocumento7 páginasMedidas para Prevenir El Desastre EcológicoGuillermo TorreAún no hay calificaciones
- EcoeficienciaDocumento13 páginasEcoeficienciaDarly DanielaAún no hay calificaciones
- Pegamento caseroDocumento4 páginasPegamento caseroRosa Ullilen ZaraviaAún no hay calificaciones
- 20 W-50 Roshfrans Aceite para Motor A Gasolina PDFDocumento5 páginas20 W-50 Roshfrans Aceite para Motor A Gasolina PDFRodolfo HuitronAún no hay calificaciones
- Prueba Diagnostica Grado Decimo 10°Documento27 páginasPrueba Diagnostica Grado Decimo 10°Bryan BohorquezAún no hay calificaciones
- Tesis - Sanchez Contador - Uria - Miguel PDFDocumento333 páginasTesis - Sanchez Contador - Uria - Miguel PDFCooper CarolineAún no hay calificaciones
- Fase 3 Causa de ProblemaDocumento16 páginasFase 3 Causa de ProblemaLorena Acevedo100% (1)
- Análisis de riesgo de incendioDocumento14 páginasAnálisis de riesgo de incendioEmiro Alberto Trujillo Velez100% (1)
- Procesos de Refinacion de ArrabioDocumento28 páginasProcesos de Refinacion de Arrabiodj_rakoAún no hay calificaciones