Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hay Un Punto Donde El Agua Se Encuentra en Tres Estados Al Mismo Tiempo
Cargado por
Emily Hernandez0 calificaciones0% encontró este documento útil (0 votos)
5 vistas2 páginasEl punto triple del agua ocurre a una temperatura de 0.01°C y una presión de 611.73 Pascales, donde el agua puede existir simultáneamente en estado sólido, líquido y gaseoso. Para alcanzar este punto, la presión debe reducirse significativamente para igualar los puntos de ebullición y fusión del agua a la misma temperatura.
Descripción original:
Título original
Hay un punto donde el agua se encuentra en tres estados al mismo tiempo
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl punto triple del agua ocurre a una temperatura de 0.01°C y una presión de 611.73 Pascales, donde el agua puede existir simultáneamente en estado sólido, líquido y gaseoso. Para alcanzar este punto, la presión debe reducirse significativamente para igualar los puntos de ebullición y fusión del agua a la misma temperatura.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas2 páginasHay Un Punto Donde El Agua Se Encuentra en Tres Estados Al Mismo Tiempo
Cargado por
Emily HernandezEl punto triple del agua ocurre a una temperatura de 0.01°C y una presión de 611.73 Pascales, donde el agua puede existir simultáneamente en estado sólido, líquido y gaseoso. Para alcanzar este punto, la presión debe reducirse significativamente para igualar los puntos de ebullición y fusión del agua a la misma temperatura.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
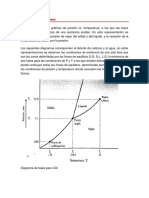
Hay un punto donde el agua se encuentra en tres estados al mismo tiempo: sólido,
líquido y vapor. Es bien conocido que en condiciones normales el agua se evapora
a 100º C y se congela a 0º C, pero, aunque parezca sorprendente hay un punto
donde el agua es capaz de pasar de sólido a vapor o viceversa. Se trata del
denominado como punto triple, una situación donde coexisten en equilibrio los tres
estados.
¿Cómo es posible que el agua esté en varios estados al mismo tiempo? Para ello
debemos entender cómo funcionan los cambios de fase. En condiciones normales
con la presión atmosférica habitual, en los cero grados centígrados el agua pasa
de hielo a agua líquida. Lo mismo sucede a cien grados, donde el agua se
evapora. Es bien conocido que, en la cima de las montañas más altas, el agua
hierve a menos temperatura.
Para alcanzar el punto triple del agua, la temperatura de ebullición debe igualarse
a la temperatura de congelación. Y ¿cómo se consigue? La respuesta la
encontramos en la presión.
Hielo, agua y vapor al mismo tiempo
Con las condiciones adecuadas de temperatura y presión, el agua puede alcanzar
el punto triple. Ese punto donde coinciden al mismo tiempo la fase gaseosa, la
fase líquida y la fase sólida. ¿En qué situación el agua alcanza estas condiciones?
Para conseguir el punto triple deberemos reducir considerablemente la presión,
como si estuviéramos casi en el vacío.
El punto triple del agua se alcanza a una temperatura de 0.0098 °C o 273.16 K,
pero la presión no es de 1 atm como de normal, sino de 611,73 Pascales o lo que
es lo mismo: 0.0060373057 atm. Con estas condiciones, conseguimos que el
punto de ebullición del agua baje hasta los 0,01ºC y el punto de fusión sube
ligeramente de 0ºC a 0,01ºC. A la temperatura de 0,01ºC y con la baja presión
nombrada, el agua puede hervir y congelarse al mismo tiempo. Un efecto que
choca radicalmente con lo que observamos en la naturaleza, pero contemplado
perfectamente por las leyes de la Termodinámica.
El punto triple del agua se sitúa en los 611,73 P.a., según la escala internacional
de temperatura ITS90. Esto equivale a una presión unas 165 veces más pequeña
que la habitual de la atmósfera terrestre. Obtener esta baja presión para poder
apreciar el punto triple en laboratorio no es sencillo, pues un mínimo efecto de
tensión en la superficie del material empleado puede ser suficiente para
desequilibrar el estado. De hecho, el punto triple del agua es tan estable que el
Kelvin se define a partir de él. Pues un Kelvin es 1/273,16 de la temperatura
termodinámica del punto triple de agua. El punto triple es la presión mínima a la
cual el agua líquida existe. Esto es un punto clave, ya que por ejemplo en el vacío,
el hielo se sublima directamente y se convierte en gas sin pasar por fase líquida.
Es necesaria al menos esta presión de 611,73 P.a. para que el agua exista en
forma líquida. El agua no es el único elemento en tener un punto triple, pero sí
tiene sus particularidades. En la mayoría de sustancias, el valor de este punto
triple coincide precisamente con la mínima temperatura a la que la fase líquida
existe, pero no así en el agua. En todas las sustancias, sí existe un solo punto
triple específico de presión y temperatura donde se produce la coexistencia de las
tres fases.
LINKS:
https://www.xataka.com/energia/punto-triple-agua-su-increible-fisica-cuando-
hielo-agua-liquida-vapor-coexisten-al-tiempo
https://youtu.be/Juz9pVVsmQQ
https://youtu.be/t3Uo_CTMHDg
https://youtu.be/eyn7MusdQ9g
https://openstax.org/books/f%C3%ADsica-universitaria-volumen-2/pages/1-5-
cambios-de-fase
También podría gustarte
- Balance de Materia y Energía en Un EvaporadorDocumento9 páginasBalance de Materia y Energía en Un EvaporadorBrenda Karen100% (1)
- Punto de EbulliciónDocumento6 páginasPunto de EbulliciónNico Basantes100% (3)
- Practica 2 TermoDocumento38 páginasPractica 2 TermoClaudioAún no hay calificaciones
- El Lenguaje de las nubes: Una introducción a su estudioDe EverandEl Lenguaje de las nubes: Una introducción a su estudioAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Seminario TermoquímicaDocumento6 páginasSeminario TermoquímicaGIANPIERO STEFANO CESPEDES CUBASAún no hay calificaciones
- Clase 9 DilataciónDocumento23 páginasClase 9 DilataciónJosé María Ojeda AguilarAún no hay calificaciones
- Quimica2 160928181315Documento11 páginasQuimica2 160928181315GodnarAún no hay calificaciones
- Análisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoDocumento17 páginasAnálisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoJesús BautistaAún no hay calificaciones
- Punto Triple Del AguaDocumento9 páginasPunto Triple Del AguadennislanchAún no hay calificaciones
- En Termodinámica Se Denomina Diagrama de Fase A La Representación de Las Fronteras Entre Diferentes Estados de La MateriaDocumento2 páginasEn Termodinámica Se Denomina Diagrama de Fase A La Representación de Las Fronteras Entre Diferentes Estados de La MateriaJazmin EsparzaAún no hay calificaciones
- Punto TripleDocumento5 páginasPunto TripleRosalino Mayoral LagunesAún no hay calificaciones
- Punto Triple Del AguaDocumento4 páginasPunto Triple Del AguaEdgar Vinicio MonteroAún no hay calificaciones
- Diagrama de FasesDocumento3 páginasDiagrama de FasesLiss BrañesAún no hay calificaciones
- Que Es El Punto Triple de Una SustanciaDocumento2 páginasQue Es El Punto Triple de Una SustanciaJean Carlos Gonzalez MoranAún no hay calificaciones
- Termo Cap 3Documento14 páginasTermo Cap 3Fraraccio IngenieriaAún no hay calificaciones
- Caracteristicas Del Punto Triple Del Aguaunto Triple Del AguaDocumento3 páginasCaracteristicas Del Punto Triple Del Aguaunto Triple Del AguaRoyderSantosLueraDominguezAún no hay calificaciones
- VARIABLES DE PROCESOS. Tema # 5. Escalas de TemperaturaDocumento9 páginasVARIABLES DE PROCESOS. Tema # 5. Escalas de Temperaturaoscar ivan bolaños navarreteAún no hay calificaciones
- Punto TripleDocumento2 páginasPunto TripleJesus Alberto Guzman0% (3)
- Diagrama de Fases Del AguaDocumento1 páginaDiagrama de Fases Del AguaDaniel BerrioAún no hay calificaciones
- Practica Diagrama de FasesDocumento7 páginasPractica Diagrama de FasesDiana CaballeroAún no hay calificaciones
- Punto TripleDocumento11 páginasPunto TripleWendy VillaflorAún no hay calificaciones
- Practica1 QA Equipo4Documento15 páginasPractica1 QA Equipo4Huerta Cerro CarolinaAún no hay calificaciones
- Estados Del AguaDocumento6 páginasEstados Del AguaMelissa MendozaAún no hay calificaciones
- Laboratorios #8 Grupo 5 Navas Espinoza Rojas Delgado Torrez Montenegro 1Documento4 páginasLaboratorios #8 Grupo 5 Navas Espinoza Rojas Delgado Torrez Montenegro 1Luis TorresAún no hay calificaciones
- Punto Triple EutécticoDocumento4 páginasPunto Triple EutécticoEzequiasAún no hay calificaciones
- Triple Punto Del AguaDocumento2 páginasTriple Punto Del AguaHéctor AlmendarezAún no hay calificaciones
- Punto de EbulliciónDocumento2 páginasPunto de EbulliciónDayana FranssAún no hay calificaciones
- Practica 4 TermoDocumento13 páginasPractica 4 TermojcbmunAún no hay calificaciones
- CAPÍTULO 3 TERMODINÁMICA 7ma EDICIÓNDocumento40 páginasCAPÍTULO 3 TERMODINÁMICA 7ma EDICIÓNanierbtaAún no hay calificaciones
- Comportamiento PVT CalidadDocumento18 páginasComportamiento PVT CalidadAnderson ArrietaAún no hay calificaciones
- Trabajo Escrito TermodinamicaDocumento42 páginasTrabajo Escrito TermodinamicaJorge Omar Sanchez VenegasAún no hay calificaciones
- A Qué Temperatura Se Evapora El Agua 1Documento4 páginasA Qué Temperatura Se Evapora El Agua 1Cristian LorenzoAún no hay calificaciones
- MonografiaDocumento7 páginasMonografiaDiegoAún no hay calificaciones
- Punto Triple Del H2ODocumento8 páginasPunto Triple Del H2OValentina Berbesi VasquezAún no hay calificaciones
- 7 Humedad AtmosfericaDocumento39 páginas7 Humedad AtmosfericaComplices AlRescateAún no hay calificaciones
- Punto Triple y Punto CriticoDocumento15 páginasPunto Triple y Punto CriticoArturo Tapia del AngelAún no hay calificaciones
- Punto Critico y Triple Del AguaDocumento9 páginasPunto Critico y Triple Del AguaDavi Jerson Huamán TorrejónAún no hay calificaciones
- Propiedades ColigativasDocumento2 páginasPropiedades ColigativasTami Di DinoAún no hay calificaciones
- Universidad de San Carlos de Guatemala Trabajo de QuimicaDocumento10 páginasUniversidad de San Carlos de Guatemala Trabajo de QuimicaTomi ChanAún no hay calificaciones
- La Ebullición Es El Proceso Físico en El Que Un Líquido Pasa A Estado GaseosoDocumento7 páginasLa Ebullición Es El Proceso Físico en El Que Un Líquido Pasa A Estado GaseosoRene Velazquez GembeAún no hay calificaciones
- Termo 2Documento18 páginasTermo 2Karenka ZeltzinAún no hay calificaciones
- Investigación NaftalinaDocumento5 páginasInvestigación NaftalinaJose Luis Lizama MuñozAún no hay calificaciones
- 76 2015 07 07 4C30.10 - Estados - MetaestablesDocumento2 páginas76 2015 07 07 4C30.10 - Estados - MetaestablesKenny Guillen RosadoAún no hay calificaciones
- Diagramas de FasesDocumento25 páginasDiagramas de FasesRobert CazarAún no hay calificaciones
- El Punto de Fusion Del HieloDocumento7 páginasEl Punto de Fusion Del Hielorafael gandaraAún no hay calificaciones
- Propiedades Coligativas de Las Disoluciones AcuosasDocumento7 páginasPropiedades Coligativas de Las Disoluciones AcuosasTatiana GonzálezAún no hay calificaciones
- Resumen Capitulo 3 Cengel 8 EdicionDocumento13 páginasResumen Capitulo 3 Cengel 8 EdicionpepepepeAún no hay calificaciones
- Apuntes de Química y Bioquímica de Los AlimentosDocumento88 páginasApuntes de Química y Bioquímica de Los AlimentosDaniel HernándezAún no hay calificaciones
- LiofilizacionDocumento14 páginasLiofilizacionCARLOS ANTONIO PROMOTOR RODRIGUEZ100% (1)
- Química LiquídosDocumento3 páginasQuímica LiquídosManuel RamírezAún no hay calificaciones
- Presion de Vapor SaturadoDocumento8 páginasPresion de Vapor SaturadoRoberto Carlos Montoya SirlupuAún no hay calificaciones
- 412 CiencioramaDocumento11 páginas412 Ciencioramaddaniel184279Aún no hay calificaciones
- GUÍA Cambios de Fase y Calor LatenteDocumento28 páginasGUÍA Cambios de Fase y Calor LatenteCristian Marcelo Marca CadenaAún no hay calificaciones
- Resumen Unidad 9 TermodinamicaDocumento10 páginasResumen Unidad 9 TermodinamicaFer NandomAún no hay calificaciones
- 7-Líquidos y SolucionesDocumento90 páginas7-Líquidos y SolucionesLuis Cesar Gutierrez MedranoAún no hay calificaciones
- Yacimiento IIIDocumento11 páginasYacimiento IIIsolangeAún no hay calificaciones
- Práctica 2 Punto de Ebullición Del AguaDocumento6 páginasPráctica 2 Punto de Ebullición Del AguaDaniela Moreno GonzálezAún no hay calificaciones
- Curva de CoexistenciaDocumento5 páginasCurva de CoexistenciaMariano HernandezAún no hay calificaciones
- Viga A Flexion y CortanteDocumento7 páginasViga A Flexion y CortanteErik PerezAún no hay calificaciones
- Memoria de Estructuras - Casa de CampoDocumento18 páginasMemoria de Estructuras - Casa de CampoWilly Melchor SalinasAún no hay calificaciones
- En Un Cilidro de Piston Movible Que Contiene 15 L de Gas Ideal A 27 ºCDocumento4 páginasEn Un Cilidro de Piston Movible Que Contiene 15 L de Gas Ideal A 27 ºCFabián Lezama DezaAún no hay calificaciones
- Industrial 1Documento4 páginasIndustrial 1Luis FornerinoAún no hay calificaciones
- Microestructura 2Documento42 páginasMicroestructura 2Juancho MendozaAún no hay calificaciones
- Hidraulica para Bomberos PDFDocumento30 páginasHidraulica para Bomberos PDFCarlos Diaz DiazAún no hay calificaciones
- Temario FisicoquimicaDocumento3 páginasTemario FisicoquimicaRicardo De LongoriaAún no hay calificaciones
- Presión Absoluta Presión Manométrica + Presión Atmosférica Presión Manométrica Densidad X Aceleración Gravitacional X AlturaDocumento2 páginasPresión Absoluta Presión Manométrica + Presión Atmosférica Presión Manométrica Densidad X Aceleración Gravitacional X AlturaMitzyAún no hay calificaciones
- Mecanicade Fluido Laboratorio 3Documento11 páginasMecanicade Fluido Laboratorio 3YALAN PEÑA ANA CRISTINAAún no hay calificaciones
- Guía 6 Química DécimoDocumento3 páginasGuía 6 Química DécimoLuisa RodríguezAún no hay calificaciones
- Destilación FraccionadaDocumento11 páginasDestilación FraccionadaHans Ortega ValerAún no hay calificaciones
- 06 Cargas Por VientoDocumento47 páginas06 Cargas Por VientoWendy PulidoAún no hay calificaciones
- Linea Del TiempoDocumento1 páginaLinea Del TiempoPaola Alejandra Castro MorgaAún no hay calificaciones
- Psicrometria AplicadaDocumento88 páginasPsicrometria AplicadaDaniela Juliana Rey BenavidesAún no hay calificaciones
- Termo XimenaDocumento5 páginasTermo XimenaMaria Ximena MoraAún no hay calificaciones
- PRACTICA No 1. PROPIEDADES DE LOS FLUIDOSDocumento17 páginasPRACTICA No 1. PROPIEDADES DE LOS FLUIDOSRossy GutierrezAún no hay calificaciones
- A1 Principios TermodinamicaDocumento3 páginasA1 Principios Termodinamicajuan moreno100% (1)
- Contenido Termodinamica (Microcurriculo)Documento6 páginasContenido Termodinamica (Microcurriculo)Czar CaicedoAún no hay calificaciones
- 1419efmym PDFDocumento3 páginas1419efmym PDFEdwin Raúl PeláezAún no hay calificaciones
- Condiciones de FronteraDocumento37 páginasCondiciones de FronteraAnother Boy On InternetAún no hay calificaciones
- Entalpias de EnlaceDocumento33 páginasEntalpias de Enlacelisbeth neiza canqui rondoAún no hay calificaciones
- Laboratorio Calor Especifico 12 PDFDocumento2 páginasLaboratorio Calor Especifico 12 PDFEvelin VegaAún no hay calificaciones
- APAZA KATATA FRITZ SEBASTIAN 3er EXAMEN Transf de Calor 2022Documento5 páginasAPAZA KATATA FRITZ SEBASTIAN 3er EXAMEN Transf de Calor 2022Eyner GonzalesAún no hay calificaciones
- Tema 01 - INTRODUCCION-Tecnologia MaterialesDocumento52 páginasTema 01 - INTRODUCCION-Tecnologia MaterialesAlexander Ian Chuquillanqui DionicioAún no hay calificaciones
- Escalas Termométricas para Primer Grado de Secundaria PDFDocumento2 páginasEscalas Termométricas para Primer Grado de Secundaria PDFAlonso Anwar Vargas Saavedra100% (2)
- TRABAJO Y COMPRESION Practica 6Documento17 páginasTRABAJO Y COMPRESION Practica 6Dayver Pascual LazcanoAún no hay calificaciones