Documentos de Académico
Documentos de Profesional
Documentos de Cultura
VALORACIONES CIDO-BASE Maxresdefault
VALORACIONES CIDO-BASE Maxresdefault
Cargado por
aliDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
VALORACIONES CIDO-BASE Maxresdefault
VALORACIONES CIDO-BASE Maxresdefault
Cargado por
aliCopyright:
Formatos disponibles
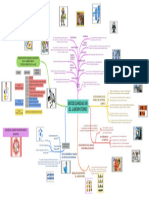
UNIVERSIDAD NACIONAL DE CHIMBORAZO
FACULTAD DE CIENCIAS DE LA EDUCACIÓN HUMANAS MATERIA: FÍSICA QUÍMICA
Y TECNOLÓGICAS
LICENCIATURA EN BIOLOGÍA, QUÍMICA Y DOCENTE: MsC. Elena Urquizo
LABORATORIO
ALUMNA: Elsa Cisa
SEMESTRE: Octavo
La reacción completa de un ácido con una base en
FECHA: 2020/08/11
disolución acuosa, denominada genéricamente reacción
de neutralización, da lugar a la formación de una sal y,
por lo general, de agua.
Las valoraciones ácido-base se denominan también volumetrías
de neutralización, ya que se reducen a medir el
HClO4 (aq) + NaOH (aq) → NaClO4 (aq) + H2 O (l) volumen de base necesario para la neutralización del ácido, o
viceversa
En una reacción entre un ácido fuerte y una base
fuerte esperamos que el punto de equivalencia VALORACIÓN
se encuentre alrededor de un pH de 7. DE ÁCIDO La valoración de un ácido se denomina acidimetría valoración de
BASE una base, alcalimetría.
DEFINICIÓN
En la valoración entre un ácido fuerte
con una base débil esperamos que el
punto de equivalencia tenga un pH Valoración de ácido
menor a 7. fuerte con base fuerte
Valoración de ácido
fuerte con base débil*
Al tener, en una reacción, una base fuerte con
un ácido débil, se espera que el punto de Valoración de ácido Mezcla gradualmente el ácido y la base hasta alcanzar el
equivalencia tenga un pH mayor a 7.
débil con base fuerte punto de equivalencia la reacción de neutralización es
completa. En ese punto, el número de H3O+ procedentes del
Valoración VALORACIONES ÁCIDO-BASE ácido es igual al de OH− procedentes de la base.
El ácido como la base se disocian por lo que se trata VALORACIÓN La valoración se alcanza cuando se produce el
de una reacción muy compleja. Por esta razón, este cambio de color o viraje de un indicador, que se
tipo de valoración no se la va a analizar. adiciona previamente a los reactivos. Para que la
Valoración de ácido Punto final valoración sea válida, el punto final debe coincidir
débil con base débil con el de equivalencia
La reacción de neutralización es:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2 O (l)
EJEMPLO En el punto de equivalencia se cumple: n H+ = n OH−
Durante el proceso de la valoración ácido-base, el pH de la Supongamos que se han gastado 17,6 mL de disolución de
disolución resultante varía continuamente. La forma concreta NaOH 0,1318 M.
de esta variación depende del carácter fuerte o débil del
ácido o de la base. Curvas de valoración
El pH varía lentamente salvo en las inmediaciones del
punto de equivalencia. Precisamente este hecho
BIBLIOGRAFÍA: Ministerio de Educación. 2016, 2 BGU Química. Quito - Ecuador pag. 190 - 193. permite determinar el final de la variación
Todas las valoraciones que realizamos siempre debemos agregar la
base sobre el ácido. A medida que se vaya agregando la base se debe
ir midiendo el pH hasta llegar al punto de equivalencia. Pueden darse
cuatro casos concretos de interacción entre ácido y bases. La concentración de la disolución de ácido clorhídrico
valorada es 0,092 8 M.
También podría gustarte
- Determinación de La Acidez de La Salsa ValentinaDocumento11 páginasDeterminación de La Acidez de La Salsa ValentinaDiana Mora100% (2)
- Túnica Vestido Hanae Mori Molde Patron Gratis ADocumento88 páginasTúnica Vestido Hanae Mori Molde Patron Gratis AaliAún no hay calificaciones
- Anteproyecto Cido Acetilsalic LicoDocumento14 páginasAnteproyecto Cido Acetilsalic LicoAxel Uriel Palacios OlivaresAún no hay calificaciones
- Informe SOBRE Soluciones BufferDocumento8 páginasInforme SOBRE Soluciones BufferAndres Camilo GVAún no hay calificaciones
- Concentración de Acidez Total de La Salsa ValentinaDocumento10 páginasConcentración de Acidez Total de La Salsa ValentinaCarlos AguilarAún no hay calificaciones
- Informe Numero 10Documento10 páginasInforme Numero 10Juan camilo Aguirre LópezAún no hay calificaciones
- Info 5 QuimDocumento4 páginasInfo 5 QuimYuleidy Katherine Ordóñez OrdóñezAún no hay calificaciones
- Free ValoracionesDocumento6 páginasFree ValoracionesliliAún no hay calificaciones
- Lab Bioquimica 1.Documento9 páginasLab Bioquimica 1.ISABELLA RODRIGUEZ NARANJOAún no hay calificaciones
- Informe de Soluciones BufferDocumento11 páginasInforme de Soluciones BufferRoy Brañez0% (3)
- 7 Aci BaseDocumento56 páginas7 Aci BaseMaria Diez BlancoAún no hay calificaciones
- Wuolah Free Tema 6Documento3 páginasWuolah Free Tema 6Nuria Sastre PujolAún no hay calificaciones
- Informe Titulacion PHDocumento4 páginasInforme Titulacion PHJuan Felipe Diaz HoyosAún no hay calificaciones
- Acido-Base 20 - 3 SRDocumento61 páginasAcido-Base 20 - 3 SRKarlos RamirezAún no hay calificaciones
- Informe Preparacio N de Soluciones Reguladoras PDFDocumento4 páginasInforme Preparacio N de Soluciones Reguladoras PDFValeria AmpudiaAún no hay calificaciones
- Informe Quimica Neutralizacion I 1Documento5 páginasInforme Quimica Neutralizacion I 1Antonio GuerraAún no hay calificaciones
- RedoxDocumento10 páginasRedoxRodrigo GarciaAún no hay calificaciones
- Resumen Cap 9c 14Documento3 páginasResumen Cap 9c 14ANA LAURA LEAL CABRERAAún no hay calificaciones
- Bryan TrabajitoDocumento6 páginasBryan TrabajitoNubia Zobeida Mota VargasAún no hay calificaciones
- EQUILIBRIO QUÍMICO - CONCENTRACIONES PH, pOH y AmortiguadoresDocumento1 páginaEQUILIBRIO QUÍMICO - CONCENTRACIONES PH, pOH y AmortiguadoresLisseth Erika Ticona LlanqueAún no hay calificaciones
- T.8 Acido Base AsDocumento13 páginasT.8 Acido Base Asisabel montillaAún no hay calificaciones
- IV Lab QuimicaDocumento10 páginasIV Lab QuimicaRosalinda Perez100% (1)
- LAB-QUIAN Semna 6Documento10 páginasLAB-QUIAN Semna 6Fernando Valdez MendozaAún no hay calificaciones
- Practica 3. Castillo Briones Hours Emanuel. 3IV1Documento5 páginasPractica 3. Castillo Briones Hours Emanuel. 3IV1Horus Emanuel Castillo BrionesAún no hay calificaciones
- Informe #2Documento9 páginasInforme #2Fernanda CarrilloAún no hay calificaciones
- Seminario P9Documento25 páginasSeminario P9Cesar AvelarAún no hay calificaciones
- Practica 6 Determinacion Del Contenido de Acido en El VinagreDocumento8 páginasPractica 6 Determinacion Del Contenido de Acido en El VinagreMonserrat Rodriguez MoralesAún no hay calificaciones
- Mapa Conceptual Ionización Del AguaDocumento3 páginasMapa Conceptual Ionización Del Aguaproxy :3Aún no hay calificaciones
- Tema6-Equilibrio en Fase Acuosa-Reacciones Acido-BaseDocumento45 páginasTema6-Equilibrio en Fase Acuosa-Reacciones Acido-BaseCarlo M. ChahuaraAún no hay calificaciones
- Ácido-Base PPS PDFDocumento17 páginasÁcido-Base PPS PDFmastrantoniAún no hay calificaciones
- QG - F TEMA - 6 2017 Equilibrios - Acido BaseDocumento56 páginasQG - F TEMA - 6 2017 Equilibrios - Acido BaseMaría Andérez FernándezAún no hay calificaciones
- Valoracion Acido - BaseDocumento6 páginasValoracion Acido - BaseJonattan OrozcoAún no hay calificaciones
- Examen Acido Base FinalDocumento28 páginasExamen Acido Base FinalCesar OrozcoAún no hay calificaciones
- Practica #6 Equilibrio Ácido-Base, Valoración, PH y Determinación Del Pka Ac. Débil 2Documento9 páginasPractica #6 Equilibrio Ácido-Base, Valoración, PH y Determinación Del Pka Ac. Débil 2emilio wasaaaAún no hay calificaciones
- Hidrolisis de Sales 9 de Abril Del 2018Documento10 páginasHidrolisis de Sales 9 de Abril Del 2018David RosenstandAún no hay calificaciones
- Reporte2 BioquímicaDocumento5 páginasReporte2 BioquímicaLuis RamirezAún no hay calificaciones
- Titulacion Acido - BaseDocumento5 páginasTitulacion Acido - BaseAlex Franz Orosco QuintanaAún no hay calificaciones
- Determinación de Ácido Acetilsalicílico en Pastillas Utilizando Volumetría ÁcidoDocumento5 páginasDeterminación de Ácido Acetilsalicílico en Pastillas Utilizando Volumetría ÁcidomarodrigueztrAún no hay calificaciones
- Indice de SaturacionDocumento6 páginasIndice de SaturacionCaballero MarioAún no hay calificaciones
- Universidad Nacional Autónoma de Nicaragua UnanDocumento6 páginasUniversidad Nacional Autónoma de Nicaragua UnanRoberto MontealegreAún no hay calificaciones
- Acido Base 1Documento9 páginasAcido Base 1pagonzales1-esAún no hay calificaciones
- P1 BioquímicaDocumento4 páginasP1 BioquímicaHernandez Chavez DavidAún no hay calificaciones
- Acido BaseDocumento4 páginasAcido BaseEdicson VelasquezAún no hay calificaciones
- INFORME # 1BIOQUIMICAaDocumento8 páginasINFORME # 1BIOQUIMICAaSilvana ArosaAún no hay calificaciones
- Reporte No. 1 (Determinación de La Constante de Equilibrio de Un Ácido Débil)Documento28 páginasReporte No. 1 (Determinación de La Constante de Equilibrio de Un Ácido Débil)Pablo José Rosales67% (3)
- Informe de Preparación de DisolucionesDocumento3 páginasInforme de Preparación de DisolucionesNadia CamargoAún no hay calificaciones
- JHDHHFGDocumento6 páginasJHDHHFGPedro MorenoAún no hay calificaciones
- Unidad 4Documento16 páginasUnidad 4Mariana Soledad Maidana FronteraAún no hay calificaciones
- wuolah-free-VALORACIONES AC-BASEDocumento5 páginaswuolah-free-VALORACIONES AC-BASEesther rodriguezAún no hay calificaciones
- Guia 6 - Acidez Acètica UnefmDocumento11 páginasGuia 6 - Acidez Acètica UnefmJuan GutierrezAún no hay calificaciones
- Laboratorio 9Documento8 páginasLaboratorio 9KELLY FLORESAún no hay calificaciones
- Tema 7Documento12 páginasTema 7Jdiego VoAún no hay calificaciones
- Informe TitulaciónDocumento4 páginasInforme TitulaciónCamiloTovarAún no hay calificaciones
- Laboratorio Titulacion Ácido BaseDocumento3 páginasLaboratorio Titulacion Ácido Basemajjojaramillo19Aún no hay calificaciones
- Determinacion de AcetilsalicilicoDocumento7 páginasDeterminacion de AcetilsalicilicoKarenAún no hay calificaciones
- Practica 14Documento9 páginasPractica 14Jess Marquéz SaranaAún no hay calificaciones
- Guía 1 Decimo 3P Quimica 2021Documento2 páginasGuía 1 Decimo 3P Quimica 2021Dayron Atn0% (1)
- Informe Laboratorios VirtualesDocumento10 páginasInforme Laboratorios VirtualesannyAún no hay calificaciones
- Metodos Instrumentales-Pregunta 1y2Documento4 páginasMetodos Instrumentales-Pregunta 1y2Raquel Espinoza SolisAún no hay calificaciones
- Métodos AcidimétricosDocumento4 páginasMétodos Acidimétricosever odar lizana anguloAún no hay calificaciones
- Bioseguridad en El LaboratorioDocumento1 páginaBioseguridad en El LaboratorioaliAún no hay calificaciones
- Equilibrio IonicoDocumento1 páginaEquilibrio IonicoaliAún no hay calificaciones
- Ejercicios Ácido BaseDocumento1 páginaEjercicios Ácido BasealiAún no hay calificaciones
- VOLUMETRA - CIDO - BASE MapaDocumento1 páginaVOLUMETRA - CIDO - BASE MapaaliAún no hay calificaciones
- Resumen Tema 5 GMBDocumento13 páginasResumen Tema 5 GMBaliAún no hay calificaciones
- GUIA Tecnicas de Microscopia DEF2Documento8 páginasGUIA Tecnicas de Microscopia DEF2aliAún no hay calificaciones
- Donde TrabajanDocumento1 páginaDonde TrabajanaliAún no hay calificaciones
- Contar de 5 A 10Documento2 páginasContar de 5 A 10aliAún no hay calificaciones
- Vestido Basico Negro 5202 Patron Gratis Talla S PDFDocumento18 páginasVestido Basico Negro 5202 Patron Gratis Talla S PDFaliAún no hay calificaciones
- TECNOLOGÍA 4º ESO TEMA 5 - Instalaciones de Agua en Las. ViviendasDocumento31 páginasTECNOLOGÍA 4º ESO TEMA 5 - Instalaciones de Agua en Las. ViviendasaliAún no hay calificaciones
- Test Nautica IIDocumento6 páginasTest Nautica IIaliAún no hay calificaciones