0% encontró este documento útil (0 votos)
59 vistas10 páginasCáncer Gástrico: Epidemiología y Tratamiento
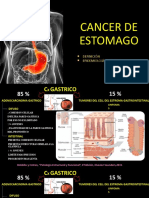
El documento resume información sobre el cáncer gástrico. Explica que el adenocarcinoma es el tipo más común, representando más del 90% de los casos. Es la quinta causa más común de cáncer y la cuarta causa de muerte por cáncer a nivel mundial. En Chile es la segunda causa de muerte por cáncer. El pronóstico depende del estadio al diagnóstico, con una sobrevida a 5 años mayor al 80% para estadios precoces pero menor al 5% para estadios avanzados. Los factores de
Cargado por
Claudia Bastías NavarreteDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
59 vistas10 páginasCáncer Gástrico: Epidemiología y Tratamiento
El documento resume información sobre el cáncer gástrico. Explica que el adenocarcinoma es el tipo más común, representando más del 90% de los casos. Es la quinta causa más común de cáncer y la cuarta causa de muerte por cáncer a nivel mundial. En Chile es la segunda causa de muerte por cáncer. El pronóstico depende del estadio al diagnóstico, con una sobrevida a 5 años mayor al 80% para estadios precoces pero menor al 5% para estadios avanzados. Los factores de
Cargado por
Claudia Bastías NavarreteDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd